融合卷曲螺旋结构域的蔗糖异构酶活性包涵体异源表达及其酶学性质
2023-07-30马志宇高向红庞焦刘羽欣李明玉王从纲李宪臻
马志宇,高向红,庞焦,刘羽欣,李明玉,王从纲,李宪臻
大连工业大学生物工程学院,辽宁大连116034
异麦芽酮糖(α-D-吡喃葡萄糖基-1,6-果糖,isomaltulose)是蔗糖的同分异构体,天然存在于蜂蜜、甘蔗汁中,甜度约为蔗糖的50%[1-3]。目前,异麦芽酮糖主要在食品工业中作为蔗糖的替代品用于保健品、糖尿病患者食品和运动饮料的生产中。此外,异麦芽酮糖还在化工领域中被用作生产一些表面活性剂和高分子聚合物的原材料,因此是一种具有较好发展前景的功能糖[4-5]。目前工业上主要利用蔗糖异构酶(sucrose isomerase,SI)催化蔗糖转化成异麦芽酮糖,相比利用化学法合成具有较大优势,如反应条件温和、制备过程绿色环保、反应专一性较高等。由于异麦芽酮糖的应用愈加广泛,导致异麦芽酮糖市场需求量逐年增长,但其生产主要由国外公司垄断,市场售价约1.5 万元/吨,因此,提高SI 的利用率从而降低异麦芽酮糖的生产成本越发受到重视[6]。
目前已发现多种产SI 的细菌,包括大黄欧文菌(Erwinia rhapontici)、沙雷杆菌(Serratia plymuthica)、多源发散菌(Pantoea dispersa)和克雷伯杆菌(Klebsiella sp.)等[7]。但野生菌普遍产酶水平较低,难以达到工业化生产要求,如Erwinia rhaponticiNX-5的发酵酶活为1.3 U/mL,Klebsiella sp.LX3 的发酵酶活为15.12 U/mL[8-9]。因此,目前研究人员主要通过异源表达手段制备重组SI,并将其固载于水不溶性载体上,制备成固定化酶以提高利用率。如利用ε-多聚-L-赖氨酸修饰的介孔TiO2及ε-多聚-L-赖氨酸和明胶制备的海绵对SI 进行固定化,分别具有93.3%和84.5%的酶活力回收率[10-11];利用壳聚糖-戊二醛交联法、海藻酸钠-羧甲基纤维素钠混合包埋法及交联酶聚集体法对SI进行固定化,分别实现了70.3%、32.5%和30.9%的酶活力回收率[12]。综上所述,通过传统的吸附法、结合法、交联法和包埋法虽然成功将SI 制备成固定化酶,但需要首先利用色谱技术对纯酶进行分离纯化,进一步利用水不溶性载体与纯酶进行固载反应,该过程中的分离纯化、制备载体和固定化反应相关化学试剂均增加了固定化酶的生产成本,不利于固定化SI 的大规模生产及应用[13]。近年研究发现,利用特定标签序列与酶蛋白融合表达,能够诱导其在细胞内形成具有催化活性的包涵体(catalytically-active inclusion bodies,CatIBs,简称活性包涵体),其表达量大、易分离纯化、尤其是表达和固定化过程同步进行,无需额外的载体材料及固载反应,是一种新型自固定化酶,不仅在理论上改变了过去“包涵体是完全无活性的蛋白聚集体”的观点,而且作为一种新型酶异源表达和固定化方法,具有较好的工业应用潜力[14-15]。目前源于细胞表面蛋白tetrabrachion 的四聚化卷曲螺旋结构域(tetrameric coiled-coli domain of the cell-surface protein tetrabrachion,TdoT)已被用作制备活性包涵体的融合标签,不仅成功制备出脂肪酶A、赖氨酸脱羧酶等活性包涵体,而且通过与苯甲醛裂解酶和乙醇脱氢酶融合后在胞内成功制备出共定位活性包涵体,进一步在体外实现了一锅法级联反应(one-pot cascade reaction),表现出较好的适用性和效果[16-18]。
源自Klebsiella sp.LX3 的SI 具有较高蔗糖转化率(99.5%)和主产物为异麦芽酮糖等优势[9,19],本研究以其为研究对象,将TdoT 分别融合在去除自身天然信号肽序列的SI 的N/C-端,构建重组表达载体并转入E.coliBL21(DE3)中进行诱导表达,进一步分离纯化活性包涵体后进行酶学性质表征,从而为重组SI的异源表达和高效利用提供新策略。
1 材料与方法
1.1SI、质粒及菌株 源自Klebsiella sp.LX3的SI(NCBI accession number:AAK82938)、携带不包含天然信号肽的SI编码基因的质粒pET-28a-SI、E.coliBL21(DE3)、E.coliDH10B、N/C-端分别融合有组氨酸标签的质粒pET-24b-6 × His-SI和pET-24b-SI-6 × His 由大连工业大学生物催化技术国家地方联合工程实验室保存并提供;携带TdoT基因的质粒pET-24a-TdoT由苏州泓迅生物科技股份有限公司合成。
1.2主要试剂及仪器 卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、Triton-X100、SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、BCA蛋白质定量检测试剂盒购自生工生物工程(上海)股份有限公司;PrimeSTAR®HS DNA Polymerase、QuickCutTMBamHⅠ和QuickCutTMXho Ⅰ、DpnⅠ、T4 DNA连接酶、DNA和蛋白质相对分子量标准品购自宝生物工程(大连)有限公司;异麦芽酮糖购自美国Sigma 公司;其他化学试剂购自天津市科密欧化学试剂有限公司;Milli-Q超纯水过滤系统购自美国Millipore公司;Infinite F50酶标仪购自瑞士TECAN公司;PCR仪、电转仪购自德国Eppendorf 公司;NanoVue plus 超微量紫外分光光度计、ImageQuant LAS4000 凝胶成像分析系统购自美国通用电气(中国)有限公司;高效液相色谱分析仪(Agilent Technologies 1260 Infinity)购自美国安捷伦科技公司;Thermo Fisher Scientific Hypersil APS-2,4.6 mm×250 mm,5µm氨基柱购自美国Thermo Fisher Scientific;UV5200 紫外分光光度计购自上海元析仪器有限公司。
1.3培养基及缓冲液配制 LB 液体培养基:含10 g/L胰蛋白胨、5 g/L酵母粉、10 g/L NaCl,pH 7.2;LB固体培养基:在LB 液体培养基中加入1.5%琼脂;LLB培养基:含10 g/L胰蛋白胨、5 g/L酵母粉、5 g/L NaCl,pH 7.2。Buffer A缓冲液:Na2HPO4·12 H2O 16.937 g、NaH2PO4·2 H2O 0.62 g,溶于450 ~750 mL去离子水,调pH至8.0后,加入50 mL甘油,去离子水定容至1 L;Buffer B 缓冲液:取0.5 mL Triton-X100 溶于100 mL Buffer A 缓冲液;Buffer C 缓冲液:Na2HPO4·12 H2O 16.937 g、NaH2PO4·2 H2O 0.62 g,溶于450 ~750 mL去离子水,调pH至8.0后,用去离子水定容至1 L。
1.4重组表达质粒的构建 引物序列见表1,引物由吉林库美生物科技有限公司合成。以pET-28a-SI为模板,利用引物P1/P2 扩增含有酶切位点的SI基因片段。PCR 反应体系:PrimeSTAR®HS DNA Polymerase 0.5 µL,5 × PrimeSTAR Buffer 10 µL,P1、P2 引物各2 µL,dNTP 4 µL,模板DNA 2 µL,加灭菌水至50µL。反应条件:95 ℃5 min;94 ℃30 s,60 ℃45 s,72 ℃2 min,共30 个循环;72 ℃延伸10 min。将回收的PCR 产物与pET-24a-TdoT用QuickCutTMBamHⅠ和QuickCutTMXhoⅠ进行双酶切,酶切产物经1%琼脂糖凝胶电泳分离后,利用DNA 胶回收试剂盒回收线性化载体和目的基因片段,经T4 DNA连接酶16 ℃连接15 h;连接产物利用热激转化至E.coliDH10B感受态细胞中,涂布含50µg/mL 卡那霉素的LB 固体平板,挑取单菌落利用引物P5/P6 进行菌落PCR 鉴定。PCR反应体系:rTaq DNA Polymerase 0.2µL,10×rTaq Buffer 2 µL,P5、P6 引物各2 µL,dNTP 1.6 µL,模板菌液1µL,加灭菌水至20µL。反应条件:95 ℃5 min;94 ℃30 s,53 ℃30 s,72 ℃3 min,共30个循环;72 ℃延伸5 min。将验证正确的阳性单克隆继续培养和提取质粒后送吉林库美生物科技有限公司测序,测序正确的质粒命名为pET-24a-TdoT-SI。采用RF(restriction free-cloning)克隆技术构建pET-24b-SITdoT表达载体[20]:以pET-24a-TdoT为模板,利用引物P3/P4进行第1轮PCR扩增反应。PCR反应体系:PrimeSTAR®HS DNA Polymerase 0.5 µL,5 × Prime-STAR Buffer 10 µL,P3、P4 引物各2 µL,dNTP 4 µL,模板DNA 2µL,加灭菌水至50µL。反应条件:95 ℃5 min;94 ℃30 s,60 ℃45 s,72 ℃30 s,共30个循环;72 ℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳分离后,利用DNA 胶回收试剂盒进行回收,将其作为第2 轮PCR 反应的长引物,继续以pET-24b-SI-6 ×His为模板进行第2轮PCR反应。PCR反应体系:PrimeSTAR®HS DNA Polymerase 0.25µL,5×Prime-STAR Buffer 5 µL,dNTP 2 µL,第1 轮PCR 扩增产物2µL,pET-24b-SI-6×His质粒1µL,加灭菌水至25µL。反应条件:95 ℃5 min;94 ℃60 s,65 ℃60 s,68 ℃10 min,共15 个循环;94 ℃60 s,55 ℃50 s,68 ℃8 min,共20 个循环;最后68 ℃延伸15 min。反应结束加入DpnⅠ分解模板质粒后,将反应产物电击转化至E.coliDH10B 感受态细胞中,涂布含50µg/mL卡那霉素的LB固体平板,挑取单菌落利用引物P5/P6进行菌落PCR鉴定,反应体系和反应条件与E.coliDH10B/pET-24a-TdoT-SI相同。将验证正确的阳性单克隆继续培养和提取质粒后送吉林库美生物科技有限公司测序,测序正确的质粒命名为为pET-24b-SI-TdoT。

表1 引物序列Tab.1 Primer sequences
1.5重组质粒的诱导表达 将pET-24a-TdoT-SI和pET-24b-SI-TdoT以及pET-24b-6×His-SI和pET-24b-SI-6 × His 分别转化至E.coliBL21(DE3)感受态细胞中,挑取阳性单克隆,接种至5 mL含50µg/mL卡那霉素的LB 液体培养基中,37 ℃,200 r/min 培养14 h,得到种子液;将种子液以1%接至含50µg/mL卡那霉素的LLB 液体培养基中,37 ℃,200 r/min 培养至A600达0.6 ~0.8 时,加入诱导剂,其中重组工程菌E.coliBL21(DE3)/pET-24a-TdoT-SI加入终浓度为0.8 mmol/L的IPTG,E.coliBL21(DE3)/pET-24b-SI-TdoT加入终浓度为0.1 mmol/L 的IPTG,E.coliBL21(DE3)/pET-24b-6×His-SI和E.coliBL21(DE3)/pET-24b-SI-6 × His 加入终浓度为0.5 mmol/L 的IPTG,将上述加入IPTG的菌液继续16 ℃,200 r/min培养20 h,进行诱导表达。
1.6活性包涵体的分离纯化 参考文献报道的缓冲液清洗法对活性包涵体进行分离纯化[21]。将诱导表达后的菌液离心收集并用Buffer A重悬后,在冰水浴中超声破碎(功率500 W,破碎3 s,间隔5 s,破碎20 min);将破碎后的全菌样品6 740×g离心15 min,分离可溶性上清和含有包涵体的沉淀组分;将沉淀依次用Buffer B 和Buffer C 洗涤2 和3 次后,6 740×g离心15 min 回收,Buffer C 充分悬浮后得到活性包涵体酶液;取少量活性包涵体酶液,加入等体积的10%SDS 溶液处理5 min 以彻底溶解包涵体,利用BCA 蛋白质定量检测试剂盒测定蛋白浓度。将细胞破碎上清液和洗涤后的活性包涵体样品进行12%SDS-PAGE检测。
1.7活性包涵体酶活力检测 取4 mg/mL活性包涵体酶液100µL,与含4%蔗糖的缓冲液400µL 混匀,在40 ℃下于200 r/min 反应2 h 后,100 ℃沸水中处理15 min 进行灭酶。将灭酶后的反应产物6 740×g离心15 min,收集上清液,经0.22 µm 滤膜过后,进行HPLC 检测:利用Thermo Fisher Scientific Hypersil APS-2,4.6 mm × 250 mm,5 µm 氨基柱对反应产物进行检测,采用示差检测器,流动相为乙腈∶水(80∶20),柱温为35 ℃,进样量为10µL,流速为1.0 mL/min。根据异麦芽酮糖标准品与其对应峰面积拟合出的标准曲线计算反应产物中异麦芽酮糖的浓度并计算酶活力。酶活力单位定义:以蔗糖为底物,每分钟释放1µmoL异麦芽酮糖所需的酶量为1个酶活力单位(U)。相对酶活定义:以同组的最高酶活为100%,计算所得比值为相对酶活。
1.8活性包涵体的酶学性质表征
1.8.1最适反应温度确定 将活性包涵体酶液与含4%蔗糖的pH 6.0 磷酸氢二钠-柠檬酸缓冲液混匀,分别在30、35、40、45、50、55 ℃条件下反应并测定酶活力以确定最适反应温度。
1.8.2最适反应pH 确定 将活性包涵体酶液分别与含4%蔗糖的pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5 的磷酸氢二钠-柠檬酸缓冲液混匀,在最适反应温度下反应并测定酶活力以确定最适反应pH。 。
1.8.3酶促反应动力学常数检测 将活性包涵体酶液分别与不同浓度(10、20、40、50、100、200、250、400、500、800 mmol/L)蔗糖溶液混合,在最适反应条件下进行催化反应后,采用HPLC法检测产物异麦芽酮糖的生成量并计算反应速度。利用GraphPad Prism 5.0 基于Michaelis-Menten 方程进行非线性拟合得到动力学常数Km和Vmax,并计算kcat/Km。
1.9产物特异性分析 将100 µL 浓度4 mg/mL 的TdoT-SI 活性包涵体酶液与400 µL 含4%蔗糖的pH 5.5 磷酸氢二钠-柠檬酸缓冲液混匀;将100µL 浓度4 mg/mL 的SI-TdoT 活性包涵体酶液与400 µL 含4%蔗糖的pH 5.0 磷酸氢二钠-柠檬酸缓冲液混匀。将上述活性包涵体转化反应体系分别在30、35、40 ℃下,于200 r/min 反应12 h 后,将酶转化样品经100 ℃沸水处理15 min进行灭酶,再经6 740×g离心15 min 得到反应产物上清,经0.22 µm 滤膜过滤后采用HPLC法检测转化反应产物。
1.10数据采集及分析 采用EXCEL 2016 软件分析数据,Origin 9软件绘图。
2 结果
2.1重组表达质粒的鉴定E.coliDH10B/pET-24a-TdoT-SI的菌落PCR 产物在1 500 ~2 250 bp 处可见单一条带,大小与预期扩增序列(2 055 bp)相符;E.coliDH10B/pET-24b-SI-TdoT的菌落PCR 产物在1 500 ~2250 bp处可见单一条带,大小与预期扩增序列(2 049 bp)相符。见图1。测序结果表明质粒构建正确。

图1 转化重组质粒工程菌的菌落PCR鉴定Fig.1 Colony PCR identification of engineered bacteria transformed with recombinant plasmid
2.2活性包涵体的鉴定E.coliBL21(DE3)/pET-24b-6×His-SI和E.coliBL21(DE3)/pET-24b-SI-6×His的诱导表达产物经12%SDS-PAGE分析,在相对分子质量约66 400 处可见与6×His-SI 和SI-6×His 理论相对分子质量(68 14 0)相符的目的蛋白条带,且主要以包涵体形式表达,经酶活力检测包涵体沉淀无催化活性,表明无论在N/C-端融合组氨酸标签,重组SI蛋白均主要以无活性包涵体形式表达。见图2。
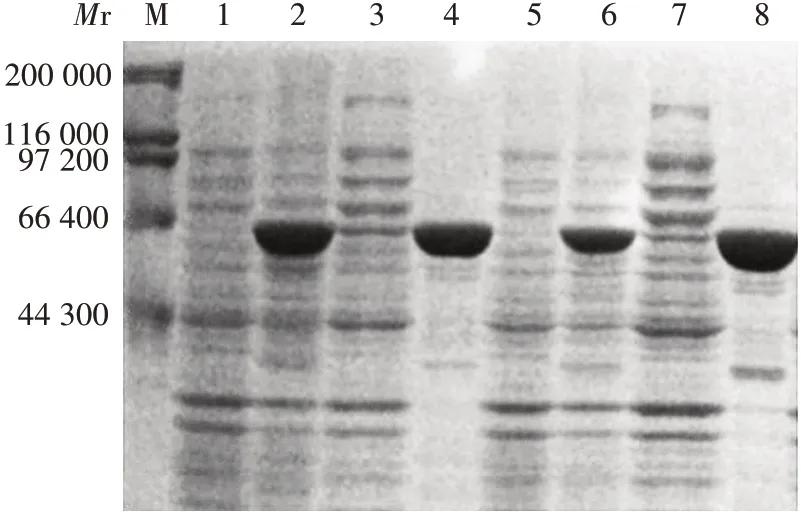
图2 重组6×His-SI和SI-6×His 的SDS-PAGE 分析Fig.2 SDS-PAGE analysis of recombinant proteins of 6 ×His-SI and SI-6×His
E.coliBL21(DE3)/pET-24a-TdoT-SI和E.coliBL21(DE3)/pET-24b-SI-TdoT的诱导表达产物经12%SDS-PAGE分析,可见与TdoT-SI和SI-TdoT理论相对分子质量(73 180)相符的目的条带,表明融合蛋白成功被诱导表达,表达的融合蛋白TdoT-SI 和SITdoT 仍主要以包涵体形式存在于沉淀样品中;将包涵体进行酶活检测,发现其具有较高催化活性,表明融合TdoT标签诱导SI表达为活性包涵体。见图3。

图3 重组TdoT-SI和SI-TdoT 的SDS-PAGE 分析Fig.3 SDS-PAGE analysis of recombinant proteins of TdoTSI and SI-TdoT
2.3活性包涵体的酶学性质表征
2.3.1最适反应温度 TdoT-SI 和SI-TdoT 活性包涵体均在40 ℃时具有最高酶活力,并且在30 ~40 ℃,酶活力随温度升高而增加,在35 ~45 ℃,二者均具有超过80%的酶活力,高于45 ℃后,TdoT-SI和SI-TdoT活性包涵体酶活力均迅速下降。见图4。
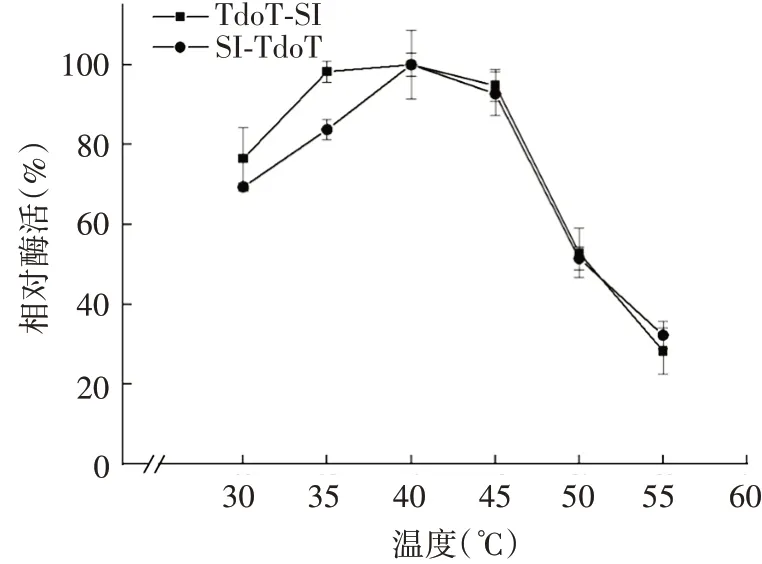
图4 温度对TdoT-SI 和SI-TdoT酶活力的影响Fig.4 Effect of temperature on enzymatic activity of TdoTSI and SI-TdoT
2.3.2最适反应pH pH 4.0 ~5.0时,随着pH升高,TdoT-SI 和SI-TdoT 活性包涵体酶活力均增加,并且分别在pH 5.5 和5.0 时具有最高酶活力;pH 5.0 ~6.0时,二者均具有超过80%的催化活性,在pH高于6.5后,酶活力迅速下降。见图5。

图5 pH对TdoT-SI 和SI-TdoT酶活力的影响Fig.5 Effect of pH on enzymatic activity of TdoT-SI and SITdoT
2.3.3酶促反应动力学常数 在最适反应条件下测定TdoT-SI 和SI-TdoT 活性包涵体的比活力分别为(622.6±17.5)和(252.6±17.1)U/g。TdoT-SI对底物蔗糖的Km为(103.9 ± 9.5)mmol/L,Vmax为(3761 ±113.3)µmol/(L·min),kcat为(5.7 ± 0.2)s-1,kcat/Km为(0.06 ± 0.002)L/(mmol·s);SI-TdoT 对底物蔗糖的Km为(54.4 ± 6.6)mmol/L,Vmax为(1 141.0 ±37.3)µmol/(L·min),kcat为(1.7 ± 0.09)s-1,kcat/Km为(0.03±0.002)L/(mmol·s),表明TdoT标签融合在SI 的N/C-端形成的活性包涵体对底物蔗糖具有不同的动力学参数,SI-TdoT 与底物蔗糖的结合能力更强,但催化效率略低于TdoT-SI。
2.4产物特异性 TdoT-SI 和SI-TdoT 活性包涵体在30 ~40 ℃,转化反应产物中的异麦芽酮糖含量并无较大幅度的变化,而产物中海藻酮糖的含量普遍随转化反应温度的升高而呈降低的趋势,同时单糖(果糖和葡萄糖)含量随温度升高而增加。见表2。
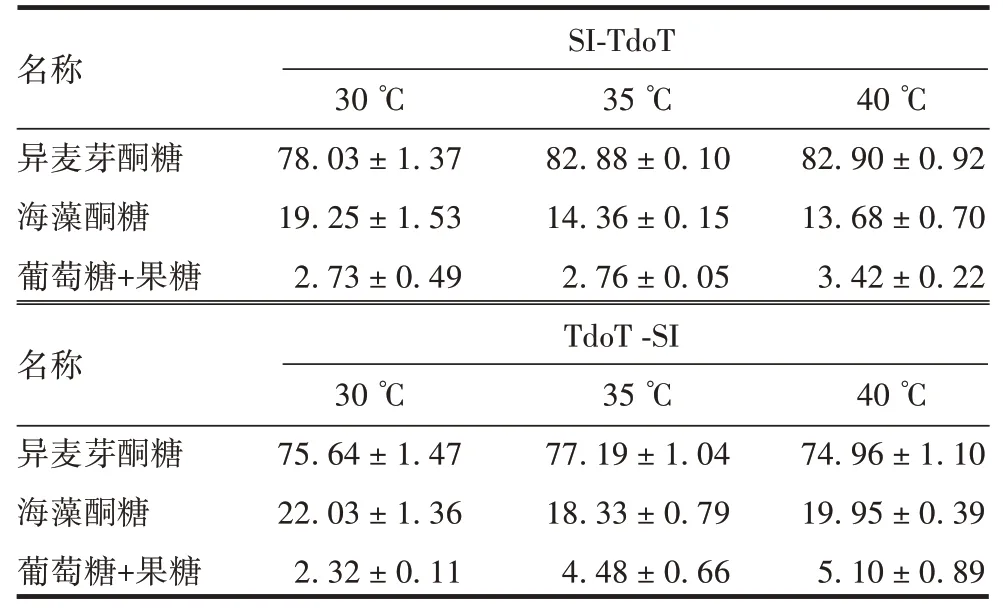
表2 不同温度下融合TdoT 标签SI 催化产物组成分析(%,x ±s,n=2)Tab.2 Composition analysis of catalytic reaction products of SI fused with TdoT tag at different temperatures(%,x±s,n=2)
3 讨论
目前我国由于对异麦芽酮糖生产相关的主要酶制剂SI 的制备及应用存在技术瓶颈,导致异麦芽酮糖的生产成本和价格较高,影响了市场拓展。将SI进行固定化有望提高其利用率,传统方法虽然有效提高了SI的利用率,但由于固定化反应需要采用载体材料和额外的固定化反应试剂,且需要首先得到纯酶,因此在工业上应用会增加额外的分离纯化和制备成本[10-12]。本研究通过融合TdoT标签诱导SI形成活性包涵体,其表达和固定化同步进行,无需额外的载体材料和固定化反应而且分离纯化过程简单,相比传统固定化方法具有较大优势。
将酶进行固定化通常会导致其空间构象发生变化进而影响酶活力,有研究报道,利用ε-多聚-L-赖氨酸修饰的介孔TiO2固载SI 的比活力为39.41 U/g,利用ε-多聚-L-赖氨酸和明胶制备的海绵对SI 进行固定化,比活力为71.58 U/g[10-11]。本研究通过将SI在细胞内同步表达和固定化制备成活性包涵体,不仅无需载体材料和额外的固定化反应,且TdoT-SI和SI-TdoT 活性包涵体的比活力分别为(622.6±17.5)和(252.6±17.1)U/g,表明具有较高的酶活力。此外,本研究产物特异性分析结果显示,制备的2种活性包涵体与文献报道的源自Klebsiellasp. LX3、Klebsiella pneumoniaeNK33-98-8 等SI 的产物特异性类似,即均在30 ~40 ℃,随转化反应温度的提高海藻酮糖含量下降,同时单糖含量增加,但异麦芽酮糖的含量无明显变化,表明将SI 表达为活性包涵体后仍具有较好的产物特异性[19,22]。
本研究通过融合表达技术,利用卷曲螺旋结构域TdoT 作为融合标签成功将SI 表达为活性包涵体,实现了表达和固定化的同步进行,其作为一种新型自固定化酶,无需载体材料和用于传统固定化反应的化学试剂,具有潜在的工业应用价值。同时,本研究也进一步证实了其他文献中提出的观点,即相比无活性的包涵体,活性包涵体具有特定的空间组织结构,从而使包涵体中包含部分酶蛋白的类天然结构,因此表现出酶活力[23-26],从而促进了关于包涵体结构功能相关的理论研究。由于TdoT 标签融合在SI 的N/C-端形成的活性包涵体对底物蔗糖表现出不同的动力学常数,表明形成的活性包涵体由于微观结构的不同影响了与底物的结合和催化过程,因此,后续研究可针对活性包涵体进行结构解析以阐明影响其形成和功能活性的分子机制,从而为进一步的精细设计和优化奠定基础,促进SI 的高效制备进而降低异麦芽酮糖的生产成本。
