豌豆酸浆中淀粉絮凝菌的筛选及其絮凝性质分析
2023-07-29刘娇李源王佳瑶张莉力顾英许云贺
刘娇,李源,王佳瑶,张莉力,顾英,许云贺
锦州医科大学食品与健康学院(锦州 121000)
酸浆法生产淀粉在我国已有数百年的历史,酸浆是将豆类磨碎成淀粉乳后放置一段时间经微生物自然发酵,形成的一种淡黄色酸性液体[1]。酸浆中微生物的絮凝作用致使淀粉颗粒迅速形成大的絮凝团,从而加快淀粉与蛋白质、纤维素等杂质的分离。用酸浆法生产的淀粉被认为比用离心等其他方法生产的淀粉更适合制作传统的东方食品粉丝[2]。这种传统的酸浆发酵方法仍在中国淀粉生产中占主导地位[3]。豌豆淀粉由于来源广泛,价格便宜且成胶能力强、凝胶制品色泽好、持水性好等其他淀粉无法比拟的优点,被用于制作粉丝、粉皮、凉粉等传统食品[4]。酸浆中的微生物类群对有效提升酸浆法的生产效率起关键性作用。但是很多因素限制了酸浆法在实际生产中的应用,如环境因素会导致酸浆的酸度不易控制,酸浆中的腐败杂菌也会致使不同批次淀粉产品的质量各不相同。所以若将酸浆的生产由自然发酵改变为纯种发酵,将会解决众多豌豆淀粉生产企业在酸浆发酵方面的技术问题。
絮凝作用菌的絮凝活性高低是其能否应用到工业化生产中的重要评价指标之一[5]。因此,试验利用平板分离法从豌豆酸浆中分离筛选出一株生长稳定且具有高絮凝淀粉活性的菌株并对其絮凝性质进行分析,从而改善淀粉生产废液排放导致的环境污染问题,减少淀粉的生产时间和酸浆的使用量,为豌豆酸浆接种发酵提供备选菌种及纯种发酵、稳定生产豌豆淀粉并研发淀粉专用微生物絮凝剂提供理论依据。
1 材料与方法
1.1 材料、试剂与培养基
新鲜豌豆(川南特产城网络商店);豌豆淀粉(新良新乡网络商店);绿豆酸浆(微生物课题组自然发酵获得);细菌基因组DNA提取试剂盒(沈阳立信生物技术有限公司);PCR引物(派森诺生物公司);葡萄糖、大豆蛋白胨、蔗糖、酵母浸粉、H2O2(天津市科密欧化学试剂有限公司);溶菌酶(Sigma-Aldrich公司);胃蛋白酶(双汇实业集团有限公司);胰蛋白酶(南宁庞博生物工程有限公司);纤维素酶(山东隆科特酶制剂有限公司);糖化酶(博立生物制品有限公司)。
豌豆汁制备方法:200 g新鲜豌豆加1 L蒸馏水加热煮沸后,转小火煮30 min,用0.125 mm孔径(120目)筛子加8层纱布过滤,用蒸馏水定容至1 L备用。
基础碗豆汁培养基:20 g葡萄糖、1 g大豆蛋白胨,碗豆汁1 L,调pH至6.5,于121 ℃灭菌30 min。
改良碗豆汁培养基:30 g蔗糖、0.5 g酵母浸粉,碗豆汁1 L,调pH至6.0,于121 ℃灭菌30 min。
UV-1600紫外可见分光光度计(北京瑞利分析仪器公司);T20MM立式高速冷冻离心机(湖南赫西仪器装备有限公司);ABI-2720PCR仪(美国Applied Biosystems公司);Mini Pro 300V Power Supply电泳仪(major science USA);ABI 3730XL测序仪(美国Applied Biosystems公司)。
1.2 试验方法
1.2.1 豌豆乳的制备
称取40 g豌豆洗净,加入1 L自来水浸泡过夜(12~18 h),利用破壁机调节至4档打浆10 s,使用0.125 mm孔径(120目)筛子加8层纱布过滤后得到新鲜豌豆乳。
1.2.2 豌豆酸浆的制备
1.2.2.1 发酵豌豆酸浆的工艺
豌豆浸泡→打浆→新鲜豌豆乳→加老浆→静置弃上清液→定容至1 L→密封培养(20~25 ℃)
1.2.2.2 酸浆的制备
新鲜豌豆乳中加入30%的绿豆发酵酸浆。弃2/3含有蛋白的上清液,用凉白开定容至1 L,置于室温下发酵24 h。
1.2.2.3 酸浆的活化
将上述酸浆加入新制备的豌豆乳中。持续活化3个月,当酸浆pH 4~5且浆液呈青白色并有少量水沫时,结束发酵并检测絮凝率,此时自然发酵的豌豆酸浆微生物区系趋于稳定。
1.2.3 DNA的提取与高通量测序分析
取絮凝率最高时的豌豆酸浆,分为酸浆组(SQ1,SQ2和SQ3)和沉淀淀粉组(CD1,CD2和CD3),酸浆组是指豌豆全浆中的上清液,沉淀淀粉组是指豌豆全浆中的沉淀淀粉,对2组样品进行DNA的提取。PCR扩增正向引物为520F,反向引物为802R。将合格的序列进行文库的扩建并上机进行高通量测序[6]。
1.2.4 ASV聚类及物种组成分析
利用Uparse软件做ASVs聚类,代表序列为出现频数最高的序列,利用分类数据库在门和属水平上统计样品的物种组成。
1.2.5 菌株的分离与筛选
初筛。酸浆组和沉淀淀粉组分别用灭菌后的生理盐水进行梯度稀释,选取适宜稀释度涂布于MRS固体培养基平板上,挑取不同形态的单个菌落进行活化,划线接种于MRS斜面培养基上。以pH为指标,筛选出pH低于3.8的产酸菌株,对其斜面进行保存。
复筛。将产酸菌株接种至碗豆汁培养基中35 ℃培养24 h。以絮凝率为指标复筛出絮凝率大于45%的菌株。将菌株活化后再次梯度稀释,重复划线3次以上,直至镜检下菌落形态一致。
1.2.6 絮凝率(FR)测定
将5 g豌豆淀粉、100 mL蒸馏水和5 mL待测液依次加入100 mL量杯中,快速搅拌3 min后,静置沉降3 min。在上清液面下10 mL处取样。用紫外可见分光光度计测定其在550 nm波长处的吸光度,以空白豌豆汁培养基作对照试验[7-8],并用式(1)计算絮凝率。
絮凝率(FR)=(A-B)/A×100% (1)式中:A为对照组在550 nm波长处的吸光度;B为试验组在550 nm波长处的吸光度。
1.2.7 菌种鉴定
1.2.7.1 形态特征观察
对絮凝率最高的菌株LJ5平板上的菌落形态进行观察并进行革兰氏染色试验,使用光学显微镜对其个体形态进行观察。
1.2.7.2 菌种生理生化试验
对筛选出的絮凝优势菌LJ5进行生理生化试验,以鉴定细菌种属。
1.2.7.3 16S rDNA的基因序列测定以及系统发育分析
细菌基因组PCR扩增,扩增正向引物为P1(27F)和反向引物为P2(1492R)。测序结果在GenBank中进行BLAST比对,使用MEGA 10.0构建絮凝优势菌的系统发育树。
1.2.8 生长曲线绘制及培养时间确定
将S.harbinensisLJ5接种于改良碗豆汁培养基中,扩大培养至第3代时,间隔2 h取样。用紫外可见分光光度计测定在600 nm波长处的吸光度,绘制生长曲线并确定最佳生长时间。采用平板计数法测定最佳生长时间的活菌数。
1.2.9 S.harbinensisLJ5絮凝性质分析
1.2.9.1 S.harbinensisLJ5絮凝活性分布
为确定S.harbinensisLJ5起絮凝作用的是菌体分泌物还是菌体细胞本身,利用光学显微镜和扫描电子显微镜观察加入改良碗豆汁发酵液前后豌豆淀粉颗粒的分布状态。对S.harbinensisLJ5发酵液、上清液、未洗涤菌悬液和洗涤菌悬液的絮凝率进行测定。发酵液为S.harbinensisLJ5在35 ℃培养36 h的碗豆汁发酵液;上清液为碗豆汁发酵液在10 000 r/min条件下离心10 min后的上清液;未洗涤菌悬液为碗豆汁发酵液离心后的菌体细胞加入等体积的无菌蒸馏水;洗涤菌悬液为碗豆汁发酵液离心后洗涤菌体细胞2次,再次加入等体积的无菌蒸馏水。
1.2.9.2 S.harbinensisLJ5絮凝活性的热稳定性分析
分别测定30,40,50,60和70 ℃条件下水浴30 min后的S.harbinensisLJ5发酵液对豌豆淀粉悬浊液的絮凝率。
1.2.9.3 酶处理对S.harbinensisLJ5发酵液絮凝活性的影响
发酵液在4 ℃条件下以8 000 r/min离心20 min,收集菌体,用pH 7.0的磷酸盐缓冲液(0.2 mol/L NaH2PO4与0.2 mol/L Na2HPO4一定比例混合)离心洗涤菌体数次,至菌体呈洁净白色为止,收集菌体备用[9]。准确称取1.0 g菌体,用磷酸盐缓冲液悬浮菌体,分别加入0.3%酶质量浓度1 mg/L的溶菌酶、胰蛋白酶、胃蛋白酶、纤维素酶和糖化酶,酶解pH分别为7.8,8.0,2.5,4.8和4.5,酶解温度分别为52,37,37,50和60℃,放在200 r/min的摇床上酶解2 h[10]。以未处理的发酵液为对照组,分别测定各试验组的絮凝率。
1.2.9.4 金属离子对S.harbinensisLJ5发酵液絮凝活性的影响
淀粉悬浊液本身带负电性,所以选择阳离子进行絮凝试验。配制1%浓度的各盐溶液:KCl、NaCl、CaCl2和MgCl2。将发酵液与1 mL各盐溶液一起加入100 mL的豌豆淀粉悬浊液,分别测定各试验组的絮凝率[11]。
1.3 数据处理
利用SPSS 26.0、MEGA 10.0和Origin 2021a软件进行数据分析和绘图。
2 结果与分析
2.1 豌豆酸浆样品中细菌群落的稀疏曲线
稀疏曲线可以判断测序数量能否反映样本中物种的组成以及测序深度和物种的丰富度程度[12-13]。随着测序数量不断增加,曲线呈快速上升趋势,表明还有大量物种未被发现,而曲线平稳时表明测序深度已经饱和且基本覆盖到样本中所有的物种及绝大部分的微生物信息[14-15]。如图1所示,测序数量超过20 000时,2个样本显示出趋于平坦的稀疏曲线,表明随着测序深度不断增加几乎不会有新的物种产生,因此试验的测序量合理[16-17]。
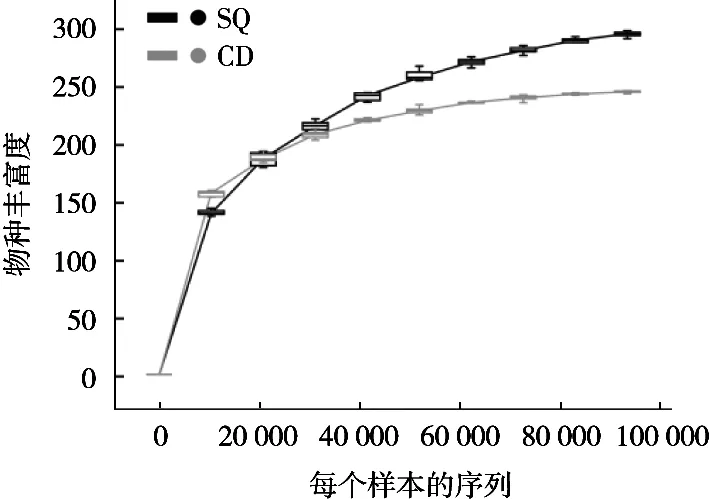
图1 细菌群落稀疏曲线分析
2.2 豌豆酸浆样品中细菌多样性分析
由图2可知,韦恩图结果共得到1 088个ASVs,酸浆组中含637个ASVs,沉淀淀粉组中含451个ASVs,其中2组共有的ASVs数为88个,2组特有的ASVs分别为549和363个,表明酸浆组中微生物群落较沉淀淀粉组丰富。2组样品多样性指数分析见表1。酸浆组和沉淀淀粉组的细菌区系,分别获得168 902和125 097条有效序列。Chao1指数可估计样本群落中包含的物种总数,物种总数越多值越大[18]。因此,酸浆组中的物种总数较沉淀淀粉组的物种总数多。酸浆组的Shannon、Simpson指数显著(P<0.05)高于沉淀淀粉组。结果表明,酸浆组的细菌丰富度及多样性更高。

表1 2种样品中细菌Alpha多样性指数

图2 2种样品的ASVs聚类
2.3 豌豆酸浆样品中细菌群落结构差异分析
2.3.1 门水平下豌豆酸浆样品中细菌群落结构分析
由图3可知,在门水平下,酸浆组与沉淀淀粉组共鉴定出8个门类细菌。酸浆组中变形菌门(Pro-teobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),所占比例依次为56.92%,38.35%,3.80%和0.91%;沉淀淀粉组中厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和蓝藻菌门(Cyanobacteria),所占比例依次为55.84%,41.03%,1.76%和0.98%。酸浆组中的优势菌门为变形菌门,沉淀淀粉组中的优势菌门为厚壁菌门。
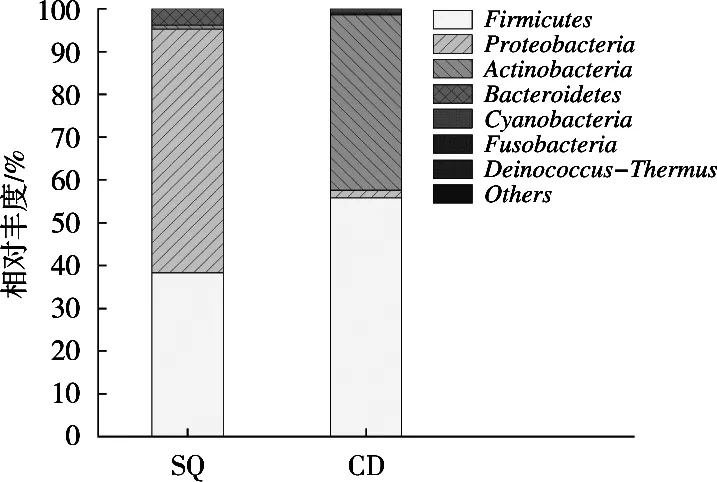
图3 基于门水平的细菌结构
2.3.2 属水平下豌豆酸浆样品中细菌群落结构分析
由图4可知,在属水平下,酸浆组与沉淀淀粉组的细菌隶属于8个属,酸浆组中醋酸杆菌属(Acetobacter)、乳酸杆菌属(Lactobacillus)和乳球菌属(Lactococcus)所占比例依次为55.70%,25.12%和10.13%;沉淀淀粉组中乳酸杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和醋酸杆菌属(Acetobacter)所占比例依次为55.60%,41.03%和1.52%。酸浆组中的优势菌属为醋酸杆菌属,沉淀淀粉组中的优势菌属为乳酸杆菌属。
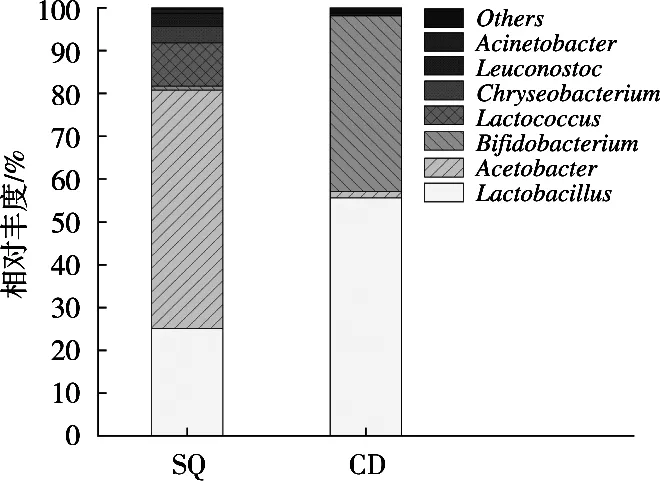
图4 基于属水平的细菌结构
2.4 菌株的分离与筛选
以pH为指标从自然发酵豌豆酸浆样品中初筛共分离出36株pH低于3.8的菌株,以絮凝率为指标复筛出6株絮凝率大于45%的菌株,结果见表2。选择絮凝率最高达71.2%±2.0%的菌株LJ5作为后续试验的研究对象。

表2 由豌豆酸浆分离出的6株菌对淀粉的絮凝率
2.5 菌种鉴定
对絮凝活性较高的菌株LJ5进行菌种鉴定。菌株LJ5的菌落形态见图5(A),光学显微镜下形态见图5(B)。
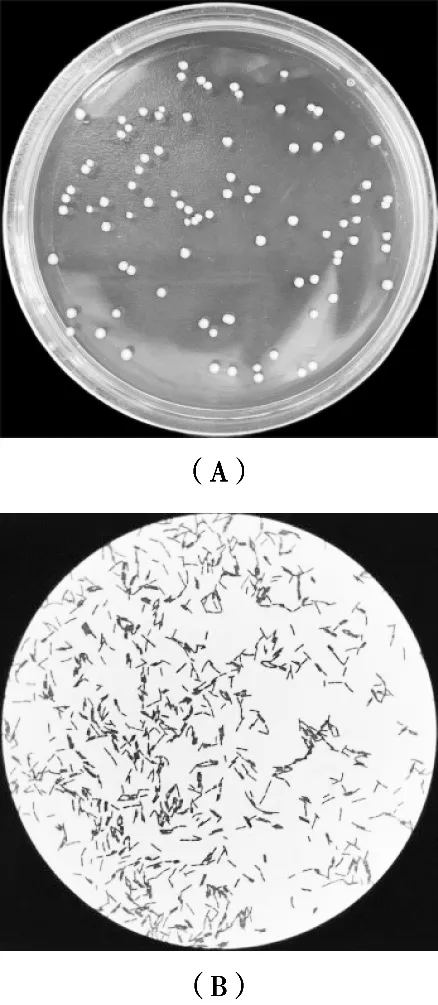
图5 菌株LJ5菌落形态及其革兰氏染色菌体形态
2.5.1 形态特征观察
通过光学显微镜观察絮凝优势菌LJ5在MRS培养基中的形态和菌落特征。菌株LJ5的菌体大小为0.5 μm×2.5 μm,杆状,链状排布方式、革兰氏阳性、无芽孢、不运动。菌株LJ5的菌落大小为1~3 mm,菌落形态为灰白色圆形、不透明、低凸隆起有光泽、边缘不整齐、表面不光滑。
2.5.2 生理生化试验
试验结果见表3,初步判断絮凝优势菌LJ5为乳酸杆菌属。

表3 菌株LJ5生理生化试验结果
2.5.3 16 S rDNA序列分析结果及系统发育树的构建
6株絮凝菌纯化后的16S rDNA的PCR产物琼脂糖凝胶电泳结果如图6所示。使用测序仪ABI 3730XL进行DNA测序。用NCBI中的BLAST程序将拼接后的序列文件与NCBI中16S rDNA数据库中的数据进行比对,选择相似度最大的序列作为物种鉴定的结果[19]。
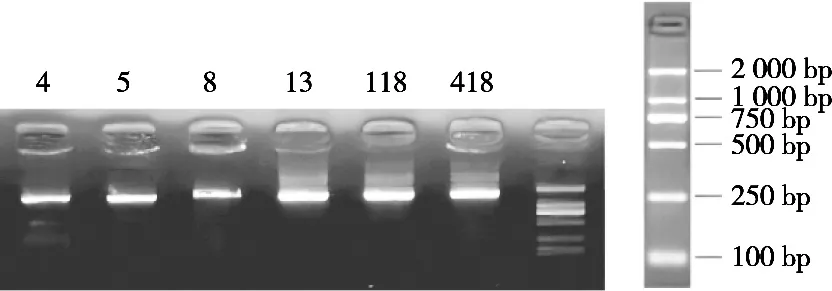
图6 菌株LJ5的16S rDNA电泳图谱
经16S rDNA鉴定,菌株LJ5的16S rDNA序列全长为1 451 bp,经GenBank比对,与Schleiferilactobacillus harbinensis相似性达到100%。利用MEGA 10.0软件构建系统发育树,菌株LJ5与Schleiferilactobacillus harbinensisOK271739.1亲缘关系最近,结果如图7所示。结合其群体、个体形态特征、生理生化试验及16S rDNA序列比对,确定菌株LJ5为哈尔滨施莱弗乳杆菌,命名为Schleiferilactobacillus harbinensisLJ5。

图7 菌株LJ5基因序列系统发育树
2.6 生长曲线的测定
生长曲线如图8所示。接种0~4 h为延滞期,4~24 h为对数生长期,24~58 h为稳定期,之后为衰亡期。结合S.harbinensisLJ5实际用途是用于豌豆酸浆的纯种发酵,为获得高絮凝淀粉活性的豌豆酸浆,对于菌株种子液的活菌数和活力均要求较高,所以选择对数期末期、稳定期前期为发酵终点,最佳发酵时间为24 h。发酵24 h时菌液的活菌数为8.31±0.03 lg CFU/mL。

图8 S.harbinensis LJ5生长曲线
2.7 S.harbinensis LJ5絮凝性质分析
2.7.1 S.harbinensisLJ5絮凝活性物质分布
普遍认为微生物絮凝剂分为两类:一类微生物分泌的胞外产物具有絮凝作用,如发酵乳杆菌的分泌物,其胞外产物具有絮凝作用,而菌体本身没有絮凝作用[20];另一类是菌体本身具有絮凝作用,如副干酪乳杆菌副干酪亚种[21]。光学显微镜下观察到加入发酵液前后豌豆淀粉颗粒的分布状态如图9(A和B)所示。加入发酵液前,淀粉颗粒在显微镜下均匀分布,加入发酵液后,众多淀粉颗粒凝聚成大的絮凝体。如图9(C和D)所示,通过扫描电子显微镜可以观察到加入发酵液前后淀粉颗粒的变化,菌粘附在淀粉颗粒表面并且使淀粉颗粒粘结在一起,所以在絮凝淀粉过程中使淀粉颗粒凝集成大的絮凝体,正是淀粉颗粒粘结体积变大后重力的增加,从而加速淀粉的沉降。发酵液絮凝位置分析图如图9(E)所示。絮凝率大小顺序为发酵液>未洗涤菌悬液>洗涤菌悬液>上清液。其中,未洗涤菌悬液和洗涤菌悬液与发酵液的絮凝率差异较小,都具有很强的絮凝活性,可能是由于离心分离过程损失一部分的菌体细胞,使菌体细胞数量减少,导致絮凝活性的稍有下降。而上清液与发酵液的絮凝率差异较大,去细胞后的上清液基本不具有絮凝活性,表明S.harbinensisLJ5的絮凝活性物质主要存在于菌体细胞本身,而不是分泌到胞外的代谢产物。结合光学显微镜和电子显微镜下S.harbinensisLJ5粘附淀粉颗粒的特性与絮凝活性物质存在于菌体细胞本身,表明絮凝因子可能在菌体细胞的表面。

图9 豌豆淀粉颗粒分布及絮凝位置分析图
2.7.2 S.harbinensisLJ5絮凝活性的热稳定性分析
从图10可以看出,温度对S.harbinensisLJ5的絮凝活性影响很大,在30~40 ℃范围内,发酵液的絮凝活性从71.5%降至68.5%,而温度大于50 ℃时,发酵液基本不具有絮凝活性,表明S.harbinensisLJ5发酵液的絮凝因子不具有热稳定性,对温度较为敏感。

图10 发酵液絮凝活性的热稳定性分析图
2.7.3 酶处理对S.harbinensisLJ5发酵液絮凝活性的影响
由图11可知,空白组的絮凝率最高,为71.1%。溶菌酶、胰蛋白酶与胃蛋白酶3种酶对发酵液的絮凝活性都有不同程度的抑制作用,其中胰蛋白酶和胃蛋白酶的抑制作用较大,而用纤维素酶和糖化酶作用后的絮凝率基本没有变化,表明S.harbinensisLJ5絮凝因子可能是蛋白类物质。结合上述试验结果推测絮凝因子可能为菌体细胞表面的蛋白类物质。
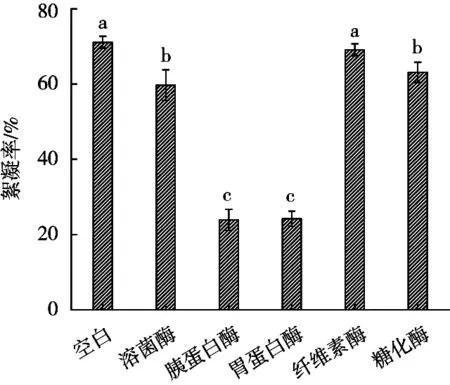
图11 酶处理对发酵液絮凝活性的影响
2.7.4 金属离子对S.harbinensisLJ5发酵液絮凝活性的影响
胶体理论表明阳离子可以和带负电性胶体微粒的表面电荷结合,从而克服静电排斥力使胶体颗粒脱稳形成细小的凝聚体并与微生物絮凝剂反应形成大絮凝团快速下沉。不同金属阳离子对发酵液絮凝活性的影响如图12所示。Na+、K+对发酵液的絮凝活性均有增强作用,Ca2+、Mg2+对絮凝活性也有不同程度的促进作用。其中,Na+的促进作用最强,所以可选Na+作为助凝剂。
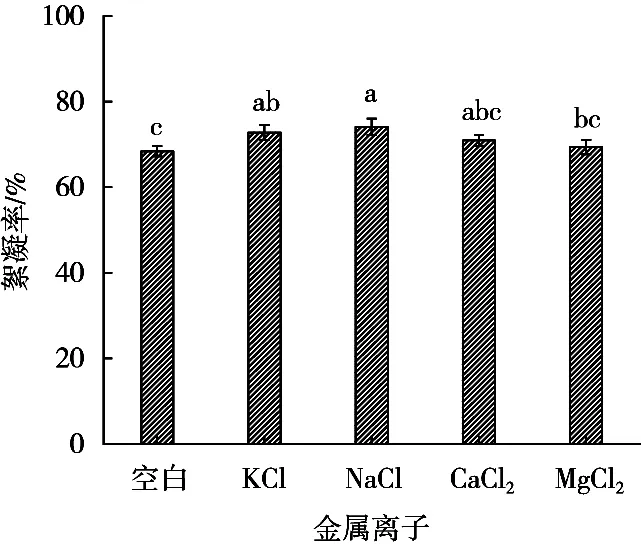
图12 金属离子对发酵液絮凝活性的影响
3 结论
通过高通量测序技术分析酸浆组和沉淀淀粉组中的微生物多样性,从中分离筛选出一株在碗豆汁培养基中生长稳定且具有高絮凝淀粉活性的S.harbinensisLJ5,为豌豆酸浆接种发酵提供备选菌种。通过絮凝活性位置分析确定絮凝活性物质主要存在于菌体细胞本身。菌株发酵液的絮凝活性受温度影响显著,絮凝活性在30 ℃时最高,而温度在50 ℃以上时,发酵液就基本不具有絮凝活性,絮凝因子对温度比较敏感。胰蛋白酶和胃蛋白酶对发酵液的抑制作用较强,说明絮凝活性物质可能是蛋白类的物质。Na+对发酵液的絮凝活性促进作用最强,可选Na+作为助凝剂。
