体外模拟胃部消化对白芸豆α-淀粉酶抑制剂活性及结构的影响
2023-07-28姜彩霞郑喜群刘晓兰王俊彤赵婉宏曾祥瑞
姜彩霞, 郑喜群,, 刘晓兰, 王俊彤, 赵婉宏, 曾祥瑞
(黑龙江八一农垦大学国家杂粮工程技术中心1,大庆 163319)
(粮食副产物加工与利用教育部工程研究中心2,大庆 163319)
(黑龙江八一农垦大学食品学院3,大庆 163319)
(齐齐哈尔大学食品与生物工程学院4,齐齐哈尔 161006)
糖尿病是一种以高血糖为主要特征的慢性代谢紊乱性疾病[1],其中Ⅱ型糖尿病患者占比在90%以上[2],具有发病率高、并发症复杂等特性,通常肥胖是糖尿病发展的一个常见驱动因素[3,4]。通过抑制α-淀粉酶的活性从而减少人体对葡萄糖的吸收被认为是Ⅱ型糖尿病治疗的有效靶点之一,并具有广泛的应用前景[5,6]。
白芸豆(Phaseolusvulgaris) 是一种广受欢迎的食物,其营养丰富[7]。研究发现白芸豆含有较高活性的 α-淀粉酶抑制剂(α-AI),能够有效抑制肠道内 α-淀粉酶活力,可以延迟和部分阻断碳水化合物的吸收,从而降低血糖水平[8],并具有较高的生物安全性,对糖尿病和肥胖症具有潜在的治疗作用[9]。尽管 α-AI本质上是一种蛋白质,但其对人体内消化酶的水解作用具有高度抗性,如胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶等,说明α-AI可以有效抵抗多种消化酶的水解[10]。尹寿伟[11]研究发现芸豆种子的主要储存蛋白球蛋白因其具有独特的空间结构,在非变性状态下很难被消化,且清蛋白的蛋白消化率也较低。Rang等[12]研究结果表明白芸豆种子中α-AI对风味蛋白酶和中性蛋白酶的水解具有高度抗性,同时在pH 3.6~6.0时 α-AI具有良好的溶解性和活性,因此基于酶水解原理提出α-AI制备新工艺。另外,大量研究结果也表明白芸豆 α-AI具有较强的α-淀粉酶抑制活性和较高的稳定性,但目前对于 α-AI蛋白消化产物的理化性质及结构特征研究较少。本研究在体外模拟胃部消化条件下比较了不同消化时间对白芸豆 α-AI的抑制活性、粒径分布、zeta电位及其二级结构的影响,以探究白芸豆 α-AI的消化特性和对 α-淀粉酶抑制活性的影响机制,为植物蛋白与功能性食品的开发提供技术支持。
1 材料与方法
1.1 材料与仪器
白芸豆:白沙克,黑龙江垦区芸豆基地;α-淀粉酶(来源于猪胰腺,50 U/mg)、胃蛋白酶:≥250 U/mg、Ellman试剂(纯度99%)、β-巯基乙醇(纯度≥99.0%);SDS(优级纯)、考马斯亮蓝(R-250,生物染色剂)、标准蛋白Maker(色谱纯)、Tris-Glycine缓冲液(色谱纯),其他试剂均为分析纯。
UV5紫外可见分光光度计,CL6R离心机,RNF-0460卷式膜多功能设备,SCIENTZ-10N真空冷冻干燥机,ZEN3700纳米粒度电位仪,FTIR傅里叶变换红外光谱仪。
1.2 方法
1.2.1 白芸豆α-AI的制备
参照钟颖颖等[13]的方法并略作修改。将白芸豆冷水浸泡12 h,45 ℃烘干粉碎,过60 目筛,按1∶10(m/V)加入pH 6.0水溶液,于35 ℃浸提2.5 h,后5 000 r/min离心20 min取上清,缓慢加入硫酸铵,至其饱和度为70%,并不断搅拌,盐析12 h,在4 ℃ 10 000 r/min离心20 min弃上清,沉淀加水复溶,再分别经截留分子质量为50 ku和30 ku的超滤膜超滤处理,取分子质量为30~50 ku超滤液经冷冻干燥后备用,制得α-AI纯度约为86%。
1.2.2 体外模拟胃部消化
以白芸豆α-AI为原料,参照毛小雨等[14]的方法并略有改动。将白芸豆 α-AI配制成质量浓度25 mg/mL的溶液,与人工胃液按体积比1∶1混合,将混合液的pH调至2.0后加入质量分数为3%的胃蛋白酶,于37 ℃水浴振荡中反应。分别消化15、30、60、90、120 min。沸水浴10 min终止消化反应,调整溶液pH至7.0,4 ℃下10 000 r/min离心20 min,上清液和沉淀分别冷冻干燥,其中沉淀用于电泳测定。
1.2.3 SDS-PAGE电泳测定
参照文献[15]并作适当修改。分离胶体积分数为12%,浓缩胶体积分数为5%。将1.2.2中沉淀冻干物溶于0.25 mol/L Tris-HCl缓冲溶液中,煮沸3 min,上样量为10 μL;电压值分别为80 V和120 V。胶片经考马斯亮蓝溶液(R-250)中染色1 h,后进行脱色处理。
1.2.4 抑制α-淀粉酶活性的测定
根据文献[16]的方法,空白对照管中加1.0 mL PBS缓冲溶液(pH 6.9),空白管中加入0.5 mL α-淀粉酶(来源于猪胰腺,6 U/mL),样品管中加入0.5 mL α-淀粉酶和0.5 mL 样液(1.2.2中上清液冻干物2 mg/mL),样品对照管中加入0.5 mL样液,每管补足 PBS缓冲溶液至1.0 mL,于37 ℃水浴10 min,加入质量分数为1%的可溶性淀粉溶液,反应5 min后立即加入DNS试剂,沸水浴10 min。冷却后于500 nm波长下测定吸光值。样品中α-AI对来源于猪胰腺的α-淀粉酶抑制率按式(1)计算。
(1)
式中:A1、A2、A3和A4分别为500 nm下空白对照管、空白管、样品管和样品对照管的吸光值。
1.2.5 粒径分布和Zeta电位测定
将1.2.2中上清液冻干物配制成1 mg/mL溶液,按照纳米粒度电位仪操作说明进行粒径分布和Zeta电位测定。
1.2.6 傅里叶变换红外光谱测定
称取1.2.2中上清液消化冻干粉2~3 mg,按1∶100(m/m)加入干燥溴化钾研磨后压片,采用傅里叶变换红外光谱仪在400~4 000 cm-1内进行扫描。
1.2.7 巯基和二硫键含量测定
参照戴意强等[17]和Wen等[18]方法分别进行游离巯基和总巯基含量测定,二硫键含量公式见式(2)。
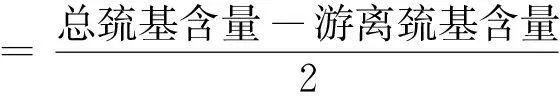
(2)
1.3 数据处理
所有数据均测量3次,以“平均值±标准误差”表示。使用SPSS 20.0 软件通过Duncan检验和 ANOVA分析数据,5% (P<0.05) 的概率水平被认为具有统计学意义,并利用Origin2017绘图。
2 结果与分析
2.1 SDS-PAGE电泳分析
经体外模拟胃部消化产物的SDS-PAGE电泳如图1所示,消化不同时间产物蛋白条带位置相似,但相较于未经胃部消化的 α-AI亮度降低,说明 α-AI蛋白含量略降低,但随着消化时间的延长条带仍较清晰,表明 α-AI组分在该过程中并未完全水解。白芸豆中 α-AI蛋白的主要亚基分子质量范围在90~20 ku,其中,α-AI主要存在于清蛋白中,其分子质量为34 ku,与文献报道接近[19]。α-AI蛋白经超滤处理后在31、27 ku处的亚基条带可能是凝集素或小分子清蛋白。经胃部消化后 α-AI在31、27 ku处的亚基条带则可能被水解为分子质量约为20 ku的多肽。
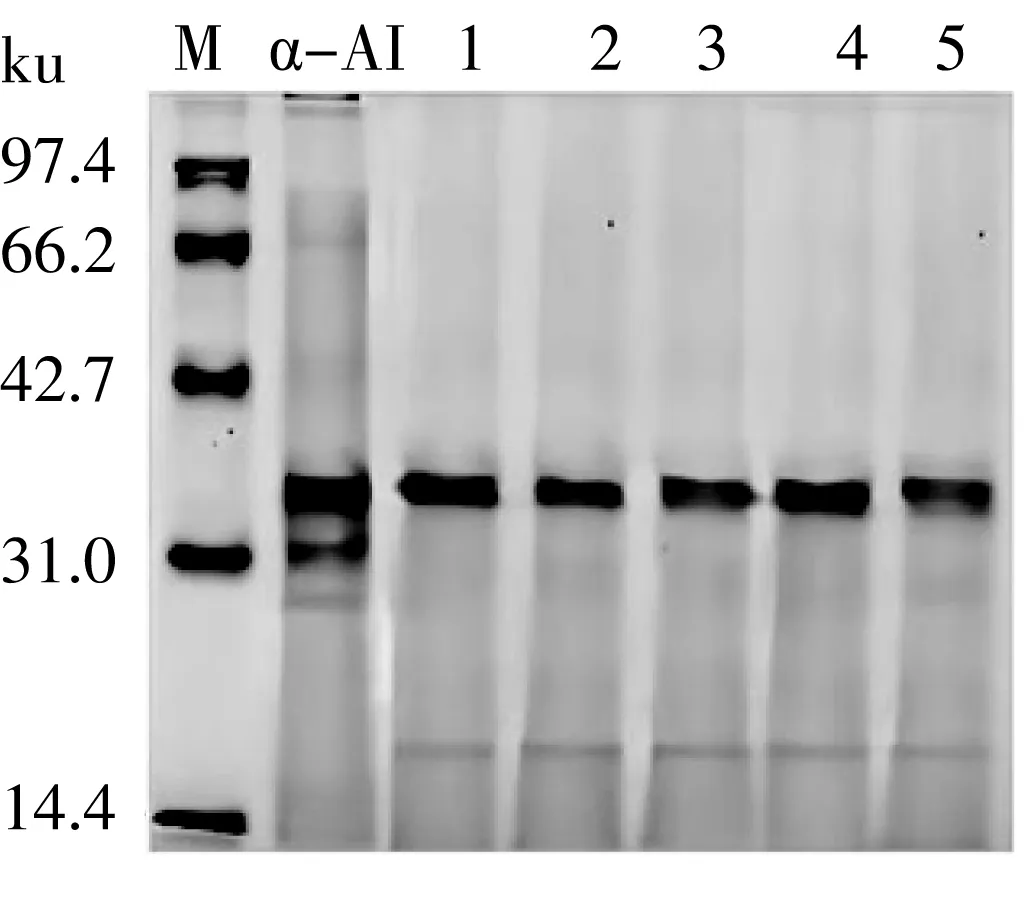
注:M为标准蛋白Marker;白芸豆α-AI、1~5分别为模拟胃部消化不同时间(0、15、30、60、90、120 min)的消化产物。图1 模拟胃消化不同时间白芸豆α-AI的SDS-PAGE电泳图
2.2 α-AI活性测定
如图2所示,当体外模拟胃部消化时间大于90 min时产物对 α-淀粉酶的抑制活性显著增加(P<0.05)。未经胃消化处理的 α-AI对 α-淀粉酶活性抑制率为(84.13±0.67)%,由于胃蛋白酶的酶解作用,消化初始阶段 α-AI的抑制率略有降低,但消化60 min时 α-AI抑制率为(84.75±0.51)%,消化120 min时 α-AI抑制率为 α-AI初始抑制率的1.04倍,这可能是由于胃蛋白酶水解了 α-AI蛋白中芳香族氨基酸或酸性氨基酸的氨基所组成的肽键,形成的多肽对 α-淀粉酶具有良好的抑制作用[20],让一峰等[21]研究也发现,α-AI在体内可以较好地发挥其抑制α-淀粉酶的活性。
2.3 α-AI粒径分布
白芸豆 α-AI经不同消化时间产物的粒径分布如图3所示,α-AI粒径分布呈单一峰型,说明体系较稳定,α-AI与不同消化时间产物的中位径(D50)基本都在120~170 nm之间。由于胃蛋白酶和消化液的共同作用蛋白质不断被酶解,因此消化后产物较未经消化的 α-AI中位径显著降低(P<0.05),且随着消化时间的延长消化产物的D50值也逐渐减小,从大到小依次为 α-AI(165.6 nm)、消化15 min(157.3 nm)、消化30 min(140.6 nm)、消化60 min(125.6 nm)、消化90 min(122.7 nm)和消化120 min(117.5 nm)。同时,经胃部消化后小部分蛋白分子粒径增加,可能是由于消化作用导致蛋白质分子之间出现聚集现象,其中消化15 min产物的粒径增加最为明显,此时产物对α-淀粉酶抑制率也最低(见图2),进一步说明 α-AI蛋白构象发生了改变。另外,经体外模拟胃部消化产物中出现强度较小的峰,结合SDS-PAGE分析,可能为 α-AI蛋白亚基(分子质量分别为31、27 ku)被水解后形成的多肽。
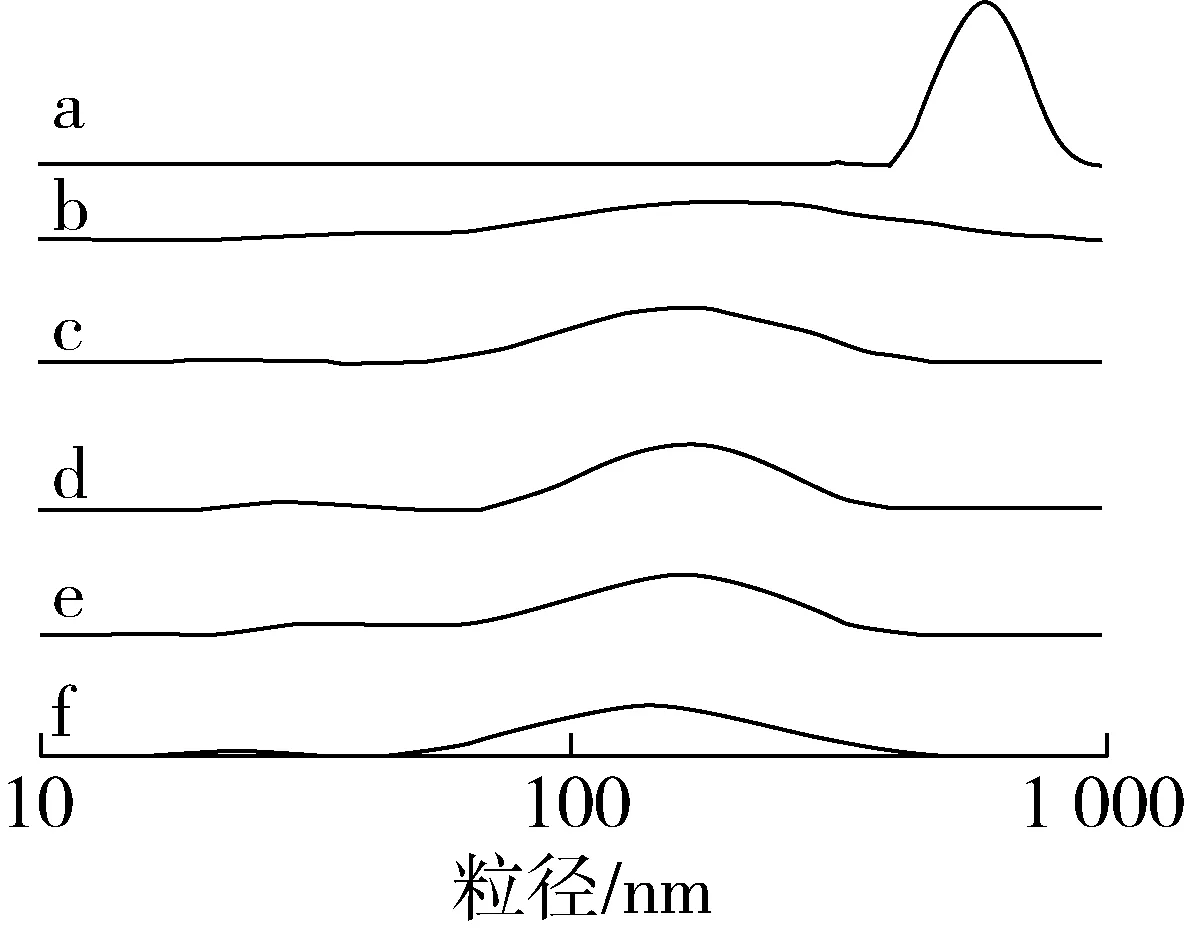
注:a~f分别为白芸豆α-AI在不同时间(0、15、30、60、90和120 min)消化产物的粒径分布图。图3 模拟胃部消化不同时间白芸豆α-AI粒径分布图
2.4 Zeta电位分析
Zeta电位是反映蛋白溶液稳定性的重要指标之一,一般而言电位的绝对值与粒子之间的相互斥力呈正相关,当电位的绝对值变大时,蛋白的结构更加稳定[22]。白芸豆 α-AI经不同时间消化产物的Zeta电位值见图4。α-AI的Zeta电位绝对值为26.8 mV,经体外模拟胃部消化后产物Zeta电位的绝对值显著降低(P<0.05),说明在胃蛋白酶和消化液的共同作用下蛋白的稳定性降低,当消化时间为30 min和60 min时样品的Zeta电位绝对值最低,蛋白表面所带同性电荷较少,由于静电排斥作用的减少,蛋白质之间发生共价交联机会增加,体系中蛋白质倾向于相互聚集[23],当消化时间大于90 min时样品的Zeta电位绝对值显著增加(P<0.05),此时蛋白表面同性电荷增多,同性电荷间的相互排斥使消化物的稳定性逐渐增强,蛋白分子间的相互聚集作用减弱,对 α-淀粉酶的抑制活性也显著增加(见图2),推测α-AI的Zeta电位变化可能与结构变化有关,进而影响其对α-淀粉酶的抑制活性。
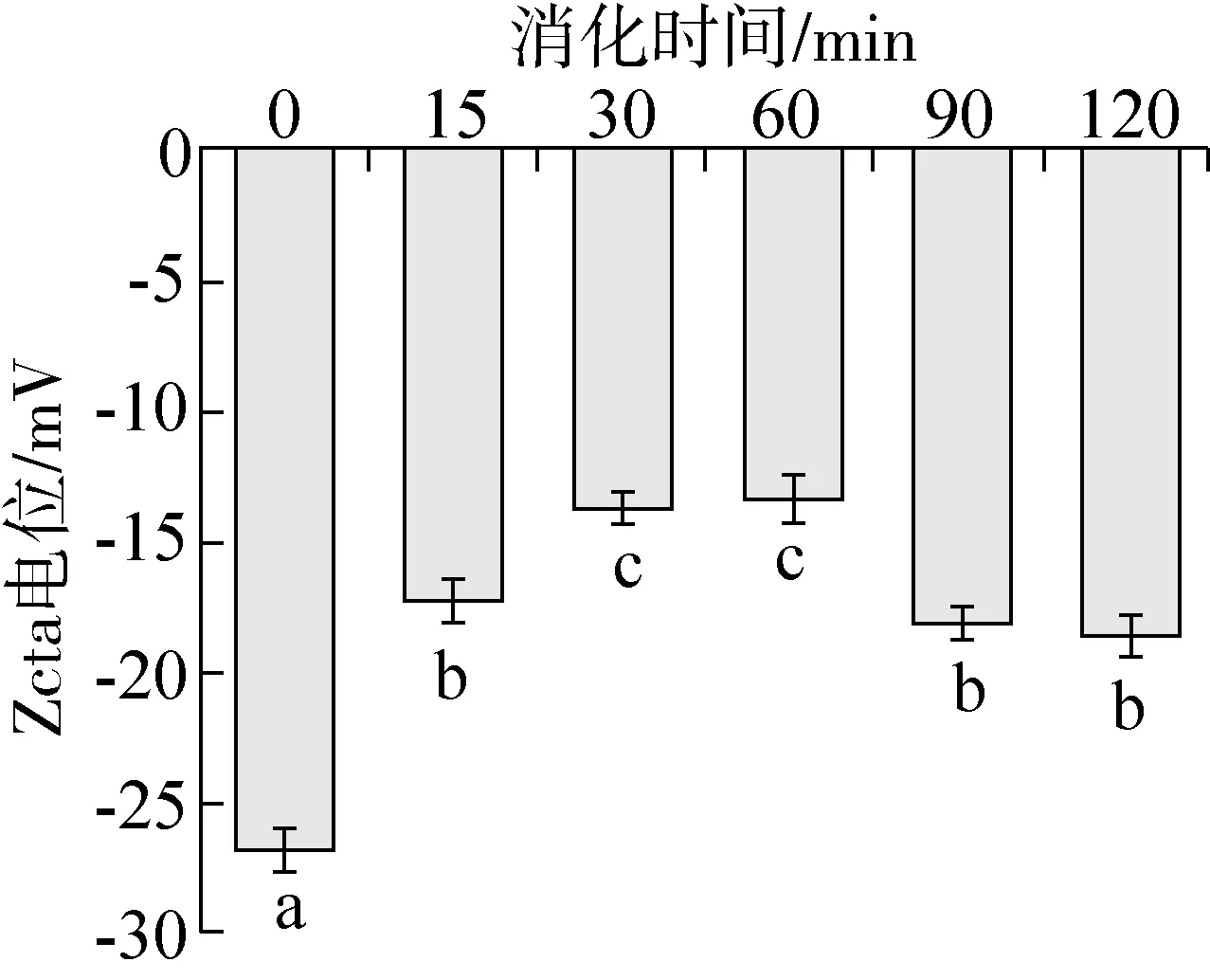
注:字母不同表示差异显著(P<0.05)。图4 模拟胃部消化不同时间白芸豆α-AI的Zeta电位值
2.5 α-AI二级结构分析
傅里叶变换红外光谱(FTIR)中,蛋白质的二级结构在1 600~1 700 cm-1波段与酰胺Ⅰ带重合[24],一般情况下不同蛋白质之间存在明显差异。α-AI经不同时间消化产物的FTIR谱图经PeakFit软件去卷积和曲线拟合后得到 α-AI及消化产物的酰胺Ⅰ带图谱,利用峰面积计算其二级结构组成。由表1可知,白芸豆α-AI蛋白二级结构中β-转角相对含量最多,无规则卷曲和β-折叠次之,与毛小雨等[14]、冯玉超等[25]研究的芸豆蛋白二级结构中以 β-折叠为主存在明显不同,说明白芸豆α-AI蛋白与白芸豆蛋白的二级结构存在一定的差异,2种蛋白的空间构效像不同。经胃蛋白酶和消化液体外模拟胃部消化反应不同时间,白芸豆α-AI蛋白二级结构中α-螺旋、β-折叠、β-转角和无规则卷曲的相对含量大部分均有显著差异(P<0.05),模拟胃部消化初期,为提高消化产物的稳定性α-AI蛋白二级结构中α-螺旋相对含量有所增加,同时存在多肽链反转180°形成β-转角[26],消化产物二级结构中β-转角相对含量增加,无规则卷曲相对含量降低。随着消化时间的延长α-AI蛋白二级结构中α-螺旋、β-折叠相对含量降低,β-转角和无规则卷曲相对含量增加。胃部消化使 α-AI蛋白二级结构中无规则卷曲首先展开,形成 α-螺旋和 β-折叠。当消化时间大于30 min时 α-AI蛋白二级结构中 β-折叠的减少以及无规则卷曲的增加都说明消化作用改变了部分蛋白的空间构象,导致蛋白质结构松散,在胃蛋白作用下形成的蛋白多肽更有利于对 α-淀粉酶的抑制作用。
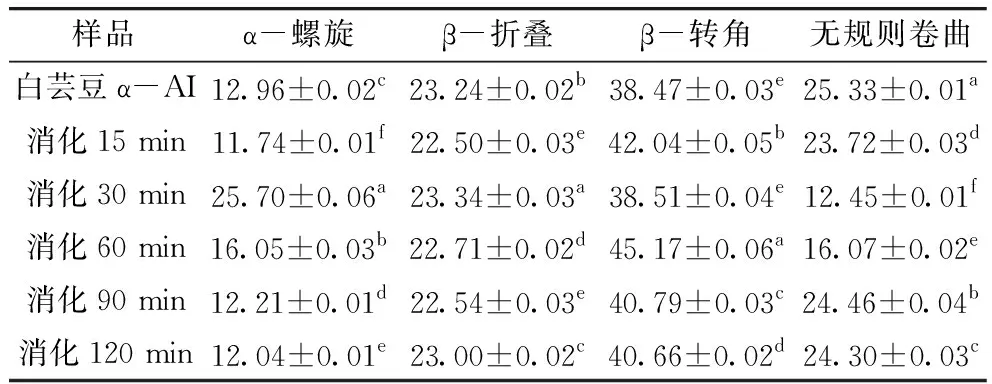
表1 模拟胃部消化不同时间白芸豆α-AI的二级结构组成/%
2.6 α-AI中巯基和二硫键含量测定
巯基是蛋白质中最具活性的官能团,巯基发生氧化反应产生的二硫键可作为稳定蛋白质构象的一种重要的共价键,有助于维持蛋白质的三维空间结构[27]。α-AI蛋白在模拟胃部消化不同时间巯基(总巯基、游离巯基)和二硫键含量如图5所示。由于胃蛋白酶及消化液的共同作用,反应初期 α-AI蛋白中巯基和二硫键含量显著降低(P<0.05),但随着消化时间延长,α-AI蛋白分子间的交互和聚集现象不断加剧,部分巯基发生氧化形成二硫键,因此 α-AI蛋白中总巯基和二硫键含量略有升高,游离巯基含量无显著变化。结果表明,α-AI蛋白经胃部消化后蛋白结构变得松散,但当消化时间大于60 min时消化产物的稳定性有所提升,仍可以较好地发挥其抑制 α-淀粉酶的活性。
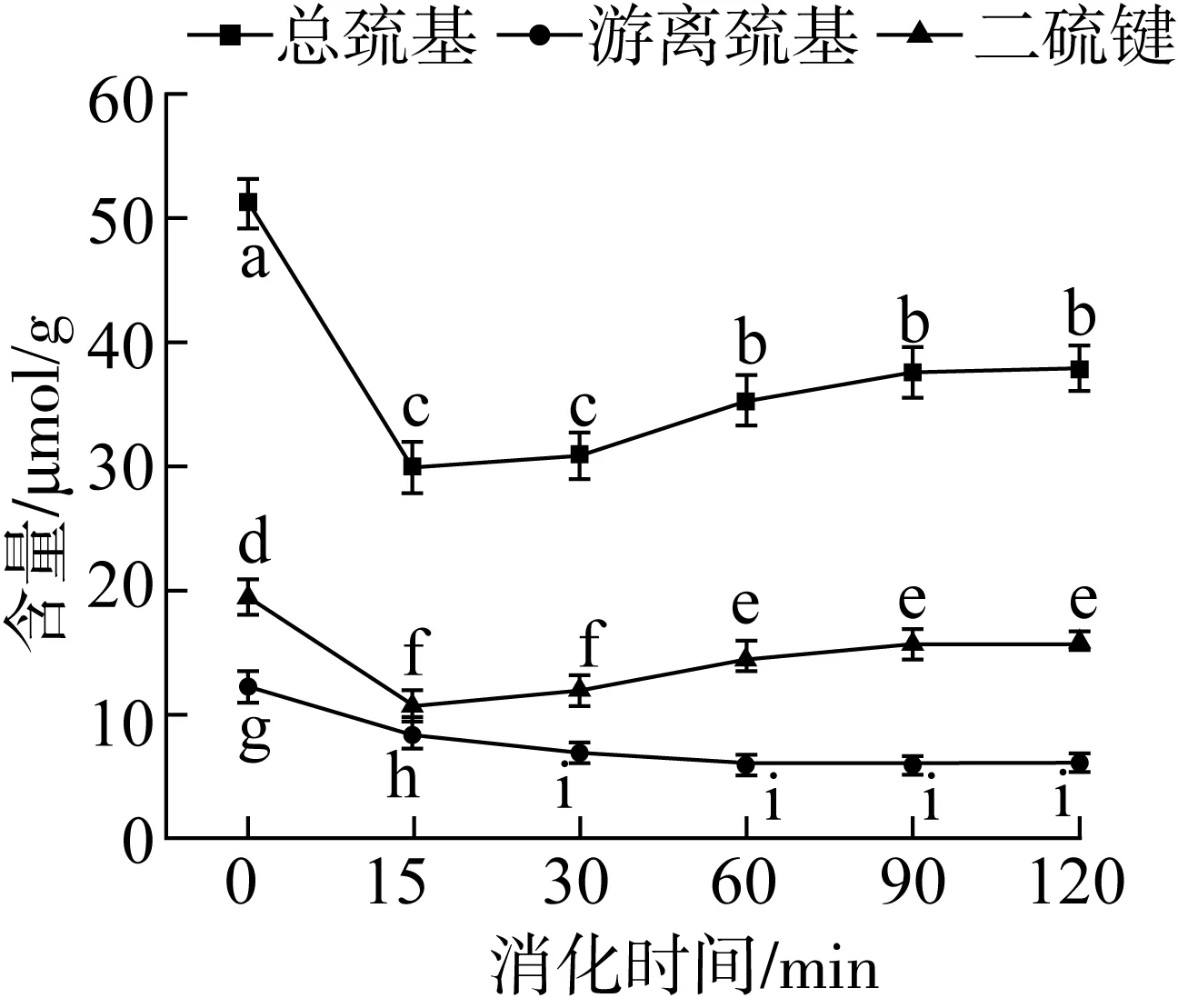
注:同一指标字母不同表示差异显著(P<0.05)。图5 模拟胃部消化不同时间白芸豆α-AI巯基和二硫键含量
3 结论
白芸豆α-AI主要以清蛋白的形式存在,经体外模拟胃部消化后α-AI蛋白可能存在部分亚基水解成多肽,对α-淀粉酶的抑制活性显著增加。消化产物粒径显著降低,但其稳定性逐渐增强。α-AI蛋白消化产物二级结构中β-转角相对含量增加,无规则卷曲相对含量降低,总巯基、游离巯基含量均显著降低,二硫键含量显著升高。另外,研究发现 α-AI的Zeta电位变化可能与其对α-淀粉酶的抑制活性有关。随着现代生物技术的不断发展,α-淀粉酶抑制剂的应用前景将更加广阔,对其消化产物的性质分析具有十分重要的意义,并对进一步分析其在人体内的转运吸收路径提供一定的借鉴。
