橄榄苦苷抑制胃癌AGS细胞增殖、迁移和侵袭
2023-07-26周鑫谷建海
周鑫 谷建海
(临沂市肿瘤医院药学部,山东 临沂 276001)
近年来,胃癌已成为我国最常见的消化道恶性肿瘤之一。由于缺乏临床症状多数患者诊断为晚期,化疗是胃癌晚期患者的主要治疗段,但往往产生骨髓抑制、肝肾功能损害、胃肠道反应等毒副作用〔1〕。因此,寻找新的治疗药物已成为医务工作者亟待解决的问题。橄榄苦苷作为橄榄油、橄榄叶等橄榄产品的主要生物酚成分,是公认的抗氧化剂。橄榄苦苷通过诱导细胞凋亡、抑制细胞增殖和肿瘤形成、逆转放疗抵抗在乳腺癌、前列腺癌、黑色素瘤、卵巢癌等肿瘤中具有抗癌活性〔2~5〕。有报道称,橄榄苦苷磁性纳米颗粒还可抑制胃癌细胞增殖,是预防和治疗胃腺癌的潜在药物〔6〕。微小RNA(miRNA)可作为治疗人类疾病的潜在药物靶点。既往研究报道,非小细胞肺癌中miR-4792表达降低,上调其表达具有诱导癌细胞凋亡,抑制癌细胞迁移和侵袭等生物学活性〔7〕。此外,miR-4792通过靶向叉头框基因(FOX)C1能够抑制鼻咽癌上皮间质转化(EMT)和侵袭〔8〕。但miR-4792在胃癌中是否发挥抗癌作用并不清楚。本研究旨在分析不同浓度橄榄苦苷对胃癌细胞增殖、迁移、侵袭的影响,并探讨其是否通过调控miR-4792表达发挥作用。
1 材料与方法
1.1细胞和试剂 胃癌细胞AGS购于中国科学院上海细胞库;橄榄苦苷(纯度≥98%)购于四川省维克奇生物科技有限公司;细胞计数试剂盒(CCK-8)、总蛋白提取试剂盒购自上海贝博生物公司;康宁24-Transwell小室购自南京迅贝生物科技有限公司;上皮型钙黏蛋白(E-cadherin)兔多克隆抗体、神经型钙黏蛋白(N-cadherin)兔单克隆抗体、磷酸甘油醛脱氢酶(GAPDH)兔单克隆抗体、山羊抗兔IgG二抗购自北京义翘神州科技股份公司;Lipofectamine2000、cDNA合成试剂盒购自美国Invitrogen公司;SYBR Premix Ex Taq购自日本TaKaRa公司;miR-4792模拟物(mimics)、抑制物(anti-miR-4792)及相应对照(miR-NC、anti-miR-NC)购自上海生工生物公司。
1.2方法
1.2.1橄榄苦苷对AGS细胞增殖的影响 分别采用含0、100、200、400 μg/ml橄榄苦苷〔9〕的杜尔伯格伊戈尔培养基(DMEM)置于37 ℃、含5%CO2、饱和湿度培养箱孵育AGS细胞,依次标记为对照组、橄榄苦苷低剂量组、橄榄苦苷中剂量组、橄榄苦苷高剂量组。孵育48 h后,收集5×102个细胞均匀铺6孔板,培养箱内孵育10~12 d。甲醇固定细胞集落,0.5%结晶紫染色20 min。以显微镜下大于50个细胞的集落为有效克隆数。每组设置3个复孔,实验独立重复9次。同时将5×103个AGS细胞接种96孔板,加入含对应剂量橄榄苦苷的DMEM培养液富于细胞48 h,更换为新鲜培养液,向各孔添加CCK-8溶液(10 μl/孔)孵育细胞2 h。设置450 nm波长,酶标仪测量各孔光密度(OD)。增殖抑制率=(A对照组-A实验组)/(A对照组-A空白组)×100%。每组设置3个复孔,实验独立重复9次。
1.2.2橄榄苦苷对AGS细胞迁移的影响 将1×104个橄榄苦苷处理48 h的AGS细胞接种6孔板,当细胞生长至一层时,用200 μl枪头尖端在细胞表面划一直线。用磷酸盐缓冲液(PBS)洗涤去除细胞碎片。在划痕0 h、培养24 h后用Image软件确定创面宽度。划痕愈合率=〔宽度(0 h)-宽度(24 h)〕/宽度(0 h)×100%。每组设置3个复孔,实验独立重复9次。
1.2.3橄榄苦苷对AGS细胞侵袭的影响 采用包被80 μl基质胶的24-Transwell小室(0.8 mg/ml)进行侵袭实验。收集橄榄苦苷处理48 h的AGS细胞,用胰蛋白酶消化细胞,用无血清DMEM培养基重悬细胞。Transwell小室接种200 μl约2×104个悬浮细胞,下腔接种600 μl含10%血清培养基。常规孵育24 h,4%多聚甲醛室温固定Transwell膜下表面15 min,PBS洗2次,0.5%结晶紫染色30 min。在倒置显微镜下随机选择3个视野对染色的侵袭性细胞拍照,以平均值表示AGS细胞侵袭数量。每组设置3个复孔,实验独立重复9次。
1.2.4橄榄苦苷对AGS细胞miR-4792表达的影响 使用Trizol试剂从对照组、橄榄苦苷处理组细胞中提取总RNA。采用cDNA合成试剂盒获得cDNA,然后SYBR Premix Ex Taq进行实时定量PCR(RT-qPCR)。内源对照为U6。PCR参数为:95 ℃ 10 min,95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。PCR循环结束后,进行熔解曲线分析。AGS细胞中miR-4792的相对表达水平以2-ΔΔCt法计算。每组设置3个复孔,实验独立重复9次。
1.2.5橄榄苦苷对AGS细胞E-cadherin和N-cadherin蛋白表达的影响 总蛋白提取试剂盒分离橄榄苦苷处理组AGS细胞总蛋白,用二喹啉甲酸(BCA)试剂盒进行定量。蛋白样品用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移蛋白至聚偏氟乙烯膜,5%脱脂牛奶封闭后,然后对膜进行免疫检测。采用1∶1 000稀释的E-cadherin一抗、N-cadherin一抗、内参GAPDH一抗室温孵育膜2 h。再用1∶1 000稀释山羊抗兔IgG二抗室温孵育膜1 h。滴加化学发光检测试剂进行显色。Quantify One软件分析测定目的蛋白条带相对灰度值。每组设置3个复孔,实验独立重复9次。
1.2.6细胞转染 将2×105个对数期AGS细胞在6孔板中培养,按照Lipofectamine2000说明分别转染miR-NC、miR-4792 mimics、anti-miR-NC、anti-miR-4792至60%汇合AGS细胞,随后收集转染48 h细胞。转染miR-NC、转染miR-4792 mimics的AGS细胞记为miR-NC组、miR-4792组。用含400 μg/ml橄榄苦苷的DMEM培养液孵育转染anti-miR-NC或者转染anti-miR-4792细胞48 h,记为橄榄苦苷+anti-miR-NC组、橄榄苦苷+anti-miR-4792组。
1.2.7过表达miR-4792或者抑制miR-4792表达联合橄榄苦苷处理对AGS细胞生物学性的影响 收集miR-NC组、miR-4792组、橄榄苦苷+anti-miR-NC组、橄榄苦苷+anti-miR-4792组AGS细胞,按照上述步骤观察过表达miR-4792或者抑制miR-4792表达联合橄榄苦苷对AGS细胞生物学行为的影响。每组设置3个复孔,实验独立重复9次。
1.3统计学分析 采用SPSS18.0软件进行t检验、方差分析,组间两两比较采用SNK-q检验。
2 结 果
2.1橄榄苦苷对胃癌AGS细胞增殖的影响 与对照组比较,橄榄苦苷处理组AGS细胞克隆形成个数均显著下降,增殖抑制率显著升高(均P<0.05)。见表1、图1。
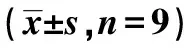
表1 橄榄苦苷对胃癌AGS细胞增殖的影响
2.2橄榄苦苷对胃癌AGS细胞迁移和侵袭的影响 与对照组比较,橄榄苦苷处理组AGS细胞N-cadherin蛋白表达量、划痕愈合率、侵袭数量显著降低,E-cadherin蛋白表达量显著升高(均P<0.05)。见图2、表2、图3。
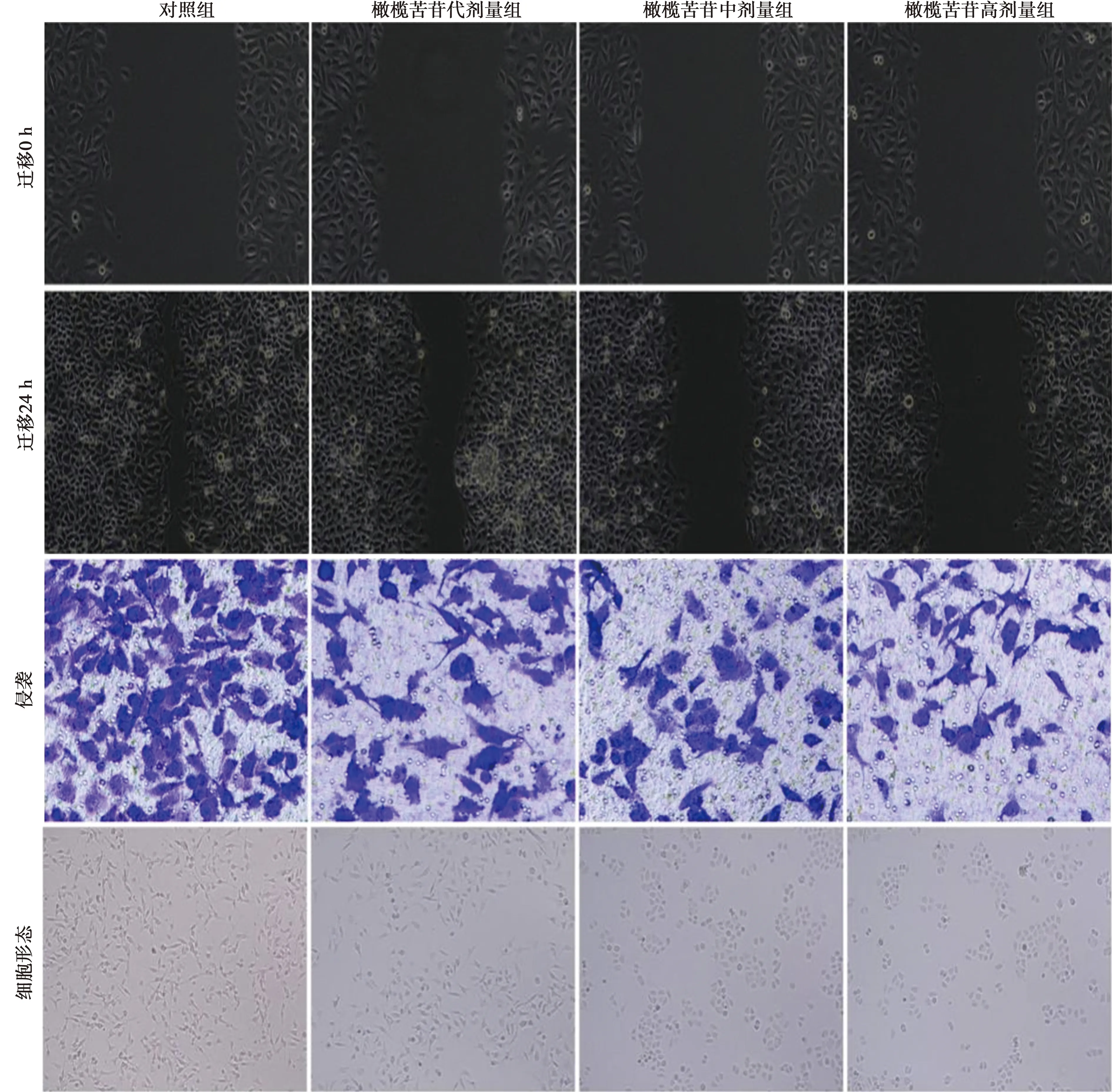
图2 橄榄苦苷对胃癌AGS细胞迁移(×200)、侵袭(结晶紫染色,×400)及形态(×200)的影响
1~4:对照组、橄榄苦苷低剂量组、橄榄苦苷中剂量组、橄榄苦苷高剂量组图3 Western印迹检测E-cadherin、N-cadherin蛋白表达
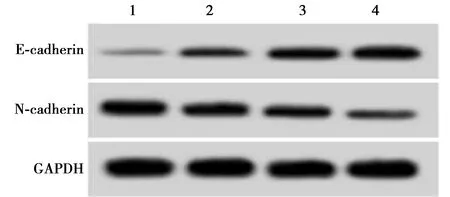
图4 miR-4792过表达对胃癌AGS细胞E-cadherin和N-cadherin蛋白表达的影响
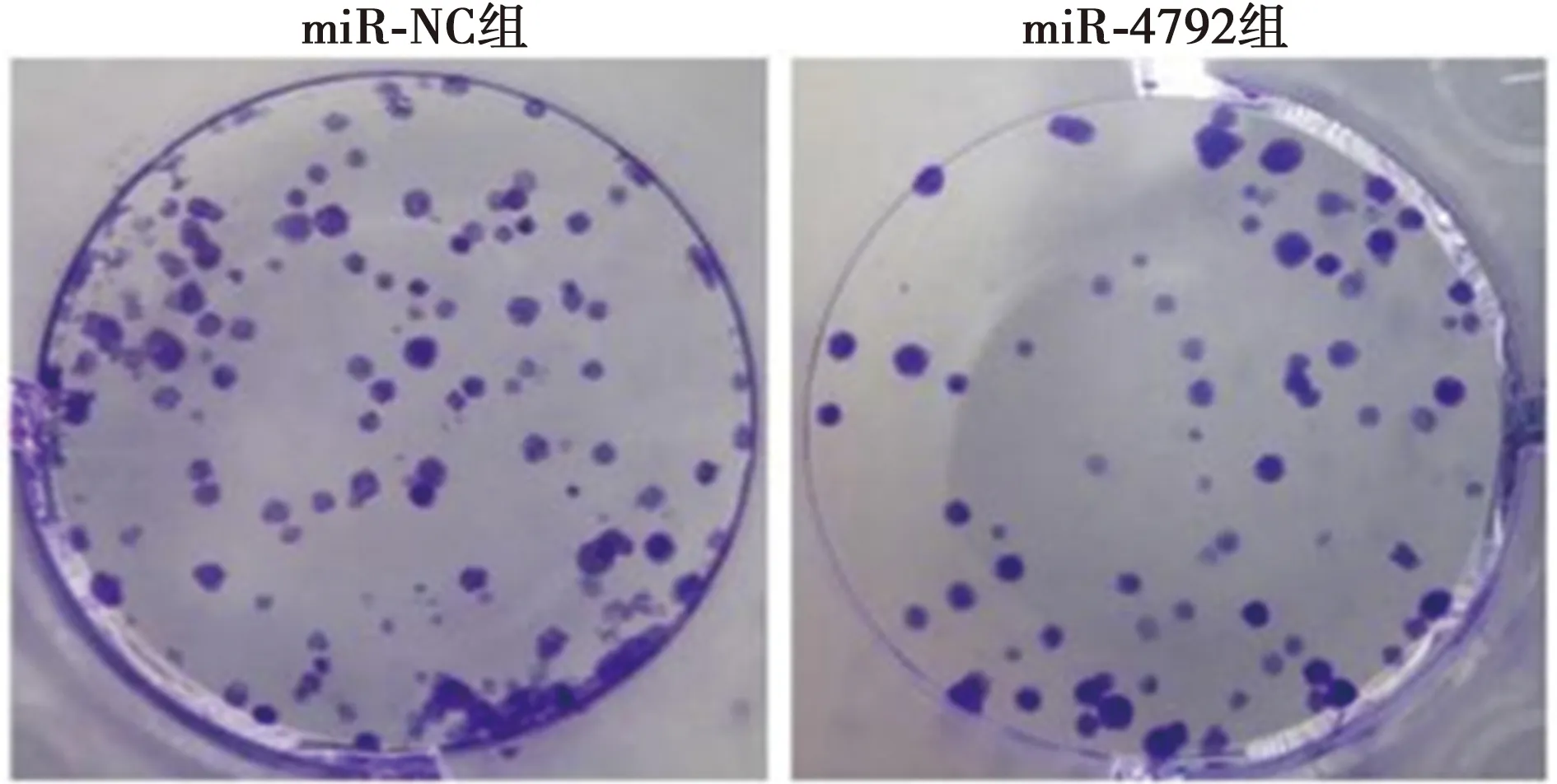
图5 miR-4792过表达对胃癌AGS细胞克隆形成的影响(结晶紫染色,×20)
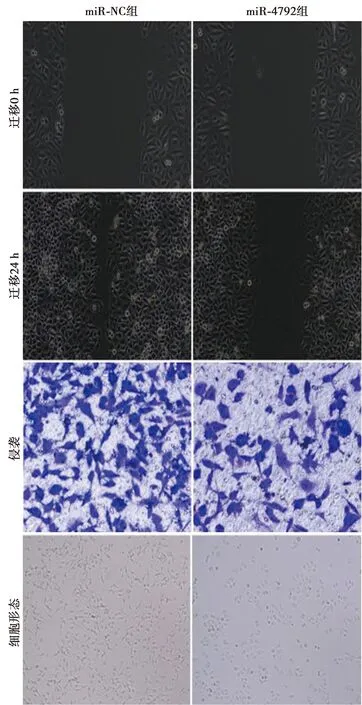
图6 miR-4792过表达对胃癌AGS细胞迁移(×200)、侵袭(结晶紫染色,×400)及形态(×200)的影响
表2 橄榄苦苷对胃癌AGS细胞迁移、侵袭及miR-4792表达的影响
2.3橄榄苦苷对胃癌AGS细胞miR-4792表达的影响 与对照组比较,橄榄苦苷处理组AGS细胞miR-4792表达量显著升高(P<0.05)。见表2。
2.4miR-4792过表达对胃癌AGS细胞增殖、迁移和侵袭的影响 与miR-NC组比较,miR-4792组AGS细胞miR-4792表达显著升高(P<0.05),提示miR-4792过表达的AGS细胞株构建成功。与miR-NC组比较,miR-4792组AGS细胞克隆形成个数、划痕愈合率、侵袭细胞数量、N-cadherin蛋白表达量显著下降,而增殖抑制率、E-cadherin蛋白表达显著升高(均P<0.05)。见图4~6、表3。
表3 miR-4792过表达对胃癌AGS细胞增殖、迁移和侵袭的影响
2.5抑制miR-4792表达逆转了橄榄苦苷(400 μg/ml)对胃癌AGS细胞增殖、迁移侵袭的影响 与橄榄苦苷+anti-miR-NC组比较,橄榄苦苷+anti-miR-4792组AGS细胞miR-4792表达量显著降低,细胞克隆形成个数、划痕愈合率、侵袭细胞数量、N-cadherin蛋白表达量显著升高,而增殖抑制率、E-cadherin蛋白表达量显著降低(均P<0.05)。见图7~图9、表4。
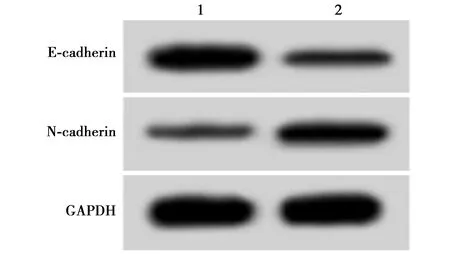
1,2:橄榄甘苷+anti-miR-NC组、橄榄苦苷+anti-miR-4792组图7 抑制miR-4792表达逆转了橄榄苦苷对胃癌AGS细胞E-cadherin和N-cadherin蛋白表达的影响
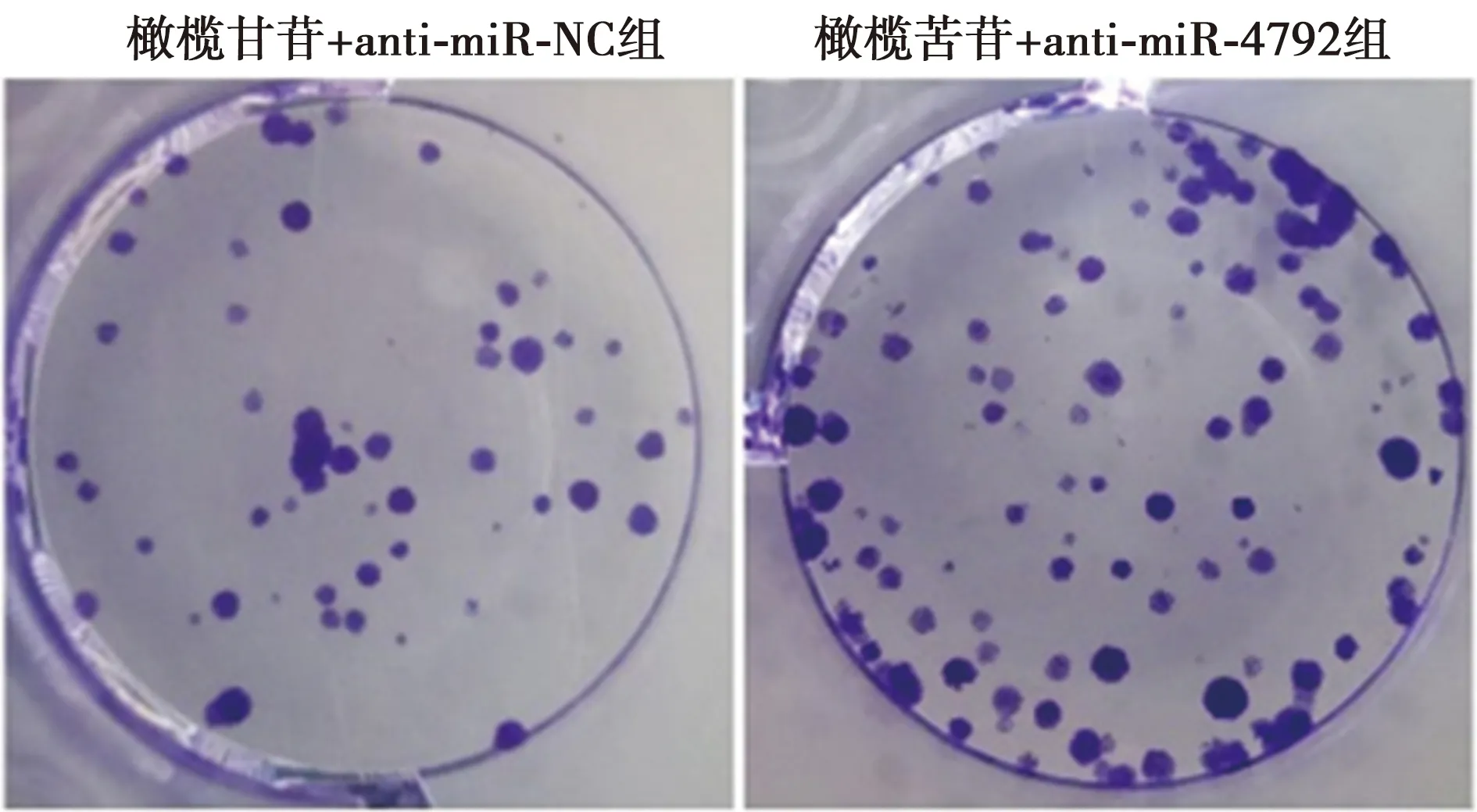
图8 抑制miR-4792表达逆转了橄榄苦苷对胃癌AGS细胞克隆形成的影响(结晶紫染色,×20)
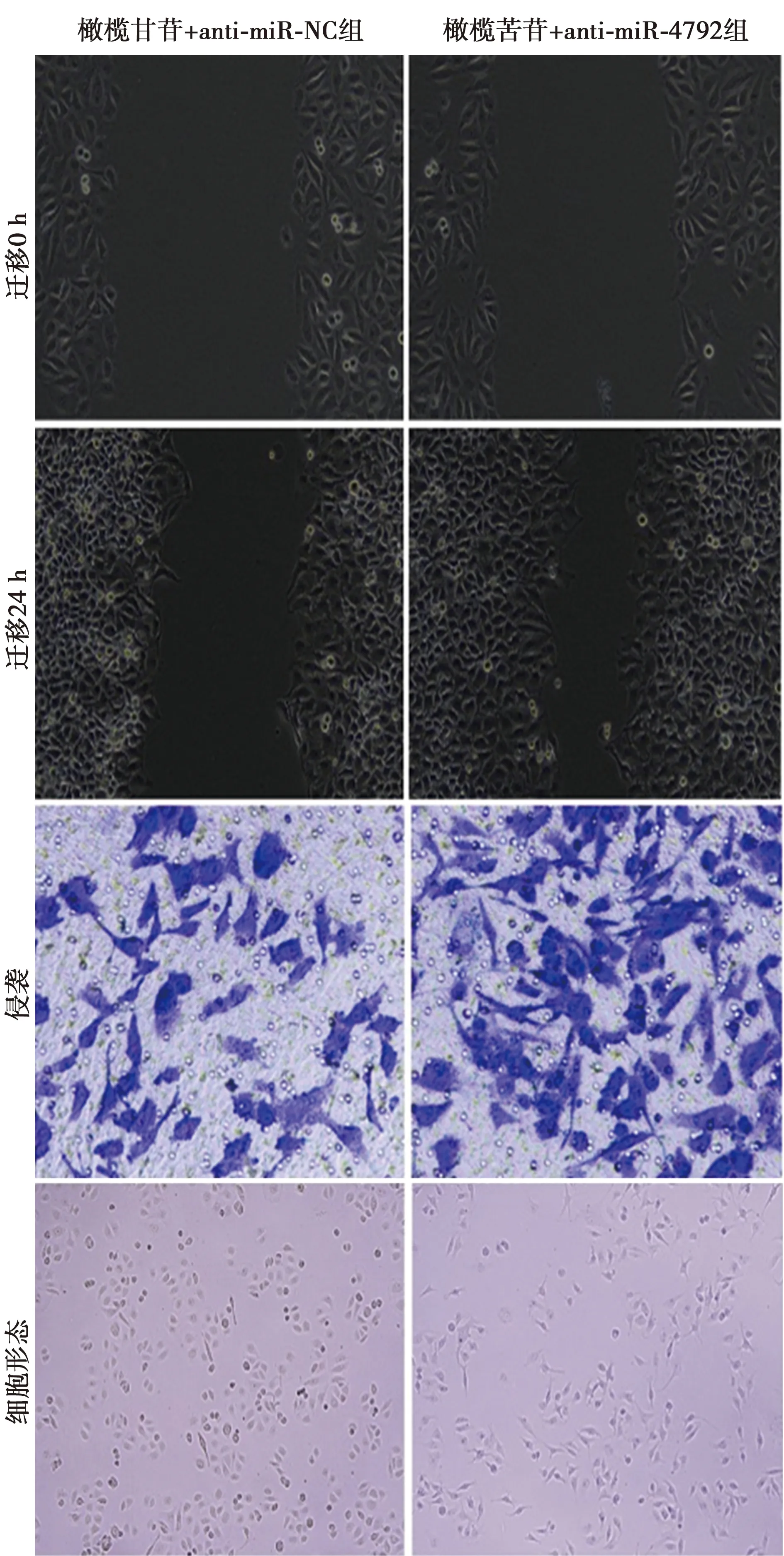
图9 抑制miR-4792表达逆转了橄榄苦苷对胃癌AGS细胞迁移(×200)、侵袭(结晶紫染色,×400)及形态(×200)的影响
表4 抑制miR-4792表达逆转了橄榄苦苷对胃癌AGS细胞增殖、迁移侵袭的影响
3 讨 论
橄榄苦苷在多种人类癌症中显示出抗肿瘤特性。Zhang等〔10〕研究表明,橄榄苦苷在体外对食管癌细胞增殖、迁移和侵袭具有抑制作用,并抑制体内异种移植瘤形成。Liu等〔11〕证实橄榄苦苷可消除核因子(NF)-κB激活级联反应,进而诱导乳腺癌细胞大量凋亡。此外,Lu等〔12〕发现橄榄苦苷可能通过激活自噬来抑制三阴性乳腺癌细胞的迁移和侵袭。本研究提示橄榄苦苷对胃癌细胞恶性生物学行为具有抑制作用。有数据表明,EMT与癌细胞的迁移、侵袭及癌症转移、复发有关〔13〕。在EMT过程中,上皮标志物E-cadherin表达下调,间质标志物N-cadherin表达上调〔14〕。本研究结果表明,橄榄苦苷可能通过抑制EMT进而抑制胃癌细胞迁移和侵袭。
miRNA表达失调可影响细胞的发育、分化、增殖、凋亡,参与肿瘤的发生和进展。前期研究发现,在乳腺癌中橄榄苦苷通过下调致癌基因miR-21和miR-155的表达来诱导乳腺癌细胞凋亡,抑制乳腺癌细胞迁移和侵袭〔15,16〕。橄榄苦苷在体外和体内均能增强鼻咽癌细胞的放射敏感性,其机制与抑制氧诱导因子(HIF)-1α诱导的miR-519d表达有关〔17〕。此外,橄榄苦苷通过调控Let-7d表达对胶质瘤细胞表现出抗癌作用〔18〕。本研究结果提示,橄榄苦苷在胃癌中的抗肿瘤作用可能与上调miR-4792有关。据报道,miR-4792在非小细胞肺癌、鼻咽癌、急性髓性白血病中起着抑癌作用,miR-4792通过靶向Kindlin-3抑制急性髓系白血病细胞增殖和侵袭,促进细胞凋亡〔7,8,19〕。本研究结果说明,橄榄苦苷对胃癌细胞AGS增殖、迁移和侵袭的抑制作用可能是通过上调miR-4792表达实现的。
