基于HIF-1信号通路基因变化探讨COPD肺血管病变的发生机制
2023-07-26李小娟郭思佳孙增涛王坤李晓丹岳宝柱栾哲宇
李小娟 郭思佳 孙增涛 王坤 李晓丹 岳宝柱 栾哲宇
(1天津中医药大学第二附属医院呼吸科,天津 300250;2天津中医药大学;3郑州市第三人民医院呼吸科)
慢性阻塞性肺疾病(COPD)是一种以气流受限为主要特征的呼吸系统常见病与高发病。该病虽可预防和治疗,但由于病程迁延反复,疾病往往呈进行性发展,严重影响患者的生活质量和劳动能力,为社会带来沉重负担〔1〕。据统计,我国目前COPD患者已达到约1亿人,其中40岁以上人群的患病率高达13.7%〔2〕。COPD患者的肺血管病变是其特征性病理学改变之一,也是其发展成肺心病的重要原因。研究显示,COPD患者中每年有约6%发展至肺心病,尸检资料显示,COPD患者中约有40%存在右心室肥大〔3〕。因此,认识COPD进展中肺血管病变的形成机制,针对性进行干预,是延缓COPD发展为肺心病的关键。
低氧诱导因子(HIF)-1是机体中调节氧稳态的核心转录因子,它是由HIF-1α和HIF-1β两个亚基组成的异二聚体。HIF-1α在常氧时基本不表达,当机体处于缺氧状态下则呈现高表达,促使细胞及组织发生一系列反应以使机体适应缺氧环境〔4〕。相关研究〔5,6〕显示,在COPD患者肺组织中 HIF-1α mRNA及其蛋白质的含量均明显升高,提示HIF-1α与缺氧性肺血管病变可能存在明显相关性。HIF-1在缺氧早期即出现表达上调,其通过调控多种靶基因的表达,参与机体缺氧早期最先出现的分子水平适应性反应。诸多内源性细胞因子失衡都可以由缺氧诱发,如热休克蛋白(HSP)90、内皮素(ET)-1、血管内皮生长因子(VEGF)生成增多,诱导型一氧化氮合成酶(iNOS)释放异常等〔7〕,这一系列变化反应会引起肺血管收缩/舒张反应失衡,造成肺血管重塑,最终导致COPD肺血管病变的发生。本研究通过检测COPD大鼠建模过程中肺组织HIF-1及其复合信号通路的基因表达情况,分析肺组织HIF-1复合通路基因表达改变情况与COPD肺血管病变发生发展的相关性。
1 材料与方法
1.1实验动物 健康的雄性SD大鼠30只,体质量(200±20)g,购自维通利华生物科技股份有限公司,许可证号:SCXK(京)2016-0006。于温度20~22 ℃,湿度50%左右环境中饲养。
1.2主要试剂及仪器 脂多糖(LPS,Sigma,批号:L2880);10% 甲醛固定液(索莱宝生物科技有限公司);无水乙醇(索莱宝生物科技有限公司);组织细胞总RNA提取试剂盒(天根生化科技有限公司);cDNA第一链合成试剂盒(天根生化科技有限公司);q-聚合酶链反应扩增试剂盒(天根生化科技有限公司);研究级倒置荧光显微镜(Olympus公司IX2-UCB型);超净工作台(ThermoFisher赛默飞世尔Herasafe KS型);高性能通用台式冷冻离心机(ThermoFisher赛默飞世尔Sorvall ST 16R型);小型台式离心机(ThermoFisher赛默飞世尔);-80 ℃超低温冰箱(ThermoFisher赛默飞世尔ULT2186-6-V49型);荧光定时定量 PCR 仪(Bio-Rad伯乐JJQ5型)。
1.3分组及模型构建 将30只雄性SD大鼠随机分为正常组10只和模型组20只,模型组后续分为造模6 w组和造模12 w组。正常组正常饲养,呼吸正常空气;模型组每天在染毒箱内被动吸烟(大前门牌烤烟型过滤嘴香烟,卷烟条码:6901028075916,烟气烟碱量:0.8 mg) 10支,1 d分上下午烟熏2次,每次60 min,每烟熏6 d,休息1 d,共持续熏烟12 w。在实验开始的第1天及第29天,使两组吸入乙醚麻醉,在其气道内分别缓慢滴注200 μl生理盐水和200 μl LPS水溶液(1 mg/ml),且当日不再予被动吸烟,通过以上方法构建COPD大鼠模型。实验过程中共有2只大鼠死亡,均来自模型组。
1.4标本采集 于造模前选取10只正常组大鼠,用2%戊巴比妥钠 100 mg/kg腹腔麻醉后,酒精消毒,打开胸腔,收集肺组织,将右肺组织中叶于-80 ℃冰箱保存,以备后续检测,左肺组织置于甲醛溶液中固定,至6 w随机选取模型组大鼠10只进行上述操作,至12 w造模完成后,将剩余模型组大鼠进行上述操作。
1.5q-PCR检测相关基因表达 各组肺组织进行q-PCR检测,将肺组织在液氮中磨碎,参照组织细胞总RNA提取试剂盒说明书提取组织总RNA。以总RNA为模板,参照cDNA第一链合成试剂盒说明书合成cDNA第一链。使用荧光定时定量PCR仪以cDNA链为模板检测相关基因表达。循环温度为:94 ℃ 4 min、94 ℃ 30 s、56 ℃ 30 s、72 ℃ 30 s,循环数为40,以磷酸甘油醛脱氢酶(GADPH)为内参,采用2-ΔΔCt法比较分析各基因表达,PCR引物序列(3′-5′):GADPH上游引物:GGCAAGTTCAACGGCACAG,下游:CGCCAGTAGACTCCACGACA;HIF-1α上游引物:CGCAACTGCCACCACTGATGAA,下游:GTGAGGCTGTCCGACTGTGAGTA;HSP-90上游引物:TTTCCAACTCCTCAGACGCTC,下游:AGGGTT-CGGTCTTGCTTGTT;VEGF上游引物:CGACAAGGCAGACTATTCAACG,下游:GGCACGATTTAAG-AGGGGAAT;ET-1上游引物:TTCAGACTGGCAGAGGACCA,下游:TCACTTGCTACCAGCGGATG;iNOS上游引物:TCTGTGCTAATGCGGAAG,下游:TTGGTGTTGAAGGCGTAG。
1.6肺组织病理切片 经洗涤、脱水、透明、透蜡、包埋、切片、展片、贴片、脱蜡复水、染色、水洗、分化、漂洗、脱水、复染、脱水、透明、封藏等步骤制成病理切片,最终细胞核被苏木素染成蓝色,细胞质被伊红染成粉红色。
1.7统计学方法 采用SPSS21.0软件行单因素方差分析,方差齐时用LSD法,方差不齐时用Dunnett法。
2 结 果
2.1COPD模型造模后不同时间点肺组织病理学变化 HE染色结果显示,正常组肺组织中支气管及肺泡结构完整,黏膜下未出现明显的炎细胞浸润,而在造模6 w后,相较正常组,支气管结构仍较为完整,但在黏膜下出现了明显的炎细胞浸润(黑色箭头),与此同时,肺泡出现结构不一,肺泡壁变薄或断裂引起部分肺泡扩大融合形成肺大泡(红色箭头),肺血管表现出不同程度增生,管壁增厚或管腔变形,管壁及周围可见较多炎性细胞浸润,微血管数量明显增多(黄色箭头);造模12 w后,COPD模型支气管结构出现一定程度损伤,部分支气管上皮细胞脱落(蓝色箭头),黏膜下出现大量炎细胞浸润(黑色箭头),肺泡结构紊乱,并进一步扩张融合形成大量肺大泡(红色箭头),且肺血管持续增生,其不论是管壁增厚还是管腔变形均较前有所加重,微血管数量进一步增多(黄色箭头)。见图1。
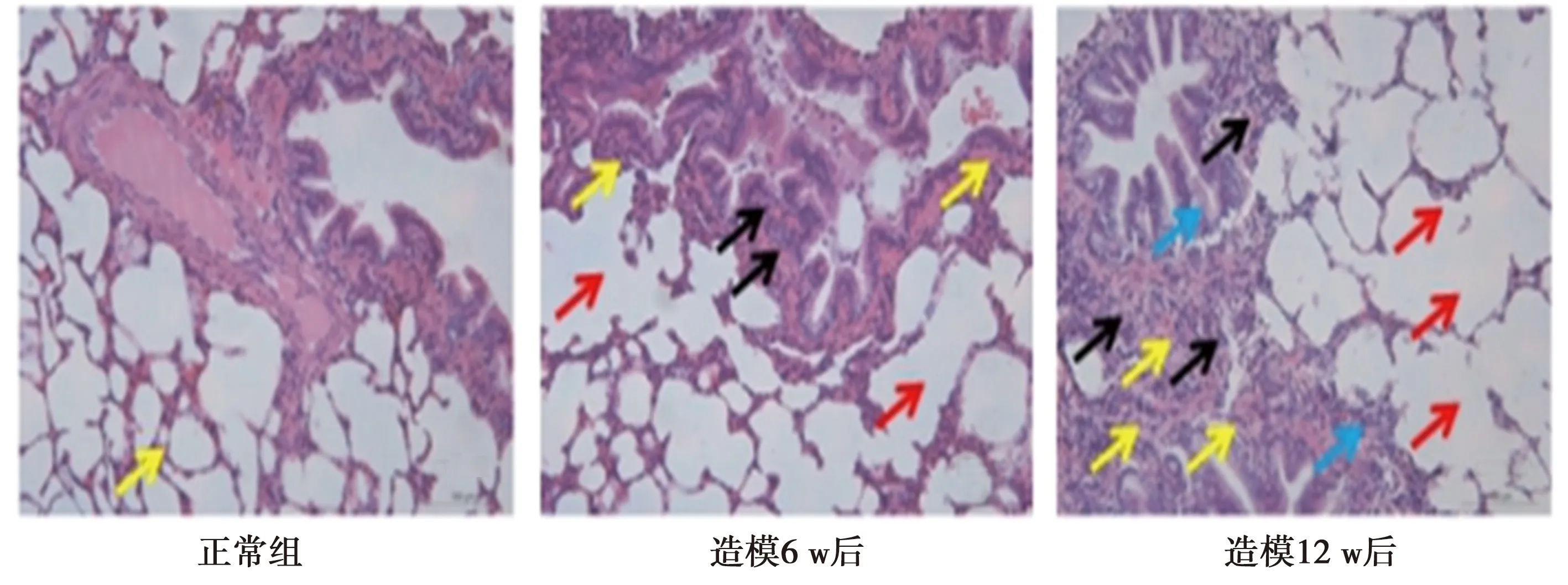
图1 COPD模型造模6、12 w时肺组织(HE染色,×200)
2.2造模后不同时间点肺组织基因表达水平 与正常组相比,造模6、12 w后肺组织中HIF-1α、HSP90、VEGF、ET-1 mRNA表达显著上调(P<0.05,P<0.01),且造模12 w后肺组织中HIF-1α、VEGF、iNOS mRNA表达与造模6 w时相比显著上调(P<0.05)。与造模6 w时相比,造模12 w后肺组织中HSP90、ET-1 mRNA表达无显著差异(P>0.05)。与正常组相比,iNOS mRNA表达在造模6 w时无显著差异(P>0.05),造模12 w后肺组织中iNOS mRNA表达显著上调(P<0.05)。见表1。
表1 造模后不同时间点肺组织中HIF1-α、HSP90、VEGF、ET-1及iNOS mRNA表达水平
2.3COPD模型造模后不同时间点肺组织中HIF-1复合通路相关基因表达水平 分别收集正常组、造模6、12 w组肺组织,q-PCR法检测COPD模型造模后不同时间点HIF-1复合通路关键基因HIF-1α、HSP90、VEGF、iNOS及ET-1 mRNA表达,GAPDH被选取作为内参。各基因扩增曲线见图2。可见各基因引物扩增曲线重复性良好,溶解曲线呈单峰,可用于后续实验检测。
3 讨 论
HIF-1是广泛分布于人体内的一种异源二聚体转录因子,由120 kU的HIF-1α 和91~94 kU的HIF-1β两个亚单位组成〔8〕。HIF-1蛋白只有机体处于缺氧状态下才具有活性,常氧下HIF-1蛋白很快失去活性。HIF-1的调控活性取决于它的α亚基,激活的HIF-1α通过增加与下游基因缺氧反应元素的结合,对多种转录因子的表达和翻译起到调控作用〔9〕。研究发现〔10〕随着COPD病程进展,血液及肺组织中HIF-1α的表达均进一步升高,平均肺动脉压也随之增加,体现血管重构的指标血管壁厚度/血管外径(WT)%及血管壁横断面积/血管横断面积(WA)%也明显升高,提示HIF-1α与肺血管病变存在显著的相关性。与本研究结果一致,进一步证明HIF-1复合信号通路参与了COPD肺血管病变的发生发展。
当机体轻度缺氧时,HIF-1α的表达即开始上调,伴随着机体持续缺氧的加重,当机体细胞质内含氧量低于5%处于重度缺氧状态时,HSP90表达开始上调。HSP90作为HIF-1α的增强子,对HIF-1α也同样起着调节作用,其可以与HIF-1α的PAS区特异结合,使HIF-1α结构更加稳定,从而干预HIF-1α的泛素化降解〔11〕。故如果低氧持续得不到改善,将导致HIF-1α生成增多,而降解减少,形成恶性循环。HSP90活性被破坏可导致蛋白酶体降解HIF-1α,研究发现〔12〕HSP90的抑制剂17-AAG和17-DMAG能够促进HIF-1α蛋白的降解,进而抑制血管的生成。作为HIF-1的下游基因,现已有研究证实,HSP90同样具有促进血管生成的作用,是血管生成的关键分子之一〔13〕。在HSP90低氧时的增强作用下,HIF-1α结构更加稳定,HIF-1复合通路在低氧时得以进一步过量表达。
有研究发现〔14〕,在合并肺动脉高压的COPD患者中,呼出气冷凝液及循环血液中的ET-1水平均较常人明显上升,并且其浓度与肺动脉的收缩压或平均压表现出明显的关联性。ET-1作为一种由21个氨基酸构成的生物活性多肽,是至今所发现的功效最强的缩血管生物因子,广泛分布于肺血管内皮细胞中〔15〕。低氧状态时,HIF-1α能够与ET-1启动子区域的 HIF-1结合位点特异性结合,激活内皮细胞ET-1表达〔16〕。ET-1的过量表达会引起肺动脉强烈收缩,促进肺动脉平滑肌细胞、血管外膜成纤维母细胞及胶原纤维的增殖,并可通过激活丝氨酸/苏氨酸蛋白激酶(Rho)减少血管和肺泡的生长,进而引起肺血管病变〔17〕。
相关研究显示〔18〕,VEGF在COPD患者血及痰液中的含量明显高于健康人群,且其升高水平与肺动脉高压的发生密切相关,提示VEGF参与肺血管病变的发展。VEGF的增强子中含有可与HIF-1α结合的低氧反应元件,当与增强子结合后可增强其蛋白水平的表达及转录,此外,HIF-1可在缺氧情况下有效增强VEGF mRNA稳定性,促使其缺氧时大量表达。VEGF是一种具有多种功能效应的细胞因子,其主要在人体血管丰富的器官及组织中分布,可以介导血管生成与血管重塑的发生〔19〕。有研究表明〔20〕,VEGF能够通过上调ET-1的表达,增强血管基质金属蛋白酶活性,以促进平滑肌细胞的增殖,参与血管重塑。作为已发现的功效最强的血管通透剂,它不但可以刺激血管内皮细胞的增殖和迁移,还能诱导体内血管形成,在肺血管病变过程中扮演着重要角色〔21〕。
机体正常状态下仅合成少量的NO,其作为重要的细胞信使,少量内源性NO能够舒张血管,改善组织微循环,发挥调节肺血流及免疫防御的功效。而当机体处于缺氧状态时,HIF-1α的大量表达可以激活NOS的转录,使其表达量显著增加,释放大量NO,产生自由基,损伤内皮细胞,造成血管活性物质的异常改变及血管收缩-舒张功能失调,使肺血管发生痉挛,引起肺动脉压升高〔22〕。NO也是一种致炎因子,在炎症反应中,NO可以激活白细胞并促进其迁移,高浓度NO的毒性作用会增加血管内壁的通透性,诱发血管炎症,致使血管扩张、内膜增厚,最终引发肺泡-肺毛细血管功能的异常改变〔23,24〕。
综上,COPD肺血管病变的发生、发展与HIF-1复合信号通路的表达相关,且随着COPD肺血管病变时间的延长,HIF-1复合信号通路的表达也逐渐升高,说明HIF-1及其下游靶基因在缺氧性肺血管病变形成中起重要作用,对研究相关疾病的发病机制有重要意义,可将HIF-1作为靶点,通过抑制其复合通路的表达,以改善或阻止肺血管的重构,从而起到治疗肺心病等肺血管疾病的作用。而HIF-1复合通路复杂,下游靶基因众多,是否还存在其他下游基因参与介导了缺氧性肺血管病变过程仍值得深入研究。
