运动预干预对心肌缺血再灌注大鼠心肌损伤及线粒体视神经萎缩蛋白1的影响
2023-07-26程吟曹振峰黄怡卢洪梅郭文涛
程吟 曹振峰 黄怡 卢洪梅 郭文涛
(1广东医科大学第二临床医学院,广东 东莞 523808;2海南体育职业技术学院;3广东医科大学基础医学院)
急性心肌梗死和心力衰竭是世界范围内导致死亡和残疾的主要原因之一。心肌缺血时,心肌组织因心肌缺氧和营养供应不足而死亡,再灌注治疗如通过溶栓或经皮冠状动脉介入等干预是心肌梗死的治疗选择,可使心肌组织损伤最小化〔1〕。然而,再灌注本身也可加剧心肌损害,使心脏更容易发生室性心律失常、心肌功能障碍和猝死,是急性心肌梗死临床治疗后的严重并发症之一〔2〕,给家庭和社会带来了日益沉重的经济负担。因此,如何保证缺血心肌组织血供的恢复,制定预防心肌缺血再灌注(I/R)损伤的有效策略至关重要。
心脏I/R损伤是通过一系列相互关联的途径介导的,包括活性氧的过度产生、内质网应激、细胞凋亡及线粒体代谢紊乱〔3〕。大量研究表明,线粒体动力学失衡是心肌I/R损伤过程中导致线粒体功能障碍和心肌细胞凋亡的重要因素〔4〕。在生理情况下,线粒体通过裂变和融合不断分裂和延长,从而以动态的方式保持其形态。线粒体裂变产生小的线粒体碎片,而融合形成伸长的相互连接网络,因此线粒体融合对于维持线粒体的正常结构和功能至关重要〔5〕。研究认为,线粒体融合对线粒体能量的产生及功能具有一定的保护作用,而I/R时线粒体融合减少,在心肌I/R损伤中起关键作用〔6〕。视神经萎缩(OPA)1是一种嵌在线粒体内膜中的蛋白,主要控制线粒体融合。Wang等〔7〕研究发现,心肌I/R损伤中OPA1表达降低,可加重线粒体碎片化,导致线粒体功能障碍和线粒体凋亡,进而导致心肌I/R损伤发生;而过表达的OPA1已被证明可以逆转线粒体功能,改善I/R大鼠心脏功能〔8〕。因此调控心肌细胞线粒体融合,尤其是OPA1可能是治疗心肌I/R损伤潜在的治疗靶点。
研究认为,运动是一种众所周知的非药物干预手段,能够改善健康和患病个体的心血管健康,并被证明可以持续改善心肌梗死患者的生活质量,减少住院和心源性死亡〔9〕。动物实验证实,运动的长期适应性变化与急性心肌梗死发生率降低有关,并通过减轻心肌细胞死亡,对I/R心脏产生有益的保护作用。Campos等〔10〕研究发现,运动可以通过减少心力衰竭时线粒体碎片的积累重建线粒体分裂-融合平衡,改善心力衰竭大鼠心脏功能。而Li等〔11〕研究发现,运动预干预可通过增加线粒体融合下调海马区β淀粉样蛋白(Aβ)水平,缓解痴呆小鼠的认知功能下降。基于上述文献可知,运动训练对线粒体动力学具有有益的影响,可以推测运动预干预可能通过增强线粒体融合减轻I/R大鼠心肌损伤。本研究通过构建大鼠心肌I/R模型,观察8 w有氧运动预干预对I/R大鼠心肌梗死面积、心律失常的发生及融合蛋白OPA1表达的影响,探讨运动预处理对I/R大鼠心肌的保护效应及可能机制。
1 材料与方法
1.1实验动物及分组 雄性SD大鼠共39只,体质量220~250 g,由广东医科大学实验动物中心提供〔使用许可证SYXK(粤)2015-0104〕。实验开始前,将所有大鼠置于标准实验室环境中饲养(室温 22 ℃±2 ℃,湿度 50%±5%,昼夜循环12 h),自由进食和饮水。适应实验室环境1 w后,将大鼠随机分为:假手术(sham)组、缺血再灌注(I/R)组、缺血再灌注运动(I/R+E)组,每组13只。心肌I/R期间I/R组死亡2只,I/R+E组死亡1只。
1.2跑台运动方案 参考Bedford等〔12〕中等强度跑台运动训练方案,共8 w(5 d/w)。跑台运动速度为20 m/min 开始,一开始每天运动15 min,每3 d运动时间增加5 min,直至每天运动时间为60 min时,运动时间不再变化,坡度为 由0 ° 调为5 °。
1.3心肌I/R模型建立 跑台运动结束后,I/R组及I/R+E组建立心肌I/R模型。术前大鼠禁食12 h,腹腔注射戊巴比妥钠(30 mg/kg)麻醉大鼠,仰卧位固定大鼠,连接小动物呼吸机进行机械通气(潮气量设置为5~6 ml,通气速率60 ~ 70次/min,实验采用加热平台将大鼠体温维持在37 ℃)。术中电极夹连接大鼠四肢,使用Ⅱ导联心电图记录大鼠心脏活动(图1),待心电图基线稳定后,常规手术备皮在第三和第四根肋骨之间开胸暴露心脏,确定左前降支(LAD),并在其远端约2 mm用6-0 丝线结扎,以心电图Ⅱ导联ST段抬高和缺血区心肌组织颜色发绀证实心肌缺血。缺血30 min后松开LAD,缺血心肌持续再灌注90 min,以ST段逐渐降低,左室前壁缺血组织颜色明显恢复,心电图T波反转,证实再灌注成功。Sham组进行相同手术,只穿线不进行心脏结扎。
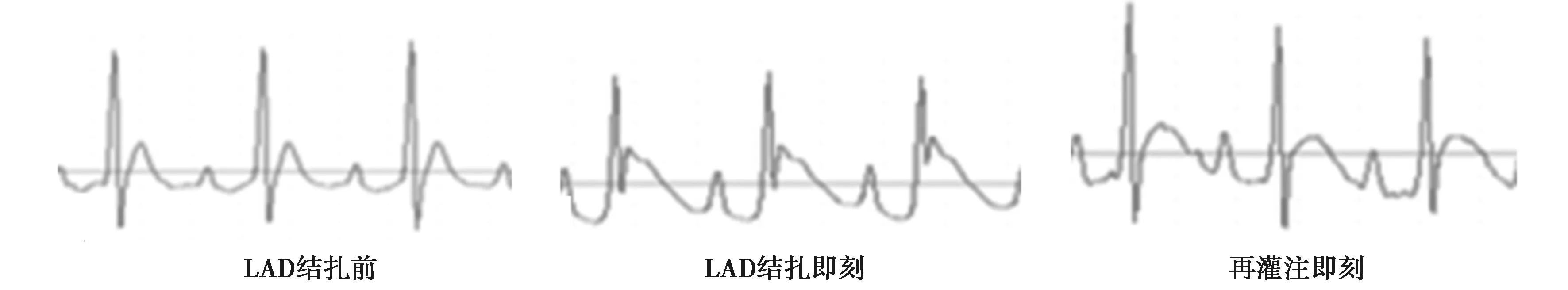
图1 大鼠心脏LAD结扎前、LAD结扎即刻及再灌注即刻心电图
1.4大鼠I/R期间心律失常监测 于缺血及再灌注期间采用标准肢体Ⅱ导联连续检测各组心电图变化,根据Lambeth原则〔1〕观察室性心动过速(VT)、室性颤动(VF)和室性早搏(PVB)发生率,并记录缺血及再灌注期间VT、VF及PVB第1次出现的时间和缺血及再灌注期间心律失常总持续时间。
1.5伊文氏蓝2,3,5-三苯基四氮唑(TTC)双着色法测定心肌梗死面积 心肌再灌注90 min结束时,再次结扎冠状动脉,经主动脉灌注2%伊文蓝3 ml,以确定心肌缺血危险区。迅速取下心脏,冰盐水冲洗滤纸试干后置于-20 ℃的冰箱冷冻15 min后切成2 mm冠状切片,随后切片被置于1% TTC中染色15 min,孵育20 min(37 ℃)。TTC将心肌危险区染成深红色,灰白色区域为缺血梗死区,非缺血区心肌呈深蓝色,最后将切片置于4%多聚甲醛溶液中,室温下固定过夜。拍摄心肌切片图像,使用 Image-ProV6.0 分析计算出梗死区面积(IFA)与危险区面积(RA)的比值,即为心肌梗死面积百分比(IFA/RA)%。
1.6心肌组织OPA1免疫组织化学染色 再灌注90 min后取左心室前壁心肌组织,4%多聚甲醛固定,常规脱水,石蜡包埋,连续切片5张(5 μm),将切片经二甲苯脱蜡、梯度酒精水化后入3% H2O2室温孵育30 min,磷酸盐缓冲液(PBS)漂洗后(3次×5 min)加山羊血清封闭液,室温下放置10 min后滴加OPA1兔抗鼠多克隆抗体(1∶300),室温孵育1 h后4 ℃过夜,PBS漂洗(3次×5 min)后滴加山羊抗兔IgG 二抗(1∶300),室温孵育1 h、PBS漂洗3次×5 min后二氨基联苯胺(DAB)显色1~3 min,自来水充分冲洗后苏木素复染2~3 min,梯度酒精脱水、二甲苯透明、树胶封片。光镜下观察并拍照,每张切片取5个视野(400倍)采集图像,利用形态学图像分析系统对心肌组织OPA1表达进行分析,用心肌组织5个不同视野内OPA1细胞个数的平均值表示心肌组织OPA1表达水平。
1.7统计学方法 采用SPSS26.0软件进行t检验、χ2检验、单因素方差分析。
2 结 果
2.1跑台运动预干预对I/R大鼠缺血期及再灌注期心律失常的影响 与sham组比较,I/R组心肌缺血及复灌过程中I/R期间VT、VF及PVB发生率均显著增加,第1次出现心律失常的时间及心律失常持续时间均明显延长(均P<0.05)。与I/R组比较,8 w跑台运动预干预可显著降低大鼠心肌缺血及复灌过程中VT、VF及PVB发生率(P<0.05,P<0.01),且能明显延长I/R大鼠心肌缺血及复灌期间第1次出现心律失常的时间,明显缩短心律失常持续时间(P<0.01)。见表1。
表1 各组缺血期及再灌注期心律失常比较
2.2跑台运动预干预对I/R大鼠心肌梗死面积的影响 与sham组〔(0.96±0.70)%〕比较,I/R组及I/R+E组心肌IFA/RA〔(44.36±9.43)%、(36.02±4.74)%〕均明显增加(P<0.05)。经过8 w跑台运动预干预,与I/R组比较,I/R+E组心肌IFA/RA明显下降(P<0.01)。见图2。
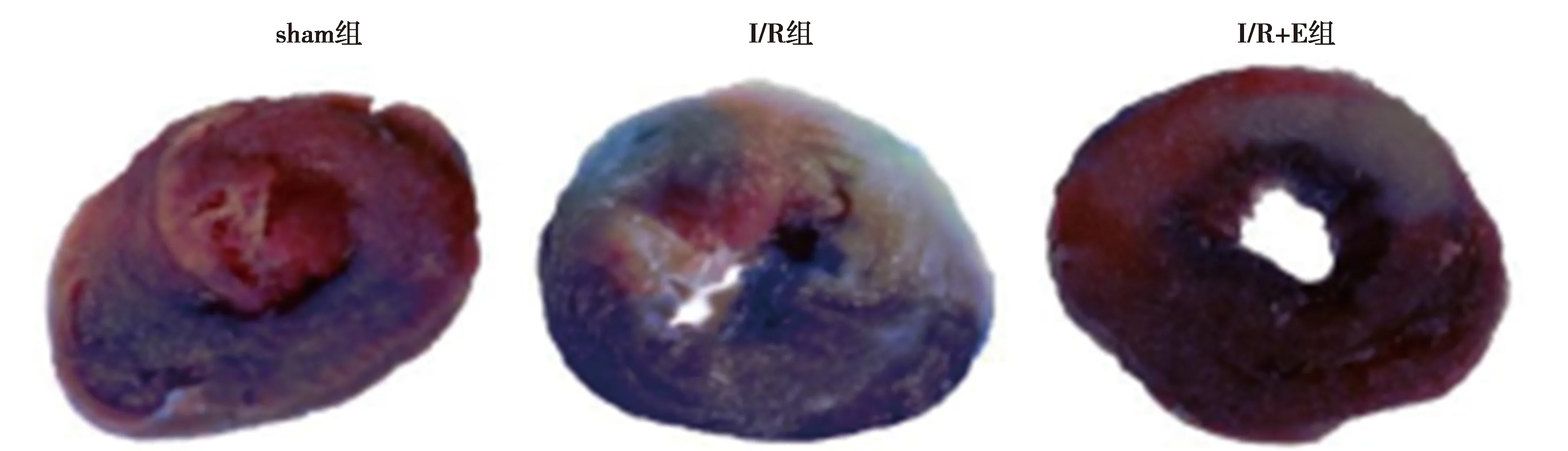
图2 各组心肌(TTC染色)
2.3跑台运动预干预对IR大鼠心肌组织OPA1表达的影响 与sham组(11.08±1.98)比较,I/R组及IR+E组心肌组织OPA1表达(6.27±1.56、8.08±1.78)均显著降低(P<0.005);与I/R组比较,I/R+E组心肌组织OPA1表达显著增多(P<0.05)。见图3。
3 讨 论
急性心肌梗死后,早期成功的心肌再灌注,如采用溶栓治疗或经皮冠状动脉介入治疗是减小心肌梗死面积、提高临床疗效的最有效策略,但再灌注本身可导致心肌细胞死亡,使心脏更容易发生室性心律失常及猝死〔13〕。研究表明,I/R诱导的心肌细胞损伤可触发强烈的炎症反应及I/R导致心脏电生理变化均可增加心肌对心律失常的易感性〔14〕。Lee等〔15〕研究发现,大鼠室性心律失常发生在LAD闭塞后及再灌注期内,表现为PVB、VT和VF,并且大鼠心律失常评分及死亡率均显著增高。并且Jiang等〔16〕研究发现,I/R可使大鼠心梗面积增加、心律失常发生率和死亡率均显著增加,心肌组织及心脏功能严重受损,本研究得到相同结果。
近年来,缺血预处理已经成为预防心肌I/R损伤、改善心律失常及心脏功能的主要研究途径〔17〕。作为安全有效、临床可操作性强的处理措施,运动预处理已被报道可以有效降低心血管疾病的发病率和死亡率〔18〕。Meta分析显示,经常进行体育锻炼的受试者中心肌梗死的发生率明显较低,而经常运动的心脏病患者的生存率要高于不运动的心脏病患者。并且动物实验证实,运动预干预可通过介导抗心肌炎症及凋亡等通路抵抗心肌I/R损伤,包括减少心律失常(VT、VF及PVB)及心肌梗死等现象的发生〔19〕。此外有研究发现,运动预干预(3 d,跑台速度 18 m/min)可通过抗炎通路预防心肌I/R损伤,减轻心律失常的发生及心肌坏死,发挥心脏保护作用〔20〕。本研究结果与上述学者研究结果一致。然而Veiga等〔21〕研究发现,雌性大鼠心肌梗死前进行8 w游泳运动预干预(1 h/d,5 d/w)并不能减少LAD永久性闭塞大鼠梗死面积,也不能对心肌缺血大鼠提供心脏保护作用,可能是因为永久性冠状动脉闭塞可能比短暂缺血再灌注对心肌组织造成更大的损害有关。据报道,I/R诱发心律失常的发生率和严重程度取决于心肌梗死的面积,本研究8 w跑台运动预干预降低I/R大鼠心律失常发生可能与此运动减小I/R大鼠的心肌梗死面积有关,具体机制需进一步研究。
线粒体是不断发生融合和分裂的动态细胞器,线粒体裂变和融合的失衡导致线粒体结构异常和功能障碍,在I/R损伤的发病机制中起着重要作用〔22〕。研究表明,心肌I/R时抑制线粒体裂变、促进线粒体融合已被证实可以改善I/R中异常的线粒体形态,增加三磷酸腺苷(ATP)的产生,减少线粒体凋亡,逆转线粒体功能,改善心肌I/R损伤的心脏性能〔23〕。研究表明,在调节线粒体融合中起关键作用的OPA1对各种心脏疾病特别是心肌I/R损伤具有保护作用〔24〕。Varanita等〔25〕研究发现,线粒体OPA1表达下降与线粒体功能障碍及IR损伤的敏感性增加有关。并且Le Page等〔26〕研究发现,与正常小鼠比较,OPA1缺失的小鼠梗死面积明显增大,心律失常的发生率更高。而心脏保护剂褪黑素最近被证明可通过增强与OPA1相关的线粒体融合对I/R大鼠提供心脏保护,从而减少I/R大鼠心肌细胞凋亡及心肌梗死面积。
本研究结果说明,I/R后线粒体融合减少,从而导致了I/R心肌损伤的发生。近年来,与OPA1相关的线粒体融合已成为治疗急性心肌I/R损伤潜在发展的新靶点。Ghahremani等〔27〕研究发现,8 w有氧运动可通过提高心肌梗死大鼠心肌融合蛋白OPA1的表达,减少大鼠心肌梗死面积、改善心肌病理变化,表明有氧运动是一种非药理学的有效的干预心肌梗死的治疗方式。Zhao等〔28〕研究表明,8 w游泳运动预干预(15 min/d,5次/w)可通过调节线粒体裂变及融合信号改善线粒体形态,抑制心肌梗死小鼠心肌纤维化和细胞凋亡,从而恢复心肌梗死后线粒体形态并改善心脏功能。另一项研究发现,2 w跑台运动预处理(20 m/min,30 min/d)可以上调脑缺血再灌注大鼠线粒体OPA1表达、但对分裂蛋白的表达无显著影响,说明此运动训练可通过增加线粒体融合对脑缺血再灌注损伤产生神经保护作用〔29〕。本研究结果与上述学者研究结果一致。而马静芬〔30〕研究发现,一次急性运动(分别为45、90、120 min)即刻均可使线粒体融合蛋白OPA1表达减少,心肌线粒体融合趋势下降、分裂趋势增强,从而增加心肌的炎症反应。因此,针对不同研究得到不同结果可能与运动干预方式不同有关。心脏线粒体去极化已被证明有助于心律失常的发生,并且线粒体融合蛋白增加可减少心肌I/R损伤引起的心脏线粒体去极化,产生抗心律失常作用。Dai 等〔31〕研究认为,I/R导致的心肌梗死面积增加与线粒体融合不足有关。因此,本研究8 w跑台运动预干预可能通过增加线粒体融合发挥心肌保护作用,从而减轻心肌I/R损伤,最终导致IR大鼠心律失常减少,梗死面积减小。但是,线粒体融合蛋白OPA1通过何种途径发挥心肌保护作用,需要进一步研究证实。
