RNF181在非小细胞肺癌中低表达并抑制肿瘤进展
2023-07-26梁伊灵黄波付星玮李晓波薄威张忠王旭光王柏芳张珉
梁伊灵 黄波 付星玮 李晓波 薄威 张忠 王旭光 王柏芳 张珉
(1沈阳医学院基础医学院病理教研室,辽宁 沈阳 110034;2辽宁省肿瘤医院病理科)
肺癌是最常见的恶性肿瘤之一〔1〕,已成为我国城市人口恶性肿瘤的首要死因,约80%的肺癌病例为非小细胞肺癌(NSCLC),其病理类型包括鳞状细胞癌、腺癌、大细胞癌等〔2〕,约75%的患者发现时已处于中晚期,5年生存率很低〔3〕。寻找调控NSCLC进展的关键因子,揭示其发挥调控作用的分子机制,将有助于临床对NSCLC的诊断及治疗。
环指蛋白(RNF)181又称为HSPC238〔4〕,属于RNF超家族,具有RING型结构域〔5〕,其基因组全长716个碱基,编码153个氨基酸〔6〕,在胰腺、肝脏、肾脏等25个组织中均有表达〔7〕。环指结构域属于锌指型蛋白质结构域,由40~60个氨基酸组成,并含有C3HC4氨基酸基序(7个半胱氨酸和1个组氨酸非连续排列),可以结合两个锌离子(Zn2+)〔8〕,多数含有RING结构域的蛋白具有E3泛素连接酶活性,可以同时结合泛素化酶及其底物,导致底物降解,是参与泛素化途径的重要蛋白。RNF181在多种肿瘤组织中存在表达,但在肿瘤进展过程中发挥的调控作用尚存在争议,其在NSCLC中的表达情况及其调控肿瘤进展的分子机制目前尚无报道,需进一步深入研究。本课题通过研究RNF181对NSCLC进展所发挥的调控作用,查找其调控的关键靶点分子及下游信号通路,揭示其调控肿瘤进展的分子机制,以期为NSCLC临床诊断及治疗提供新的靶点。
1 材料与方法
1.1病例选取 选取2013年6月至2018年12月经手术切除后并经病理诊断确诊的肺腺癌组织45例及肺鳞癌组织30例,以各病例癌旁肺组织作为对照。患者术前均未进行放疗、化疗或内分泌治疗,年龄38~82岁,平均年龄59.8岁;男43例,女32例;病理学分级Ⅰ级39例,Ⅱ和Ⅲ级36例,出现局部淋巴结转移 38例。以上病例均进行苏木素-伊红(HE)染色,并由沈阳医学院附属中心医院两位病理科医师复核确诊,根据世界卫生组织(WHO)2015年颁布的肺癌组织学分型标准进行病理分型,并根据国际抗癌联盟(UICC)2017年颁布的第8版肺癌肿瘤原发灶-淋巴结-转移(TNM)分期系统进行肺癌分期、分级。本实验经沈阳医学院伦理委员会批准实行,患者均签署知情同意书。
1.2免疫组织化学染色
1.2.1主要试剂 磷酸盐缓冲液(PBS,pH7.2~7.6)、抗原修复缓冲液(柠檬酸法,pH6.0)、内源性过氧化物酶阻断剂、非免疫山羊血清封闭液、即用型免疫组织化学染色EliVision plus试剂盒(鼠/兔)、二氨基联苯胺(DAB)辣根过氧化物酶显色试剂盒等均购于福州迈新生物技术开发有限公司,RNF181单克隆抗体(鼠抗人)购于美国Santa cruz公司(SC-376343)。
1.2.2主要方法 手术切除的肺癌组织经10%中性甲醛溶液固定,采用常规石蜡包埋;制作连续的4 μm厚切片,用涂有0.5%多聚赖氨酸处理的载玻片捞出;所有切片在同一实验室采用同一批号试剂进行后续实验;免疫组织化学染色采用两步法:将切片放入70 ℃烤片机烤1 h;将切片用二甲苯脱蜡,梯度酒精水化;进行抗原修复(以pH6.0柠檬酸钠为缓冲液进行高压修复2 min);3%H2O2阻断内源性过氧化物酶;非免疫山羊血清阻断非特异性结合;RNF181一抗(1∶650)4 ℃孵育过夜;Evision A液、B液37 ℃各孵育15 min;DAB显色,苏木素复染核,自来水返蓝,常规梯度酒精脱水,二甲苯透明,封片观察。结果判定:每张免疫组织化学染色切片,随机选取10个(×400)视野,并随机计数细胞200个,进行RNF181阳性结果判定,判定标准如下:阳性染色主要位于胞质,(1)染色强度:没有阳性染色计0分,浅黄色计1分,棕色计2分,棕褐色计3分;(2)阳性染色范围:阳性染色肿瘤细胞范围<10%计0分,10%~25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。两项评分相乘得最终评分(0~12分),得分<6分为RNF181低表达,≥6分为高表达。
1.3细胞培养及转染 A549和H1299细胞株购于中国科学院上海细胞库,用含10%胎牛血清的RPMI1640培养液(Biological Industries,美国)在37 ℃、5%二氧化碳恒温培养箱中培养。RNF181质粒购自北京傲锐东源生物科技有限公司,其中RNF181 开放阅读框(ORF)构建于PCMV6载体中,转染此载体过表达RNF181,作为PCMV6-RNF181组,转染PCMV6空载体作为对照,即PCMV6组。RNF181小干扰RNA(siRNA)购自苏州吉玛基因公司,序列分别为:①阴性对照(NC):正义引物:5′-UUCUUCGAACGUGUCACGUTT-3′,反义:5′-ACGUG ACACGUUCGGAGAATT-3′;②siRNA1:正义引物:5′-GGCGUCCUAUUUCGAUGAATT-3′,反义:5′-UUCA-UCGAAAUAGGACGCCTT-3′;③siRNA2:正义引物:5′-CCCACUGAUGACGACAUUTT-3′,反义:5′-AAGUGUCGUCAUCAGUGGGTT-3′;④siRNA3:正义引物:5′-GAUGCCUUGCCAUCACCUUTT-3′,反义:5′-AAGGU-GAUGGCAAGGCAUCTT-3′。转染NC作为对照组,分别转染siRNA序列②、③、④,作为RNAi1、RNAi2、RNAi3组。细胞转染试剂为LipofectamineTM3000(购于Thermo Fisher Scientific,美国),按照说明书推荐剂量进行转染,48 h后提取蛋白。
1.4Western印迹实验 将H1299和A549细胞转染48 h后,NP40裂解液(碧云天,中国)裂解细胞提取蛋白,并用二喹啉甲酸(BCA)法(碧云天,中国)进行蛋白定量。40 μg总蛋白通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移到聚偏氟乙烯(PVDF)膜(Millipore,美国)上,用TBST(含5%脱脂奶粉)封闭1.5 h后。加入稀释后的一抗,一抗稀释比例如下:RNF181(1∶800,SantaCruz Biotechnology,美国)、细胞周期蛋白(cyclin)D1、cyclinA2、cyclinB1、内皮型钙黏附蛋白(E-cadherin)、神经型钙黏附蛋白(N-cadherin)、Snail同源物1(Snail)、Snail同源物2(Slug,1∶1 000,Cell Signaling Technology,美国)及甘油醛-3-磷酸脱氢酶(GAPDH)、微管蛋白(α-tublin,1∶20 000,proteintech,中国)。之后用过氧化物酶耦联抗鼠或兔IgG(1∶1 000,Cell Signaling Technology,美国)室温孵育2 h,滴加电化学发光(ECL)液(Thermo Scientific,美国)使用化学发光成像系统(Tanon,中国)检测蛋白表达及活化水平。
1.5MTT实验 饥饿培养细胞后转染,24 h后接种于96孔板中〔4×103个细胞/(100 μl·孔)〕,每孔加入20 μl(5 mg/ml)MTT培养4 h,移除孔内溶液加入二甲基亚砜(DMSO,150 μl/孔),震荡后用酶标仪(Molecular Devices,美国)检测在490 nm处的OD值,每种处理条件均有5个复孔,连续观察5 d。
1.6Transwell实验 将Transwell上室底部预先铺置基质胶,细胞转染24 h后消化并重悬于无血清RPMI1640培养液中,上室内加入〔2×105个细胞/(100 μl·孔)〕细胞悬液,在下室内加入600 μl含10%胎牛血清(FBS)的RPMI1640培养液,放入孵箱中培养22 h后,取出孔板,吸出小室中的培养液,用棉签擦掉上室内的细胞,PBS淋洗后将小室放入4%多聚甲醛中固定10 min后吸出,将小室放入结晶紫染液中染色5 min后经清水洗涤,倒置显微镜下随机选取5个视野对侵袭细胞进行计数。
1.7流式细胞技术检测细胞周期 采用无血清培养基饥饿培养24 h使细胞周期同步化,更换正常培养基并转染48 h后,经胰酶消化,吹打制成单细胞悬液,PBS洗涤、离心弃上清,经75%乙醇4 ℃固定过夜,PBS洗涤、洗涤离心弃上清,加入碘化丙啶(PI)重悬细胞避光孵育30 min,流式细胞仪分析细胞周期。
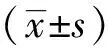
2 结 果
2.1RNF181在NSCLC中低表达,并抑制肿瘤进展 免疫组织化学染色发现,RNF181主要定位于细胞质,肺癌组织中RNF181表达水平(4.19±2.10)显著低于癌旁肺组织(9.39±1.54,t=17.17,P<0.01)。见图1。不同肺癌临床分期、淋巴结转移情况对RNF181表达影响差异有统计学意义(P<0.05,P<0.01)。见表1。
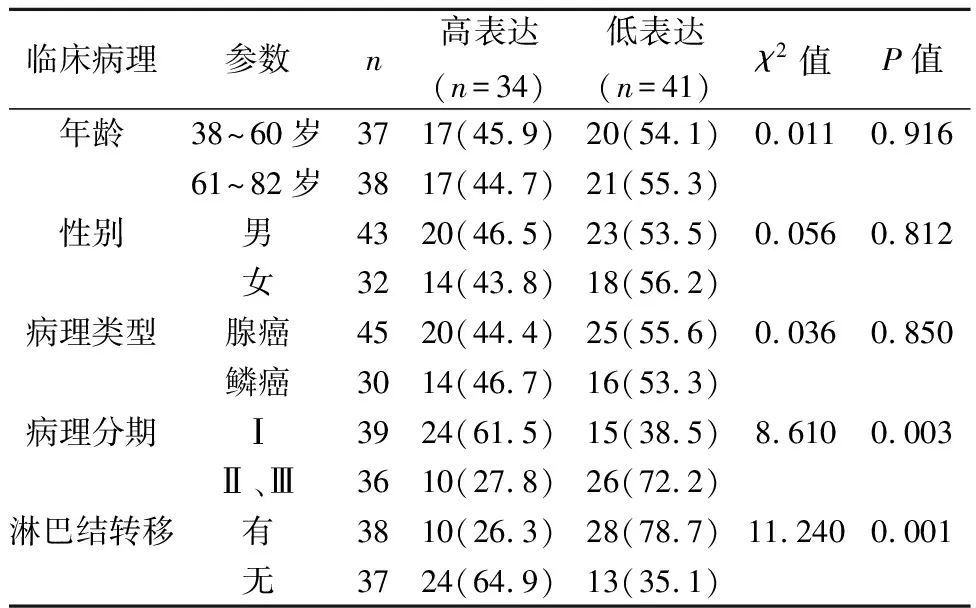
表1 RNF181的表达与临床病理指标之间的关系〔n(%)〕
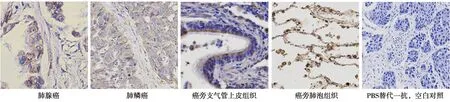
图1 NSCLC组织中RNF181免疫组织化学染色(×400)
2.2RNF181抑制NSCLC细胞侵袭、增殖能力 Western 印迹检测显示,H1299及A549细胞NC组RNF181蛋白表达量显著高于RNAi1组、RNAi2组及RNAi3组(P<0.05),2种细胞系中RNAi2干扰效果最为明显,将其用于后续实验。见图2、表2。Transwell实验结果显示,H1299和A549细胞PCMV6-RNF181组侵袭细胞显著少于PCMV6组(P<0.05),RNAi2组侵袭细胞显著多于NC组(P<0.05)。见表3、图3。MTT实验结果显示,2~5 d H1299和 A549细胞PCMV6-RNF181组增殖能力显著低于PCMV6组(P<0.05),RNAi2组的增殖能力显著高于NC组(P<0.05)。见表4。流式细胞术检测发现,H1299和A549细胞PCMV6-RNF181组处于G0/G1期的细胞数显著多于PCMV6组(P<0.05),RNAi2组处于G0/G1期的细胞数显著少于NC组(P<0.05)。见图4、表5。上述结果提示RNF181可抑制NSCLC细胞的侵袭能力,且可通过调控细胞周期抑制细胞增殖能力。
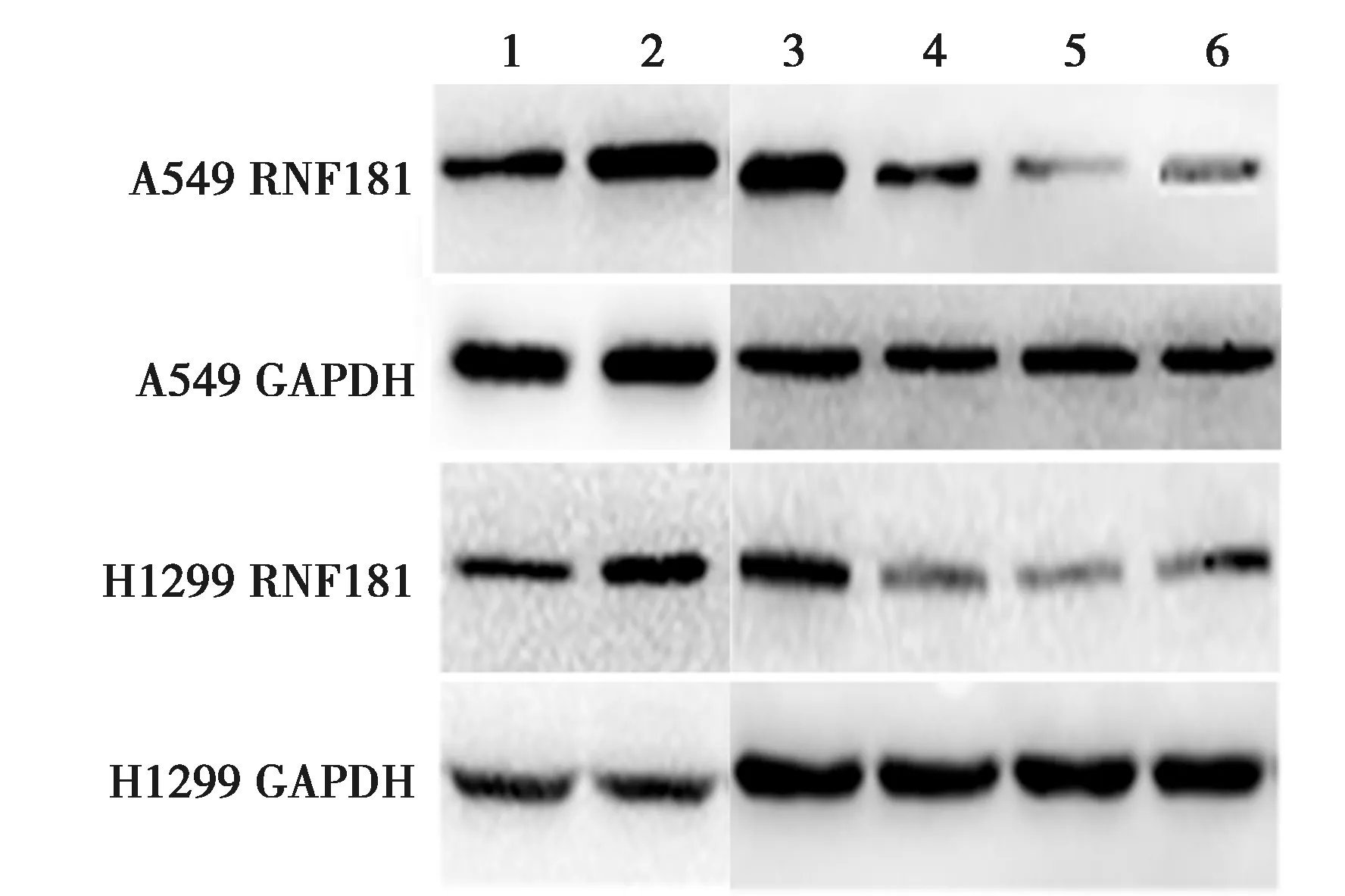
1~6:PCMV6组、PCMV6-RNF181组、NC组、RNAi1组、RNAi2组、RNAi3图2 Western印迹检测各组H1299、A549细胞中RNF181的过表达及干扰效率
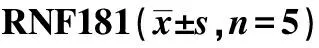
表2 在H1299及A549细胞中过表达及干扰
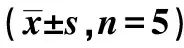
表3 RNF181对NSCLC细胞侵袭能力的影响
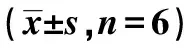
表4 MTT实验检测RNF181对 NSCLC细胞增殖能力的影响
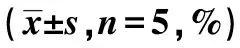
表5 RNF181对NSCLC细胞周期G0/G1期的影响
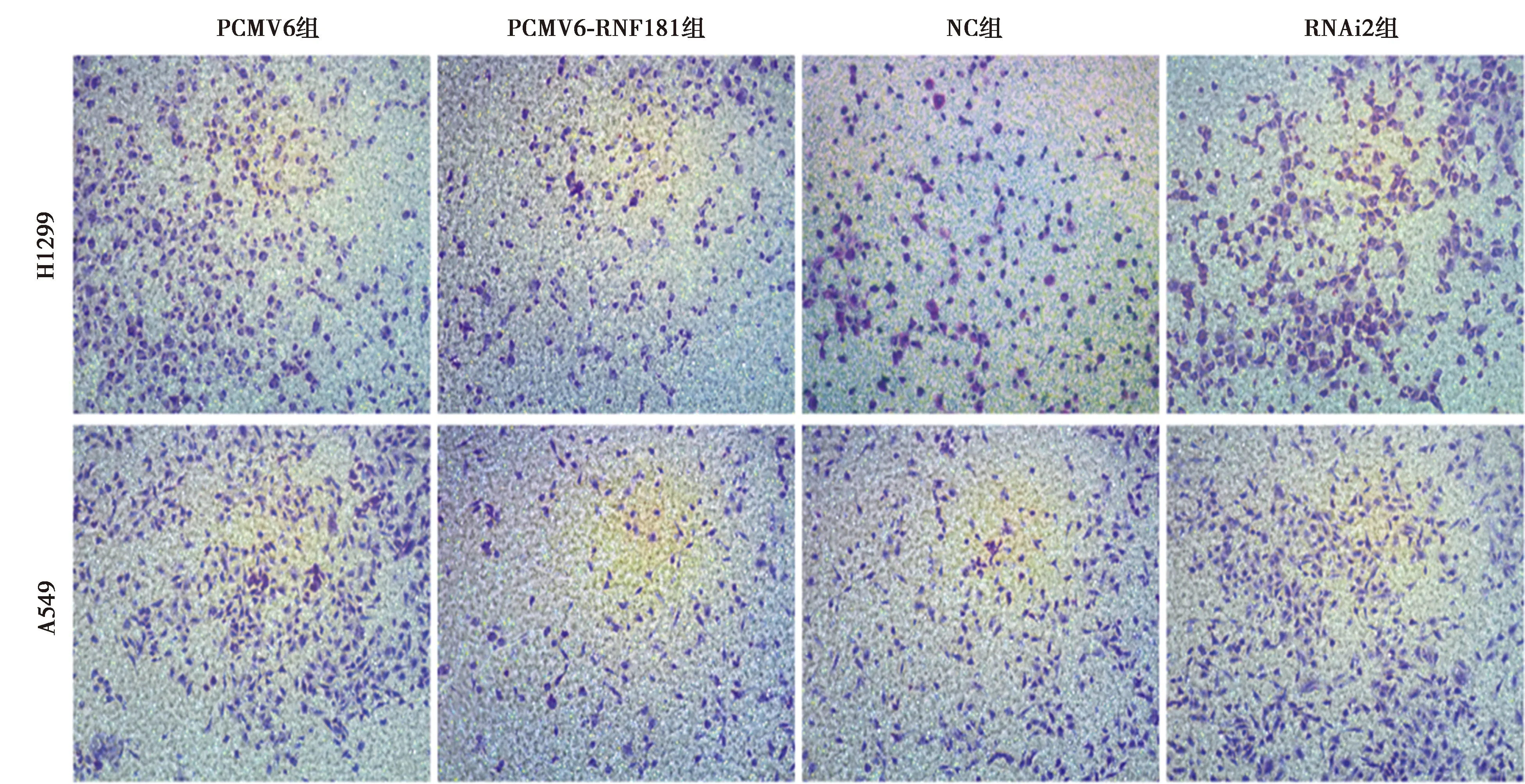
图3 Transwell实验检测RNF181对NSCLC细胞侵袭能力的影响(结晶紫染色,×200)
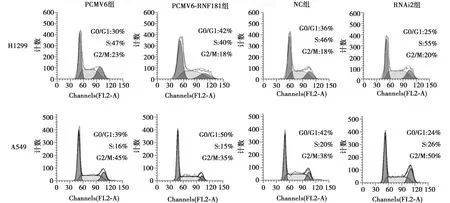
图4 流式细胞技术检测RNF181对NSCLC细胞周期的影响
2.3RNF181通过抑制EMT抑制NSCLC侵袭 上调H1299及A549细胞中RNF181的表达水平后,E-cadherin的表达水平显著增高,而N-cadherin、Snail和Slug的表达水平显著下降(P<0.05)。而敲低RNF181表达水平后得到相反的结果,E-cadherin的表达水平显著下降,N-cadherin、Snail及Slug的表达水平显著升高(P<0.05)。见表6、图6。上述结果提示,RNF181 可能通过抑制EMT降低H1299及A549细胞的侵袭能力。
表6 RNF181对NSCLC细胞EMT及细胞周期相关蛋白表达的调控作用
2.4RNF181通过调控细胞周期抑制NSCLC增殖 上调H1299及A549细胞中RNF181的表达水平后,cyclinD1的表达水平显著下降(P<0.05),而下调RNF181表达水平后得到相反的结果(P<0.05),而cyclinB1、cyclinA2的表达水平并未发生相应变化(P>0.05)。见表6、图5。上述研究结果提示RNF181可能通过抑制cyclinD1的表达水平介导细胞G1/S期阻滞,进而抑制NSCLC增殖。
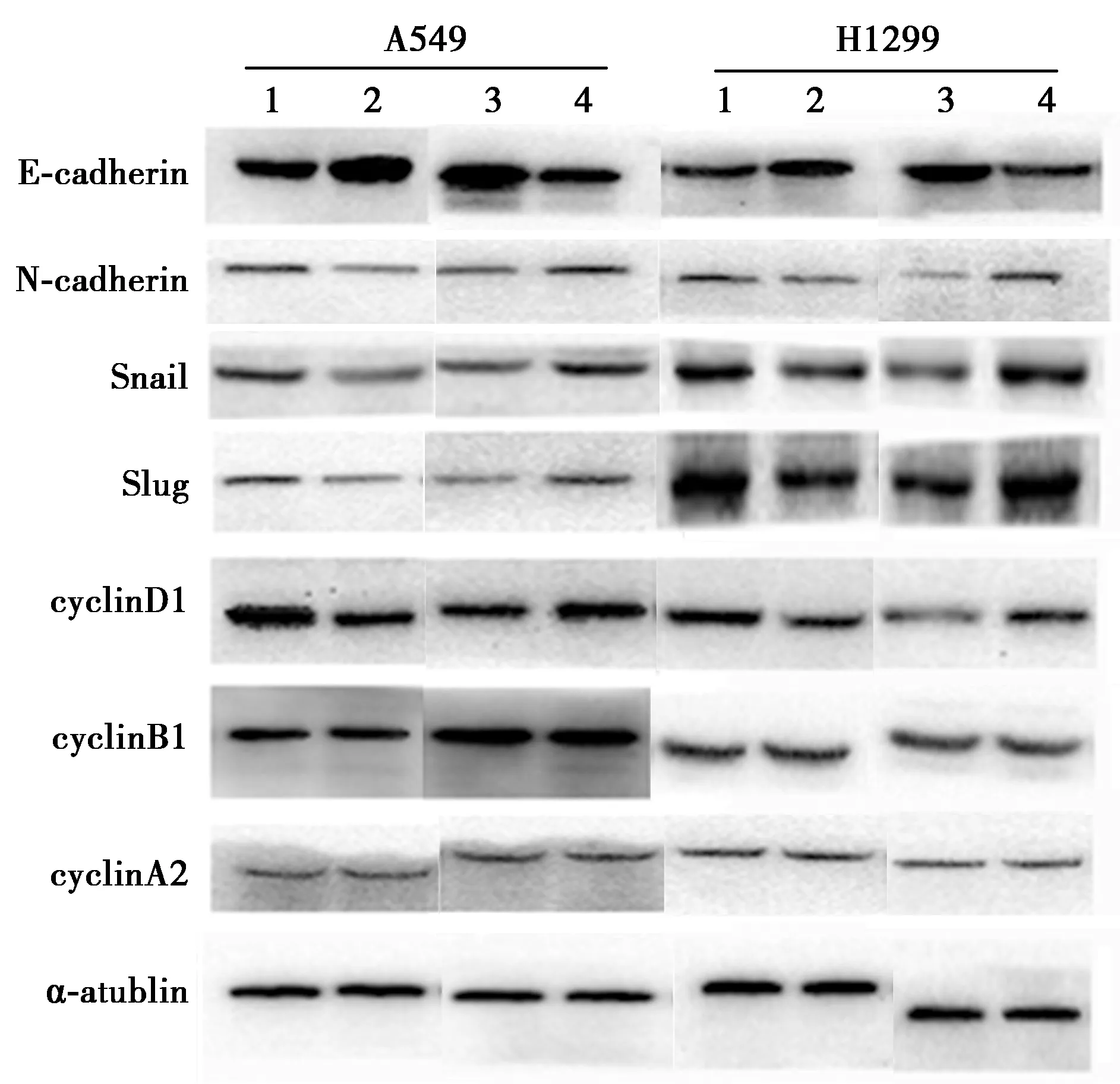
1~4:PCMV6组、PCMV6-RNF181组、NC组、RNAi2组图5 RNF181对NSCLC细胞EMT及细胞周期相关蛋白的表达调控
3 讨 论
本文表明,RNF181主要定位于细胞质,其在NSCLC组织中相对低表达,且与肺癌临床病理分期及肿瘤局部淋巴结转移负相关,提示RNF181可能对NSCLC进展发挥抑制作用。
Transwell实验发现RNF181可抑制A549及H1299细胞侵袭能力,同步进行的Western印迹实验发现RNF181可上调E-cadherin的表达水平,下调N-cadherin、Snail、Slug的表达水平。E-cadherin是上皮细胞的标志物〔9,10〕,E-cadherin 表达的丢失是上皮细胞间质转化(EMT)最早发生的步骤之一〔11〕。Snail和Slug是E-cadherin的转录抑制剂,N-cadherin是间质细胞的标志物,细胞发生EMT时,三者的表达水平可能相应增加〔12〕。EMT是上皮细胞逐渐失去自身特有的表型而逐渐获得间质细胞表型的转换过程,在生长发育,纤维化等多种生理、病理过程中发挥重要作用,尤其在肿瘤进展过程中,肿瘤细胞常通过EMT获得更强的侵袭、转移能力及生存能力〔13〕。本研究结果提示,RNF181可通过调控EMT抑制NSCLC细胞侵袭能力。
MTT实验结果显示,RNF181可以抑制A549,H1299两种细胞的增殖能力,经流式细胞技术检测细胞周期发现:上调RNF181的表达水平可将细胞周期阻滞于G1/S期。通过Western印迹实验检测发现:RNF181对cyclinA2、cyclinB1等蛋白表达水平无明显影响,但其可引起cyclinD1表达水平下降。细胞通过进入细胞周期不断分裂增殖,细胞周期相关蛋白及其激酶和抑制物对细胞周期发挥重要调控作用〔14~16〕,cyclinD1与CDK4/6结合可促进细胞通过G1/S期,加速分裂增殖〔17,18〕,本研究结果提示,RNF181可通过抑制cyclinD1表达水平阻滞细胞G1/S期转换,进而抑制NSCLC增殖能力。
现有研究中对RNF181调控肿瘤进展作用的报道尚存在矛盾之处,RNF181在弥漫大B细胞淋巴瘤、肝癌、胃癌、乳腺浸润性导管癌中低表达,并且与肿瘤进展及不良预后相关〔5,19~24〕。研究发现,RNF181可通过发挥E3泛素连接酶作用抑制NF-κB信号通路,进而抑制弥漫大B细胞淋巴瘤的生长〔5,8〕。Wang等〔19〕发现,肝癌组织中RNF181表达水平低于癌旁组织,RNF181通过抑制细胞外调节蛋白激酶/促分裂素原活化蛋白激酶(ERK/MAPK)信号通路抑制肝癌细胞的体外生长和体内成瘤能力。过表达RNF181可导致肝癌的细胞周期阻滞〔25〕。采用顺铂治疗肝癌时,RNF181可通过死亡受体途径促进肝癌细胞凋亡〔26,27〕。体外细胞学实验发现,过表达RNF181可以明显抑制肝癌细胞的生长,而敲低RNF181可得到相反的结果〔28,29〕。RNF181在乳腺浸润性导管癌中低表达,且与局部淋巴结转移呈负相关〔30〕。有研究报道了胃癌组织中RNF181的表达水平低于癌旁组织,并且与肿瘤分化、肿瘤大小、临床病理分期及患者总体生存时间呈负相关,RNF181在体外细胞学实验及动物模型体内实验中均可通过抑制肿瘤细胞增殖及促进凋亡来抑制胃癌的生长〔21〕。在人胃癌细胞系中,RNF181通过抑制ERK/MAPK信号通路活性,调控细胞周期相关蛋白cyclinD1/ D3,p21及CDK4/6的表达水平,从而控制细胞周期从G1期到S期的进展,与细胞学实验结果相呼应,胃癌临床标本中RNF181的表达水平与cyclinD1、CDK4的表达水平呈负相关,揭示了胃癌病变中RNF181-ERK/MAPK-cyclin D1/CDK4通路可抑制胃癌进展〔23〕。
与上述研究结果相反,部分研究发现,RNF181可促进肿瘤进展。研究发现,RNF181可增加结肠癌细胞增殖能力并可促进肿瘤血管生成〔31〕。Zhu等〔32〕发现在ERα阳性乳腺癌细胞中,RNF181通过对ERα特定位点的泛素化修饰防止其进入蛋白酶体降解,进而介导乳腺癌抵抗内分泌治疗。Zhou等〔26〕发现在三阴性乳腺癌中,RNF181通过调控Hippo/YAP通路促进肿瘤细胞侵袭、迁移及增殖能力。
而基于肠癌的部分研究出现了体内、体外实验结果不一致的现象,RNF181高表达于癌旁组织,但肠癌体外细胞学实验中,干扰RNF181并未明显影响肿瘤的生长能力〔33〕,而下调RNF181可明显抑制裸鼠体内种植肠癌的生长〔34~36〕。
上述看似矛盾的结果提示,肿瘤微环境,RNF181上、下游分子表达水平及相关信号通路的活化情况均可能影响并改变RNF181的生物学功能,进而影响其对肿瘤进展的调控方向,发挥“促癌”或“抑癌”的功能,对其生物功能的研究不能脱离其周围环境及遗传背景等多方面因素,需要综合考量、分析。
综上,RNF181可分别通过调控细胞周期及EMT抑制NSCLC细胞增殖及侵袭能力,其抑制NSCLC进展作用的分子机制仍需深入研究,以期为肺癌诊断及治疗提供新的靶点。
