Shh信号通路对快速老化小鼠肾脏衰老的影响
2023-07-26叶成杜艳军刘欣媛邓晓妮吴文辉
叶成 杜艳军,2 刘欣媛 邓晓妮 吴文辉
(1湖北中医药大学针灸骨伤学院,湖北 武汉 430061;2针灸治未病湖北省协同创新中心)
肾脏与其他脏器协同维持机体的内环境稳定、保证正常生理功能的运行,是人体的重要器官。然而,随着时间推移,细胞功能逐渐减退,肾脏不可避免地出现形态结构变化及生理功能退行性改变。其中,纤维化是衰老肾脏最为显著的病理特征之一,包括肾小球硬化及肾间质纤维化。同时,肾纤维化是目前已知的各种不同因素导致的慢性肾脏病发展至终末期肾病的病理特征和必经途径,肾纤维化严重程度与肾功能下降之间存在线性关系,也是一项决定预后发展的可靠指标〔1〕。
近年来,国内外有学者观察发现快速老化(SAMP)8小鼠肾脏在老年期具有典型的纤维化病理表现〔2~4〕,然而Shh信号通路与该品系小鼠肾脏病理改变之间的关系目前尚未见研究报道。本实验旨在通过对比同龄抗快速老化(SAMR)1小鼠,观察快速老化SAMP8小鼠老年期肾脏病理变化及Shh信号通路中Shh、平滑蛋白(Smo)、胶质瘤相关癌基因同源物(Gli1)蛋白表达水平。
1 材料与方法
1.1实验动物及分组 6只雄性SAMP8小鼠,6只雄性SAMR1小鼠为对照,均购自北京大学医学部〔实验动物科学部,许可证号:SCXK(京)2016-0010〕,月龄为10个月,体质量为(35±5)g。均在SPF环境下喂养,温度为 (22±2)℃,自然光线,自由饮水,普通饲料(非铝制品的器皿中存放)。整个实验过程严格遵守国家科技部发布的《关于善待实验动物的指导性意见》相关规定。
1.2主要实验试剂和仪器 Shh一抗(北京博奥森BIOSS,BS-1544R),Smo一抗(武汉三鹰PTG,66851-1-IG),Gli1一抗(北京博奥森BIOSS,BS-1206R),荧光二抗(488山羊抗兔,Jackson111-545-003),荧光二抗(488山羊抗鼠,Jackson111-545-003),4′,6-二脒基-2-苯基吲哚(DAPI,索莱宝C0060),抗荧光淬灭封片剂(southbiotech0100-100)。
1.3动物取材 麻醉后用脱颈法处死,组织剪沿皮肤及皮下组织各层剖开腹腔,迅速剥离小鼠肾脏组织,用预冷的PBS清洗后滤纸吸干多余液体,肾脏浸泡于4%多聚甲醛用于苏木素-伊红(HE)、马松(Masson)染色和免疫荧光实验。
1.4HE染色与Masson染色 切片常规二甲苯脱蜡、梯度乙醇脱水后,HE染色经苏木素染细胞核,伊红染细胞质后在光学显微镜下观察肾脏结构病理改变;Masson染色经苏木素染色、丽春红染色、苯胺蓝染色后在光学显微镜下观察肾脏组织胶原沉积情况。在400倍镜下每张切片随机选取10个不同视野,将呈现为蓝色区域的胶原纤维视为阳性目标,以阳性区域的面积与整个视野总面积的比值为肾脏纤维化指数。采用 Image Pro Plus6.0 软件进行半定量分析。
1.5免疫荧光 切片常规使用二甲苯脱蜡、梯度乙醇水化;柠檬酸抗原修复缓冲液(pH6.0)抗原修复,将玻片置于磷酸盐缓冲液(PBS)中在脱色摇床上晃动洗涤3次,5 min/次,吸干,在切片上滴加PBS按一定比例配好的一抗4 ℃孵育过夜后置PBS中摇床洗涤3次,5 min/次;吸干,在圈内滴加与一抗相应种属辣根过氧化物酶(HRP)的二抗覆盖组织,避光室温孵育50 min,再置于 PBS 中摇床洗涤3次,5 min/次;吸干,滴加DAPI染液,避光室温孵育10 min;再置于PBS中摇床洗涤3次,5 min/次后用抗荧光淬灭封片剂封片。切片于蔡司倒置显微镜下观察并采集图片,阳性表达呈绿色,细胞核呈蓝色,并采用 Image Pro Plus6.0 软件进行半定量分析荧光强度。
1.6统计学方法 采用SPSS25.0软件进行t检验。
2 结 果
2.1HE、Masson染色病理表现 HE染色观察小鼠肾脏组织病理学改变,Masson染色观察肾脏组织纤维化程度,结果显示,SAMR1组肾脏未见明显异常病理变化,肾小管结构清楚、完整,肾小球结构清晰,形态规则,系膜细胞及间质无明显改变,血管周围间质仅见少量炎性细胞浸润,肾小球基底膜及肾小管间质处见少量阳性着染,胶原纤维沉积较少;与SAMR1组比较,SAMP8组肾脏于镜下可见明显病理损伤,肾小管上皮细胞水肿、空泡样变性,小管间质处有炎性细胞浸润;肾小球体积增大、充血,系膜增生,基底膜增厚,血管周围间质有大量炎性细胞浸润;肾小球及肾小管出现明显蓝色着染,表明胶原沉积较多,纤维化明显。SAMR1组、SAMP8组肾脏纤维化表达面积占比具有显著差异〔(15.32±1.32)%、(4.10±1.30)%,P<0.01〕。见图1、图2。
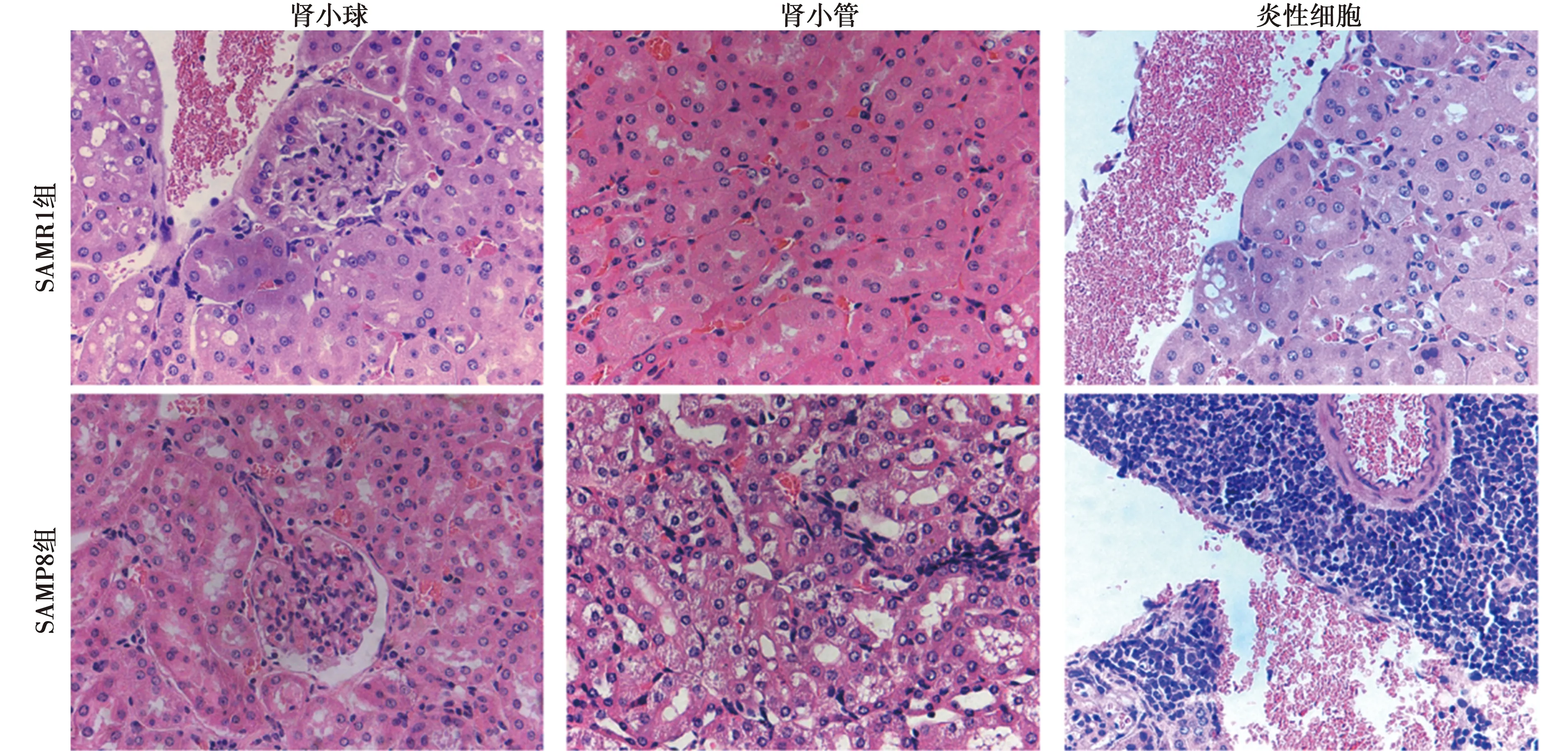
图1 两组肾脏组织(HE染色,×400)
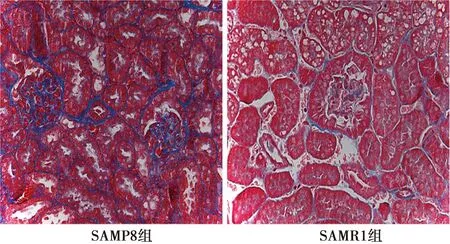
图2 两组肾脏组织(Masson染色,×400)
2.2一般情况 SAMR1组生长状态良好,反应灵敏,食欲旺盛,毛发光亮,二便正常;SAMP8组精神萎靡,活动能力降低,食量减少,毛发无光泽且有部分脱落,大小便减少。解剖后对肾脏组织进行观察可见SAMR1组肾脏大小正常,色暗红质软;而SAMP8组肾脏稍肿胀增大,呈暗褐色,质地偏硬。
2.3Shh、Smo、Gli1的免疫荧光表达 Shh、Smo、Gli1蛋白的表达主要集中在肾小管,在肾小球中鲜有表达。SAMP8组肾小管中Shh、Smo、Gli1蛋白表达明显高于SAMR1组(P<0.01)。见表1、图3。
表1 两组Shh、Smo、Gli1蛋白表达
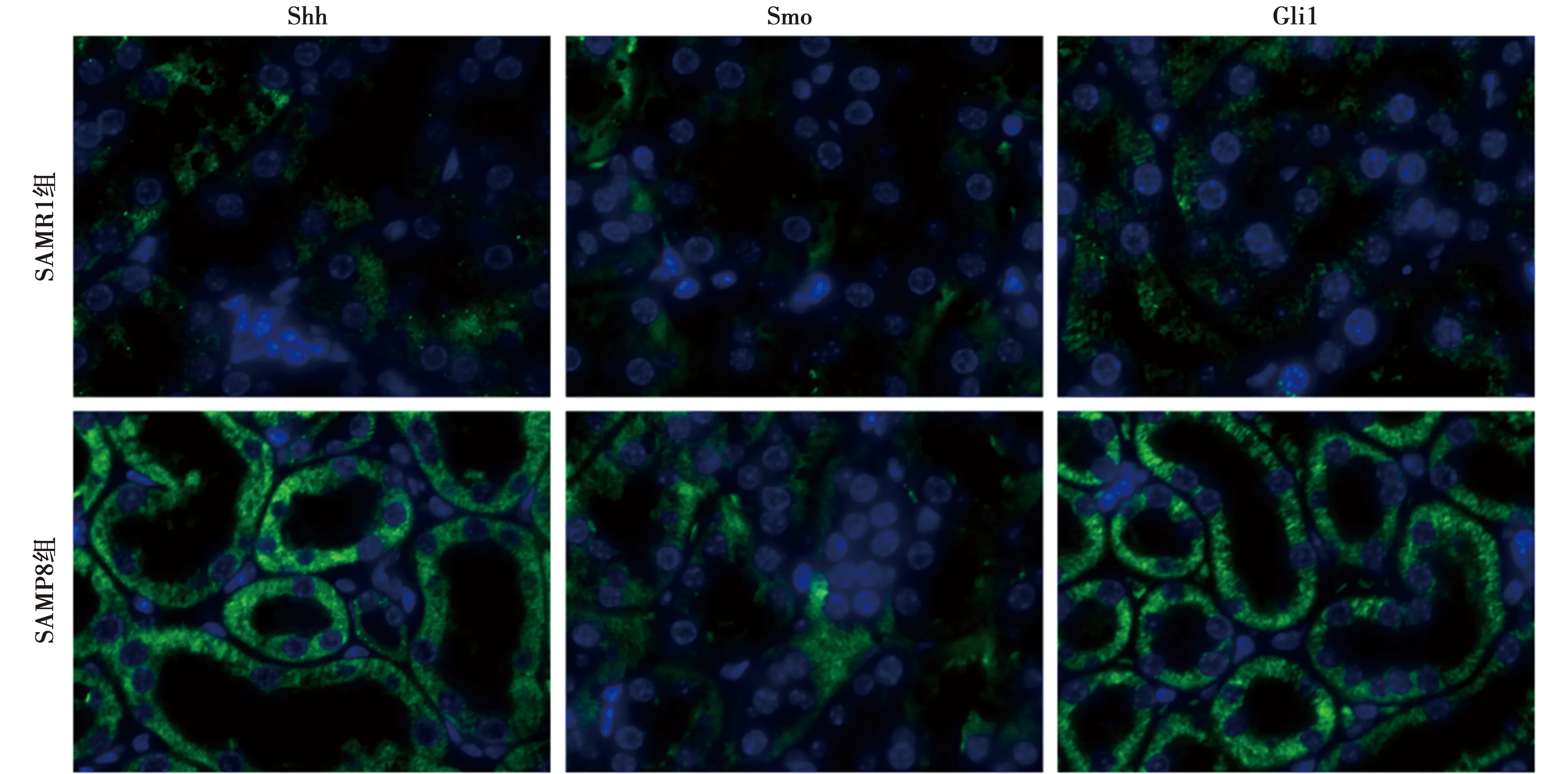
图3 两组肾脏组织Shh、Smo、Gli1免疫荧光表达(×400)
3 讨 论
SAM小鼠于20世纪70年代初由日本京都大学竹田俊男教授开发并沿用至今,该种类小鼠平均生存年限为12~13个月,相较于其他一般小鼠缩短了2~3倍,同时因其具有与人类老化性疾病所相似的相关衰老病理表现,而成为目前最广泛运用于研究衰老的哺乳类动物模型。SAMP8小鼠作为SAM小鼠中的一个品系,经过研究证实其短寿,学习和记忆能力缺损,免疫反应低下且随年龄增长而加速衰退等特点〔5,6〕。
肾脏是受损伤、衰老等因素影响时变化较为明显的器官。在年龄增长过程中,肾小球硬化及肾小管间质纤维化是伴随着衰老所产生的特征性变化,肾脏结构与血流动力学发生改变导致肾脏功能进行性恶化甚至丧失〔7~9〕。因此,调控肾纤维化的相关信号通路受到高度关注,包括Shh、Wnt/β-catenin、转化生长因子(TGF)-β1/Smad、m-TOR、细胞外调节蛋白激酶(ERK)-1/2、丝裂原活化蛋白激酶(MAPKs)、肝细胞生长因子(HGF)/c-met等信号通路〔10~12〕。其中,Shh信号通路主要是由分泌型糖蛋白配体、跨膜蛋白受体复合物Ptch和Smo及下游转录因子Gli蛋白组成。在胚胎期,该通路高度活化,调控着细胞的增殖、分化,参与肾脏组织的形成,维持机体的稳态;在成体期,该通路高度保守,鲜有表达。然而,当Shh信号通路异常激活会引发肾脏纤维化、肿瘤等发育异常。有研究发现Shh信号通路不仅能通过复杂的网络机制联系串话Wnt/β-catenin、TGF-β/Smad等常见通路,共同影响肾纤维化的进展,还能直接靶向作用于肌成纤维细胞的活化、增殖与转化〔13〕。本实验结果表明Shh信号通路的异常激活参与了肾纤维化过程。
综上,Shh信号通路与肾纤维化密切相关的联系在SAMP8衰老小鼠中有明显表现,然而对于抑制Shh信号通路与改善肾纤维化仍需深入研究,以期更好地指导衰老相关的肾纤维化临床治疗。
