单针藻(Monoraphidium sp.)4M-18对4种抗生素的敏感性分析
2023-07-21张云野尹紫良林宜萌葛菁萍平文祥
李 畅, 张云野, 樊 阳, 孙 莹, 尹紫良,林宜萌, 葛菁萍, 平文祥
(1.黑龙江大学 农业微生物技术教育部工程研究中心, 哈尔滨 150500;2.黑龙江大学 生命科学学院 黑龙江省普通高等学校微生物重点实验室, 哈尔滨 150080)
0 引 言
化石能源的使用带动了全球经济的快速进步与发展。自工业革命开始,全球化石能源的消耗一直处于加剧上升状态。美国能源信息管理局预测,这种消耗状态至少还要持续20年[1]。化石能源的加剧消耗在推动社会进步、改善人们生活水平的同时,也导致了气候变暖[2]和化石能源危机[3]等问题。因此,大力发掘清洁环保、可再生的化石能源替代品,对于满足国家清洁能源和可持续发展的需求及解决因化石能源大量使用导致的诸多问题具有重要意义。
微藻是一类光学显微镜下可见、个体微小、种类繁多、营养价值丰富、分布广泛、单细胞或简单多细胞、真核或原核的水生生物[4-7]。微藻经代谢可以在体内累积中性脂肪三酰甘油(Triacylglycerol, TAG),它是生产生物质燃料生物柴油的主要原料。生物柴油是当前公认的可以替代化石能源的清洁能源,利用微藻生产生物柴油具有以下三大优势:(1)微藻环境适应力强,在淡水、海水甚至污水中都可生长,不与粮食作物竞争土地,且在一定程度上有助于污水的回收利用与净化处理并减少粮食危机发生的概率[8-12];(2)微藻的光合速率高、繁殖速度快、生长周期短、单位面积生物量产量高[13-14];(3)微藻具有较高的含油量及产油量,其含油量及产油量可分别高达传统产油作物的10倍和103倍[15]。因此,目前科研工作者致力于利用微藻高产生物柴油的研究,以满足国家清洁能源和可持续发展的要求。
微藻在培养和纯化过程中容易染菌,针对微藻容易染菌的问题,研究人员通常采用物理及化学方法对微藻进行无菌化处理,以获得微藻纯藻株。不同的无菌化处理方法有其各自不同的特点,物理无菌化处理方法操作复杂、工作量大,且仅可除去微藻培养环境中的杂菌,而对微藻体内共生杂菌的去除效果较差;化学无菌化处理方法操作方便、技术简单,且能够同时抑制微藻体内及培养环境中的杂菌生长[16-17],对于微藻的无菌化处理更彻底,因此得到研究人员的普遍认可。本文分别采用液体培养和固体培养两种不同的手段,观察单针藻4M-18对卡那霉素、四环素、氯霉素和青霉素4种抗生素的敏感性,为单针藻4M-18利用抗生素法进行无菌化处理提供了参考。
1 材料与方法
1.1 试验材料
1.1.1供试藻株
单针藻4M-18由黑龙江大学微生物重点实验室保存。
1.1.2主要培养基
BG11培养基[18]用于单针藻4M-18种子液的扩大培养;TAP含氮培养基[19]用于藻株的混合培养。在相应的液体培养基中加入2.0%~2.5%的琼脂,用于藻株的固体平板培养。
1.1.3主要试剂
冰乙酸购于天津市光复科技发展有限公司;琼脂粉、卡那霉素、四环素、青霉素和氯霉素购于上海索莱宝生物科技有限公司;草酸铵、石碳酸、结晶紫、复红和碘化钾购于天津市科密欧化学试剂有限公司。
1.2 试验方法
1.2.1藻株的培养
利用光照摇床和人工气候箱,采用混合培养和自养培养两种方式对藻株进行培养。除特别说明外,藻株的培养均按以下方式进行:光照摇床的培养条件设定为:转速100 r·min-1、温度25 ℃、光照强度3 000 lux,每天下午4点开摇床(开光照和转速按钮),次日早8点关摇床(关光照和转速按钮);人工气候箱的培养条件设定为:培养温度25 ℃、光照强度3 000 lux、光暗周期比12 h ∶12 h。
1.2.2单针藻4M-18种子液的培养
取单针藻4M-18藻液,按照10%的量接种于BG11自养培养基中,最终装液量为200 mL/500 mL(三角瓶),于光照摇床中培养至稳定期(20~22 d),即得种子液。
1.2.3利用TAP含氮培养基培养藻株
取自养培养的单针藻4M-18种子液,按照终止OD680 nm= 0.3接于TAP含氮培养基中,并接入适宜体积的抗生素母液,TAP含氮培养基最终装液量为250 mL/500 mL(三角瓶),于光照摇床中培养至稳定期。
1.2.4单针藻4M-18在液体培养基中的抗生素敏感性试验
取自养培养至稳定期的单针藻4M-18种子液,按照10%的比例接种于TAP含氮培养基中,最终装液量为100 mL/250 mL(三角瓶),按表1所示的抗生素浓度分别加入适宜体积的抗生素母液后,于人工气候培养箱中培养,每天固定时间早晚各摇晃藻液一次,避免藻细胞沉底影响其生长;同时,每天早8点取样测定藻细胞密度,观察藻细胞生长情况。每个浓度抗生素均设置3个平行试验,以降低试验误差。抗生素浓度梯度的调整方法为:在最终装液量为100 mL/250 mL(三角瓶)的单针藻4M-18培养液中,分别加入浓度为100 mg·mL-1的青霉素母液0、 50、 100、 150、 200和250 μL,调整培养液中青霉素终浓度分别为0、 50、 100、 150、 200和 250 mg·mL-1。以上为青霉素浓度梯度的调整方法,其他抗生素与之相同。
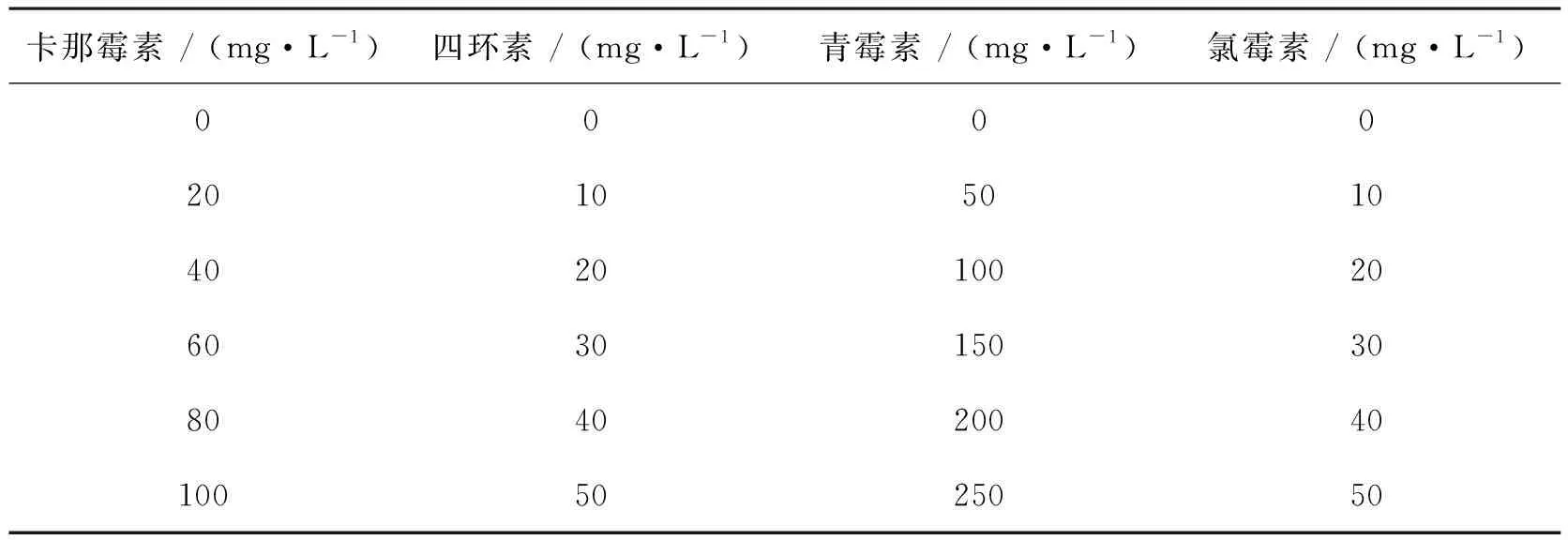
表1 不同种类抗生素的浓度梯度设定
1.2.5单针藻4M-18在固体培养基中的抗生素敏感性试验
取自养培养至稳定期的单针藻4M-18种子液,利用血球计数板计算藻细胞密度,以确定藻液的稀释倍数。利用无菌0.9%NaCl溶液稀释藻液,取稀释好的藻液100~200 μL均匀涂布于含有不同浓度抗生素(0、100、150和200 mg·L-1)的TAP含氮培养基的固体平板上(保证每个平板上200~300个藻落即可),于人工气候箱中培养15 d后,观察不同浓度抗生素在平板上对杂菌的抑制作用及对单针藻4M-18生长的影响。每个浓度抗生素均设置3个平行试验,以减小试验误差。固体培养基中抗生素的选择及浓度梯度设定如表2所示。
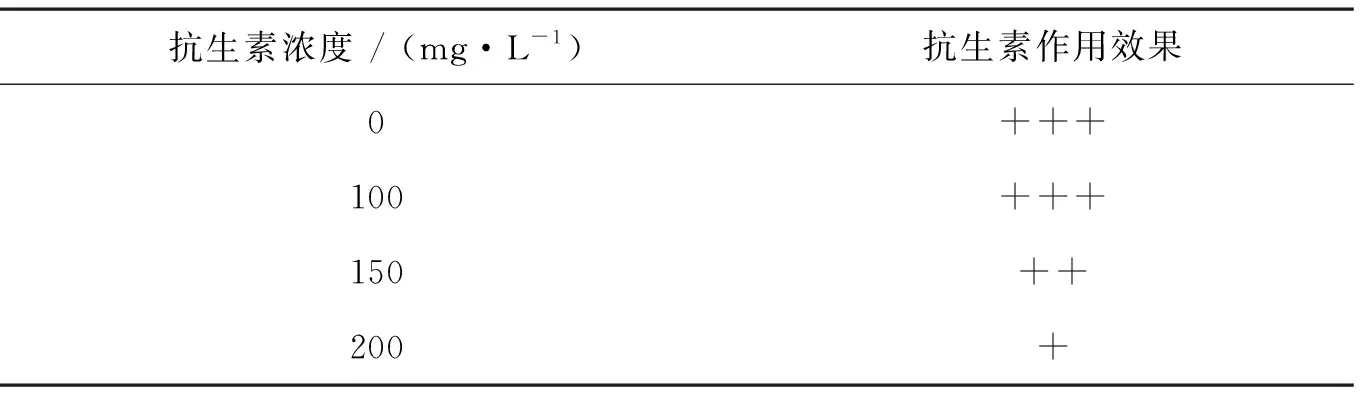
表2 不同浓度青霉素处理15 d后单针藻4M-18的生长情况
2 结果与讨论
2.1 单针藻4M-18的杂菌污染情况
在利用TAP含氮培养基培养单针藻4M-18的过程中,发现藻液极易受杂菌污染,通过革兰氏染色及镜检发现,藻液所染杂菌主要为革兰氏阳性球菌及革兰氏阳性杆菌,如图1所示。
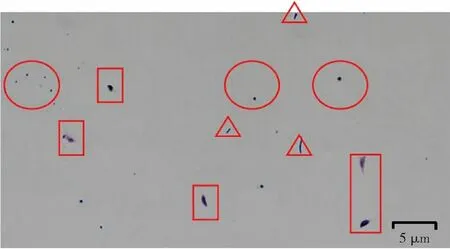
注: 圆圈内为藻液中的革兰氏阳性球菌; 三角形内为藻液中的革兰氏阳性杆菌; 长方形内为单针藻4M-18细胞。
2.2 单针藻4M-18在液体培养基中的抗生素敏感性试验
根据不同抗生素抗菌谱范围的不同,选择卡那霉素、四环素、氯霉素和青霉素4种抗生素,在液体培养基中对单针藻4M-18进行了抗生素敏感性试验。
2.2.1卡那霉素对单针藻4M-18生长的影响
卡那霉素是一种氨基糖苷类抗生素,对大多数革兰氏阴性菌具有强大的抑制作用。图2为卡那霉素对单针藻4M-18生长的影响结果,由图可知,20 mg·L-1卡那霉素处理后的单针藻4M-18细胞在培养0~4 d时处于延滞期,4~6 d时处于急剧生长期,且藻细胞密度在6 d时与对照组持平。由于经20 mg·L-1卡那霉素处理后的单针藻4M-18细胞生长延滞期过长,因此不选择卡那霉素作为最优抗生素。余旭亚等利用卡那霉素在液体培养基中对单针藻FXY-10进行抗生素敏感试验,发现25~200 mg·L-1卡那霉素均可显著抑制藻细胞的生长[20],本试验结果与其一致。
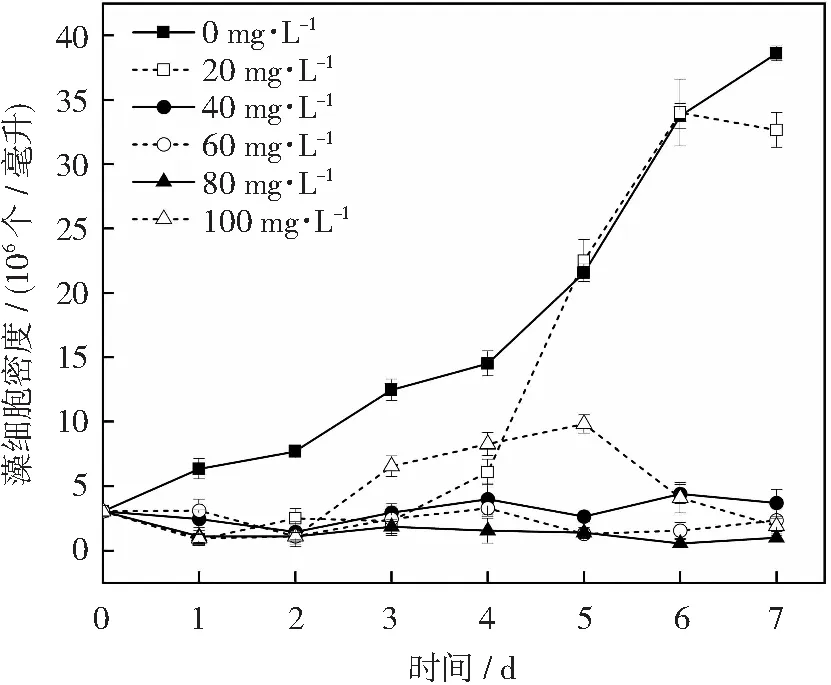
图2 卡那霉素对单针藻4M-18生长的影响
2.2.2四环素对单针藻4M-18生长的影响
四环素是一种能防治革兰氏阳性菌和革兰氏阴性菌引发的疾病、维持人体健康的一类抗生素[21]。图3为四环素对单针藻4M-18生长的影响,由图可知,不同浓度的四环素对单针藻4M-18生长均有不同程度的抑制作用。当四环素浓度为10 mg·L-1时,微藻有生长的现象,但与未添加抗生素组相比,生长相对缓慢,而其他四环素浓度下的微藻基本不生长。张茜等研究发现,在液体培养基中的低浓度四环素(10 mg·L-1)可抑制富油新绿藻(Neochlorisoleoabundans)的生长[22],本试验结果与其相似。
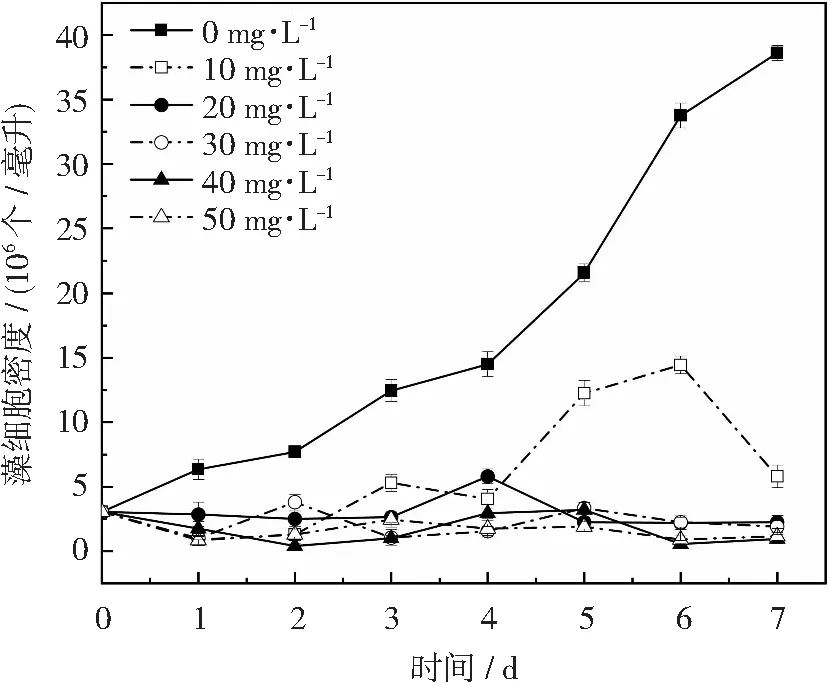
图3 四环素对单针藻4M-18生长的影响
2.2.3氯霉素对单针藻4M-18生长的影响
氯霉素是从委内瑞拉链霉菌(Streptomycesvenezuela)中分离提取的广谱抗生素,对许多需氧革兰氏阳性细菌、革兰氏阴性细菌以及厌氧的菌质体都有抑制作用[23]。图4为氯霉素对单针藻4M-18生长的影响结果,从图中可以看出,当氯霉素浓度为10 mg·L-1时,单针藻4M-18藻株生长缓慢;在抗生素浓度高于10 mg·L-1时,藻株几乎不再生长,受到明显的抑制。这与余旭亚等研究发现10~200 mg·L-1氯霉素可抑制藻细胞生长的结果[23]一致。

图4 氯霉素对单针藻4M-18生长的影响
2.2.4青霉素对单针藻4M-18生长的影响
青霉素通过抑制细菌细胞壁四肽侧链和五肽交连桥的结合,阻碍细菌细胞壁合成,从而发挥杀菌作用[24]。图5为青霉素对单针藻4M-18生长的影响结果,由图可知,当青霉素浓度为50和150 mg·L-1时,藻细胞呈现S型增长,且在培养周期5~6 d的藻细胞密度高于对照组。由图6可知,150 mg·L-1青霉素能够有效抑制杂菌生长,且经两种浓度青霉素(50和150 mg·L-1)处理后的单针藻4M-18藻液,藻细胞形态无明显变化,均呈现弯曲的月牙型,表明浓度为150 mg·L-1的青霉素对单针藻4M-18的细胞形态无影响。有文献报道,青霉素可以广泛应用于微藻的无菌化处理,其能够有效抑制微藻共生杂菌的生长,但对微藻的生长抑制不明显,一定浓度的青霉素还可促进微藻细胞的生长[24],这与本试验结果相似。刘晓娟等研究发现,在液体培养基中添加50 mg·L-1青霉素,对眼点拟微绿球藻(Nannochloropsisocutala)的生长无明显影响,且在添加青霉素2 d后,培养液中的共生杂菌数目有所减少[25];李静红等研究发现,当培养液中的青霉素终浓度为1.5 g·L-1时,波吉卵囊藻(Oocystisborgei)的生长才被抑制[26]。本试验结果与刘晓娟和李静红等的研究结果有一定差异,可能是由于不同藻株之间存在种属差异性和特异性。因此,在液体培养基中可选择添加150 mg·L-1青霉素作为单针藻无菌体系建立的备选抗生素。
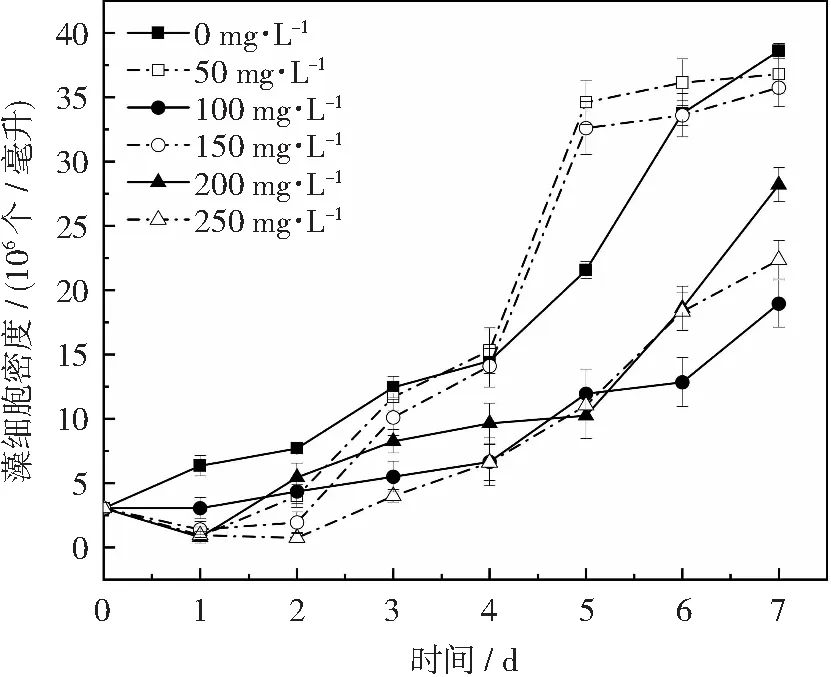
图5 青霉素对单针藻4M-18生长的影响

图6 不同浓度青霉素处理7 d后单针藻4M-18的染菌情况(400×):(a) 0 mg·L-1 ; (b) 50 mg·L-1;(c) 150 mg·L-1
2.3 单针藻4M-18在固体平板上的抗生素敏感性试验
藻株在固体培养基和液体培养基中对抗生素的耐受浓度是不同的[27],而且固体平板培养法可以直观地反映微藻在不同浓度抗生素的固体培养基中能否生长存活,方法简便[20]。以TAP含氮液体培养基中添加的抗生素种类和浓度为基础,进一步在固体平板上确定单针藻4M-18所耐受的抗生素浓度。在固体平板上,不同浓度青霉素对单针藻4M-18藻落生长和藻落形态的影响及对杂菌的抑制情况如表2和图7所示。

图7 不同浓度青霉素处理15 d后单针藻4M-18的生长、形态和染菌情况: (a) 0 mg·L-1;(b) 100 mg·L-1; (c) 150 mg·L-1;(d) 200 mg·L-1
在固体平板上,100 mg·L-1青霉素对单针藻4M-18的生长无显著影响,同时未见其他杂菌生长。与对照组相比,藻落形态无明显变化,均表现为大而饱满有光泽,该结果与张茜等报道的“同一种藻在固体和液体培养基中对同一种抗生素敏感度不同”的结论[22]相似。因此,在固体平板上可选择添加100 mg·L-1青霉素作为单针藻无菌体系建立的备选抗生素。综上所述,由于不同藻株之间存在种属特异性及差异性,在利用抗生素抑菌法对藻株进行无菌化处理时, 应根据藻株的性质来选择适宜种类及浓度的抗生素。
3 结 论
以实验室保存的单针藻4M-18为出发藻株,利用4种抗生素对单针藻4M-18进行敏感性试验,最终选用青霉素对单针藻4M-18进行无菌化处理。在液体和固体培养基中,150和100 mg·L-1青霉素能够有效抑制单针藻4M-18共生杂菌的生长,同时对藻细胞(藻落)生长及形态无显著影响。
