高迁移率蛋白1/Toll样受体4信号通路与下肢动脉硬化闭塞症介入治疗后复发的相关性分析
2023-07-20李光泽张济林昌俭王垚柯俞慎林
李光泽 张济 林昌俭 王垚柯 俞慎林
下肢动脉硬化闭塞症(arteriosclerosis obliterans,ASO)是因形成下肢动脉粥样斑块,阻塞血管,导致下肢供血不足,最终全身动脉硬化病变[1]。介入治疗可有效再通狭窄或闭塞血管,但介入术后血管再狭窄一直是临床难以解决的难题。血管再狭窄的具体发生机制可能与炎症反应、血管内皮损伤、血栓形成等多种原因相关,且血管炎症反应是ASO介入术后血管再狭窄的重要原因之一[2]。李立涛等[3]研究发现,ASO介入术后再狭窄病人血清内皮素-1(endothelin-1,ET-1)水平升高,并可能与术后狭窄形成相关。李全成等[4]研究发现,术前高敏C反应蛋白(high-sensitive C-reactive protein,hs-CRP)水平升高也是ASO介入术后再狭窄的危险因素。ASO的病理基础是动脉粥样硬化(atherosclerosis,AS),而高迁移率蛋白1(high-mobility group box 1,HMGB1)及Toll样受体(Toll-like receptors,TLRs)途径可能通过免疫炎症反应参与AS的发生发展[5]。本文研究HMGB1/TLR4信号通路是否也参与ASO介入术后血管再狭窄,并分析该通路与血管炎症相关因子ET-1及hs-CRP之间的关系。
对象与方法
一、对象
我院2020年1月~2021年1月间收治的84例,共96条病变血管行介入治疗的ASO病人纳为研究对象。纳入标准:所有病人均符合下肢动脉硬化闭塞症治疗指南(中华医学会外科学分会血管外科学组,2008年版)中相关诊断标准[6];年龄≥60岁;经下肢血管造影(DSA)或CT血管成像(CTA)证实下肢动脉狭窄程度≥50%;均为首次行介入术治疗;术后可配合完成随访。排除标准:合并大动脉炎活动期;合并重要器官功能严重障碍;精神异常;严重凝血功能障碍;因栓子脱落的急性下肢动脉缺血。84例ASO病人中,男50例,女34例,年龄60~77岁,平均年龄(64.54±10.63)岁。36例病人接受球囊扩张术,30例病人接受支架形成术,18例病人接受球囊扩张+支架形成术。本研究经医院伦理委员会批准,参与者均知情且同意。
二、方法
1.手术方法:根据术前CTA影像学资料评估血管情况,选择合适的入路,以Seldinger技术穿刺动脉置入鞘管后静脉给予0.5~1.0 mg/kg肝素进行全身肝素化,放入超滑导丝并跟进导管,从腹主动脉开始行双侧髂动脉及患侧肢体动脉造影,根据血管病变情况决定手术方式。造影后将导丝导管通过狭窄或闭塞部位,交换超硬导丝,造影后根据病变情况选择不同直径球囊扩张狭窄或闭塞部位,对髂动脉病变多者考虑置放支架,股动脉病变者根据球囊扩张后有无遗留狭窄及夹层等情况选择性置放支架。
2.外周血单个核细胞(PBMCs)的HMGB1/TLR4 mRNA水平检测:(1)PBMCs分离:分别于术前及术后1个月,采集所有病人空腹肘静脉血1 ml,抗凝试管收集,使用外周血单个核细胞分离试剂盒(北京索莱宝)分离单个核细胞。具体操作如下:1 ml外周血与1 ml生理盐水混合均匀后,每分钟4 000 r离心20分钟,溶液从上到下分为分为血浆层、乳白色PBMCs层、透明分离液层及红细胞层,收集PBMCs至5 ml生理盐水中,每分钟4 000 r离心20分钟,取沉淀洗涤2次,得到PBMCs。(2)逆转录实时荧光定量PCR(qRT-PCR):使用Trizol试剂提取PBMCs细胞总RNA,用cDNAiScriptTM合成试剂盒进行RNA反转录成cDNA。采用Takara SYBR Premix Ex TaqTM对cDNA进行RT-PCR反应,实验设定的反应温度与时间如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火,延伸40 s,40个循环,RT-PCR引物序列如下,HMGB1上游引物:5'-TGCAGATGACAAGCAGCCTT-3';HMGB1下游引物:5'-GCTGCATCAGGCTTTC CTTT-3';TLR4 上游引物:5'-TCCGACGGCCGTCTGCTCGC-3';TLR4 下游引物:5'-TACGGATAGTAGCTGGCCAGCC-3';GAPDH上游引物:5'-TGCCAAATATGATGAC ATCAAGAA-3';GAPDH下游引物:5'-GGAGTGGGTGTCGCTGTTG-3'。利用2-△△Ct方法分析结果,以GAPDH作为内参,将每组所测得的目的基因cDNA拷贝数与其相应的内参相比,得出目标基因的相对含量,上述实验重复3次。
3.观察及随访:低分子肝素抗凝3~5天,氯吡格雷口服半年,阿司匹林终生服用。术后行CTA检查,病变血管残余狭窄<30%,无动脉夹层存在即为成功。术后随访12个月,行双下肢彩超了解靶血管通畅情况,对临床症状严重者行双下肢CTA检查,血管狭窄≥50%定义为血管再狭窄或复发。
三、统计学方法
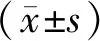
结果
1.ASO介入治疗术后复发情况:介入治疗后,84例病人96条病变血管均开通,随访12个月(无病例丢失),经双下肢超声及CTA检查提示有16例病人(共18条病变血管)再狭窄,其中髂动脉病变病人7条,股腘动脉病变病人11条。将16例复发者纳为复发组,剩余68例病人纳为对照组。
2.两组病人一般资料比较:两组性别、年龄、基础性疾病及住院时间等一般资料进行比较,差异无统计学意义(P>0.05),见表1。

表1 两组病人一般资料比较
3. 两组病人HMGB1/TLR4表达水平:复发组病人PBMCs内HMGB1及TLR4表达水平高于对照组,差异有统计学意义(P<0.05),见图1。复发组HMGB1的相对表达水平为1.26±0.19,对照组HMGB1的相对表达水平为0.52±0.03,两组比较,差异有统计学意义(P<0.01);复发组TLR4的相对表达水平为2.57±0.22,对照组TLR4的相对表达水平为0.29±0.02,两者比较差异有统计学意义(P<0.01)。

A.HGMB1 mRNA;B.TLR4 mRNA (**表示P<0.01)
4.两组ET-1及hs-CRP水平比较见图2。复发组病人血清ET-1及hs-CRP水平高于对照组,差异有统计学意义(P<0.05)。复发组血清ET-1水平为(76.95±13.68)pg/ml,对照组为(63.15±12.07)pg/ml,两组比较差异有统计学意义(P<0.01);复发组血清hs-CRP水平为(6.79±1.92)mg/L,对照组为(3.94±1.54)mg/L,两组比较,差异有统计学意义(P<0.01)。

A.ET-1;B.hsCRP(**表示P<0.01)
5. HMGB1/TLR4水平与ET-1、hs-CRP关系分析见表2。相关性分析提示,复发组病人外周血PBMCs的HMGB1及TLR4水平与血清的ET-1及hs-CRP水平均呈正相关(P<0.05)。

表2 复发组病人PBMCs的HMGB1/TLR4与ET-1、hs-CRP的关系分析
讨论
目前,以球囊扩张及支架置入为主要代表的介入治疗已成为目前ASO治疗的主流。有研究显示,介入术后3年,下肢动脉狭窄及闭塞动脉病人血管再狭窄率分别为39%和52%,严重狭窄及闭塞病人3年复发率更高[7]。体内置入支架后,会导致局部血小板聚集,引起炎症反应和血栓形成;同时,损伤的血管周围有大量白细胞聚集,会导致炎症反应,使平滑肌细胞迁移和增殖,引起内膜增生,发生再狭窄[8]。本研究对84例行介入治疗的ASO病人进行为期1年的随访,经CTA检查证实术后1年内有16例病人出现再狭窄,再狭窄发生率为19.05%。
介入术后再狭窄所涉及的原因及机制复杂,其中血管内皮损伤及炎症反应是最主要的机制之一。血管内皮细胞产生和释放收缩(内皮素,ET-1)和舒张因子(一氧化氮,NO),以上因子在生理状态下保持动态平衡,从而维持正常的血管张力和血流量。ET-1是一种活性多肽,由内皮细胞合成及分泌,可刺激平滑肌收缩,也是重要的血管损伤因子[9]。有研究表示,内外界作用对血管的牵拉及刺激,均可促进内皮细胞分泌更多的ET-1,导致血管收缩及狭窄[10]。置入支架可损伤血管内皮细胞,导致ET-1水平升高可预测血管再狭窄的发生[11]。hs-CRP是炎症反应的敏感标志物,hs-CRP水平升高提示机体炎症反应,hs-CRP也参与ASO的发生及发展[12]。李全成等[4]研究表明,hs-CRP水平升高是ASO病人介入术治疗后复发的危险因素。本研究发现,ASO复发者血清hs-CRP水平高于未复发者,提示hs-CRP也可能参与介入术后血管再狭窄。
HMGB1是HMGB家族中的一员,在多种器官及细胞中表达,可与DNA结合,参与DNA修复、基因转录、细胞复制等生命活动。TLR4属于TLRs家族,TLR4能识别内外源性配体,参与多种病理过程。有研究表示,HMGB1与TLR4结合后,可活化髓样分化蛋88(MyD88)及Toll/IL-1受体结构域衔接蛋白,活化NF-κΒ,激活炎症反应,参与AS的发生发展[13]。据报道,hs-CRP可以激活和促进HMGB1的释放,且在急性冠脉综合征病人血清HMGB1与hs-CRP存在正相关性,均是反映炎症程度重要指标[14]。冠心病病人血清HMGB1与ET-1水平成显著正相关,且可反映病人体内炎症水平[15]。本研究发现,与对照组未复发病人相比,介入术后复发ASO病人外周血PBMCs内HMGB1及TLR4表达量更高,提示HMGB1/TLR4信号通路可能参与介入术后复发。相关性分析发现,介入术后复发病人外周血PBMCs的HMGB1及TLR4表达量与血管损伤因子ET-1及炎症因子hs-CRP水平间均呈正相关。提示HMGB1/TLR4信号通路可能通过激活炎症因子释放,促进血管损伤,进而参与ASO病人介入术后复发。
本研究存在以下局限性:首先,本研究对HMGB1/TLR4信号通路的检测受条件限制仅基于外周血PBMCs,缺乏病变部位的直接标本;其次,所获的结果仅为相关性,并不能明确其机制及因果联系;最后,本研究未能收集病人手术前的标本,HMGB1/TLR4以及ET-1、hsCRP水平的变化还存在较多混杂因素。
综上所述,HMGB1/TLR4信号通路可能通过激活炎症因子释放,促进血管损伤,进而参与ASO病人介入术后复发。
