DPMAS 序贯PE 治疗脓毒症所致肝衰竭患者疗效及对凝血功能、肝功能和炎症因子水平的影响
2023-07-10杨斌韩小勇黄伟邓利艳张德春
杨斌 韩小勇 黄伟 邓利艳 张德春★
脓毒症所致肝衰竭是一种发病率低但死亡率高的危重症,生理和病理变化主要包括凝血因子合成减少、肝糖异生减少、骨髓造血抑制、血乳酸代谢降低、体内高分解代谢状态和血液中氨清除减少等,治疗主要以保肝为主,采用人工肝支持,暂时清除有毒物质和维持内部环境稳定[1-2]。连续性静脉-静脉血液滤过(continuous veno-venous hemofiltration,CVVH)是该疾病常用临床治疗方法,其通过吸附去除有毒物质进行净化,但对相对分子质量较大的炎症介质净化效果有限[3]。血浆置换(Plasma exchange,PE)是目前应用最多人工肝支持治疗方式,成功率高,但对血浆需求量较高[4]。双重血浆分子吸附系统(Dual Plasma Molecular Adsorption System,DPMAS)不仅能吸附胆红素,还能彻底清除体内炎症介质,同时减轻血浆供给需求[5]。本研究采用DPMAS 联合PE 治疗脓毒症所致肝衰竭患者,观察其临床疗效,报道如下。
1 资料和方法
1.1 一般资料
选取2020 年2 月至2022 年10 月重庆三峡医药高等专科学校附属人民医院收治的脓毒症所致肝衰竭患者60 例。纳入标准:①符合脓毒症[6]和肝衰竭[7]诊断标准;②患者家属知情同意。排除标准:①存在活动性出血及弥散性血管内凝血者;②自身免疫缺陷患者;③合并有其他严重器官疾病者;④具有肝移植历史者;⑤不能耐受本研究过程者。根据治疗方式不同分为对照组和观察组,经倾向性匹配评分法(卡钳值为0.02)排除性别、年龄、病程、肝衰竭分期、急性生理与慢性健康评分(Acute Physiology and Chronic Health EvaluationⅡ,APACHE Ⅱ)评分及终末期肝病模型评分等混杂因素影响,按1∶1 比例匹配最终获得两组各30例患者,匹配后两组基线资料均衡可比。见表1。本研究经院医学伦理委员会批准通过。
表1 两组临床资料对比[n(%),()]Table 1 Comparison of clinical data between the two groups[n(%),()]

表1 两组临床资料对比[n(%),()]Table 1 Comparison of clinical data between the two groups[n(%),()]
1.2 方法
对照组:接受抗病毒药物、营养支持、酸碱平衡、维持电解质和保肝降酶退黄等基本治疗。CVVH:建立血管通路,采用EQUAsmart 连续性血液滤过机,选取xevonta 聚砜膜滤过器,持续治疗,采用碳酸氢盐置换,25 mL 5%葡糖碳酸钙+2.7 mL 25%硫酸镁以16 mL/h 速度持续静脉泵入,参数根据患者情况灵活设置,滤过时间8~12 h,所有患者均使用低分子肝素抗凝。观察组在上述基础上进行DPMAS 联合PE 治疗:置换液采用新鲜冷冻血浆,每次血浆置换量约2 500 mL,血浆分离速率为20~25 mL/min;床侧双血浆吸附采用阴离子交换树脂吸附柱和中性大孔树脂吸附柱,患者每天接受1 次治疗,间隔3~5 天,总治疗期为28 d。
1.3 观察指标
1.3.1 指标测定
在治疗前后,采取患者空腹状态下静脉血5 mL,取血清,采用BK400 全自动生化分析仪检测患者肝功能主要指标,包括总胆红素(total bilirubin,TBIL)、谷丙转氨酶(Alanine transaminase,ALT)、白蛋白(Albumin,ALB)和胆碱酯酶(Cholinesterase,CHE)水平;采用RAC-120 全自动凝血分析仪测定凝血功能主要指标,包括凝血酶原活动度(Prothrombin activity,PTA)及血小板聚集功能(platelet aggregation,PAG);采用酶联免疫吸附法检测患者主要炎症因子,包括C 反应蛋白(C-reactive protein,CRP)和白介素-6(Interleukin-6,IL-6)水平。
1.3.2 28 d 死亡率及死亡危险因素
记录两组患者28 d 内死亡率,采用logistics 回归分析脓毒症所致肝衰竭患者28 d 死亡危险因素。
1.4 统计学分析
采用SPSS 24.0 软件对数据统计分析,计量资料以()表示,采用独立样本t检验;使用n(%)来进行描述计数资料,采用χ2检验,等级资料采用秩和检验,采用Logistics 回归分析脓毒症所致肝衰竭患者28 d 死亡危险因素,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组肝功能主要指标比较
治疗后,两组TBIL 和ALT 均较治疗前降低,且观察组低于对照组,两组ALB 和CHE 均较治疗前升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组肝功能主要指标比较()Table 2 Comparison of main indicators of liver function between the two groups()

表2 两组肝功能主要指标比较()Table 2 Comparison of main indicators of liver function between the two groups()
注:与同组治疗前比较,aP<0.05。
2.2 两组凝血功能主要指标比较
治疗后,两组PTA 和PAG 均较治疗前升高,且观察组高于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组凝血功能主要指标比较()Table 3 Comparison of main indicators of coagulation function between the two groups()

表3 两组凝血功能主要指标比较()Table 3 Comparison of main indicators of coagulation function between the two groups()
注:与同组治疗前比较,aP<0.05。
2.3 两组炎症因子主要指标水平比较
治疗后,两组CRP 和IL-6 均较治疗前降低,且观察组显著低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组炎症因子主要指标水平比较()Table 4 Comparison of main indicators of inflammatory factors between the two groups()
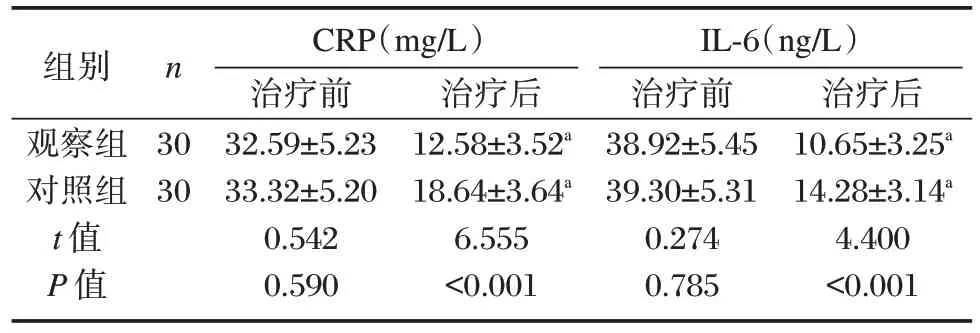
表4 两组炎症因子主要指标水平比较()Table 4 Comparison of main indicators of inflammatory factors between the two groups()
注:与本组治疗前比较,aP<0.05。
2.4 脓毒症所致肝衰竭患者28 d 死亡的危险因素logistics 回归分析
观察组死亡率为6.67%(2/30),对照组死亡率为16.67%(5/30),两组间比较差异无统计学意义(P>0.05)。logistics 回归分析结果显示,肝衰竭分期、APACHE Ⅱ评分、肝功能异常均为影响患者死亡独立危险因素(P<0.05)。见表5。

表5 影响患者28 d 死亡的危险因素logistics 回归分析Table 5 Logistics regression analysis of risk factors affecting 28-day mortality of patients
3 讨论
急性肝衰竭是脓毒症常见并发症之一,目前治疗主要采取血液透析、CVVH、PE、DPMAS 和特异性胆红素吸附等非生物型人工肝方式保护肝脏为主[8]。CVVH 主要过滤患者体内炎症介质,以抑制炎症反应发展,然而其具有一定局限性,无法有效去除中、大分子炎症介质,因此整体治疗效果并不理想[9]。PE 是一个体外循环过程,通过血浆分离和等效的新鲜冷冻血浆置换有效去除内源性毒素以及大分子物质。但PE 不能有效去除水溶性毒素,此外由于用血安全及血液资源缺乏等因素,单纯PE 模式已不能满足患者需求[10]。DPMAS 是近年来使用的一种新型人工肝技术,是采用中性大孔树脂吸附和离子交换树脂相结合的方法进行治疗,其可以选择性地吸附胆红素和胆汁酸,还可以有效地去除体内有害物质,同时保留自身血浆,可避免消耗大量外部血浆,降低输血和疾病传播风险,并减轻其他器官衰竭[11]。
血清TBIL、ALT、ALB、CHE、PTA 和PAG 等,这些指标均为反映肝脏功能、判断病情和预后的重要指标,ALB 水平降低表明肝脏病理损伤严重;PTA 和PAG 是诊断肝功能衰竭重要参数,其值与肝功能不全程度成反比关系[12]。炎症介质可以引起体内炎症反应,并参与肝细胞损伤过程,CRP 和IL-6 是典型促炎因子[13]。本研究结果这表明DPMAS 联合PE 可以促进患者肝功能恢复,改善凝血指标,有效清除机体促炎因子。分析原因,DPMAS 为胆红素吸附法和血液灌注装置相结合,其增强了对有毒物质的清除能力,降低了对肝脏的损伤;且在治疗过程中不会与血细胞直接接触,减少了对血细胞的损伤和血液过滤过程中血浆中有益物质的损耗;此外,DPMAS 具有更强的吸附作用,能够与大分子毒素及炎症介质等物质紧密结合,降低机体炎症反应,为肝细胞再生以及肝功能恢复提供一个相对稳定的内环境,利于凝血功能改善[14]。
张瑞芬等人[15]研究表明年龄、APACHEⅡ评分、肝功能指标等诸多因素对脓毒症患者预后有预测价值。本研究结果显示,年龄、肝衰竭分期、APACHEⅡ评分、肝功能异常均为影响患者死亡独立危险因素。因此,动态监测脓毒症患者肝功能变化有助于及时了解患者病情进展,对预后评估具有参考意义。同时,在脓毒症的治疗中建立肝脏保护计划,也是降低患者死亡率的关键。
综上所述,DPMAS联合PE治疗可明显改善脓毒症所致肝衰竭患者肝脏功能,促进凝血功能恢复,消除炎症因子,是治疗脓毒症所致肝衰竭的有效手段。
