肿瘤坏死因子受体相关周期性发热综合征1例并文献复习
2023-06-28林志华毛成刚王芳柏翠司辉郭兴青
林志华 毛成刚 王芳 柏翠 司辉 郭兴青

[摘要] 目的 总结1例因TNFRSF1A基因变异导致肿瘤坏死因子受体相关周期性发热综合征(TRAPS)的诊疗过程,以提高临床医生对该病的认识。
方法 回顾性分析我院收治的1例TRAPS病儿的临床资料,并进行相关文献复习。
结果 病儿,女,6岁7个月,反复发热4年,每次发热伴有白细胞、C反应蛋白、红细胞沉降率明显升高,1年前全外显子基因检测示TNFRSF1A基因c.350G>C变异,其父母无此变异,该变异为新发致病性变异,修正诊断为TRAPS。
结论 TRAPS为罕见遗传病,其临床表现多样,以反复发热最为常见,基因检测有助于诊断和指导治疗。
[关键词] 遗传性自身炎症性疾病;发热;受体,肿瘤坏死因子,Ⅰ型;遗传变异;病例报告
[中图分类号] R725.96
[文献标志码] B
[文章编号] 2096-5532(2023)02-0300-04
doi:10.11712/jms.2096-5532.2023.59.054
[开放科学(资源服务)标识码(OSID)]
肿瘤坏死因子受体相关周期性发热综合征(TRAPS)是一种常染色体显性遗传周期性发热综合征,它源于表达肿瘤坏死因子(TNF)α受体的TNFRSF1A(TNF受体超级家族成员1A)基因的突变。TRAPS病人主要临床表现为长期反复发热,该病为一种罕见的遗传性自身炎症性疾病,亚洲人发病少见,国内鲜有报道,发病年龄可从新生儿到成人,临床症状缺少特异性。本文报告1例TRAPS,并进行文献复习,以提高临床医生对该病的认识。
1 病例报告
病儿,女,6岁7个月,反复发热4年。初次发病年龄为1岁10个月,当时因“间断发热8 d”于2017年5月8日入院,最高体温40 ℃,发热每天1~2次,反复出现,无其他症状。既往史、出生史、喂养史、预防接种史和家族史均无异常。体格检查:T 36.5 ℃,P 122 min-1,R 34 min-1,体质量14 kg;神志清,精神可,发育、营养良好,全身皮肤黏膜无皮疹及出血点,浅表淋巴结无肿大,球结膜轻度充血,无分泌物,咽红,扁桃体Ⅰ度大,无脓栓及疱疹,心、肺无异常,腹平软,肝脾未及,神经系统查体未见异常。
入院后多次行血常規等检查:白细胞计数为(15.18~28.08)×109/L,中性粒细胞计数为(9.46~21.71)×109/L,血小板计数为(376.00~563.00)×109/L,C反应蛋白(CRP)63.45~133.08 mg/L,红细胞沉降率56.00~58.80 mm/h,降钙素原0.15~0.34 μg/L,铁蛋白252.20~25 960.00 μg/L。免疫球蛋白检查:IgA 2.2 g/L(0.7~4.0 g/L),IgM 2.9 g/L(0.4~2.3 g/L),IgG 8.0 g/L(7.0~16.0 g/L)。布鲁菌、EB病毒、巨细胞病毒、真菌G试验、曲霉菌GM试验、尿培养、血培养、肝炎全套+HIV+梅毒、结核感染T细胞检测均阴性,肺炎支原体抗体滴度1∶40。血凝常规、尿常规、粪便常规、肝肾功能、心肌酶检测均正常,骨髓常规检查未见异常,胸部CT平扫、消化系统超声、腹部包块超声、心脏超声检查均未见异常。
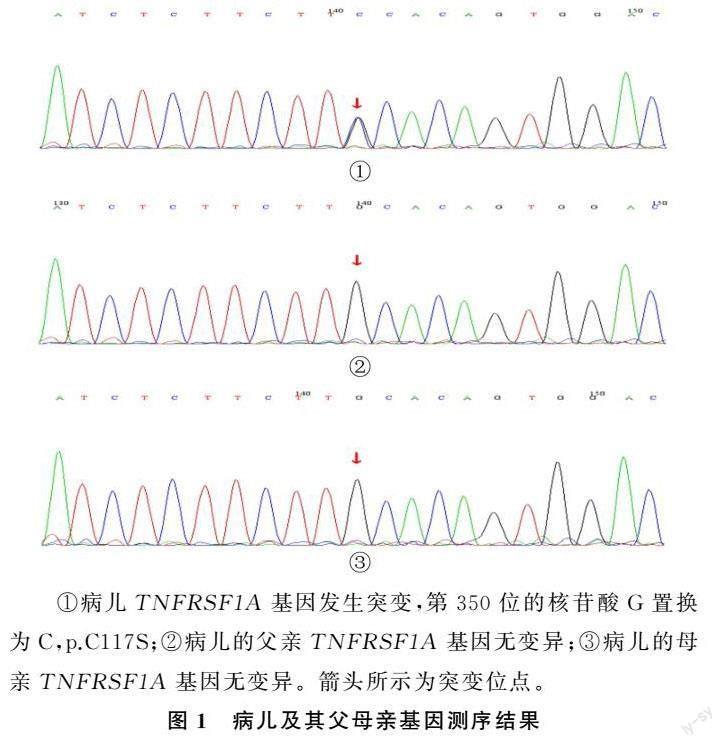
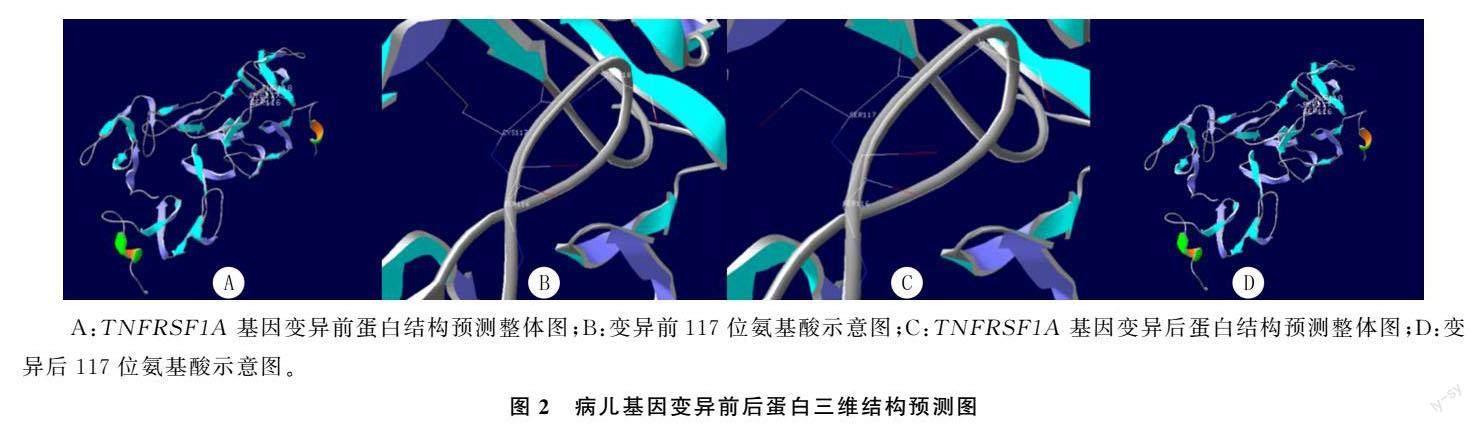
入院后先后予病儿哌拉西林钠他唑巴坦钠、比阿培南抗感染治疗2周无效,初步诊断为幼年特发性关节炎(全身型),停抗生素加用醋酸泼尼松片(25 mg/d)治疗,体温快速恢复正常并保持稳定。3 d后复查实验室检查结果均较前明显好转,白细胞计数7.62×109/L,CRP 15.53 mg/L。出院后根据病情调整泼尼松用量,泼尼松减量至15 mg每天1次时,病儿再次出现发热,白细胞计数、中性粒细胞计数、CRP、红细胞沉降率显著升高。加用生物制剂托珠单抗(雅美罗,每次160 mg)治疗。2017年7月24日—2019年12月16日先后住院18次,雅美罗初期用法为每2周1次,体温持续稳定,逐渐延长间隔时间达4周1次后再次发热,表现同前。发热时曾有一过性皮疹、肌痛和眶周水肿,考虑自身炎症性疾病不能排除,2019年6月17日—2020年1月22日加用甲氨蝶呤(每周三1次,每次7.5 mg),病儿体温仍时有反复。第19次入院后,经医院伦理委员会批准且家属知情同意后,对病儿进行家系全外显子检测及Sanger验证,发现病儿存在TNFRSF1A基因4号外显子c.350G>C位点杂合变异,p.C117S,遗传方式为常染色体显性遗传。正常人群该变异携带频率为 0,在千人基因组、gnomAD、ESP6500等正常人数据库中均未见该变异,在HGMD专业版数据库中也未见报道,且病儿父母不携带该变异,故该变异为新发变异(图1)。在 OMIM 数据库中关联的疾病与受检者临床症状部分匹配,ACMG 指南评定为 Pathogenic(致病性变异),以上均提示该突变位点为致病性变异。该变异位点位于β折叠间的连接处,导致第117位的半胱氨酸变成了丝氨酸,利用SWISS-MODEL软件得到该病儿基因变异前后的蛋白三维结构预测图(图2)。利用PolyPhen-2软件预测本文病儿氨基酸替换对蛋白质的影响:HumDiv和HumVar结果预测突变分值均为1.0,提示极有可能对蛋白质功能造成损害(此分值取值范围为0~1,越接近1,说明氨基酸替换对蛋白质结构和功能造成影响的概率越大)。结合病儿临床表现与遗传学检测,修正诊断为TRAPS。
修正诊断后,停用糖皮质激素,加用秋水仙碱 (每次1 mg,每日2次)、TNF受体-抗体融合蛋白(益赛普,每次12.5 mg,每周2次)治疗,体温持续稳定1个月,逐渐延长用药间隔时间,益赛普改为每周1次。当益赛普减量至每2周1次时病儿又出现反复发热,于用药3个月后停用秋水仙碱,给予益赛普(每周1次)加用沙利度胺(25 mg/d)治疗,病儿体温持续稳定,无不良反应,定期随访至今。
2 文献复习
以“Tumor necrosis factor receptor-1 associated periodic syndrome”和“Tumor necrosis factor receptor-associated periodic syndrome case”为检索式在PubMed数据库中进行检索,时间为2010年1月1日—2021年4月13日。共检索到文献110篇,纳入符合TRAPS诊断文献,排除重复报道、资料不足文献,最终检索到54篇文献,其中国外报道48篇,国内报道6篇。这54篇文献共报道TRAPS病人77例,其中女性38例,男性39例;成年人(>18岁)41例,儿童(≤18岁)36例;主要临床症状为发热64例(83%),关节炎51例(66%),腹痛49例(64%),皮疹43例(56%),肌痛40例(52%),眼部异常19例(35%),肾脏异常11例(14%)等。将77例病人根据年龄分为成人组(平均确诊年龄为35.0岁;男22例,女19例)及儿童组(平均确诊年龄为10.5岁;男17例,女19例),应用 SPSS 26.0 软件进行统计学处理分析。结果显示,成人组病人更可能出现肌痛、肾部病变,差异有统计学意义(χ2=8.110、4.208,P<0.05),两组病人出现发热、腹痛、关节炎、皮疹概率差异无统计学意义(P>0.05)。见表1。另外,收集这77例病人的TNFRSF1A基因突变类型,排除文献中未表明突变位点的病例,最终符合要求的有39例,其中儿童20例,成人19例。在儿童病例中3号外显子变异者15例,占比75%;在成人病例中3号外显子变异者8例,占比42%。
3 讨论
TRAPS属于单基因突变的周期性发热自身炎症疾病,是继家族性地中海热之后遗传性周期性发热综合征中第二常见的疾病。TRAPS最先在爱尔兰周期性发热的家庭中被发现,在发现TNFRSF1A基因的致病突变后更名为TRAPS。TNFRSF1A基因位于人12号染色体p13.31,包含10个外显子,编码1型TNF受体(TNFR1)。到目前为止,已确定的诱发TRAPS的TNFRSF1A基因突变至少有180个(周期性发热数据库https://infevers.umai-montpellier.fr/web/),其中致病性评级为Pathogenic或Likely pathogenic的位点共计102个,以2、3、4号外显子变异位点的占比较高,3号外显子记录的变异位点最多,可达49个。其中位于3号外显子上的T50M是最常见的变异位点。TRAPS发病机制十分复杂,目前认为与TNF信号通路相关:TNFRSF1A基因变异引起受体错误定位和(或)配体非依赖性激活,TNFR1脱落障碍,细胞表面高水平的TNFR1使细胞对TNF的刺激产生超敏反应,进一步引起炎症反应。TNFRSF1A基因包含TNFRSF1A、Atrophin-1和Death_TNFR1共3个结构域,突变氨基酸位于TNFRSF1A结构域,TNFRSF1A与TNF-α结合,通过死亡结构域激活核因子κB(NF-κB),介导细胞凋亡和激活信号转导途径,控制炎症和免疫反应。
TRAPS通常发生在儿童时期,发病的中位年龄为3岁,但也有成人发病的相关报道。在病人男女比例方面,目前认为没有明显差异;大部分TRAPS病人表现为持续1~3周的反复发热,但也有学者指出成人病人可以没有发热表现。STOJANOV等对来自世界各地的153例TRAPS病人的文献回顾分析表明,与发热相关的最常见症状是腹痛(77%),可导致33%的TRAPS病人进行手术。反复出现皮疹也是该病的另一常见症状,该症状在中国病人中比在日本和欧洲病人中更为多见。另外,大约15%的病人可能发展为继发性肾脏淀粉样变性,这是TRAPS最严重的长期并发症,也是影响病人预后的最主要因素,而在我们检索的文献中发现成人病人更有可能累及肾脏。值得一提的是,在目前的文献记载中,还没有发现亚洲TRAPS病人患有淀粉样变性。TRAPS的确切患病率尚不清楚,估计仅1/100万,目前报告的病例大多数为欧洲血统的病人,亚洲病人少见。2020年我国报道了第1篇也是中国报道病例数量最多的成人TRAPS病例报告,文中对北京协和医院风湿病科诊断的9例成年TRAPS病人的临床和遗传特征进行了评估,发现该病男性与女性的性别比例相差较大(7∶2),这与之前的研究结果(1∶1)不同。该文还指出各地区TRAPS病人之间之所以存在表现差异,可能与TNFRSF1A基因型差异有关。但TRAPS临床表现多样,相同突变的病人其临床症状也具有很大差异,且此研究中的9例病人不包括儿童,因此尚不能明确这些差异是否取决于致病突变、遗传或环境背景,还需要收集病例进一步研究。
TRAPS可通过反复发热病史和一种或多种伴随症状来进行临床诊断,但因其临床表现具有异质性,故必须通过基因检测来进一步证实诊断。虽然某些TRAPS突变携带者在儿童时期未表现出任何症状,但这类病人的家族史通常阳性,往往会在成人期发病。由于此病极为罕见,通常会延误诊断。有研究显示,中国TRAPS病人的诊断延迟比欧洲人长得多(16.5年vs 10.3年)。本文报道的儿童病例在发病第3年通过基因检测才得以明确诊断。这提醒临床医生应加强对该病的再认识,提高诊治水平,以减少误诊发生。
TRAPS治疗的主要目的是控制疾病活动,防治相关并发症,并提高病人的生活质量,目前多采用秋水仙碱、皮质类固醇、生物制剂和非甾体类抗炎药(NSAIDs)等药物进行治疗。虽然NSAIDs对大多数病人能部分缓解症状,但它们往往无法终止疾病进展。当使用剂量為0.5~1.0 mg/kg时,皮质类固醇可以短期控制症状发作,但其疗效可能会随着时间的推移而降低。此外,类固醇激素不能预防淀粉样变性,而且通常在停止治疗后疾病复发,因此不建议长期使用。依那西普是一种TNF-α抑制剂,在多个病例系列中显示出疗效和安全性,可减轻病人症状,减少发作频率和持续时间,还可降低无症状期间急性期反应物的水平,并减少NSAIDs和糖皮质激素的使用。其他TNF-α抑制剂,如英夫利昔单抗和阿达木单抗,已有文献报道它们无效并可能导致疾病反复或恶化。用于治疗TRAPS的另一组药物是抗白细胞介素1(IL-1)类药物,如阿那白滞素(Anakinra)和卡那奴单抗(Canakinumab),这类药物可通过阻断特定免疫递质(如TNF-α、IL-1β)有效抑制疾病活动、预防反应性淀粉样变性和阻止器官损伤的进展。本文报道的病儿应用秋水仙碱获益甚微,改用糖皮质激素治疗有效,但是减量容易反复。在明确诊断后,换用TNF-α拮抗剂益赛普治疗,益赛普是TNF受体-抗体融合蛋白,可以竞争结合TNF。病儿应用该药后体温得以控制,效果好,但是在益赛普减量至每2周1次时再次发热,病情复发,提示益赛普治疗过程中不可减量过快。沙利度胺是一种谷氨酸衍生物,具有抗炎、免疫调节作用,可以阻断TNF-α的表达,抑制NF-κB的表达,而NF-κB是TNF-ɑ和其他细胞因子的必需转录因子。基于以上原理,我国专家建议沙利度胺可应用于其他药物治疗无效的儿童风湿性疾病,如系统性红斑狼疮、幼年特发性关节炎等。本文报道的病儿在应用多种药物治疗后病情反复,尝试加用沙利度胺治疗,未见不良反应,最终取得满意效果。关于沙利度胺治疗TRAPS的用药经验,目前未见报道,故仍需对该例病儿进行长期随访和临床评估。
综上,临床医师如遇到有反复发热、皮疹、肌痛等症状病儿,白细胞、CRP、红细胞沉降率高时要考虑到周期性发热综合征,需及时进行基因检测,早期诊断,指导调整治疗方案,以减轻症状及并发症,提高病儿的生活质量,减轻社会和家庭的经济负担。
[参考文献]
ALMEIDA DE JESUS A, GOLDBACH-MANSKY R. Monogenic autoinflammatory diseases: concept and clinical manifestations. Clinical Immunology (Orlando, Fla), 2013,147(3):155-174.
HOLZINGER D, KESSEL C, OMENETTI A, et al. From bench to bedside and back again: translational research in autoinflammation. Nature Reviews Rheumatology, 2015,11(10):573-585.
UEDA N, IDA H, WASHIO M, et al. Clinical and genetic features of patients with TNFRSF1A variants in Japan: fin-
dings of a nationwide survey. Arthritis & Rheumatology (Hoboken, N J), 2016,68(11):2760-2771.
WILLIAMSON L M, HULL D, MEHTA R, et al. Familial Hibernian fever. QJM: an International Journal of Medicine,1982,51(4):469-480.
QUINTERO J, SABA, GARCIA C. Tumor necrosis factor receptor-1 associated periodic syndrome: case report and review of an auto-inflammatory disorder. Cureus, 2019,11(1):e3916.
TURNER M D, CHAUDHRY A, NEDJAI B. Tumour necrosis factor receptor trafficking dysfunction opens the TRAPS door to pro-inflammatory cytokine secretion. Bioscience Reports, 2012,32(2):105-112.
MCDERMOTT M F, AKSENTIJEVICH I, GALON J, et al. Germline mutations in the extracellular domains of the 55 kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes. Cell,1999,97(1):133-144.
KHABAZI A, MARALANI M, ANDALIB S, et al. A novel TNFRSF1A gene mutation in a patient with tumor necrosis factor receptor-associated periodic syndrome. Hematology/Oncology and Stem Cell Therapy, 2018,11(3):175-177.
孫金峤,王晓川. 肿瘤坏死因子受体相关周期性发热综合征. 中国实用儿科杂志, 2018,33(1):23-25.
YLLDLZ M, HA LAK F, ADROVIC A, et al. Autoinflammatory diseases in childhood. Balkan Medical Journal, 2020,37(5):236-246.
李莎,欧榕琼,张碧红,等. 肿瘤坏死因子受体相关周期性发热综合征一家系分析. 中华儿科杂志, 2019,57(6):477-482.
STOJANOV S, MCDERMOTT M F. The tumour necrosis factor receptor-associated periodic syndrome: current concepts. Expert Reviews in Molecular Medicine, 2005,7(22):1-18.
CHEN Y X, HUANG X Q, ZHENG S J, et al. Recurrent fever and arthralgia as the presentation of tumor necrosis factor receptor-associated periodic syndrome (TRAPS) in a Chinese girl: a case report and review of the literature. Clinical Rheumatology, 2018,37(5):1433-1438.
DELALEU J, DESHAYES S, RODRIGUES F, et al. Tumour necrosis factor receptor-1 associated periodic syndrome (TRAPS)-related AA amyloidosis: a national case series and systematic review. Rheumatology (Oxford, England), 2021,60(12):5775-5784.
ZHAO M Z, LUO Y, WU D, et al. Clinical and genetic features of Chinese adult patients with tumour necrosis factor receptor-associated periodic fever syndrome. Rheumatology, 2020,59(8):1969-1974.
LACHMANN H J. Periodic fever syndromes. Best Practice & Research Clinical Rheumatology, 2017,31(4):596-609.
YAKHMI N, KNUTSEN A P. Tumor necrosis factor receptor-associated periodic syndrome in a pediatric patient. Annals of Allergy, Asthma & Immunology, 2020,125(4):369-371.
TER HAAR N, LACHMANN H, ZEN S, et al. Treatment of autoinflammatory diseases:
Results from the Eurofever Registry and a literature review. Annals of the Rheumatic Diseases, 2013,72(5):678-685.
CUDRICI C, DEUITCH N, AKSENTIJEVICH I. Revisiting TNF receptor-associated periodic syndrome (TRAPS): current perspectives. International Journal of Molecular Sciences, 2020,21(9):3263.
KAYMAKCALAN Z, SAKORAFAS P, BOSE S, et al. Comparisons of affinities, avidities, and complement activation of adalimumab, infliximab, and etanercept in binding to soluble and membrane tumor necrosis factor. Clinical Immunology (Orlando, Fla), 2009,131(2):308-316.
楊思睿,赵冬梅,杜悦,等. 儿童免疫相关性疾病临床实用热点问题专家建议系列之五——沙利度胺在中国儿童免疫相关疾病中的应用建议. 中国实用儿科杂志, 2020,35(6):431-434.
(本文编辑 马伟平)
