干旱胁迫下沙棘NAC基因的时空表达模式
2023-06-26马红荣段勋军乔维范耶芳芳冶贵生马玉花
张 丹,马红荣,段勋军,乔维范,耶芳芳,马 强,冶贵生,马玉花
(1.青海大学 农牧学院,西宁 810016; 2.海东市乐都区下北山林场,青海海东 810699;3.西宁市西山林场,西宁 810016)
干旱胁迫是影响全球作物产量最重要的环境因子。在过去的10 a,全球变暖显著增加干旱发生的频率[1-2]。目前,世界上大约三分之一的国家面临不同程度的水资源短缺,但预计水资源可获得性将进一步下降20%~70%[3],这不仅增加了干旱的频率,同时也提高了植物高效利用水资源的需求,还会引发粮食短缺、木材的有效供给降低、农民种植业经济效益受损等一系列社会问题。因此,研究植物的抗旱机理,提高植物的耐旱性从而节约水资源尤为重要。在长期进化过程中,为了响应干旱胁迫以确保在缺水环境中生存,植物在分子、生化、生理和发育水平上形成一系列复杂的应激反应机制[4-5]。基因表达的转录调控是最重要的调控机制之一,转录因子(Transcription Factors TFs)与特定顺式作用调控元件(Cis-Acting Regulatory Elements CAREs)上的DNA结合,从而决定转录的起始,激活或抑制应激诱导基因的表达[6],是调控基因表达的关键调控因子之一[7]。
NAC(NAM-ATAF-CUC)是最大的植物特异性转录因子家族之一[8]。NAC转录因子广泛存在于植物中,在模式植物水稻和拟南芥中分别鉴定出了151和117个NAC转录因子[9],在沙棘(Hippophaerhamnoides)中鉴定出177个NAC家族基因[10]。研究表明NAC家族基因参与调控植物细胞内各种生理生化过程,包括顶端分生组织、细胞分裂、次生壁的形成、叶片衰老、开花和种子的形成。此外,NAC家族基因在植物响应非生物胁迫过程中也起着至关重要的作用,大多数NAC转录因子被各种非生物胁迫和生物胁迫诱导[11]。研究表明,干旱胁迫下,小麦(Triticumaestivum)叶片和小麦籽粒中23个TaNAC基因中,7个具有叶片特异性表达,5个具有籽粒特异性表达[12];对辽宁碱蓬(Suaedaliaotungensis)的SlNAC1基因进行功能验证,结果显示转基因拟南芥的成活率较高,水分损失率低于野生型和对照组,表明SlNAC1能增强转基因植物的耐旱性[13]。综上可知,NAC转录因子在植物抵抗干旱胁迫中发挥重要作用。在植物响应干旱胁迫的过程中起着重要的调控作用。
中国沙棘(Hippophaerhamnoides)是胡颓子科沙棘属的一种旱生且耐低温的落叶灌木[14],又名沙棘、醋柳、黑刺等。沙棘雌雄异株,是典型的风媒授粉树种。沙棘根系发达,萌蘖能力强,根系能与放线菌形成根瘤共生体,具有很强的固氮能力[15],且中国沙棘抗旱抗寒性强,是理想的改良生态环境的人工林造林树种;此外,沙棘作为一种药食同源植物,含有丰富的营养物质和生物活性成分,在沙棘属植物的叶子和果实等器官中,含有上百种生物活性物质,富含维生素类、胡萝卜素类、黄酮类、甾醇类、氨基酸类、脂肪酸类等多类天然化合物约12类近300种[16]。目前,国内对沙棘营养成分的研究很多,据测定,沙棘原汁的维生素C含量是西红柿的95.4倍,黄瓜的78.8倍,苹果的105.5倍[17]。吴帅[18]以10个中国沙棘种源1 a生幼苗为研究对象,从生长特性、生理生化特征和形态解剖结构等方面研究种源的耐旱性,并采用主成分分析法和隶属函数法对不同种源进行抗旱性综合评价;马玉花等[19]以青海中国沙棘盆栽苗为材料,研究不同程度干旱胁迫处理对叶片生理指标以及保护酶活性的影响;Zhang等[20]对不同浓度CO2处理的两个沙棘品种进行转录分析,在沙棘对CO2浓度升高的反应中发现4 740个差异表达基因,两个沙棘品种的转录因子WRKY、MYB和NAC的表达水平有显著差异;Ye等[10]基于RNA-seq技术,对干旱胁迫下沙棘的转录组进行分析显示,在沙棘中有4 438个转录因子,并且有100个基因在胁迫组和对照组差异表达。本试验选择干旱胁迫下中国沙棘差异表达的8个HrNAC基因,分析其核苷酸序列特征、编码蛋白氨基酸数量及分子质量、等电点等理化性质,预测蛋白的亲水性、亚细胞定位。此外,通过实时荧光定量PCR研究上述8个基因在干旱胁迫下的时空表达模式,从而探究沙棘HrNAC转录因子在响应干旱胁迫中的作用。
1 材料与方法
1.1 试验材料
植物材料采用青海省湟源县野生沙棘(Hippophaerhamnoides)种子,采种后去浆、晾晒、除杂、消毒并播于直径35 cm的塑料花盆中(每盆均匀撒播30粒种子),盆土用育苗基质、蛭石、珍珠岩、壤土混合配制,播种后在花盆上覆膜,以维持土壤温度和湿度,提高沙棘种子的发芽率,待苗木发芽后去掉塑料膜,幼苗长至3~5 cm时间苗,抚育期每4 d浇1次水,15 d施1次hoagland营养液。
1.2 试验方法
1.2.1 NAC转录因子的选择及荧光定量引物的设计与合成 通过干旱胁迫下沙棘转录组测序结果[10],对比干旱胁迫下沙棘中177个NAC转录因子的表达差异性,筛选其中差异表达的8个基因,设计荧光定量引物,基因ID及引物序列见表1。

表1 沙棘NAC家族基因及内参定量引物Table 1 Quantitative primers of seabuckthorn NAC family and reference genes
1.2.2 胁迫处理及样本采集 沙棘幼苗长至 20~30 cm开始进行干旱胁迫处理。选取生长健壮、长势一致的沙棘幼苗,分为对照组(CK)6盆和胁迫组(XP)30盆。对照组正常浇水,胁迫组停止浇水。在第0天(CK)、第4天(XP1)、第10天(XP2)、第19天(XP3)、第27天(XP4)的8:00-10:00分别采集对照组和胁迫组沙棘的根、茎、叶样本,沙棘盆栽苗在干旱胁迫第10天叶片出现轻度萎蔫,干旱胁迫第27天出现重度萎蔫,叶片发黄,叶缘失水变干。持续干旱胁迫直至沙棘苗萎蔫后(干旱胁迫第28天)早晨复水,并在复水后48 h采样(FS);每次采样同一个处理梯度至少采集3盆重复样本,所有样品放置于-80 ℃冰箱中保存,备用。
1.2.3 沙棘NAC家族基因的生物信息学分析 使用DNASTAR软件进行沙棘HrNAC家族转录因子的分子质量、等电点、核苷酸序列和蛋白质亲水性分析;使用在线预测软件(https://psort.hgc.jp/form2.html)预测NAC蛋白的亚细胞定位。

1.2.5 实时荧光定量PCR扩增 以沙棘各个样本的cDNA为模板,β-actin为内参基因进行实时荧光定量PCR扩增,扩增体系均为 20 μL: 上游引物0.6 μL、下游引物0.6 μL、 cDNA 2 μL、RNase-free Water 6.8 μL、SYBR Premix(TAKARA) 10 μL;扩增程序为:95 ℃ 50 s, 60 ℃ 60 s,72 ℃ 30 s,40个循环;72 ℃ 10 min。
1.3 数据分析
HrNAC转录因子的相对荧光定量分析方法为2-ΔΔCt法,采用Excel 2021、SPSS 22对数据进行统计分析。
2 结果与分析
2.1 NAC转录因子的序列分析
利用DNASTAR软件分析8个沙棘HrNAC转录因子的核苷酸和氨基酸序列,图1是HrNAC1的核苷酸序列及对应的氨基酸序列,分析统计结果见表2,8个HrNAC转录因子的核苷酸序列中A+T的含量均大于C+G的含量。长度最长的HrNAC蛋白(HrNAC6编码)361个氨基酸,最短的蛋白(HrNAC3编码)103个氨基酸;其等电点为4.910(HrNAC6编码)~ 9.264(HrNAC1编码);此外,8个NAC转录因子蛋白的亚细胞定位于细胞核、细胞质、线粒体上,HrNAC3转录因子蛋白还定位于内质网中。

图1 HrNAC1的核苷酸和氨基酸序列比对图Fig.1 Comparison of nucleotide and amino acid sequences of HrNAC1

表2 沙棘HrNAC基因的生物学信息Table 2 Related information of sea buckthorn HrNAC gene
2.2 NAC转录因子蛋白亲水性分析
通过DNASTAR软件预测分析沙棘HrNAC蛋白的亲水性,由图2可见,8个HrNAC蛋白都呈现出疏水区域较少,连续分布多个亲水区域的特点,整体属于稳定亲水蛋白,该性质符合胞内蛋白的代谢环境。
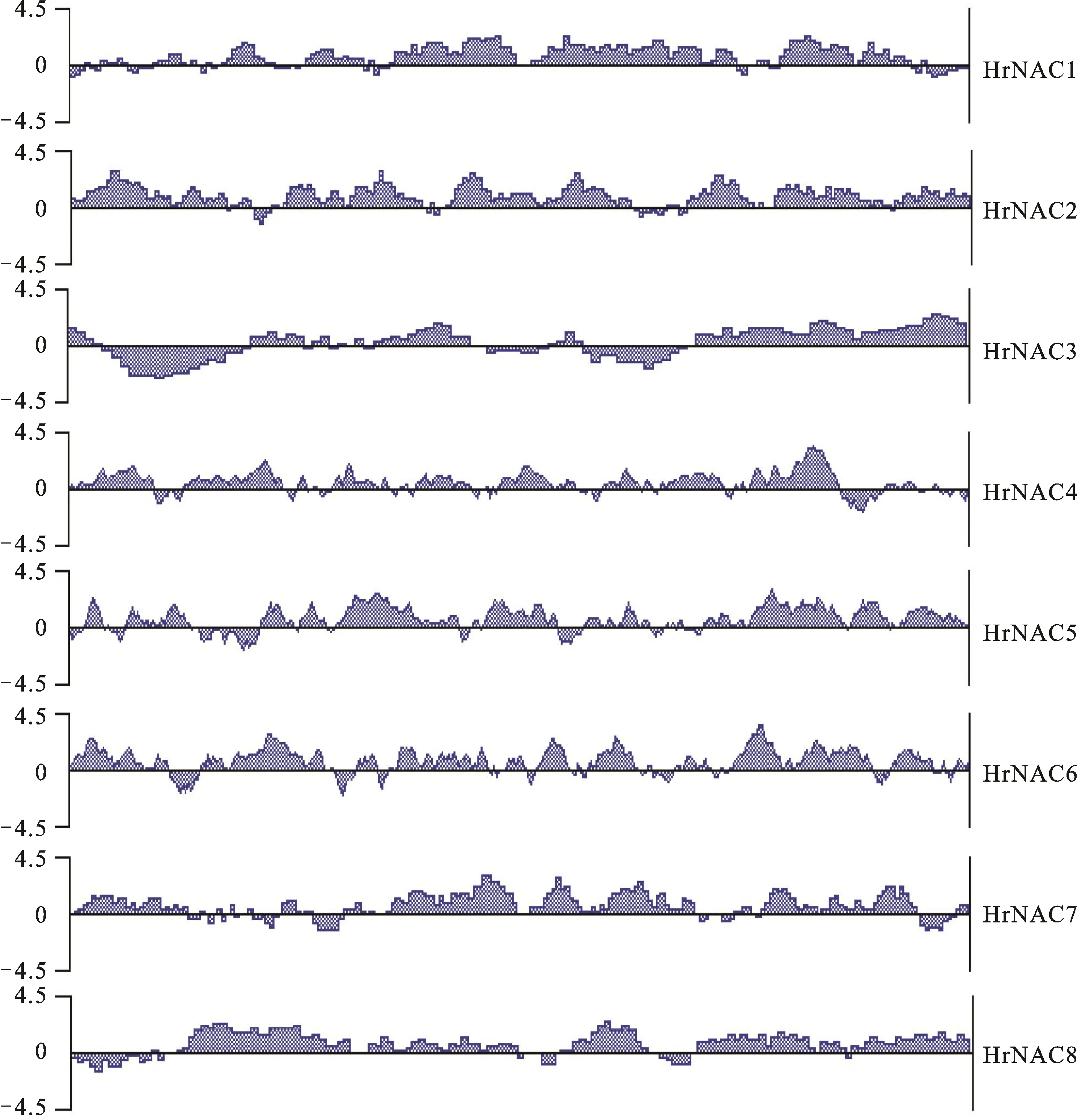
图2 HrNAC家族蛋白亲水性Fig.2 Hydrophilicity of HrNAC family proteins
2.3 沙棘不同组织总RNA浓度
测定结果表明,中国沙棘各组织总RNA的质量浓度均大于100 ng/μL,且OD260/OD280值为1.8~2.2,为了进一步验证中国沙棘各组织总RNA的质量,对提取的总RNA进行琼脂糖凝胶电泳。由图3可见,3个组织的RNA凝胶电泳图中 28 S、18 S、5 S条带清晰,无明显拖尾现象,且28 S与18 S电泳条带的亮度约为2∶1,说明提取的沙棘总RNA完整性良好、无降解,可用于后续荧光定量PCR扩增试验。

M为DL 2000 DNA Marker条带,1~21为部分中国沙棘总RNA电泳图
2.4 干旱胁迫下NAC转录因子的时空表达模式
2.4.1 在根中的表达模式 为了研究干旱胁迫下,沙棘根、茎、叶中的NAC转录因子表达模式,对不同胁迫程度下沙棘根、茎、叶样本进行实时荧光定量PCR扩增,结果见图4。8个HrNAC转录因子中,7个均显示差异表达,HrNAC1在根中未表达。干旱胁迫下,沙棘根中的7个HrNAC转录因子的相对表达量均呈现先升高后降低的趋势,不同的基因在不同的干旱胁迫下达到最大值,其中HrNAC5在胁迫第4天(XP1)时相对表达量达到峰值;HrNAC1、HrNAC2、HrNAC3、HrNAC4、HrNAC7、HrNAC8在胁迫第19天相对表达量最大;HrNAC6在胁迫第27天相对表达量达到最大值,此外,8个HrNAC转录因子复水后的相对表达量均急剧下降。
2.4.2 在茎中的表达模式 在沙棘茎中,8个HrNAC转录因子均差异表达。干旱胁迫下,沙棘茎中的8个HrNAC转录因子中,6个HrNAC转录因子(HrNAC2、HrNAC3、HrNAC4、HrNAC6、HrNAC7、HrNAC8)的相对表达量呈现先升高后降低的趋势,HrNAC5的表达下调;HrNAC1、HrNAC2、HrNAC3、HrNAC4、HrNAC6、HrNAC8在胁迫第19天(XP3)时相对表达量达到峰值;HrNAC7在胁迫第27天(XP4)达到峰值;此外,8个HrNAC转录因子复水后的相对表达量均急剧下降。
2.4.3 在叶中的表达模式 在沙棘叶中,8个HrNAC转录因子均差异表达。干旱胁迫下,大部分HrNAC家族转录因子呈现出先上升后下降的趋势,在胁迫初期(XP1),HrNAC1、HrNAC5的相对表达量出现小幅下降趋势,但随着干旱胁迫的进一步加深,其表达量逐渐上升且高于CK。HrNAC7和HrNAC8的变化极为相似,均表现出缓慢上升-大幅上升(XP4)-快速下降(FS)的趋势,可能存在两个转录因子互作调控。HrNAC2在XP3达到峰值,其余7个转录因子均在重度干旱胁迫(胁迫第27天)达到最大值,且8个转录因子复水后相对表达量均快速降低。
3 讨 论
沙棘是西北地区重要的造林树种,生长适应性极强,尤其在高海拔等生境恶劣地区。本研究以沙棘实生苗为材料进行结构预测,结果表明:沙棘HrNAC家族转录因子大部分位于细胞核、细胞质、线粒体上,转录的主要场所在细胞核,这与NAC转录因子控制胁迫应答相关基因表达的功能一致,同时表明沙棘HrNAC转录因子可能控制某些蛋白质的加工和修饰。8个HrNAC转录因子均属于稳定的亲水性蛋白,这与荞麦、苹果和冰草中NAC转录因子的亲水性结果一致[21]。
NAC转录因子是植物异性转录调控因子的最大家族之一[22],首次报道的NAC基因(NAM)与牵牛花(Pharbitisnil)顶端分生组织和原基的形成有关[23]。有研究[24]发现干旱胁迫下大豆中有22种NAC转录因子受干旱胁迫诱导差异表达;番茄的NAC转录因子JUB1(SlJUB1)在干旱等多种非生物胁迫下表达增强,基因沉默抑制SlJUB1的表达显著降低了耐旱性,并且各种抗旱相关基因表达减少[25];拟南芥中的基因表达分析表明,SlNAC8由干旱胁迫诱导表达,过表达SlNAC8的拟南芥对干旱耐受性增强[26];干旱胁迫下,刚毛柽柳过表达ThNAC24基因会导致POD(过氧化物酶)和SOD(超氧化物歧化酶)的活性增强,减缓细胞损伤或死亡,提高刚毛柽柳的抗旱能力[27]。由此可见NAC转录因子受干旱胁迫诱导表达,且与植物抗旱性密切相关。NAC转录因子受上游转录因子,如DREBs(脱水反应元件结合蛋白质)、ABREs(ABA反应元件结合蛋白)的调控,DRE/CAT是ABA独立通道信号传导的顺式作用元件,ABRE是依赖ABA信号传导的顺式作用元件[28]。由此可见,NAC转录因子即参与ABA独立通道的胁迫响应调控,也参与ABA依赖通道的胁迫响应过程。在ABA依赖途径中,NAC受ABA累积的刺激,干旱胁迫会造成ABA的累积,激活下游相关的胁迫应答基因;在ABA独立通道中,NAC接收干旱胁迫信号刺激后可直接激活干旱胁迫应答基因启动子,从而激活胁迫应答基因的表达[11]。
沙棘作为中国西北地区的一种先锋树种,具有抗旱、耐寒等优良的遗传特性,是干旱区、山地等自然环境恶劣区域较为理想的人工造林树种[29],具有很大的生态效益和经济价值,在基因资源开发上有极大的潜力。本研究在转录组测序基础上筛选出8个显著差异表达的沙棘HrNAC转录因子进行干旱胁迫下的表达模式研究,结果显示其中7个具有根特异性表达,8个具有茎和叶片特异性表达。在干旱胁迫过程中,沙棘的叶片最为敏感,干旱胁迫对叶片的正常生长影响最大,胁迫下叶片通过减少蒸腾失水和增强吸水来维持组织的正常生命活动,因此,在本研究中,重度干旱胁迫时(XP4),沙棘HrNAC转录因子的相对表达量大幅上升,从而可能激活下游的干旱胁迫应答基因,以增强植物在干旱胁迫下的成活率。植物遭遇干旱胁迫时主要通过增强根部吸水来维持细胞内外水势平衡,当处于轻度胁迫时,沙棘根部HrNAC基因的表达量显著上升,可能激活根部胁迫应答基因的表达,提高根毛吸水能力,当处于重度缺水时,土壤中的自由水含量极低,沙棘根系吸水很困难,即将永久萎焉时,HrNAC的表达逐渐下降,可能是沙棘根部的HrNAC累积导致的负反馈调节[30]。在茎中,HrNAC的相对表达量较少,植物茎中的维管系统将根系吸收的水分和养分输送到叶片来维持沙棘的水分平衡,HrNAC的表达会激活传输过程中维持细胞水分和渗透平衡相关基因(如AQP、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等)的表达,以保持叶片中水分和养分的有效供给。复水后,3个组织的NAC基因相对表达量都迅速下降,这是由于复水后沙棘根系快速吸水,恢复胞内水势平衡,反馈抑制NAC基因的表达。在前期的研究中也发现干旱胁迫下沙棘的叶片相对含水量、叶绿素含量以及脯氨酸、可溶性糖、可溶性蛋白等呈现一定的变化规律,同时P5CS和ProDH基因的表达模式也很好地解释了脯氨酸含量为何会呈现先增加后减少的趋势[31];此外,干旱胁迫也诱导AQP基因表达量的上调[32],但是这些生理指标的变化与NAC转录因子之间存在着什么样的关系以及其下游的调控基因还需要进一步探索验证。综上可知,NAC转录因子是沙棘抗旱的重要调控基因。
植物NAC转录因子通过结合响应干旱胁迫的关键转录因子的顺式作用元件、增加植物保护酶等方面增强植物的抗旱性,在后期的试验中,通过这些抗旱相关基因(如:BADH、AQP、CMO、SOD、POD等)的表达来进一步探究NAC转录因子调控干旱胁迫响应的复杂网络机制,同时也可以通过酵母杂交技术,筛选NAC转录因子上下游的基因,以及特异识别序列,来验证沙棘中的HrNAC转录因子参与植物抗旱的调控网络。
4 结 论
本研究通过软件预测表明沙棘HrNAC家族转录因子大部分位于细胞核、细胞质、线粒体上;8个HrNAC转录因子均属于稳定的亲水性蛋白;荧光定量PCR分析结果表明,干旱胁迫诱导沙棘HrNAC转录因子的差异表达,且呈现出组织特异性,此外,随着干旱胁迫程度的加深,大部分沙棘HrNAC基因的相对表达量都逐渐升高,复水后急剧下降,说明干旱胁迫下HrNAC转录因子通过表达量的升高激活抗旱相关基因的表达,从而提高沙棘的抗旱性。
