盐碱胁迫下花生生长及生理特性的研究
2023-06-26李锁丞王海江董红业柳延涛
徐 婷,李锁丞,王海江,董红业,李 强,柳延涛
(1.石河子大学 农学院,新疆石河子 832000;2.新疆农垦科学院 作物研究所,新疆石河子 832000;3.新疆农业科学院 经济作物所,乌鲁木齐 830091)
土壤盐渍化已成为当今世界面临的重要环境问题[1]。中国可利用盐碱地面积为6.7×106hm2,是盐碱地大国之一[2]。新疆盐渍土分布面积广,占全国盐渍土总面积的1/3,其中盐渍化耕地面积占灌区耕地总面积的32.07%[2-3],严重影响了作物的生长发育,已成为降低作物产量和品种,制约农业发展的主要生态因素之一[4-5]。2019年新疆花生种植面积超过6 666.67 hm2,单位面积产量达4 071.59 kg·hm-2,可作为出口物资。随着经济发展,人民生活水平日益提高,花生的需求量不断增加,由于可利用耕地面积不增加,油料作物与粮棉作物必然会出现争地矛盾,为避免矛盾发生,种植盐碱地花生是提高盐碱地利用率、促进花生产业可持续发展和解决当今食用油问题的有效途径[6]。
植物在盐碱胁迫下生长发育受到抑制[7]。前人对盐碱胁迫下植物的生理特性做了相应研究,发现随着胁迫浓度的增加,花生、棉花、油菜、小麦、玉米等作物生长发育缓慢,茎叶干质量和鲜质量显著降低,根长减小[8-13]。盐碱胁迫下植物细胞内积聚了大量的活性氧,体内清除活性氧系统受损,膜结构被破坏,为抵御活性氧损伤,植株通过一系列的反应机制来减轻盐碱胁迫带来的危害[14]。研究表明小麦幼苗、野生杏树随盐胁迫浓度增加体内活性氧清除系统被激活[15-16],SOD和POD活性提高,‘花育25号’和‘花育20号’SOD及CAT 活性下降[6],且高浓度盐胁迫下高耐盐型和耐盐性品种根系SOD和POD活性较高[17]。藜麦、棉花、小麦、湖南稷子和石竹的MDA和脯氨酸含量逐渐增加[4,14-15,18-19]。花生的盐碱胁迫响应机制与其他作物存在差异,虽然前人对花生耐盐性的研究做了大量研究,但主要集中在萌发期单盐胁迫下发芽特性的差异和苗期单盐胁迫下花生生理特性及产量的变化,对于苗期花生对不同盐碱类型及胁迫浓度的生理响应和不同耐盐性花生品种间生理响应差异的相关研究较少。本试验以前期筛选的耐盐碱品种‘益花1号’和‘花育25号’,盐碱敏感品种‘花育39号’‘豫花37号’和‘汾花1号’为试验材料,通过对比3种盐碱类型5种胁迫浓度下花生生长指标和生理指标的差异,分析花生幼苗对盐碱胁迫的生理响应,为阐释花生耐盐碱机理,选育耐盐碱花生品种提供参考依据。
1 材料与方法
1.1 试验材料
材料如表1所示。

表1 供试品种及供应单位Table 1 Tested varieties and suppliers
1.2 试验方法
试验设置NaCl、NaHCO3和NaCl+NaHCO3(1∶1)3种盐碱类型,4种胁迫浓度,分别为0.30%、0.60%、0.90%和1.20%(质量分数),对照0%(CK)为蒸馏水,每个处理设置3组重复。各品种选取25粒大小均一,健康饱满的种子,10% H2O2处理10 min,蒸馏水冲洗2~3次,吸干水分,备用。发芽盒高温灭菌后放置等量清洁、灭菌的锯末,根据发芽床特性分别加入等量对应的胁迫溶液,使其达到饱和含水量的60%~80%。将种子均匀放置于湿润的锯末中,粒与粒间距一致,盖上发芽盒盖子,置于昼夜温度分别为30 ℃和25 ℃,周期分别为12 h和12 h的光照恒温培养箱中培养致苗期,培养期间定时补充蒸馏水。苗期各处理分别采样6株,3次重复,将样品带回试验室清洗并吸干表面残余水分,取3株测定主根长、地上部与地下部鲜质量和干质量,3株取根尖部位低温研磨后进行生理指标的测定。
1.3 测定项目
主根长采用直尺测量;地上部鲜质量、地上部干质量、地下部鲜质量、地下部干质量采用千分之一天平称量;过氧化物酶活性、超氧化物歧化酶活性、过氧化氢酶活性、丙二醛、脯氨酸含量的测定依次采用愈创木酚比色法[20]、氮蓝四唑(NBT) 光还原法[20]、紫外吸收法[20]、硫代巴比妥酸法[20]、磺基水杨酸法[21]。
1.4 数据分析
使用 EXCEL 2010和SPSS 19.0 进行数据处理和方差分析,多重比较采用 Duncan’s法,显著水平为 0.05。利用Origin 2018制图,所有试验指标的测定至少为3次重复。
2 结果与分析
2.1 不同盐碱胁迫对花生主根长的影响
由图1可以看出,花生主根长随着3种盐碱类型胁迫浓度的增加呈下降趋势。在NaCl胁迫0.30%、0.90%和1.20%浓度下‘益花1号’的主根长均较‘花育25号’‘花育39号’‘豫花37号’和‘汾花1号’高,分别为15.00 、7.83和4.69 cm,其中1.20%浓度下‘花育39号’主根长为0,0.30%浓度下‘豫花37号’和‘汾花1号’主根长差异不显著,其余品种间差异显著,0.6%浓度时‘益花1号’‘花育25号’和‘豫花37号’分别与‘花育39号’和‘汾花1号’差异显著,0.90%浓度‘益花1号’‘花育25号’和‘汾花1号’分别与‘花育39号’和‘豫花37号’主根长差异显著。NaHCO3胁迫随着盐碱浓度增加,各品种主根长显著降低,0.60%浓度和0.90%浓度下‘益花1号’主根长略高于其余品种,分别为1.93 cm和0.77 cm,当胁迫浓度达到1.20%时各品种主根长均为0, 0.30%浓度‘益花1号’‘花育25号’和‘豫花37号’分别与‘花育39号’和‘汾花1号’差异显著, 0.90%浓度‘花育39号’和‘汾花1号’分别与其余品种间差异显著。NaCl+NaHCO3胁迫时各品种主根长急剧下降,当胁迫浓度达到 0.90%时,各品种主根长为0、0.30%和0.60%浓度下‘益花1号’主根长最高分别为6.43 cm和 3.00 cm,其主根长与其余品种差异显著。说明过高的盐碱浓度抑制种子根系生长,甚至导致种子不发芽生根,NaCl+NaHCO3胁迫对根系生长的抑制作用更强。

YH1.益花1号;HY25.花育25号;HY39.花育39号;Y37.豫花37号;N1.汾花1号。不同字母代表0.05水平下差异显著,下同YH1.Yihua 1;HY25.Huayu 25;HY39.Huayu 39;Y37.Yuhua 37;N1.Fenhua 1.Different letters indicate significant differences at the 0.05 level,the same below图1 NaCl、NaHCO3和NaCl+NaHCO3(1∶1)不同浓度胁迫下花生主根长Fig.1 Peanut taproot length under different concentrations of NaCl, NaHCO3 and NaCl + NaHCO3 (1∶1)
2.2 不同盐碱胁迫对花生苗期地上部鲜质量及干质量的影响
如图2所示,各盐碱类型胁迫下花生地上部鲜质量和干质量随盐碱浓度增加呈缓慢降低趋势。随着NaCl胁迫浓度增大,1.20%较0.60%浓度‘益花1号’‘花育25号’‘豫花37号’和‘汾花1号’苗期地上部鲜质量分别降低89.22%、71.65%、83.80%和95.94%,较0.90%浓度分别降低85.03%、32.91%、45.84%和50.42%,且0.30%浓度各品种间鲜质量差异显著,0.90%浓度‘花育25号’和‘豫花37号’分别与其余品种差异显著;对于地上部干质量而言,1.20%较 0.30%浓度‘益花1号’‘花育25号’‘豫花37号’和‘汾花1号’苗期地上部干质量分别降低 37.07%、 47.52%、27.99%和91.73%,较 0.60%浓度分别降低7.76%、19.63%、 27.33%和70.48%,较 0.90%浓度分别降低6.22%、 16.26%、5.26%和50.69%,0.30%浓度‘花育39号’‘豫花37号’和‘汾花1号’分别与‘益花1号’和‘花育25号’差异显著,0.90%浓度‘益花1号’和‘花育25号’分别与‘花育39号’‘豫花37号’和‘汾花1号’差异显著,0.60%和1.20%浓度各品种间干质量差异显著。NaHCO3胁迫各浓度下苗期地上部鲜质量呈小幅下降趋势,0.90%浓度各品种地上部鲜质量分别为 2.69、2.58、1.18、 2.39和1.91 g,‘花育25号’和‘豫花37号’分别与其余品种差异显著,1.20%浓度各品种地上部鲜质量已均为0,0.30%浓度‘花育25号’‘豫花37号’和‘汾花1号’分别与‘益花1号’和‘花育39号’差异显著,0.60%浓度‘益花1号’和‘花育25号’分别与其余品种差异显著;地上部干质量而言,0.90%浓度较0.60%浓度下各品种地上部干质量降低1.48%、30.24%、67.02%、 4.77%和73.67%,‘花育39号’和‘汾花1号’分别与其余品种差异显著。NaCl+NaHCO3胁迫0.60%浓度各品种地上部鲜质量分别为2.58、1.37、1.19、1.35和1.29 g,0.90%和 1.20%浓度下各品种地上部鲜质量均为0,‘益花1号’与其余品种差异显著;对于地上部干质量, 0.60%浓度各品种地上部干质量分别降低 0.73、0.68、0.28、0.48和0.44 g,并且‘花育39号’分别与其余品种差异显著,0.30%浓度时‘益花1号’和‘花育25号’分别与其余品种差异显著。说明花生幼苗受盐碱胁迫抑制,生长发育缓慢,地上部鲜质量及干质量显著降低。
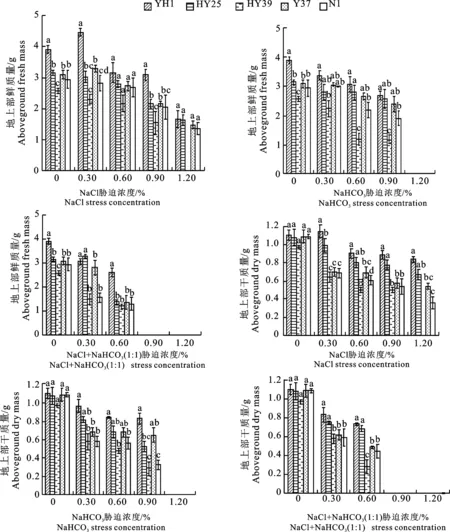
图2 NaCl、NaHCO3和NaCl+NaHCO3(1∶1)不同浓度胁迫下花生苗期地上部鲜质量及干质量Fig.2 Aboveground fresh mass and dry mass of peanut seedlings under different concentrations of NaCl,NaHCO3 and NaCl + NaHCO3(1∶1)
2.3 不同盐碱胁迫对花生地下部鲜质量和干质量的影响
由图3可知,随着胁迫浓度的增加,各品种地下部鲜质量及干质量均呈下降趋势,NaCl胁迫‘益花1号’‘花育25号’‘花育39号’‘豫花37号’和‘汾花1号’在5种胁迫浓度下地下部鲜质量分别为 0.83~1.31 g、0.53~0.99 g、0.31~ 0.57 g、 0.13~ 0.42 g和0.11~0.30 g,0.30%浓度下‘豫花37号’降幅最大为60.25%,‘花育25’号降幅最小为20.12%,0.60%和0.90%浓度时‘花育39号’降幅最大,1.20%时‘花育39号’地下部鲜质量为0,各品种在0.30%浓度时差异达到显著水平,0.60%浓度时‘益花1号’‘豫花37号’和‘汾花1号’分别与‘花育25号’和‘花育39号’差异显著,0.90%浓度‘花育25号’‘豫花37号’和‘汾花1号’分别与‘益花1号’和‘花育39号’差异显著,1.20%浓度‘益花1号’与其余品种差异达到显著水平;不同浓度下各品种地下部干质量分别为0.08~0.19 g、0.06~0.11 g、 0.03~0.07 g和0.02~0.03 g,0.30%浓度‘花育39号’降幅最大,‘花育25号’降幅最小, 0.60%浓度‘豫花37号’与其余品种差异显著, 0.90%浓度‘益花1号’‘豫花37号’和‘汾花1号’分别与‘花育25号’和‘花育39号’差异显著。NaHCO3胁迫不同浓度下各品种的地下部鲜质量分别为0.83~1.31 g、0.20~0.58 g、0.09~ 0.30 g和 0.07~ 0.19 g,0.30%浓度‘花育25号’降幅最小为74.29%,其中‘益花1号’和‘花育25号’分别与其余品种差异显著,0.60%浓度‘花育39号’分别与其余品种差异显著,0.90%浓度‘益花1号’‘花育39号’分别与其余品种差异显著;对于地下部干质量而言,在0.30%、0.60%和 0.90%浓度下各品种的地下部干质量为 0.05~0.09 g、0.02~0.05 g和0.02~0.04 g, 0.60%浓度‘益花1号’和‘花育25号’分别与其余品种差异显著。NaCl+NaHCO3胁迫0.90%和 1.20%浓度地下部鲜质量和地下部干质量平均为0,各品种在0.30%和0.60%浓度下的地下部鲜质量分别为0.23~0.47 g和0.07~0.42 g,且 0.60%浓度下‘花育39号’分别与其余品种差异显著。说明盐碱胁迫不仅抑制花生苗期地上部生长,随着胁迫浓度增大还对植株根系的生长产生明显的抑制作用,地下部鲜质量和干质量显著降低,且NaCl+NaHCO3胁迫对花生苗期地下部鲜质量和干质量影响最大。

图3 NaCl、NaHCO3和NaCl+NaHCO3 (1∶1)不同浓度胁迫下花生苗期地下部鲜质量及干质量Fig.3 Underground fresh and dry mass of peanut seedlings under different concentrations of NaCl,NaHCO3 and NaCl + NaHCO3 (1∶1)
2.4 不同盐碱胁迫对花生过氧化物酶(POD)和超氧化物歧化酶(SOD)活性的影响
如图4所示,随着NaCl胁迫浓度升高,花生根尖POD活性呈现先升高后降低的趋势,当胁迫浓度达到0.60%时,‘花育25号’‘花育39号’‘豫花37号’和‘汾花1号’POD活性达到峰值,分别为421.68 U·g-1、340.80 U·g-1、421.98 U·g-1和396.00 U·g-1,与对照相比活性分别提高了30.62%、33.65%、 32.89%和48.92%,1.20%时‘花育39号’POD活性为0,当胁迫浓度小于0.60%时POD活性由强到弱依次为‘益花1号’‘花育25号’‘豫花37号’‘汾花1号’和‘花育39号’,而0.90%浓度时POD活性由强到弱依次为‘益花1号’‘花育25号’‘汾花1号’‘豫花37号’‘花育39号’。NaHCO3胁迫当浓度达到 0.30%时‘花育39号’‘豫花37号’和‘汾花1号’POD活性达到峰值,分别为342.03 U·g-1、427.19 U·g-1和421.49 U·g-1,较对照各品种POD活性提高了34.13%、34.53%和 58.51%,0.60%时‘益花1号’和‘花育25号’POD活性先达到峰值后降低,与0%(CK)相较两个品种POD活性提高了46.78%和49.49%,不同浓度胁迫下POD活性由强到弱依次为‘益花1号’‘花育25号’‘豫花37号’‘汾花1号’‘花育39号’。NaCl+NaHCO3胁迫随着胁迫浓度增加‘花育25号’‘豫花37号’和‘汾花1号’POD活性呈先升高后降低的趋势,0.30%时POD活性达到峰值,与0%(CK)相较3个品种POD活性依次提高了33.87%、15.85%和11.66%,POD活性由强到弱依次为‘花育25号’‘豫花37号’‘汾花1号’,而‘益花1号’POD活性则随着胁迫浓度增加不断提高,0.90%时最高为530.82 U·g-1,较CK处理提高了57.14%,‘花育39号’随胁迫浓度增加POD活性不断降低。

图4 NaCl、NaHCO3和NaCl+NaHCO3 (1∶1)不同浓度胁迫下花生根尖POD活性和SOD活性Fig.4 POD activity and SOD activity in peanut root tips under different concentrations of NaCl,NaHCO3 and NaCl + NaHCO3 (1∶1)
随着NaCl胁迫浓度增加‘益花1号’‘花育39号’和‘汾花1号’SOD活性呈先升高后降低的趋势,0.60%浓度时活性显著增加并达到峰值,分别为93.41 U·g-1、77.08 U·g-1和84.10 U·g-1,与0%(CK)相较提高了3.58%、5.75%和12.19%,‘花育25号’和‘豫花37号’SOD活性随着胁迫浓度增加呈下降趋势,1.20%浓度SOD活性最低分别为83.29 U·g-1和76.97 U·g-1,花育39号SOD活性为0,各品种SOD活性由强到弱依次为‘益花1号’‘花育25号’‘豫花37号’‘汾花1号’‘花育39号’。NaHCO3胁迫随着胁迫浓度增加各品种SOD活性均呈先增加后降低的趋势,0.60%浓度时各品种SOD活性达到峰值,较0%(CK)分别提高了4.48%、 4.14%、8.29%、5.39%和14.99%,当胁迫浓度达到 0.90%时SOD活性强弱与NaCl胁迫一致。随着NaCl+NaHCO3胁迫浓度增加‘花育25号’‘花育39号’和‘豫花37号’SOD活性呈下降趋势,‘益花1号’和‘汾花1号’SOD活性呈先增加后降低的趋势,各品种在0.60%浓度时SOD活性强弱与NaCl和NaHCO3胁迫一致。
2.5 不同盐碱胁迫对花生过氧化氢酶(CAT)活性的影响
如图5所示,当NaCl胁迫浓度不断增加各品种CAT活性呈下降趋势,1.20%浓度时各品种CAT活性最低,其中‘花育39号’CAT活性为0,与0%(CK)相比各品种CAT活性依次降低了50.65%、68.82%、88.58%和79.28%,活性由强到弱依次为‘益花1号’‘花育25号’‘豫花37号’‘汾花1号’‘花育39号’。NaHCO3胁迫浓度增加CAT活性先小幅升高再降低,1.20%浓度各品种CAT活性均为0,与0%(CK)相比,0.90%浓度下各品种CAT活性分别降低了18.42%、 4.09%、29.37%、26.11%和53.72%。NaCl+NaHCO3胁迫不同浓度下CAT活性变化趋势与NaCl胁迫一致,与0%(CK)相较0.60%浓度下CAT活性分别降低了26.17%、29.35%、 36.27%、39.06%和83.25%,活性由强到弱排序与NaCl胁迫和NaHCO3胁迫一致。

图5 NaCl、NaHCO3和NaCl+NaHCO3 (1∶1)不同浓度胁迫下花生根尖CAT酶活性Fig.5 CAT enzyme activity in peanut root tips under different concentrations of NaCl,NaHCO3 and NaCl + NaHCO3 (1∶1)
2.6 不同盐碱胁迫对花生脯氨酸(Pro)含量的 影响
由图6可知,随着盐碱胁迫浓度增加各品种脯氨酸含量呈上升趋势。NaCl胁迫1.20%浓度‘花育39号’脯氨酸含量为0,‘益花1号’‘花育25号’‘豫花37号’和‘汾花1号’脯氨酸含量较0%(CK)分别增加了3.56、2.68、3.80和3.49倍,不同胁迫浓度下‘益花1号’脯氨酸含量高于其余品种,与其余品种差异显著,‘花育39号’脯氨酸含量最低。NaHCO3胁迫0.90%浓度下各品种脯氨酸含量较0%(CK)分别增加了4.20、 4.13、5.05、4.85和5.16倍,‘益花1号’脯氨酸含量最高为 404.17 μg·g-1,‘花育39号’脯氨酸含量最低为271.26 μg·g-1,当浓度达到 1.20%时各品种脯氨酸含量为0,0.30%和 0.60%浓度下各品种间差异显著。随着NaCl+NaHCO3胁迫浓度增加,0.60%浓度较0%(CK)各品种脯氨酸含量分别增加4.41、4.31、6.23、 5.14和5.49倍,‘益花1号’脯氨酸含量达到最高为425 μg·g-1。

图6 NaCl、NaHCO3和NaCl+NaHCO3 (1∶1)不同浓度胁迫下花生根尖脯氨酸含量Fig.6 Pro content in peanut root tips under different concentrations of NaCl, NaHCO3 and NaCl + NaHCO3 (1∶1)
2.7 不同盐碱胁迫对花生丙二醛(MDA)含量的影响
由图7可知,随着NaCl胁迫浓度增加各品种MDA含量呈上升趋势,当浓度为1.20%时‘花育39号’MDA含量为0,‘益花1号’‘花育25号’‘豫花37号’和‘汾花1号’MDA含量较0%(CK)增加3.88、3.85、3.82和3.79倍,此时‘汾花1号’MDA含量较其余品种最高为62.32 mmol·g-1,‘益花1号’MDA含量最低为55.88 mmol·g-1,0.60%和0.90%浓度下各品种间差异显著。NaHCO3胁迫下各品种MDA含量变化趋势与NaCl胁迫一致,且随着胁迫浓度增大各品种MDA含量增幅较NaCl胁迫大,0.90%浓度与0%(CK)相较MDA含量分别增加了4.14、4.09、4.18、4.12和4.04倍,其中‘花育39号’MDA含量较高为68.60 mmol·g-1,‘益花1号’MDA含量较低为59.64 mmol·g-1,0.60%和0.90%浓度下各品种间差异显著。随着 NaCl+NaHCO3胁迫浓度增加, 0.60%浓度较0%(CK)各品种MDA含量分别增加3.90、3.77、 3.71、3.68和3.60倍,‘花育39号’MDA含量较其余品种高为60.81 mmol·g-1,‘益花1号’MDA含量较其余品种低为56.21 mmol·g-1,各品种间差异显著。

图7 NaCl、NaHCO3和NaCl+NaHCO3 (1∶1)不同浓度胁迫下花生根尖MDA含量Fig.7 MDA content in peanut root tips under different concentrations of NaCl,NaHCO3 and NaCl + NaHCO3 (1∶1)
2.8 各指标主成分分析
为分析不同盐碱类型及胁迫浓度对花生生长指标(主根长、地上部鲜质量及干质量、地下部鲜质量及干质量)和生理指标(抗氧化酶活性、渗透调节物质)的影响,对各指标进行主成分分析(图8)。‘益花1号’RL、UFW、UDW和AFW与A1、A2、B1、C1和A3处理呈正相关关系,ADW、CAT、POD、SOD、MDA和Pro与A4、B2、C2、B3和C3呈正相关关系,各处理下RL与A2和C1的影响最大,Pro、MDA与B3和C3的影响最大。‘花育25号’ADW与A3、A2、A1、B1、C1处理呈正相关关系,ADW与A3的影响最大。‘花育39号’Pro和MDA与B3和C2的影响最大。‘豫花37号’和‘汾花1号’相似,AFW、POD、CAT、SOD、MDA和Pro与B2、B3和C2呈正相关关系,MDA和Pro与B3的影响最大。
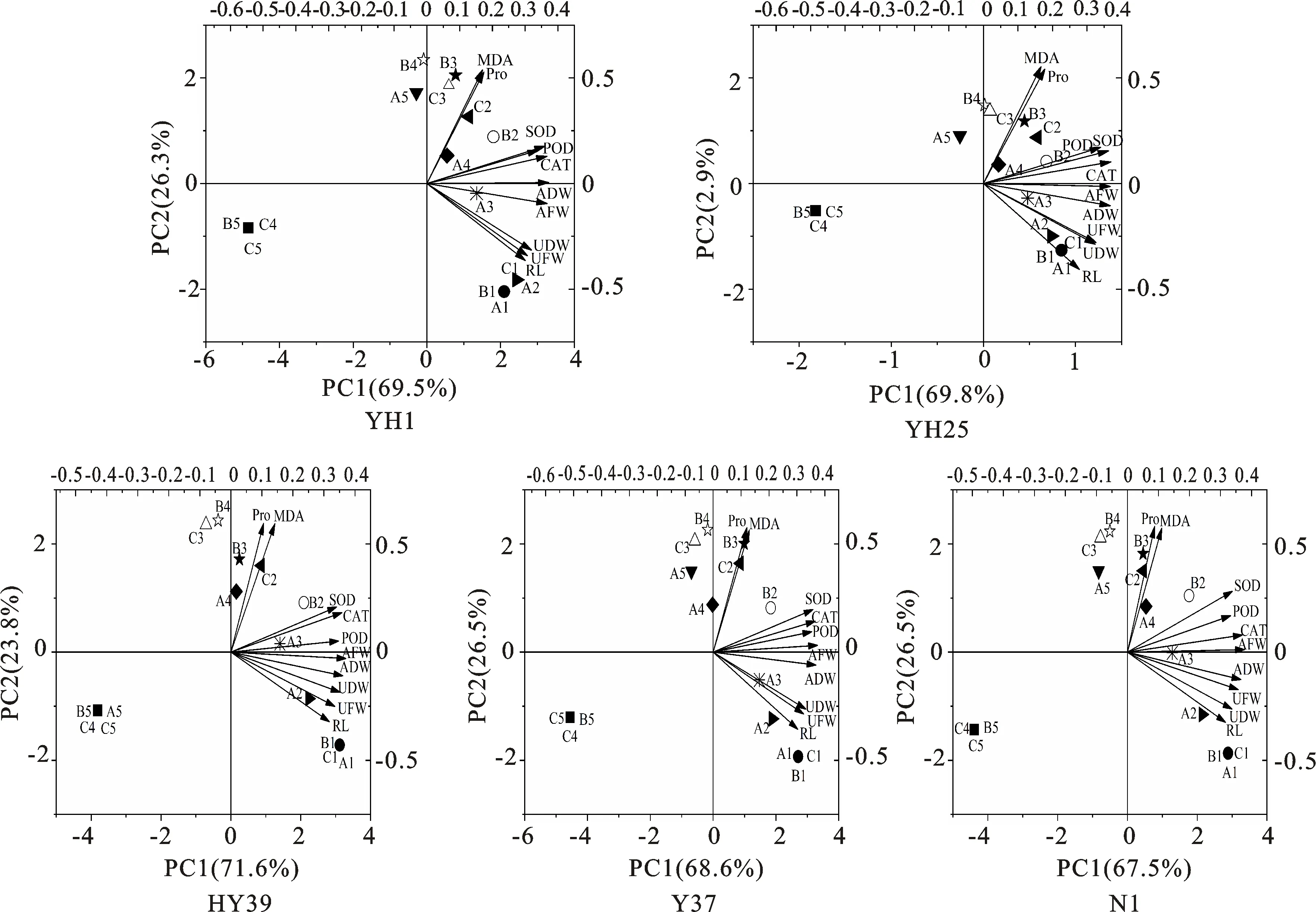
A代表NaCl;B代表NaHCO3;C代表NaCl+NaHCO3 (1∶1);1代表0%;2代表0.3%;3代表0.6%;4代表0.9%;5代表1.2%;ADW代表地上部干质量;AFW代表地上部鲜质量;UDW代表地下部干质量;UFW代表地下部鲜质量;RL代表主根长A stands for NaCl; B stands for NaHCO3; C stands for NaCl + NaHCO3 (1∶1); 1 stands for 0%; 2 stands for 0.3%; 3 stands for 0.6%; 4 stands for 0.9%; 5 stands for 1.2%; ADW stands for aboveground dry mass;AFW stands for aboveground fresh mass;UDW stands for the dry mass of underground; UFW stands for underground fresh mass;RL stands for taproot length图8 不同处理与各指标之间的关系Fig.8 Relationship between different treatments and indicators
3 讨 论
盐碱胁迫是植物生长过程中最常见的胁迫形式之一,受胁迫影响根系生长受到阻碍[8]。研究表明,混合盐碱胁迫下,油菜[7]和芸芥[22]生长被抑制,根长和干鲜质量降低,明显抑制了地上部生长。本研究表明3种盐碱类型不同浓度胁迫下花生根长显著降低,NaCl胁迫0.90%浓度和 NaCl+NaHCO3胁迫0.90%和1.20%浓度花生主根长为0,且NaCl+NaHCO3胁迫下各品种主根长长度较其他盐碱类型减小与前人研究结果一致,说明一定浓度的盐碱胁迫能够严重抑制花生根系的生长。不同胁迫处理下‘益花1号’的主根长最长,‘花育39号’的主根长普遍最短,说明同一作物具有耐盐性遗传多样性[23],由于盐碱胁迫对盐敏感品种根系生长的抑制作用最强,因而根长较短。本研究表明,盐碱胁迫能显著抑制花生幼苗的生长。随着胁迫浓度增加,不同品种地上部和地下部鲜质量及干质量均下降,且NaHCO3和NaCl+NaHCO31.20%胁迫浓度下,种子不萌发出苗,与王树风等[24]研究结果基本一致,说明盐碱浓度的增加,导致根系过度吸收盐离子,植株被抑制生长,生物量减少,从而降低了鲜质量和干质量。本研究中不同盐碱类型胁迫浓度下,‘益花1号’地上部和地下部鲜质量及干质量均高于其余品种,‘花育39号’最低,说明盐碱胁迫对盐碱敏感品种‘花育39号’‘豫花37号’和‘汾花1号’地上部生长的抑制作用显著大于耐盐碱品种‘益花1号’和‘花育25号’。
抗氧化酶系统是保护植物免受自由氧化伤害的最重要酶系统[25]。有研究发现随着油菜苗期复合盐碱浓度的增加,SOD和POD活性呈先降低后升高的趋势,CAT活性变化趋势相反[7]。藜麦幼苗叶片中3种酶活性均呈先上升后下降的趋势[4]。本研究结果表明,随着胁迫浓度增加,POD和SOD活性呈先升高后降低的趋势,其中NaHCO3胁迫0.60%浓度时POD和SOD活性达到峰值,NaCl+NaHCO3胁迫0.30%浓度时SOD达到峰值与杨洋[7]研究结果一致,说明胁迫开始时抗氧化酶被激活进行自由基的清除,随着胁迫浓度不断增加,植株体内积累了大量的自由基,阻碍了蛋白质的合成,从而使酶活性显著降低。本研究结果表明,在NaHCO3胁迫时CAT活性的变化趋势与前人研究结果一致,而NaCl和NaCl+NaHCO3胁迫时CAT活性随胁迫浓度增加呈下降趋势与前人研究结果不一致,原因可能是活性氧的清除能力不是无限的,当盐浓度超过一定限度时,酶的保护能力急剧下降[26-27],因此CAT活性呈直线下降趋势。本研究表明当NaHCO3胁迫浓度超过0.90%时,耐盐品种‘益花1号’和‘花育25号’POD和SOD活性降幅低于盐敏感品种,与温赛群等[2]研究结果一致,而与石婧[10]结果存在差异,原因可能是前人研究中SOD活性的增大抑制了POD的活性,由于不同作物耐盐性存在差异,因而酶活性间抑制能力也不同。
植株受逆境胁迫影响积累大量的过氧化产物MDA[28]。研究发现,随着盐浓度的增加藜麦、龟背竹叶片中MDA含量增加[4,29]。本研究结果表明,随着胁迫浓度增加花生根尖MDA含量呈上升趋势,其中NaCl+NaHCO3胁迫下MDA含量急剧上升,当胁迫浓度超过0.60%时花生不出苗,MDA含量为0与前人研究结果一致。说明高浓度盐碱胁迫对花生造成的影响是不可逆转的,氧化损伤严重造成植物死亡和MDA水平下降[30]。前人研究中盐敏感花生叶片MDA含量增幅较耐盐品种高,本研究结果表明不同胁迫处理下耐盐碱品种‘益花1号’的MDA含量最低,盐碱敏感品种‘花育39号’的MDA含量最高与前人研究结果一致,说明耐盐品种与敏感盐品种相比,MDA积累率低,具有较高的活性氧代谢能力。盐碱胁迫造成植株细胞缺水,出现渗透胁迫,而渗透调节物质脯氨酸的积累可抵御盐碱胁迫带来的影响。研究表明,随着盐胁迫浓度增加紫花苜蓿和水稻幼叶中脯氨酸含量逐渐增加[31-32]。本研究表明,随着盐碱浓度的升高,花生根尖脯氨酸含量与0%(CK)处理相较显著增加与前人研究结果一致,说明花生幼苗可以通过积累脯氨酸以适应盐碱胁迫带来的损害。前人研究发现耐盐植物体内脯氨酸含量较高[17,33]。本研究表明耐盐碱品种‘益花1号’脯氨酸含量较高,盐碱敏感品种‘花育39号’脯氨酸含量最低与前人研究结果一致,说明脯氨酸的积累随花生品种耐盐性的差异而变化,‘益花1号’受盐碱胁迫后最先对胁迫做出响应并进行调节,从而积累了大量的脯氨酸。
4 结 论
盐碱胁迫下花生主根长、地上部和地下部鲜质量及干质量显著降低,且NaCl+NaHCO3胁迫下主根长和鲜质量及干质量较NaCl和NaHCO3胁迫低。随着盐碱胁迫浓度增加,花生根尖POD和SOD活性先升高后降低,NaHCO3胁迫0.60%浓度时POD和SOD活性达到峰值,当胁迫浓度超过0.90%时,耐盐品种‘益花1号’和‘花育25号’POD和SOD活性降幅低于其余盐敏感品种,NaCl+NaHCO3胁迫0.30%浓度时SOD活性达到峰值。各品种在NaCl和NaCl+NaHCO3胁迫下CAT活性随胁迫浓度增加逐渐降低,NaHCO3胁迫下CAT活性呈小幅增加再下降的趋势。不同胁迫处理下各品种MDA和脯氨酸含量显著增加,其中盐碱敏感品种较耐盐碱品种MDA含量较高、脯氨酸含量较低,‘花育39号’受盐碱胁迫的影响最大脯氨酸含量最低。
