抑制Nav1.6表达对奥沙利铂诱导的大鼠神经病理性疼痛的影响
2023-06-26潘桢婕李攀阳冀建伟李志业
潘桢婕,李攀阳,李 磊,冀建伟,白 倩,李志业
1)郑州大学第二附属医院药学部 郑州 450014 2)河南医学高等专科学校组织胚胎学教研室 郑州 451191 3)郑州大学基础医学院人体解剖学教研室 郑州 450001 4)郑州大学第二附属医院麻醉科 郑州 450014
奥沙利铂在结直肠癌、乳腺癌、胃癌等实体肿瘤的治疗中取得了良好的疗效,但在治疗过程中诱发的周围神经毒性可严重影响患者的生活质量[1]。研究[2]发现奥沙利铂可诱导大鼠周围神经毒性,出现神经病理性疼痛,与增加钠离子通道蛋白Nav1.6的表达有关。DiBAC4(3)是负离子荧光染料,具有亲脂性[3-5],对膜电位敏感,可以随着细胞膜电位的改变而进出细胞膜[6-7]。当DiBAC4(3)与细胞内蛋白质结合时即可发出荧光,荧光的变化可反映离子通道改变对膜电位的影响,进而反映神经元兴奋性的变化[8-10]。Nav1.6由SCN8A基因编码,是一种钠离子通道蛋白亚型。本研究在激光共聚焦显微镜下观察抑制Nav1.6表达后大鼠肾上腺嗜铬细胞瘤PC12细胞膜电位的动态变化,以及大鼠机械痛缩足阈值和冷痛阈值的变化,探讨Nav1.6在奥沙利铂诱导神经病理性疼痛的作用。
1 材料与方法
1.1 主要试剂、仪器与动物奥沙利铂购于齐鲁制药(海南)有限公司(产品批号:FA1E9011B),DMEM购于北京索莱宝科技有限公司,胎牛血清购于美国赛默飞世尔科技有限公司,SCN8A-siRNA-1、SCN8A-siRNA-2和SCN8A-siRNA-3由上海吉玛公司合成,β-actin抗体购于武汉三鹰生物公司,Nav1.6抗体及其二抗购于以色列Alomone Labs公司;激光共聚焦显微镜为日本Olympus公司产品,Von-Frey纤维测痛仪为上海玉研公司产品;PC12细胞来源于郑州大学基础医学院人体解剖学教研室;SPF清洁级、体重180~220 g成年雄性SD大鼠购于河南省实验动物中心。
1.2 奥沙利铂对PC12细胞Nav1.6表达的影响选用DMEM培养液,置37 ℃、体积分数5% CO2培养箱中培养PC12细胞,隔天换液,待细胞密度达70%~80%后,接种于6孔板,细胞分3组,分别加入终浓度为0.00、0.02和0.05 μmol/L的奥沙利铂48 h。胰蛋白酶消化细胞45 s。收集细胞于EP管中,4 ℃、1 000 r/min离心5 min,弃上清液,重复两遍。EP管中加入500 μL细胞裂解液,吹打后冰盒上孵育5 min,低温离心机12 000 r/min离心5 min。收集上清液,置100 ℃的水浴锅5 min。测蛋白浓度,等量上样。采用Western blot检测Nav1.6的表达。分离胶电泳后转PVDF膜。用50 g/L脱脂奶封闭2 h。洗涤后加入Nav1.6抗体(按1∶200稀释),低温4 ℃过夜。用TBST洗涤3遍,然后加二抗(按1∶1 000稀释)。实验重复4次。采用Image J软件分析,以Nav1.6与β-actin条带灰度值比值作为Nav1.6的表达水平。
1.3 抑制Nav1.6表达对奥沙利铂作用后的PC12细胞膜电位的影响
1.3.1实验分组 PC12细胞分为奥沙利铂组、对照组、SCN8A-siRNA-1组、SCN8A-siRNA-2组、SCN8A-siRNA-3组。奥沙利铂组是用含终浓度为0.05 μmol/L奥沙利铂培养的PC12细胞,对照组是正常培养的PC12细胞。SCN8A-siRNA-1、SCN8A-siRNA-2、SCN8A-siRNA-3组:取对数生长期的PC12细胞,以每孔1×105个细胞接种于6孔板中,加入2 mL含0.05 μmol/L奥沙利铂的DMEM培养液,置37 ℃、体积分数5%CO2的培养箱中培养,细胞密度达30%~50%时转染。先将5 μL Lipofectamine 3000转染试剂加入200 μL无血清、无抗生素的DMEM中混匀室温静置 5 min,分别加入5 mL SCN8A-siRNA-1、SCN8A-siRNA-2或SCN8A-siRNA-3混匀,室温静置 25 min,加入含PC12细胞的DMEM培养液,置37 ℃、体积分数5%CO2的培养箱中孵育6 h后终止转染。更换含胎牛血清和青链霉素的DMEM培养液继续培养48 h。
1.3.2Nav1.6表达的检测 收集各组细胞,采用1.2中的Western blot法检测Nav1.6的表达。
1.3.3膜电位的检测 将各组PC12细胞以1×104个/mL的密度接种于激光共聚焦专用皿上,用PBS润洗5遍,皿中保留少量PBS以保持细胞浸润;添加含有钾通道阻滞剂和钙通道阻滞剂的细胞外液,用NaOH调节至pH 7.4。将终浓度为0.25 μmol/L的DiBAC4(3)加入细胞外液,同时进入荧光动态扫描,保留染液,检测荧光强度的变化。激发波长为488 nm,荧光波长为530 nm,间隔5 s扫描1次,共计5 min。采用Image J软件分析。
1.4 奥沙利铂对大鼠机械痛缩足阈值及冷痛阈值的影响配制完全溶解于葡萄糖注射液的奥沙利铂,终浓度为2 g/L。SD大鼠24只随机分为3组,每组8只。分别给予0(对照组)、2和4 mg/kg奥沙利铂腹腔注射,每2 d注射1次,共6次。采用Von-Frey纤维测痛仪和冷板检测大鼠给药后第0、7、15、21天的机械痛缩足阈值及冷痛阈值,检测时间均设在上午9:30~11:30。
1.5 抑制Nav1.6的表达对奥沙利铂作用的大鼠机械痛缩足阈值及冷痛阈值的影响SD大鼠24只分为3组:对照组、奥沙利铂组和SCN8A-siRNA-3组,每组8只。奥沙利铂组给予4 mg/kg奥沙利铂腹腔注射,每2 d注射1次,共6次。SCN8A-siRNA-3组在奥沙利铂注射后第7天背根神经节(DRG)显微注射SCN8A-siRNA-3。对照组不处理。异氟烷麻醉大鼠,剔去大鼠背部毛发备皮,碘伏擦拭,以髂嵴为坐标点沿脊柱左侧方向,将皮肤划开2 cm,暴露筋膜层,并划破到达肌肉层,夹开棘突、横突、关节突,暴露L4、L5的DRG;立体定位仪抽吸2 μL SCN8A-siRNA-3,每个DRG分别注射1 μL,注射时间为5 min。采用1.4的方法检测建模第0、3、7、11、15、18、21天大鼠机械痛缩足阈值及冷痛阈值。
1.6 统计学处理采用SPSS 21.0分析。各组PC12细胞Nav1.6表达的比较采用单因素方差分析和SNK-q检验。不同时间点各组大鼠机械痛缩足阈值及冷痛阈值的比较采用重复测量数据的方差分析。检验水准α=0.05。
2 结果
2.1 奥沙利铂对PC12细胞Nav1.6表达的影响见表1。奥沙利铂增加了PC12细胞Nav1.6的表达。选用0.05 μmol/L奥沙利铂用于后续实验。

表1 奥沙利铂作用后3组PC12细胞Nav1.6表达的比较
2.2 抑制Nav1.6表达对奥沙利铂作用的PC12细胞膜电位的影响
2.2.1各组PC12细胞Nav1.6表达水平的比较 见表2。SCN8A-siRNA转染抑制了经奥沙利铂处理的PC12细胞Nav1.6的表达,SCN8A-siRNA-3的抑制效果最好。
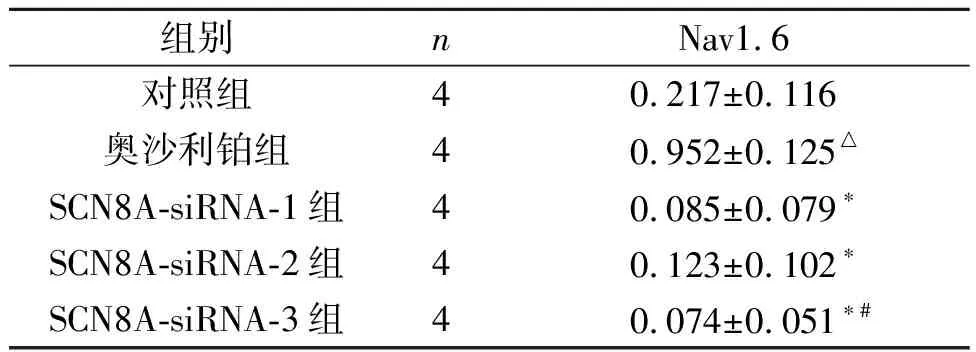
表2 各组PC12细胞Nav1.6表达水平的比较
2.2.2各组PC12细胞膜电位的荧光强度变化 见图1。与奥沙利铂组相比,SCN8A-siRNA-1、SCN8A-siRNA-2和SCN8A-siRNA-3组细胞膜电位荧光强度变化均减慢,后两组变化更明显。
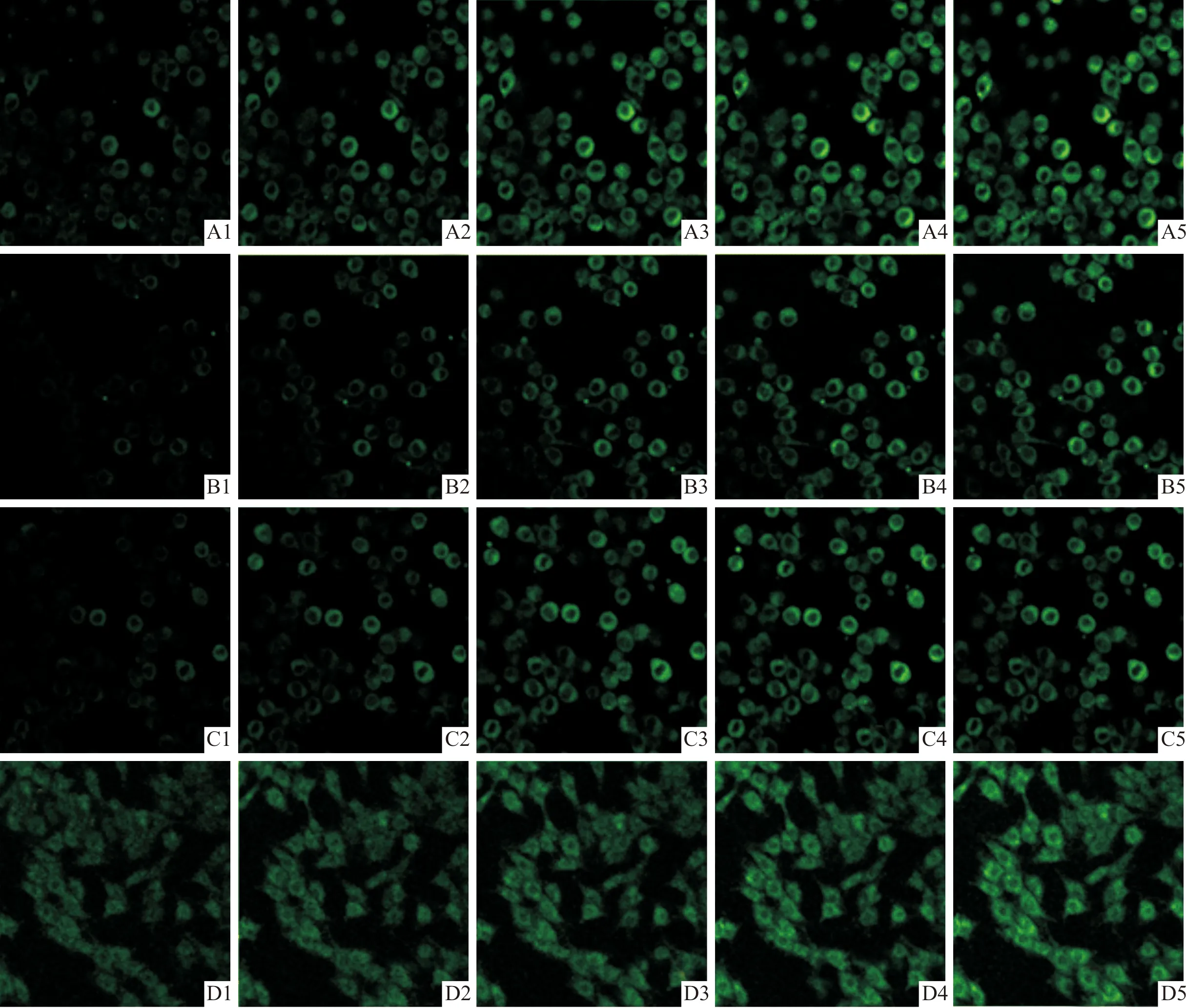
A:奥沙利铂组;B:SCN8A-siRNA-1组;C:SCN8A-siRNA-2组;D:SCN8A-siRNA-3组;1~5:分别为10 s、20 s、30 s、1 min、5 min
2.3 奥沙利铂对大鼠机械痛缩足阈值及冷痛阈值的影响见图2。奥沙利铂可降低大鼠的机械痛缩足阈值和冷痛阈值。
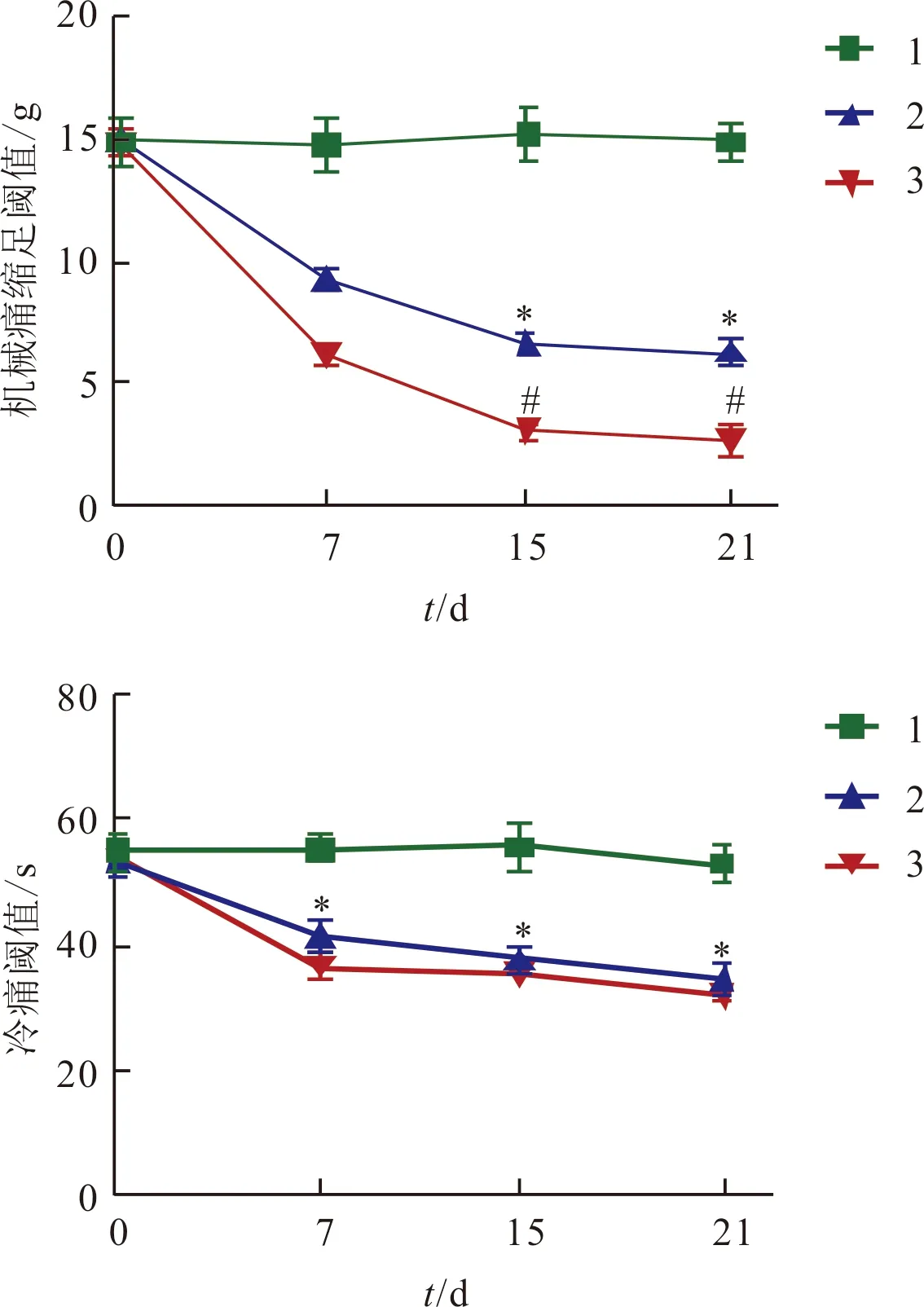
1:对照组;2:2 mg/kg奥沙利铂组;3:4 mg/kg奥沙利铂组;上:F组间=209.553,F时间=40.807,F交互=36.561,P均<0.001;下:F组间=83.799,F时间=38.537,F交互=23.741,P均<0.001;*:与1相比,P<0.05;#:与2相比,P<0.05
2.4 抑制Nav1.6表达对奥沙利铂作用的大鼠机械痛缩足阈值及冷痛阈值的影响见图3。与奥沙利铂组相比,在siRNA注射后第18和21天SCN8A-siRNA-3组机械痛缩足阈值及冷痛阈值均升高。
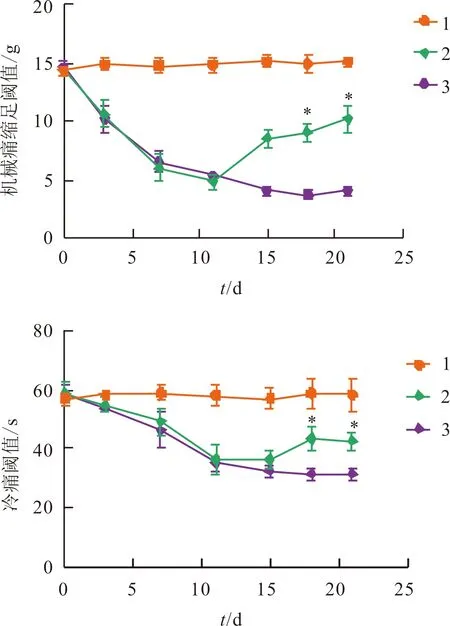
1:对照组;2:SCN8A-siRNA-3组;3:奥沙利铂组;上:F组间=201.306,F时间=19.489,F交互=26.367,P均<0.001;下:F组间=103.576,F时间=29.879,F交互=34.236,P均<0.001;*:与1和3比较,P<0.05
3 讨论
高分化的PC12细胞具有交感神经元的形态[11-12]。由于PC12细胞膜上的离子通道特性与神经元类似,因此其在神经科学研究中被广泛使用[12]。本研究结果显示奥沙利铂作用后PC12细胞Nav1.6的表达增加,而SCN8A-siRNA-1、SCN8A-siRNA-2、SCN8A-siRNA-3均可有效抑制PC12细胞Nav1.6的表达。DRG显微注射SCN8A-siRNA-3后,奥沙利铂诱导的周围神经痛大鼠的机械痛缩足阈值及冷痛阈值升高,表明通过调低钠离子通道亚型Nav1.6的表达,可以缓解奥沙利铂诱导的神经病理性疼痛。
激光共聚焦显微镜利用荧光探针在细胞膜内外分布的瞬时变化而检测出膜电位的动态改变,适用于检测非兴奋细胞的平均膜电位变化,被测量细胞需浸在含有DiBAC4(3)的细胞外液中。它与传统膜片钳相比较,避免了使用微电极对细胞所造成的损伤[13-14]。本研究结果显示SCN8A-siRNA-2、SCN8A-siRNA-3组钠离子进入细胞的速度明显减慢,使静息细胞膜电位去极化程度明显减慢。
综上所述,降低钠离子通道亚型Nav1.6的表达可减缓钠离子透过细胞膜传导的神经冲动,膜电位的改变降低了细胞兴奋性,最终可缓解奥沙利铂诱导的神经病理性疼痛。
