颈内动脉狭窄及合并缺血性脑卒中患者视网膜微血管神经改变特征△
2023-06-14陈祉帆马桂贤李昌茂刘春玲吴光宇吴希宇孟倩丽
陈祉帆 马桂贤 李昌茂 刘春玲 吴光宇 谢 洁 吕 正 吴希宇 孟倩丽
眼动脉作为颈内动脉的第一分支,是眼部组织供血的主要来源。因此,颈动脉狭窄,特别是颈内动脉狭窄(ICAS),往往造成眼部供血不足,出现一过性黑矇、眼缺血综合征、缺血性视神经病变、视盘或视网膜新生血管形成等慢性缺血性眼部病变。视网膜是机体唯一可以直视下观察到血管改变的组织。诸多关于眼部微血管系统与全身系统性疾病相关性的研究显示,视网膜血管改变可以提示颅内、全身血管病变、神经退行性疾病以及微血管疾病的发生及进程[1-3]。有研究发现,合并颈动脉狭窄的糖尿病患者出现微血管病变的概率升高[4-5];视网膜小动脉和静脉口径的变化可反映高血压、高血糖、炎症、缺氧和内皮细胞功能障碍的一系列病理生理改变,不仅可以预测糖尿病微血管并发症,还可以预测脑卒中和冠心病等疾病发生[1,6-8]。因此,早期发现视网膜病变对系统性疾病的评估、预测及治疗有重要作用。作为可快速、无创观察视网膜血管改变的新技术,光学相干断层扫描血管成像(OCTA)在视网膜脉络膜血管改变及退行性神经病变的检查诊断、疗效评估和随访管理等方面具有独特优势[9-10]。诸多研究显示,OCTA不仅可以用于眼科疾病,如糖尿病视网膜病变(DR)、原发性青光眼、视网膜动静脉阻塞、年龄相关性黄斑病变、葡萄膜炎等[9,11-12]的诊断与评估,还可以为神经系统疾病,如阿尔茨海默病、脱髓鞘疾病等的研究提供重要的参考数据[13-16]。众所周知,颈动脉粥样硬化是缺血性脑卒中的重要危险因素,与其发生发展及复发有密切的关系[17-18]。虽然已有研究观察了OCTA各参数在颈动脉粥样硬化患者中的变化特点,但由于临床中颈动脉粥样硬化或脑卒中患者常合并有高血压、糖尿病、高脂血症等系统性因素,这些因素可能对观察此类患者视网膜血管的变化造成干扰,使研究结果缺乏较好的特异性。因此,为了尽可能减少此类混杂因素的干扰,本研究利用OCTA检测单侧ICAS患者双眼视网膜厚度、血流密度(VD)及神经节细胞复合体(GCC)厚度等相关指标的变化,通过自身对照研究,探讨单侧ICAS患者视网膜微血管神经改变特征,初步观察其与缺血性脑卒中发生的可能关系。
1 资料与方法
1.1 一般资料本研究为横断面研究。选取 2019年12月至2021年12月在我院完善颈部血管超声、计算机断层血管造影(CTA)或数字减影血管造影(DSA)检查的ICAS患者307例为研究对象。纳入标准:一侧ICAS≥70%,对侧颈内动脉无狭窄或狭窄程度<50%的患者。排除标准:(1)大动脉炎、纤维肌性发育不良、颈动脉迂曲等疾病导致的ICAS;(2)非缺血性脑卒中;(3)合并有明确视网膜或脉络膜病变、屈光不正(≥+3.00 D或≤-3.00 D)、难治性青光眼、严重的白内障、眼内炎症、眼外伤或手术史;(4)合并其他严重全身疾病可能影响检测结果者;(5)影响结果判断的其他情况。采用北美症状性颈动脉内膜切除试验法(NASCET)[19]测量颈动脉狭窄程度。根据颈动脉内径缩小程度将颈动脉的狭窄程度分为4级,其中,(1)轻度狭窄:颈动脉内径缩小<50%;(2)中度狭窄:颈动脉内径缩小50%~<70%;(3)重度狭窄:颈动脉内径缩小70%~99%;(4)完全闭塞:颈动脉内径缩小>99%[20]。根据纳入及排除标准最终纳入27例患者。所有研究程序均符合《赫尔辛基宣言》原则,通过广东省人民医院医学研究伦理委员会批准[批号:GDREC2020207H(R1)],患者均知情同意。
1.2 方法
1.2.1 一般资料的收集收集患者的一般资料,包括性别、年龄、既往史(缺血性脑卒中、原发性高血压、糖尿病、高脂血症、冠心病)、烟酒史等。
1.2.2 眼科检查所有患者均接受眼科裂隙灯检查、眼底照相和OCTA(RTVue-XR Avanti; Optovue,美国)检查。所有OCTA检查均由专业的眼科医生在暗室中进行。对每位患者的双眼进行黄斑区HD 6 mm×6 mm、视网膜GCC、视盘区4.5 mm×4.5 mm超高分辨率扫描,通过用于校正运动伪影的内置软件合并三维OCTA图像。计算所得图像中信号像素占总像素的面积比例,即为视网膜VD。黄斑区HD 6 mm×6 mm程序:以黄斑中心凹为中心,边长为6 mm的正方形区域,自视网膜内界膜至内丛状层上方10 μm为浅层毛细血管丛(SCP),内丛状层上方10 μm至外丛状层下方10 μm为深层毛细血管丛(DCP)。视盘区4.5 mm×4.5 mm程序:以视盘为中心的 4.5 mm×4.5 mm 的扫描区域,测量视盘周围的毛细血管VD和视盘区视网膜神经纤维层(RNFL)厚度。视盘区细分为8个区域:鼻上区、鼻下区、下鼻区、下颞区、颞下区、颞上区、上颞区和上鼻区。黄斑中心凹面积、黄斑中心凹无灌注区(FAZ)的周长和非圆指数(测量的周长与相同尺寸圆形区域的周长之比)、FAZ周围300 μm环内的VD(FD-300)、RNFL厚度、视网膜厚度(内界膜-视网膜色素上皮层)以及黄斑区GCC厚度(包括 RNFL、神经节细胞层和内丛状层,经中心凹的水平线分为上半部分及下半部分),均通过设备内置软件自动获得[12]。本研究只分析质量指数>6分的图像结果。
1.2.3 分组根据患者颈内动脉的狭窄程度分组,将狭窄程度≥70%的同侧眼设为狭窄侧眼组,将对侧颈内动脉无狭窄或狭窄程度<50%的同侧眼设为对侧眼组。根据患者是否合并缺血性脑卒中进行亚组分析。
1.3 统计学方法采用SPSS 25.0统计学软件行统计分析,使用Shapiro-Wilk检验对数据进行正态性分析,符合正态分布的计量资料采用配对t检验,以均数±标准差表示,不符合正态分布者采用非参数Wilcoxon秩检验,以中位数(上、下四分位数)表示。检验水准:α=0.05。
2 结果
2.1 临床特点纳入27例单侧ICAS患者,其中,男22例(81.5%),女5例(18.5%),年龄(60.93±8.30)岁。27例患者中,合并高血压18例(66.7%)、2型糖尿病10例(37.0%)、高脂血症6例(22.2%)、冠心病5例(18.5%),吸烟12例(44.4%)、饮酒4例(14.8%)。27例患者中,重度ICAS 19例(70.4%),其中13例合并缺血性脑卒中(48.1%)(典型病例见图1);颈内动脉完全闭塞8例(29.6%),其中6例合并缺血性脑卒中(22.2%)。
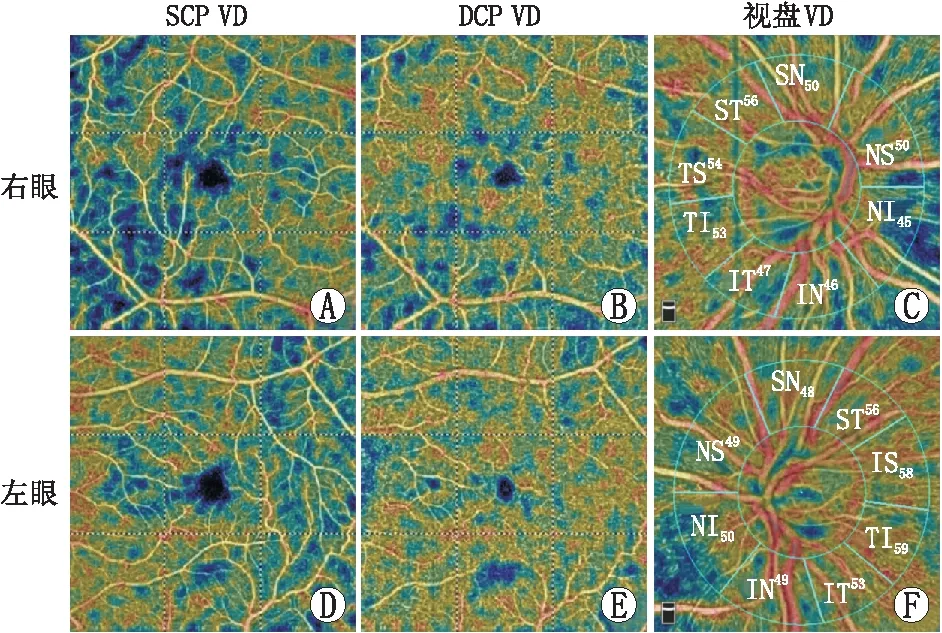
图1 合并缺血性脑卒中患者双眼OCTA检查 男性,64岁,右侧ICAS,颈内动脉内经缩小>70%,左侧颈内动脉无狭窄,右侧大脑缺血性脑卒中,有高血压病史,无糖尿病病史。A、B、D、E:OCTA黄斑区HD 6 mm×6 mm模式,狭窄侧眼(右眼)的黄斑区SCP及DCP VD较对侧眼(左眼)降低。C、F:视盘区4.5 mm×4.5 mm模式,8个视盘分区包括鼻上区(NS)、鼻下区(NI)、下鼻区(IN)、下颞区(IT)、颞下区(TI)、颞上区(TS)、上颞区(ST)和上鼻区(SN)。狭窄侧眼的视盘下颞区及颞下区VD比对侧眼降低,较其他区域明显。
2.2 单侧ICAS患者狭窄侧眼组与对侧眼组OCTA参数比较27例单侧ICAS患者狭窄侧眼组黄斑区SCP、DCP及FD-300 VD均较对侧眼组明显降低(均为P<0.05),两组间的黄斑中心凹厚度、GCC厚度差异均无统计学意义(均为P>0.05)(表1)。狭窄侧眼组视盘下颞区、颞下区VD较对侧眼组明显降低(均为P<0.05),两组间视盘其余区域VD、RNFL厚度相比差异均无统计学意义(均为P>0.05)(表2)。

表1 单侧ICAS患者狭窄侧眼组与对侧眼组黄斑区视网膜参数比较
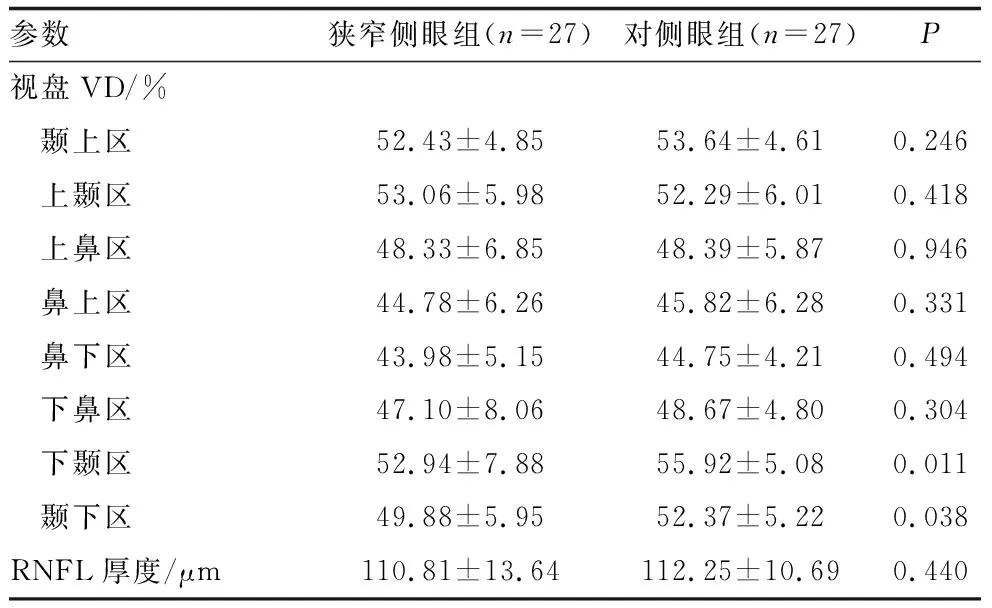
表2 单侧ICAS患者狭窄侧眼组与对侧眼组视盘区视网膜参数比较
2.3 合并缺血性脑卒中ICAS患者狭窄侧眼组与对侧眼组的OCTA参数比较在27例单侧重度以上ICAS患者中有19例(70.4%)合并有缺血性脑卒中,提示并非所有的严重ICAS均会导致脑卒中。19例合并缺血性脑卒中的ICAS患者狭窄侧眼黄斑区SCP、DCP VD和FD-300、下半部GCC厚度均较对侧组明显降低(均为P<0.05)(表3)。狭窄侧眼组视盘下颞区及颞下区VD均较对侧眼组显著降低(均为P<0.05),视盘其余区域VD及RNFL厚度差异均无统计学意义(均为P>0.05)(表4)。

表3 合并缺血性脑卒中的单侧ICAS患者狭窄侧眼组与对侧眼组黄斑区视网膜参数比较
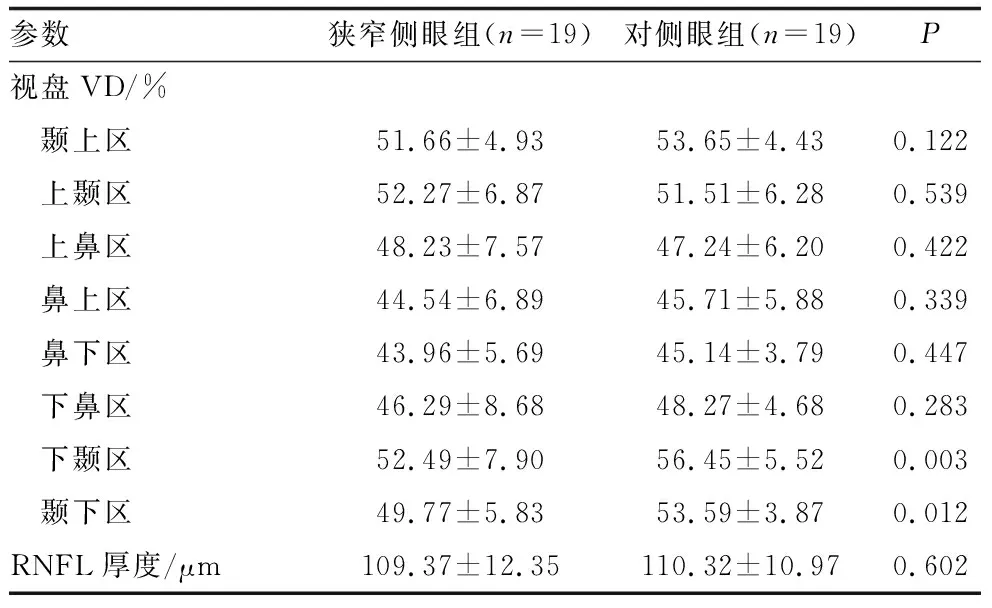
表4 合并缺血性脑卒中的ICAS患者狭窄侧眼组与对侧眼组视盘区视网膜参数比较
8例不合并缺血性脑卒中的ICAS患者狭窄侧眼组黄斑区及视盘区VD、RNFL及GCC厚度与对侧眼相比差异均无统计学意义(均为P>0.05)(表5)。

表5 不合并缺血性脑卒中的单侧ICAS患者狭窄侧眼组与对侧眼组黄斑区及视盘区视网膜参数比较
3 讨论
本研究利用OCTA对单侧ICAS≥70%且未出现视网膜病变的患者行双眼黄斑区、视盘区视网膜血流及神经相关参数的定量分析,证实在此类患者中视网膜已经开始出现微循环障碍,且累及视网膜全层;合并有缺血性脑卒中的ICAS患者其狭窄侧眼的视网膜VD显著下降,GCC厚度减少,提示ICAS合并视网膜血管和神经节细胞的改变可能是缺血性脑卒中发生的危险因素。
本研究结果显示,ICAS≥70%的患者狭窄侧眼视网膜黄斑区SCP、DCP VD及FD-300均较对侧眼显著降低,差异均有统计学意义(均为P<0.05)。Lahme等[21]研究发现,无临床症状颈动脉狭窄≥70%的患者黄斑区SCP及视盘毛细血管VD比健康受试者显著降低,而两组间DCP无明显差异。Pierro等[22]研究发现,满足血管外科学会指南手术治疗指征的单侧颈动脉狭窄患者同侧眼黄斑区DCP VD与对侧眼及健康患者相比显著降低,而SCP并未发现此现象。Zhang等[23]研究发现,无眼底疾病的ICAS患者狭窄侧眼视网膜小动脉直径小于健康受试者,视网膜小动脉血管氧饱和度和动静脉血氧饱和度差值高于对侧眼和健康受试者,提示在可见的眼底损害发生前,ICAS患者存在视网膜氧代谢改变。有研究提出,睫状后动脉的收缩期峰值速度下降是颈内动脉缺血的敏感指标[24],视网膜外层的灌注受睫状后动脉的影响,因此颈内动脉出现缺血时,视网膜外层血管灌注先出现下降。外层视网膜缺氧导致自我调节机制能力受损,从而使 DCP 灌注速度降低或毛细血管损伤[25-26]。由于视网膜深层毛细血管属于低压血管网,受视网膜中央动脉灌注支配,另一方面,DCP是最敏感、最脆弱、最难修复的血管网[27-28],如DR早期最常见视网膜深层血管病变[12]。所以当机体灌注压降低时,DCP最先受到影响。SCP主要位于视网膜神经纤维层及大血管附近,对视网膜缺血缺氧的病理变化相对滞后[29]。本研究结果提示,重度及以上ICAS的患者尽管暂未出现眼部临床症状及可见的眼底损害,但视网膜已经开始出现浅层和深层的毛细血管丛VD降低,提示视网膜发生累及全层的微循环障碍。
基于缺血性脑卒中的亚组分析结果显示,合并脑卒中的ICAS患者狭窄侧眼视网膜SCP和DCP的VD均较对侧眼显著下降,并且下方GCC厚度明显降低。而未合并脑卒中的ICAS患者双侧视网膜血流、RNFL及GCC厚度比较差异均无统计学意义。视网膜神经节细胞属于中枢神经细胞,缺氧、炎症、氧化应激等病理因素和各种蛋白通路均可影响其活性、功能及代谢[30]。视网膜缺血不仅直接诱导GCC死亡,还会引起一系列炎症反应,激活小胶质细胞,进一步导致GCC死亡[31]。有研究提出,视网膜神经节细胞损伤发生在糖尿病性视网膜病变的早期阶段,并早于明显的视网膜血管损伤[32]。本研究结果显示,未出现脑卒中的ICAS患者双侧眼视网膜血流及GCC未发生明显变化,而合并缺血性脑卒中的ICAS患者的狭窄侧眼视网膜VD较对侧眼降低更明显,并且出现GCC厚度的降低,表明狭窄侧眼视网膜缺血缺氧程度更严重,这可能与缺血性脑卒中的发生有关。因此,我们推测ICAS患者合并视网膜微循环障碍可能与缺血性脑卒中的发生存在一定相关性,有可能是缺血性脑卒中发生风险的评估指标。
鉴于对视网膜微血管及神经变化的观察易受性别、年龄、高血压、糖尿病、高血脂、冠心病、吸烟、饮酒等全身因素的影响,因此,为了排除上述混杂因素对研究结果的干扰,准确评估ICAS中视网膜微血管及神经的变化特点,本研究采用自身对照研究方法,以更好地观察ICAS中视网膜微血管及神经的变化特征。但本研究也存在以下不足:(1)本研究为横断面研究,不能对ICAS合并视网膜微循环障碍与缺血性脑卒中的发生进行因果关系的推断;(2)本研究收集了无眼部疾病的单侧ICAS≥70%患者双眼OCTA的数据,由于研究时间和纳排条件的限制,使本研究的样本量相对较少。
综上,本研究发现,单侧重度及以上ICAS患者狭窄侧眼出现视网膜VD下降,当合并缺血性脑卒中时,其狭窄侧眼视网膜微循环障碍较对侧眼加重,并出现GCC损伤。本研究结果提示,ICAS合并视网膜微血管和神经节细胞损伤有可能与缺血性脑卒中发生相关,未来需要大样本前瞻性研究进一步明确其作为缺血性脑卒中预测因素的可能性。
