Gardner综合征1例报告
2023-06-11张梦璇刘洪娜郑吉敏申安东徐燕燕苏少慧
张梦璇,刘洪娜,郑吉敏,申安东,徐燕燕,苏少慧
张梦璇,刘洪娜,郑吉敏,申安东,徐燕燕,苏少慧,河北省人民医院老年消化科 河北省石家庄 050001
张梦璇,河北北方学院研究生院 河北省张家口 075000
0 引言
Gardner综合征(gardner syndrome,GS)是一种非常罕见的常染色体显性遗传性疾病,累及多个系统,临床表现多样,肠外表现常早于肠内病变出现,容易漏诊误诊,如何早期正确识别GS,对其预后有重要意义.
1 病例简介
患者女,38岁,因“间断腹胀、恶心、呕吐15 mo,加重1 wk”入院.患者15 mo前无明显诱因间断出现上腹部饱胀,餐后加重,偶有恶心、呕吐,呕吐物为胃内容物,进食量较前减少.于当地医院查胃镜示胃多发息肉,予以抑酸、促动力等药物治疗,症状稍好转.8 mo前复查胃镜: 胃潴留、胃多发息肉,幽门螺杆菌检测阳性,四联疗法根除治疗后转阴.5 mo前患者发现腹部包块,于当地医院行腹部CT示中腹部占位,口服中草药治疗效果欠佳.1 wk前患者腹胀加重,伴恶心、呕吐,呕吐物为胃内容物,为进一步诊治收入我科.患者自发病以来精神、睡眠可,进食量逐渐减少,小便正常,大便3 d-5 d/次,颜色正常.体重下降5 kg.既往史: 既往分别于2010年及2016年行剖宫产手术两次.家族史: 奶奶因食管癌去世,母亲因结肠癌去世,姐姐因“腹部肿物”(具体不详)去世,父亲及子女因无消化道症状未行胃肠镜等检查.入院查体: T36.6 ℃,P77次/分,R20次/分,BP109/80 mmHg.神清,精神可,心肺查体未见明显异常.腹软,脐周压之不适,上腹可触及大小约4 cm×5 cm包块,形状不规则,边界较清,无触痛,右下腹似可触及包块,界限不清.辅助检查: 血、尿、便常规、C反应蛋白、结核感染T细胞检测、肿瘤标志物均未见明显异常.胃镜:胃多发息肉(图1A)、十二指肠水平部狭窄(考虑外压所致)(图1B).胃息肉病理(图2A): 胃底腺息肉.结肠镜(图1C和D): 结肠多发息肉.行内镜下肠息肉电切术,息肉病理示(图2B): (横结肠)管状腺瘤.腹盆CT(图3): 腹腔内及左侧腹直肌、右外侧腹壁多发占位,考虑纤维来源肿瘤可能性大;其中腹腔内病变可见气体影且局部与肠管分界欠清,不除外内瘘形成.行超声引导下左侧腹直肌肿物活检,病理回报(图4A): 梭形细胞肿瘤.免疫组化染色(图4B-D): CKpan(-),Vimentin(+),Desmin(部分弱+),SMA(部分+),Calponin(部分+),CD34(血管+),S100(-),B-catenin(+),Ki-67(约3%+),P53(+).符合韧带样纤维瘤病.外周血腺瘤性结肠息肉病(adenomatous polyposis coli,APC)基因测序: 检测到APC基因杂合突变,突变命名为NM_000038.6:c.7932_7935del(p.Y2645fs*14).颅脑和胸部CT未见明显占位性病变.
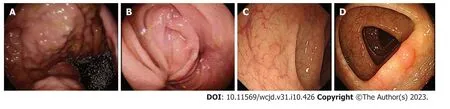
图1 胃肠镜结果(2021-12-20).A: 胃镜: 胃底及胃体见多发直径在0.3 cm-0.6 cm山田Ⅰ型及Ⅱ型息肉,表面光滑;B: 十二指肠水平部似有外压,腔狭窄,内镜不能通过,粘膜尚光滑;C: 肠镜: 横结肠见0.5 cm×0.5 cm山田Ⅱ型息肉,表面光滑,i-scan观察呈NICE分型2型;D: 乙状结肠结肠见0.4 cm×0.4 cm山田Ⅱ型息肉,表面光滑,i-scan观察呈NICE分型2型.

图2 胃结肠息肉病理(2021-12-22).A: 胃体息肉: 胃底腺息肉(HE×40);B:横结肠息肉: 管状腺瘤(HE×40).
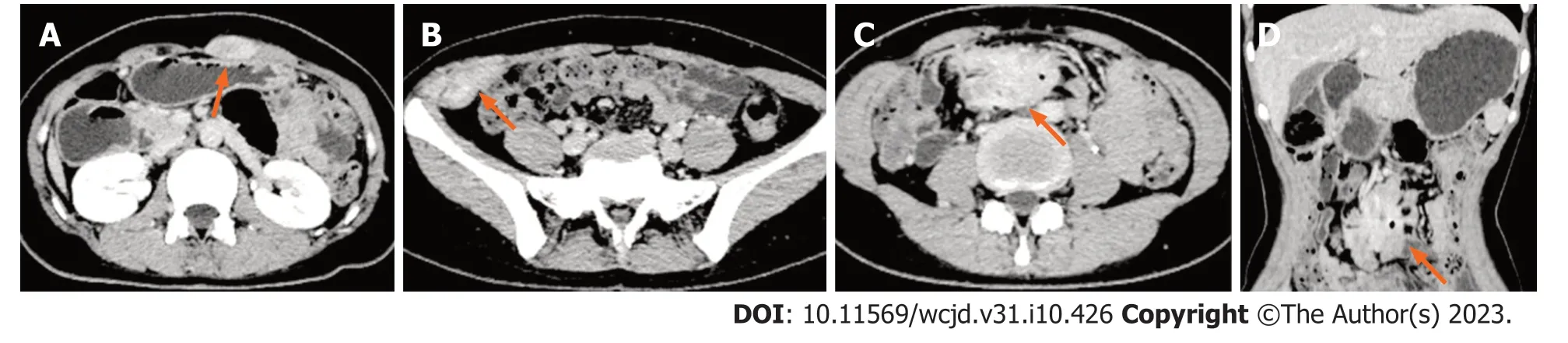
图3 腹部增强CT(2021-12-17).A: 左侧腹直肌(延迟期,橙色箭头)可见团块状稍低及等混杂密度影,边界欠清,增强扫描呈渐进性不均匀明显强化;B: 髂嵴水平右外侧腹壁(延迟期,橙色箭头)可见团块状稍低及等混杂密度影,边界欠清,大小约26 mm×52 mm,增强扫描呈渐进性不均匀明显强化;C,D: 约L4椎体水平腹腔正中(延迟期,橙色箭头)可见团块状稍低及等混杂密度影,边界不清,大小约53 mm×33 mm×43 mm,与周围多发肠管分界欠清,其内可见散在气体密度影,增强扫描病变呈渐进性不均匀明显强化,可见斑片状低密度影,另其内可见肠系膜上动脉多发分支走行.

图4 腹直肌穿刺组织病理(2021-12-23).A: 梭形细胞瘤(HE×100);B: 免疫组化[B-catenin(+),×100];C: 免疫组化[SMA(部分+),×100];D:免疫组化[Vimentin(+),×100].
2 最终诊断
(1)GS;(2)十二指肠梗阻;(3)结肠多发管状腺瘤;(4)胃多发胃底腺息肉;(5)慢性非萎缩性胃炎;(6)剖宫产术后.
3 治疗
入院后向患者交代病情及治疗方案,患者因手术风险大且复发率高及化疗等治疗方法存在副作用,表示暂不行特殊治疗,考虑患者多发胃底腺息肉可能与既往应用质子泵抑制剂和幽门螺杆菌根除治疗相关,息肉较小,癌变风险低,暂不予切除;予以肠息肉切除及对症处理后患者腹胀、呕吐症状好转出院.
4 结果和随访
2022-01患者为求进一步诊治就诊于北京肿瘤医院,同样因上述顾虑,未行相关治疗.2022-03患者因恶心、呕吐症状加重,不能进食,就诊于河北省第四医院,术中行腹部探查判定患者腹内肿瘤无法切除,给予行“胃空场侧侧吻合、空肠空肠侧侧吻合术”,术后患者恢复,无恶心、呕吐,可正常进食.后就诊于北京四惠中医院,予以中药汤剂及膏剂治疗腹部硬纤维瘤,具体不详,截止2022-03随访,患者仍行中草药治疗中,因暂无相关不适,患者未复查腹部CT及胃肠镜,正在进一步随访中.
5 讨论
GS是家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)的亚型之一,是一种罕见常染色体显性遗传性疾病,约占FAP患者的10%[1],发病率在1:6850至1:31250,任何年龄均可发病,无明显性别差异[2].GS与APC基因突变相关.APC基因是一种抑癌基因,其编码的APC蛋白是一种多功能蛋白,Wnt/β-连环蛋白为其代表性通路.β-连环蛋白在细胞核内和转录激活因子(T细胞因子和淋巴增强因子)形成复合物,激活细胞生长发育相关基因的转录,促进细胞增殖.正常APC蛋白与GSK-3β、Axin及其他辅助因子形成复合体,降解β-连环蛋白,防止细胞过度生长.而APC突变基因下游产物不能结合相关因子形成复合体,导致β-连环蛋白在细胞核中积累,持续激活Wnt信号通路,致使相关肿瘤发生[3].此外,正常APC蛋白还可与微管蛋白结合蛋白EB1、肿瘤抑制基因hDLG和蛋白酪氨酸磷酸酶PTP-BL结合,影响包括细胞骨架调节和染色体稳定性等在内的多种细胞发育过程[4],进一步解释突变的APC蛋白在癌变进程中的作用.
GS临床病变主要为结直肠腺瘤性息肉合并肠外表现,包括多发骨瘤、牙齿异常、皮肤和软组织肿瘤,硬纤维瘤是其主要肠外病变之一.硬纤维瘤(desmoid tumors,DT)起源于结缔组织成纤维细胞和肌成纤维细胞,是罕见的间质肿瘤,发病率约为5例-6例/百万人口,约占软组织肉瘤的3%[5].DT存在Wnt/β-连环蛋白途径的改变,与APC基因、CTNNB1基因突变相关,CTNNB1基因突变减少β-连环蛋白的泛素化,避免被蛋白酶体降解,导致β-连环蛋白核积累增加,从而持续激活相关细胞增殖通路,并且APC基因突变和CTNNB1基因突变往往不会同时出现[6],因此对于CTNNB1基因突变阴性的DT患者应更加警惕FAP的存在.此外,DT发病还与女性、妊娠、剖腹产等因素相关,可能与雌激素及创伤等因素相关[7].文献表明FAP患者发生硬纤维瘤的风险是普通人群的850倍,15%-20%的DT和GS相关,GS中DT多位于腹内,约占80%,10%-15%位于腹壁,5%位于腹外[8].DT属于良性肿瘤,不会发生转移,但具有局部侵袭性,且复发率高,以腹内DT为甚[9].腹内DT临床表现主要包括两个阶段,早期肿瘤的占位效应主要引起输尿管和肠梗阻,或血管和神经压迫;随后肿瘤进一步浸润周围组织导致缺血、穿孔、空腔器官瘘管形成以及胃肠道或肿瘤内出血,严重者可能危及生命[10].病理是诊断DT的金标准,主要表现为细胞核为单个、小且均匀的椭圆形或圆形的梭形细胞,不存在恶性细胞学特征(例如核深染、核异型性、坏死或核分裂).超过80%的病例显示免疫组化显示β-连环蛋白的异常核定位[11],这是WNT/β-连环蛋白信号通路潜在致病激活的表现.除此以外,CT及MRI也可为临床诊断提供一定依据.由于肿瘤内包含肌成纤维细胞、胶原蛋白、肌纤维等多种组织成分,并且缺少包膜,因此其在影像学上多表现为形状不规则、边界不清、密度不均匀的软组织密度肿块,其中CT多可见不均匀强化[12],在MRI T1加权像显示低信号或等强病变,T2加权像显示混合性高信号病变[13].本例患者青年女性,伴有APC基因突变,既往两次妊娠及剖宫产手术史,存在损伤因素,腹壁肿物病理证实为硬纤维瘤,腹内肿物无相关病理检查,但CT示腹腔及腹壁病变呈不均匀密度影,增强扫描呈渐进性不均匀明显强化,可见斑片状低密度影,符合硬纤维瘤影像学表现[14].
GS临床表现多变,常以口腔、颌面异常或其他部位肿瘤等肠外病变为主诉,临床易漏诊;或表现为腹泻、便血等肠道症状,易被误诊为肠息肉.本例患者同时伴发腹腔内及腹壁多处纤维瘤,瘤体较大,压迫十二指肠,造成不全梗阻,引发长达1年余的恶心、呕吐,实属少见.发病期间多次就诊于当地医院,按胃肠息肉、炎症对症处理,忽略了对肠外病变及肿瘤家族史的早期识别,给患者造成极大痛苦.
GS目前尚无规范的治疗方案,对于消化道息肉样病变,给予内镜切除及定期随访监测,有恶变倾向者适时行预防性肠切除有助于预后[15].如有手术禁忌或拒绝手术者可应用非甾体类消炎药如舒林酸、塞来昔布等减少或抑制息肉发生[16].DT是仅次于结直肠癌的第二大致死原因[2],其治疗策略主要包括主动监测(active surveillance,AS)及积极治疗(手术、放化疗等)[17].目前AS已被推荐作为DTF管理的前期方法[5].研究表明在未经任何治疗的腹腔内AF病例中,有20%观察到萎缩[8],Schut等[17]纳入105名腹腔外DT患者的队列研究结果表明,疾病进展多发生在前2年内,三年内仅30%患者由AS转为积极治疗;在AS期间,32%的患者疾病稳定,28%消退,40%显示初始进展.较大的肿瘤[≥5 cm;风险比=2.38(95%CI: 1.15-4.90)]与积极治疗的开始相关.因此,对于没有临床症状且瘤体较小的患者,AS可能是一种更优的选择.积极治疗适用于存在临床症状的患者,对于腹壁及腹外DT,其复发率相对低,可行手术切除[18];腹内DT与腹腔器官及组织广泛粘连,手术难度大,较难实现根治性切除,复发率高,且手术涉及广泛的小肠切除,存在显著营养及感染风险[19,20].目前,腹内DT建议行药物保守治疗,包括激素疗法、非甾体抗炎药、细胞毒性化学治疗剂及酪氨酸激酶抑制剂[21].
6 结论
GS起病隐匿,早期诊断及治疗对其极其重要.对于有家族史、APC基因突变等高危人群,定期进行胃肠镜检查、头颅及牙齿摄片、甲状腺、腹部彩超尽早发现、早期治疗十分必要.该患者剖宫产育有二女,建议其女行基因检测,并完善相关检查,及早评估,定期监测,另外避免剖宫产等创伤.
