PARP抑制剂在胰腺癌治疗中的应用及耐药性研究进展
2023-05-30王韬沈亦钰
王韬,沈亦钰
(1.浙江中医药大学 研究生院,浙江 杭州 310053;2.嘉兴第二医院 肝胆外科,浙江 嘉兴 314000)
胰腺癌是一种高度侵袭性疾病,多起病隐匿、发展迅速且预后极差[1]。尽管目前临床放化疗治疗方案众多,但多因全身细胞毒性和耐药性而获益受限[2-3],其分子特征主要表现为基因组不稳定性和致癌基因、肿瘤抑制基因的高激活突变率[4]。因此寻找新的基因靶向治疗药物成为了临床维持治疗的新方向。抑癌基因BRCA1/2、PALB2属于同源重组蛋白(homologous recombination,HR)主要通过诱导RAD51细丝着位于损失位点,修复被损伤的DNA复制叉,亦可防止新生DNA在停滞分叉处降解。其突变可直接导致DNA基因组的完整性受到破坏,不利于复制叉的保护和已损伤DNA的修复,大大增加该类人群胰腺癌易感性。因此聚二磷酸腺苷(ADP)核糖聚合酶抑制剂[poly(ADP ribose)polymerase inhibitor,PARPi]针对突变位点的高效治疗效应受到了广泛的关注和重视。PARPi治疗效应主要通过停滞DNA复制叉的重启动和破坏其稳定性,进而加重肿瘤细胞DNA损伤水平影响其DNA修复能力[5-6]。在BRCA1/2基因缺陷的胰腺癌细胞中PARPi依靠合成致死性效应,进一步减弱肿瘤细胞的DNA损伤修复(DNA damage response,DDR)能力。对存在铂敏感的胰腺癌患者可用PARPi协同治疗,通过增敏放化疗进一步改善患者预后[7]。PARPi作为新型靶向药物越来越受到临床治疗的重视,其中奥拉帕利已被FDA正式批准用于胰腺癌治疗,但其相关药物如卢卡帕利、维拉帕利等在胰腺癌方面的临床应用和研究仍较少。本文主要对PARPi作用机制和临床应用前景及其耐药性进行综述,以期为晚期胰腺癌维持治疗提供参考。
1 PARPi抗胰腺癌的主要机制
DDR与癌症易感性的联系已被广泛证实[8],已成为癌症靶向治疗的一个基本且有吸引力的方向。尽管肿瘤细胞可通过移除或容忍损伤、细胞死亡途径等方式激活DDR保护DNA,然而MYC和RAS家族等原癌基因以及抑癌基因的突变仍可推动癌症发生发展[9]。PARPi靶向个性化治疗现仍处于相对初级阶段,其中通过合成致死原理阻遏DNA损伤修复已成为研究的主要方向。有文献报道奥拉帕利通过该机制在PALB2和BRCA1/2突变的胰腺癌患者中显著改善了无进展生存率[10]。
1.1 PARPi通过合成致死效应抑制DRR
“合成致死”即单独干扰任意单个基因不会细胞致死,但同时干扰两个或以上基因时会导致癌细胞生存能力丧失,基因之间会发生合成致命相互作用。合成致死已成为癌症治疗中的关键点[11]。癌驱动基因KRAS、CDKN2A、TP53和SMAD4在胰腺癌中高表达,但均为非有效治疗靶点。目前遗传易感相关基因BRCA1/2已被作为PARPi治疗靶点[12]。针对敏感靶点PARPi可与癌细胞内NAD+结合,使其发生构象变化进而发生功能障碍,形成周期停滞产物,最终复制叉停滞,产生单链DNA断裂造成DNA的深度损伤[13-14]。总的来说在PARPi的作用下,通过该效应致死了存在敏感靶点的肿瘤细胞。
1.2 PARPi参与致死癌细胞的其他模型
除了通过DDR 抑制形成合成致死的经典模型外,非同源端连接(nonhomologous end joining,NHEJ)抑制也可导致癌细胞致死。该通路为补偿修复途径之一,在PARPi阻遏NHEJ时便会驱动细胞合成致死[15]。此外PARPi也可以通过抑制NHEJ途径的催化亚基如Ku70/Ku80和DNA-PKcs等导致癌细胞突变增加而死亡[16],或者抑制PARP依赖性肿瘤基因的转录调控,最终抑制参与调节染色质结构和组蛋白paryl生成的多种蛋白质的转录[17]。阻遏DDX21基因的转录,减少rDNA转录和核糖体生成[18],降低癌症生长性能。由此可见PARPi通过多种途径抑制共同作用促进肿瘤细胞凋亡,包括合成致死、DRR、染色质重构、结合位点和转录抑制等。
2 PARPi在胰腺癌治疗中的应用
目前仅有奥拉帕利在BRCA1/2遗传基因突变的胰腺癌患者治疗应用被FDA批准。但PARPi的应用已经不再局限于奥拉帕利与BRCA1/2基因位点。卢卡帕利、尼拉帕利、新型高选择性PARPi(AZD5305)以及各种联合用药方案均在相关的临床试验和基础实验中展现出良好的疗效和应用前景,特别是新型高选择性药物AZD5305。2022年一项大鼠临床前模型中的研究表明,AZD5305 组[≥0.1 mg/(kg·d)]比奥拉帕利组[100 mg/(kg·d)]肿瘤消退深度更大、反应持续时间更长且血液学不良反应影响更小,AZD5305 可针对性抑制PARP1 靶点,且避免阻遏PARP2位点带来的血液毒性等不良反应[19]。这或将成为PARPi治疗胰腺癌领域新的支点。
2.1 PARPi单药在胰腺癌中的治疗效果
大量的临床数据表明PARPi的医疗有效性,推动了其在胰腺癌治疗中的广泛应用。有研究采用奥拉帕利(200 mg/d,每日两次)单药治疗排除种系BRCA1/2突变伴有DDR缺陷基因(DDR-GAs)的48例胰腺癌患者,结果显示总体中位无进展生存期为3.7个月,DDR-Gas组(5.7个月,P=0.008)和铂敏感组(4.1个月,P=0.01)明显更高,表明奥拉帕利可能对非种系BRCA突变,但具有特异性DDR-GAs或铂敏感的胰腺癌患者也存在治疗价值[20]。在种系BRCA突变胰腺癌患者治疗方案上,一项随机双盲对照Ⅲ期临床试验(NCT02184195)纳入154例BRCA突变的胰腺癌患者,治疗组(92例)予奥拉帕利(300 mg/d,每日两次)中位无进展生存期显著高于安慰剂组(7.4个月vs3.8个月)[21-22]。另外一项多中心Ⅱ期研究纳入未接受过PARPi治疗的298 例肿瘤患者,其中23例存在BRCA突变的晚期胰腺癌患者给予奥拉帕利(400 mg/d,每日两次)治疗28 d后肿瘤缓解率21.7%,病情稳定8周以上的患者共8例,总体中位缓解时间为134 d[23]。这些结果均显示在种系BRCA1/2突变的胰腺癌患者中,奥拉帕利单药具有显著的抗肿瘤活性。
2.2 PARPi联合用药在胰腺癌中的治疗效果
胰腺癌肿瘤细胞微环境中存在着大量淋巴细胞、中性粒细胞、髓系抑制细胞和高度粘连增生的细胞外基质,形成独特的免疫抑制特性,这是大多数单剂治疗易产生耐药性的主要原因[24-25]。因此联合用药在胰腺癌的维持治疗中显得尤为重要,尤其是在BRCA种系突变的胰腺癌方面,联合用药展现了更好的疗效[26-27]。
有文献报道奥拉帕利可通过增敏吉西他滨化疗效应而增强胰腺癌患者体内的局部控制,改善无病生存期[28]。一项Ⅰb/Ⅱ期临床研究(NCT03404960)将纳入91例对铂类化疗有稳定反应疗效的晚期胰腺癌患者随机分为尼拉帕(200 mg/d)利联合抗PD-1组(480 mg,每四周静脉注射)(n=46)或抗CTLA-4组(3 mg/kg,每四周静脉注射)(n=45),主要终点为6 个月无进展生存率44%(无效假设),结果显示CTLA-4组无进展生存率明显优于PD-1组(59.6%vs20.6%)[29]。该团队在2021 年的一项卢卡帕利联合铂类化疗的Ⅱ期临床研究(NCT03140670)纳入46例BRCA1/2,PALB2种系突变的胰腺癌患者,铂基化疗16周以上后停止化疗(未出现铂耐药),然后予每日两次口服600 mg卢卡帕利,其中可评估的42例患者无进展生存率为59.5%,客观缓解率(objective response rate,ORR)为41.7%[30]。这些研究显示PARPi参铂化疗与非细胞毒性在晚期胰腺癌患者中治疗具有潜力,为降低化疗耐药性和毒性和建立终身化疗方案提供了良好的临床指导。
吉西他滨在胰腺癌晚期化疗中的疗效已经获得公认,PARPi与吉西他滨联合治疗也已用于临床。一项首次以维利帕利、吉西他滨联合放疗的Ⅰ期临床研究(NCT01908478)纳入34例晚期胰腺癌患者,予吉西他滨400 mg/m2联合维利帕利剂量递增,结果显示中位总生存期达15个月,但其淋巴细胞减少症高达96%[31]。该研究首次证明PARPi联合放化疗治疗方案安全且成效明显。但是联合吉西他滨治疗还需要临床医师对剂量有选择判断能力。在一项探究药物耐受量的Ⅰ期剂量递增实验(NCT00515866)中奥拉帕利(100 mg bid)+吉西他宾(600 mg/m2)组患者药物耐受性最佳且毒副反应发生率低[32]。PARPi系列药物在临床试验中,对胰腺肿患者生存和疾病控制方面均展现出良好疗效,其疗效与常见不良事件详见表1。
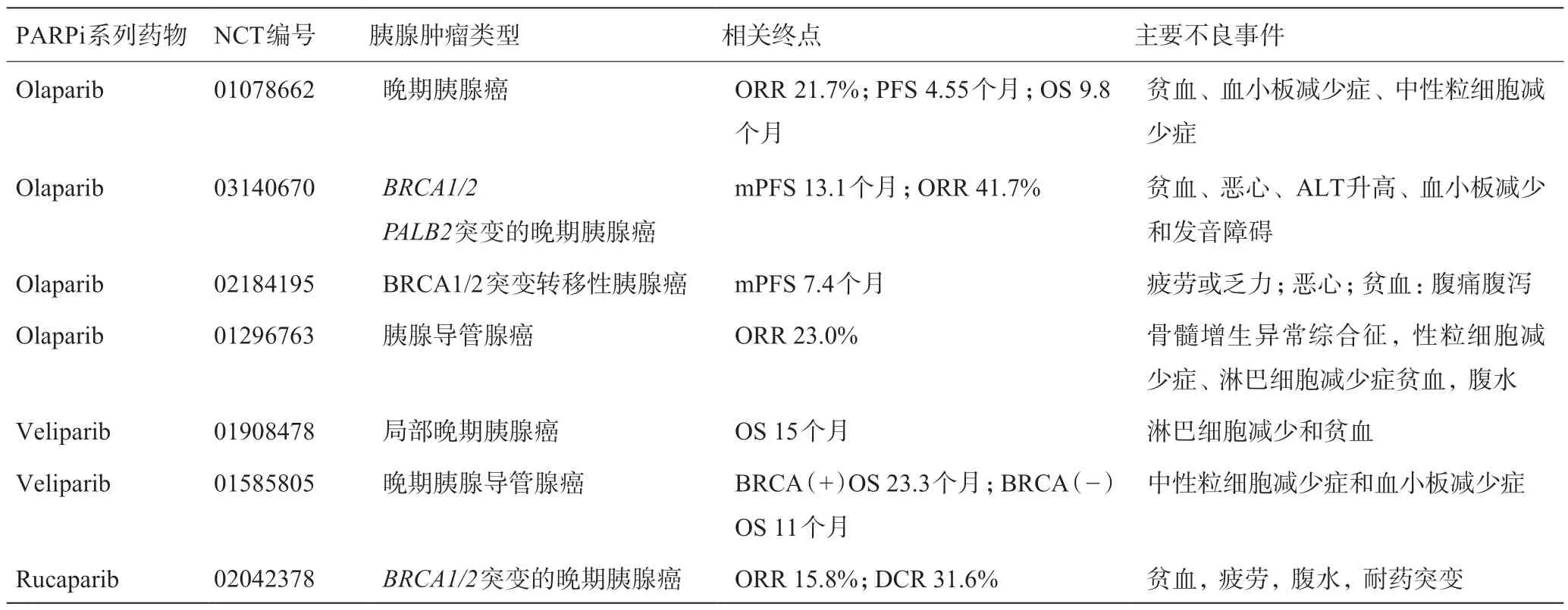
表1 PARPi药物在临床研究中的表现
3 PARPi耐药及逆转
3.1 BRCA2突变所致的耐药
尽管PARPi靶向治疗在临床和相关试验中均表现出了良好疗效,然而药物耐受不可避免。早在2017年就有关于BRCA2基因逆转突变进而导致胰腺导管腺癌患者对PARPi治疗产生耐药性的首次报道[33]。在胰腺恶性肿瘤中BRCA1/2种系特别是BRCA2靶点突变率高,这类患者往往会丢失BRCA种系基因的两个拷贝区,因而对PARPi和铂类药物非常敏感。对PARPi系列药物的耐受,大多是由于其所针对基因靶点的二次突变所致,即由BRCA基因突变驱动DNA末端连接修复而产生PARPi耐药[34]。其中外显子11 片段翻译得到的氨基酸序列多数参与耐药抗性。通过增强肿瘤细胞的DNA末端再修复效应,进而对药物产生耐药反应[35]。
3.2 降低PARPi耐药的研究
当前大多数研究认为肿瘤细胞的末端修复效应可能导致细胞耐药癌细胞可通过多种机制克服PARPi的细胞毒性作用。如何进一步增敏PARPi的细胞毒性作用,或者逆转癌细胞耐药关系到PARPi是否在临床有更好应用前景。在Capan-1变体细胞(耐奥拉帕利的BRCA2突变细胞系)中约有32%~49%可以通过BRCA2亚型的缺失使其对奥拉帕利重新获敏。70%~72%的耐药细胞通过过度耗竭抗凋亡蛋白环氧合酶2(COX-2)和人杆状病毒IAP重复序列3(baculoviral IAP repeat-containing 3,BIRC3)能显著降低了耐药细胞的凋亡抗性[36]。另外有研究在对抗性细胞系研究中发现端粒沉默干扰体1(disruptor of telomeric silencing 1-Like,DOT1L)是BRCA2的相关蛋白,DOT1L有助予染色体的重排融合,可能在PARPi抗性细胞的染色体中发挥积极的稳定作用,敲除DOT1L足以使细胞对奥拉帕利重新敏感[37]。因此,由于BRCA2在同源重组DNA的修复过程中承担着重要的角色,其有害突变或其阅读框的恢复,都使得肿瘤细胞获得对PARPi产生耐药,针对这一特性的敲除或截断该基因都可以使耐药的肿瘤细胞对PARPi重新获敏。
肿瘤细胞耐药的途径多种多样,因此逆转耐药的方式也不仅仅局限于BRCA2途径。KRAS基因在胰腺癌中的突变率高,而存在KRAS突变的肿瘤细胞更容易对PARPi诱导的DNA损失产生耐药抗性。针对该途径,专家发现丝裂原活化细胞外信号调节激酶抑制剂(mitogen activated extracellular signal regulated kinase inhibitors,MEKi)能使放大PARPi诱导的DNA损伤及dsDNA积累进而改善KRAS突变肿瘤细胞的耐药[38]。此外,逆转卵巢癌PARPi耐药的研究还发现ATR抑制剂联合PARPi使用可以有效抑制ATR/CCHK1信号通路激活和G2-M阻滞,增加复制叉的破坏[39]。虽然可以通过敲除、截断BRCA2相关耐药基因或是应用MEKi、ATR抑制剂,改善细胞耐药使其对PARPi重新获敏,然而这些机理大多局限在细胞基因实验或是动物模型实验。抗耐药的临床应用还需我们不断地前行与努力。
4 小结与展望
在大量胰腺癌患者中一部分患者具有独特的靶向生物学特性,这开拓了胰腺癌的治疗领域。PARPi可通过多种机制阻遏肿瘤细胞DNA损伤修复。提高晚期胰腺癌患者的预后。在降低耐药方面,已发现可通过敲除耐药相关基因或联用其他抑制剂改善患者耐药情况。尽管PARPi优秀的药物疗效使其在晚期胰腺癌的治疗中备受关注。但目前仅有奥拉帕被FDA正式批准用于胰腺癌临床治疗。卢卡帕利、尼拉帕利等虽在各期临床实验中表现优秀,但相关临床研究数据并不全面且改善耐药多局限于基础研究。因此在胰腺癌治疗中是否能达到实验预期的疗效,目前仍存在争议。未来如何提高各类PARPi在临床治疗中的安全有效性和进一步改善药物耐药,都将成为临床胰腺癌治疗的重要探索方向。
