lncRNA SNHG12促进宫颈癌SiHa细胞迁移、侵袭和抑制细胞凋亡
2023-05-30王玉净都治香
王 旭,徐 静,滑 芳,王玉净,都治香
(河北医科大学第一医院妇产科,河北 石家庄 050031)
宫颈癌(cervical cancer,CC)是常见的女性癌症之一[1]。研究证实,在大多数宫颈癌病例中发现了人乳头瘤病毒(human papilloma virus,HPV)感染[2],虽然HPV疫苗的出现降低了感染发生率,宫颈癌早期诊断的治疗效果有所提高,但在晚期和预防化疗耐药发展方面仍存在许多挑战[3]。研究发现,包括非编码RNA在内的其他辅助因子,已经证实与宫颈癌的发生发展相关,因此探究其他基因变异对于了解子宫颈癌的发病机制至关重要。长链非编码RNA(long non-coding RNA,lncRNA)作为一种非编码RNA,与宫颈癌发生发展密切相关,随着研究的深入发现lncRNA异常表达可诱发癌变,并与癌症患者预后不良有关。易彬彬等[4]研究发现,HOTAIR与宫颈癌易感性相关;邵学成等[5]研究发现,HOTAIR,ANRIL,H19多种lncRNAs在宫颈癌中异常表达,并与其发病机制相关。lncRNA核仁小分子宿主基因12(small nucleolar host gene12,SNHG12)位在染色体1p35.3区域,抑制SNHG12通过阻断G0/G1期细胞周期进程可抑制细胞增殖、侵袭和迁移能力[6];在结直肠癌中,SNHG12可以充当miR-16的海绵促进结肠癌细胞的增殖、迁移[7];SNHG12还可以在肝癌、肺癌等多种癌症中促进肿瘤生长[8-9]。现阶段SNHG12在宫颈癌中的作用上尚不明确。本研究旨在阐述体内外试验中SNHG12对宫颈癌SiHa细胞的部分生物行为调控能力,参与宫颈癌的发生发展。
1 资 料 与 方 法
1.1一般资料 选择2018年6月—2021年5月于河北医科大学第一医院经病理确诊的宫颈癌患者45例,年龄(48.82±13.26)岁,收集手术切除的肿瘤标本及癌旁正常组织。
本研究经医院伦理委员会批准通过。所有患者均知情同意并签署知情同意书。
1.2宫颈癌细胞培养和转染 本研究所用HaCaT,C33A,SiHa和CasKi细胞株,培养液:RPMI 1640并添加10%胎牛血清,抗生素100 kU/L青霉素和100 mg/L链霉素。功能性试验选取SiHa细胞,将SiHa细胞分为NC组,SNHG12组,siNC组和SNHG12 siRNA组,应用转染试剂LipofectamineTM 2000试剂,SiHa细胞转染SNHG12过表达质粒,SNHG12 siRNA以及对应的阴性对照。
1.3RNA提取及实时定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR) 使用Trizol从SiHa细胞系或河北医科大学第一医院收集的宫颈癌组织样本中提取总RNA,采用逆转录试剂盒将提取的总RNA合成cDNA,进行试验。试验结果以2-△△CT值形式表示。
1.4CCK8试验 将NC组、SNHG12组、siNC组、SNHG12 siRNA组SiHa细胞接种于96孔板,参照CCK-8试剂盒操作说明书指示进行细胞增殖试验检测,37 ℃孵育1~2 h,将其置于酶联免疫检测仪上,在450 nm下测量吸光。
1.5流式细胞法 将NC组、SNHG12组、siNC组、SNHG12 siRNA组SiHa细胞收集于5 mL流式离心管中,4 ℃预冷的70%乙醇固定各组宫颈癌SiHa细胞1 h。流式细胞仪检测细胞周期。
1.6Transwell试验 SiHa细胞Matrigel胶对小室包被,将各组SiHa细胞悬液200 μL置于Transwell上室,下室加入600 μL10%胎牛血清培养基,恒温培养箱培养24 h。取出腔室后,将小室用95%乙醇中固定10 min。0.5%结晶紫染色10 min,轻拭去Transwell小室上层细胞,显微镜观察下层细胞。
1.7细胞划痕试验 NC组、SNHG12组、siNC组、SNHG12 siRNA组SiHa细胞置于6孔板上,当细胞汇合度达到80%~90%时,200 μL移液器枪头在正中央位置划一直线,形成单层细胞间划痕,分别观察SiHa细胞显微镜下切片。
1.8Tunel试验 在4%多聚甲醛中固定NC组,SNHG12组、siNC组、SNHG12 siRNA组宫颈癌SiHa细胞30~60 min,0.3% H2O2孵育(37 ℃,20 min),50 μL生物素标记液孵育(37 ℃,60 min)。0.1~0.3 mL标记反应终止液,37 ℃孵育10 min,50 μL Streptavidin-HRP工作液,37 ℃,30 min,滴加0.2~0.5 mL DAB显色液,用苏木素染色液进行细胞核染色。95%乙醇脱水5 min,100%乙醇脱水2次(3 min/次),甲苯透明2次(5 min/次),显微镜下观察切片。
1.9动物模型 BALB/c裸鼠24只,6~8周,体重13~19 g,随机分为NC组,SNHG12组,siNC组,SNHG12 siRNA组,每组6只。SiHa细胞分别转染转染SNHG12过表达质粒,SNHG12 siRNA以及对应的阴性对照,1 mL注射器将转染好的SiHa细胞悬液注射到各组裸鼠右后肢腋部皮下(1×106个/只),21 d建模成功。
1.10免疫组织化学 将小鼠宫颈癌组织切片脱蜡入水,加热修复抗原,5%正常羊血清封闭(37 ℃,60 min)。1∶100比例稀释的Ki67抗体,4 ℃过夜。加入兔二抗(1∶200),37 ℃孵育30 min。滴加辣根酶标记链霉卵白素工作液,37 ℃,30 min。DAB显色,苏木精染色2 min,脱水,封片。
1.11统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用t检验、单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1SNHG12在宫颈癌组织和多种细胞株中表达 qRT-PCR检测SNHG12在宫颈癌组织中的表达,宫颈癌组织中SNHG12mRNA相对表达显著高于癌旁组织(2.58±0.21vs.1.01±0.10,t=45.280,P<0.001), 同时在相比正常细胞HaCaT,SNHG12在宫颈癌细胞株C33A、SiHa和CasKi中表达水平也均显著升高,其中在SiHa细胞中表达量最高,差异有统计学意义(P<0.05)。见表1。后续细胞试验以SiHa为目标细胞。提示SNHG12异常表达的变化情况可能和宫颈癌有关。
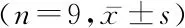
表1 SNHG12在宫颈癌组织和细胞株中表达Table 1 Expression of SNHG12 in cervical cancer tissues and cell lines
2.2SNHG12调控SiHa细胞增殖和周期 将SNHG12或siSNHG12转染SiHa细胞后,采用qRT-PCR检测发现,相比NC组,SNHG12或siSNHG12的表达水平显著升高或降低,差异均有统计学意义(P<0.05)。证明转染成功。采用CCK8法检测SNHG12对SiHa细胞的增殖能力,结果发现,SNHG12组SiHa细胞的增殖显著增加,而siSNHG12组SiHa细胞增殖能力降低。采用流式细胞法检测发现,SNHG12组能促进S期阻滞,而siSNHG12组则产生了相反的结论,可抑制SiHa细胞的增殖以及S期阻滞,提示SNHG12能对SiHa细胞增殖和周期具有一定的调控能力。见表2,3。
2.3SNHG12调控SiHa细胞的侵袭、迁移及凋亡 Transwell试验检测SNHG12对SiHa细胞侵袭的能力,结果发现与正常组相比,SNHG12组能促进SiHa细胞侵袭的能力,细胞穿孔数明显增加。而siSNHG12组,细胞穿孔数显著降低,抑制了SiHa细胞的侵袭能力(图1A)。Tunel细胞凋亡试验结果显示,SNHG12组的SiHa细胞凋亡率显著减少,siSNHG12组促进了SiHa细胞凋亡(图1B)。细胞划痕试验结果显示,SNHG12组促进SiHa细胞的迁移率,siSNHG12组抑制SiHa细胞的迁移能力(图1C)。提示SNHG12能调控SiHa细胞的部分生物行为。
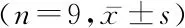
表2 SNHG12对宫颈癌SiHa细胞增殖和周期影响Table 2 Effects of SNHG12 on proliferation and cycle of cervical cancer SiHa cells
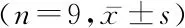
表3 siSNHG12对宫颈癌SiHa细胞增殖和周期影响Table 3 Effects of siSNHG12 on proliferation and cycle of cervical cancer SiHa cells


图1 SNHG12调控SiHa细胞的侵袭、迁移及凋亡
2.4构建宫颈癌裸鼠通过体内试验检测增殖情况 利用SiHa细胞构建了宫颈癌小鼠模型,21 d后剥离瘤体称重并选取组织进行切片,结果显示,SNHG12组肿瘤重量高于NC对照组,而SiSNHG12组肿瘤重量低于SiNC对照组,差异均有统计学意义(P<0.05),说明表达SNHG12促进了裸鼠肿瘤生长,而干扰SNHG12则相反抑制了肿瘤生长,见表4,5。Ki67试验检测皮下宫颈癌细胞核中阳性染色细胞所占的百分比,结果显示,上调SNHG12的阳性信号显著高于正常对照组,下调SNHG12则结论相反(图2),提示SNHG12能在体内试验中加强增殖能力,促进肿瘤生长,而通过RNA干扰技术,则能产生则能抑制宫颈癌细胞增殖。

表4 SNHG12组肿瘤重量Table 4 Tumor weights of SNHG12 group

表5 siSNHG12组肿瘤重量Table 5 Tumor weights of siSNHG12 group


图2 Ki67检测小鼠肿瘤增殖(苏木精染色,Scale bar=50 μm,×200)
3 讨 论
本研究结果显示,在宫颈癌组织和细胞中,SNHG12异常高表达,过表达SNHG12能促进宫颈癌SiHa恶性生物学行为,而干扰SNHG12则出现了相反的结论,随后构建动物模型进行验证,发现在体内试验中SNHG12能加强增殖能力,促进肿瘤生长,而通过RNA干扰技术,沉默SNHG12后则能产生抗宫颈癌的调控机制,充分说明SNHG12促进宫颈癌细胞SiHa细胞增殖、周期、侵袭、迁移及抑制凋亡,参与宫颈癌的发生发展。
宫颈癌相关研究发现,lncRNA UCA1在宫颈癌组织中表达升高,UCA1水平高的患者生存时间短,并通过细胞试验发现Lnc-RNA UCA1通过靶向miR-155调控宫颈癌细胞EMT的发生[10]。LncRNA TP73-AS1宫颈癌细胞中上调,并能促进宫颈癌细胞的增殖和迁移能力,进一步的挽救试验证实TP73-AS1通过miR-329-3p/ARF1调控宫颈细胞的增殖和迁移,TP73-AS1可能成为一种新的宫颈癌调控因子[11]。LncRNA SOX2OT通过调控SOX2影响宫颈癌细胞的生长、迁移和侵袭[12]。有多种lncRNAs与宫颈癌发病机制相关,但现阶段SNHG12在宫颈癌中的相关作用机制暂未发现。
SNHG12作为一种新型lncRNA,近年来已发现在多种癌症中呈现异常高表达[13],比如SNHG12在卵巢癌组织中表达高于正常组织,同时高水平SNHG12卵巢癌患者的5年生存率明显低于低水平组[14]。Chen等[15]研究发现,lncRNA SNHG12通过海绵细胞miR-133b调控前列腺癌的预后并促进肿瘤的发生。Zhang等[16]研究发现SNHG12通过激活PI3K/AKT通路诱导胃癌发生。本研究中,发现SNHG12在宫颈癌组织和C33A、SiHa和CasKi等多种细胞株均高表达,说明SNHG12异常表达的变化情况可能和宫颈癌有密切关系。
相比较宫颈癌细胞C33A和CasKi,SNHG12在SiHa细胞表达最高,因此后续细胞试验以SiHa为目标细胞进行功能性试验,发现lncRNA SNHG12促进宫颈癌SiHa细胞的增殖、周期、侵袭、迁移及抑制凋亡,而干扰SNHG12则出现了相反的结论,可以抑制宫颈癌细胞的增殖、周期、侵袭、迁移并促进凋亡。说明SNHG12能够调控宫颈癌SiHa细胞的部分生物行为,参与宫颈癌的发生发展[17-19]。为了验证细胞试验的结论,利用SiHa细胞构建宫颈癌裸鼠移植瘤模型,发现过表达SNHG12促进了裸鼠肿瘤生长,干扰SNHG12则抑制了肿瘤生长。上调SNHG12的阳性信号显著高于正常对照组,而下调SNHG12则结论相反,提示SNHG12能加强增殖能力,促进肿瘤生长,而通过RNA干扰技术,沉默SNHG12后则能产生抗宫颈癌的调控机制。
综上所述,SNHG12促进SiHa细胞增殖、周期、侵袭、迁移及抑制凋亡,参与宫颈癌的发生发展。因此SNHG12可能成为宫颈癌诊断及治疗的新靶点。
