基于网络药理学及动物实验探讨欧李类黄酮成分抗骨质疏松作用
2023-05-30徐春晖张芳荣陈方会杜俊民
王 瑶,徐春晖,张芳荣,陈方会,杜俊民
基于网络药理学及动物实验探讨欧李类黄酮成分抗骨质疏松作用
王 瑶,徐春晖,张芳荣,陈方会,杜俊民*
(山西中医药大学中药与食品工程学院,晋中 030619)
为了定性分析欧李果实中的类黄酮成分,通过动物实验研究欧李类黄酮抗骨质疏松作用,并基于网络药理学探讨其作用机制。采用液相色谱-质谱联用法,对欧李果实类黄酮粉末进行成分分析,建立维甲酸小鼠骨质疏松模型,检测小鼠血清中Ca、StrACP、AKP、MDA、T-SOD等含量及股骨长度等物理指标。利用Swiss和PubMed挖掘活性成分靶点信息,通过GeneCards、OMIM、TTD和PharmGKB数据库得到骨质疏松相关靶点信息,将成分靶点和骨质疏松靶点取交集。使用STRING建立蛋白质-蛋白质相互作用(PPI)网络。使用DAVID对欧李果实类黄酮治疗骨质疏松作用靶点进行KEGG通路分析,绘制KEGG富集分析高级气泡图。利用Cytoscape软件构建欧李果实类黄酮治疗骨质疏松“活性成分-靶点”网络图。结果表明:欧李果实类黄酮粉末正离子模式下共检测到50 种活性成分;在小鼠骨质疏松模型中,欧李类黄酮显著提高血清钙和AKP水平,增强T-SOD活性,降低MDA含量及StrACP水平;基于网络药理学分析得到欧李果实类黄酮治疗骨质疏松作用前5 位KEGG通路主要是催乳素信号通路、内分泌抵抗、C型凝集素受体信号通路、甲状腺激素信号通路和血小板活化通路。参与上述5 个途径,其中,程度最高的靶向基因是。可见欧李果实类黄酮可以改善维甲酸引起的小鼠骨质疏松,其可能与、等靶基因有关。
欧李;类黄酮;抗骨质疏松;网络药理学
骨质疏松症是一种代谢性骨病,会导致骨折风险增加。骨质疏松症患者的骨微结构受损,导致骨密度降低和骨脆性增加[1]。绝经期妇女由于雌激素缺乏而导致的骨质流失被认为是骨质疏松的主要原因。目前激素替代疗法被广泛用于补偿骨质流失,但该过程伴随着严重的不良反应。因此,研发安全有效的新型合成产品,抵御与更年期相关的骨质疏松症的影响很有必要。
欧李是我国特有的果药兼用型树种[2],主要分布在黑龙江、吉林、内蒙古等干旱寒冷地区[3-4]。欧李果实营养十分丰富,特别是钙的含量居于所有水果之首,因此又称“钙果”[5-6],欧李果肉其他营养成分含量也较高,如氨基酸354.9 mg·100 g-1,总糖62.5 g·kg-1,它们和矿质元素、有机酸、类黄酮等一道形成酸甜可口、风味独特的口味,深受消费者的欢迎[7-8]。除钙含量外,果肉含有大量的多酚,是欧李关键的活性成分,它们具有抗氧化、抗菌、抗病毒和抗肿瘤等特性[9-10]。
白东海[11]研究发现欧李含有类黄酮,并且绝大多数品种欧李果实果皮类黄酮含量在10 ~ 30 mg·g-1范围内,但到目前为止,还尚未有人针对欧李中的黄酮类成分进行系统研究。课题组前期试验研究发现欧李类黄酮可提高小鼠骨密度,因此,本研究在此基础上,通过液相色谱-质谱联用法对欧李类黄酮成分进行分析,通过动物试验研究欧李类黄对骨质疏松药效作用,并基于网络药理学初步探讨欧李类黄酮抗骨质疏松作用机制,以期为今后临床应用及治疗骨质疏松症新药研发提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 欧李果实类黄酮(含量60.34 %)为实验室前期经提取纯化后粉末;维甲酸(HPLC ≥ 98 %)购自北京索莱宝科技有限公司;钙试剂盒(20220107)、抗酒石酸酸性磷酸酶(StrACP)(20220110)、碱性磷酸酶(AKP)(20211230)、总超氧化物歧化酶(T-SOD)(20211231)和丙二醛(MDA)(20220103)均购自南京建成生物工程研究所;复方葡萄糖酸钙口服液(国药准字H20193040)购自哈药集团三精制药股份有限公司。
1.1.2 仪器与设备 电子分析天平:上海赞维衡器有限公司(CP124C);超声波清洗仪:厦门明甬航自动化科技有限公司(JM-20D-40);BIOBASE-EL10系列酶标仪:济南济威医疗器械有限公司(SB25 -12DTS);游标卡尺:东莞市景有模具五金有限公司(0 ~150 mm);超速低温离心机:赛默飞(世尔)仪器有限公司(Legend Micro 17);线性离子阱-静电场轨道阱高分辨液质:赛默飞(世尔)仪器有限公司(LTQ ORBITRAP VELOS PRO)。
1.1.3 供试动物 清洁型雌性昆明小白鼠,60 只,体重(25±2.3)g,购于山西医科大学,饲养环境(22 ± 2)℃,相对湿度:45% ~ 65%,定期环境消毒。
1.1.4 网络药理学数据库 PubMed数据库(https:// pubmed.ncbi.nlm.nih.gov/),Swiss TargetPrediction数据库(http://www.swisstarget prediction.ch/),GeneCards数据库(https://www. gene cards.org/),在线人类孟德尔遗传(OMIM)数据库(https://www.ncbi.nlm.nih.gov/omim),TTD数据库(http://db.idrblab.net/ttd/),PharmGKB数据库(https://www.pharmgkb.org/),STRING数据库(https://cn.string-db.org/)和DAVID 数据库(https:// david.ncifcrf.gov/)。
1.2 方法
1.2.1 欧李果实类黄酮成分分析 (1)供试品制备方法。取欧李果实类黄酮纯化后样品0.1 g于离心管(10 mL)内,加入50%甲醇水溶液(8 mL),超声提取40 min(45 ℃),静置5 min,取上清液,13 000 r·min-1离心10 min,过微孔滤膜(0.22 μm),得到欧李黄酮提取液。同样条件得到空白对照样品。放入4 ℃冰箱保存,分析前取出(保存时间不能超过24 h)。
(2)色谱条件。色谱仪器为:UltiMate 3000 UHPLC。色谱柱为C18(1.8 μm,2.1mm×100 mm);柱温(45 ℃);流速(0.4 mL·min-1);进样量(4 μL);流动相采用乙腈﹣0.1 %甲酸水溶液的梯度洗脱程序,具体见表1。
(3)质谱条件。质谱仪器为LTQ ORBITRAP VELOS PRO, Thermo Fisher Scientific, San Jose, CA, USA。HESI源,正离子模式,离子源温度为350 ℃,毛细管温度为320 ℃,鞘气体积流量35 L·h-1,辅助气体积流量10 L·h-1,喷雾电压(4 kV),毛细管电压(35 V),管透镜电压(110 V),样品先进行全扫描,分辨率设为30 000,扫描范围(50 ~ 900),二级采用动态数据依赖性扫描(data dependent scan,DDS),选取上一级丰度前三强的峰进行碰撞诱导解离(CID)碎片扫描,以离子阱打拿极(dynode)检测。
1.2.2 维甲酸诱导的骨质疏松试验 (1)动物分组及维甲酸小鼠模型建立。将60 只小鼠随机分为6 组,分别为空白组、模型组(维甲酸组)、对照组(葡萄糖酸钙组)、低、中、高剂量组(58.5、117 和234 mg·kg-1),适应性喂养1 周,所有动物喂养条件一致。除空白组外,各组小鼠每天灌胃给予维甲酸(105 mg·kg-1),连续造模14 d后成功。模型组给予维甲酸,对照组给予葡萄糖酸钙(3.9 mL·kg-1)、低、中、高剂量组(58.5、117 和234 mg·kg-1)分别给予不同浓度的欧李果实类黄酮。小鼠每日/每千克给药量=成人每日给药量除以人体重70 kg×9.1,给药容积为0.02 mL·g-1。持续给药14 d。
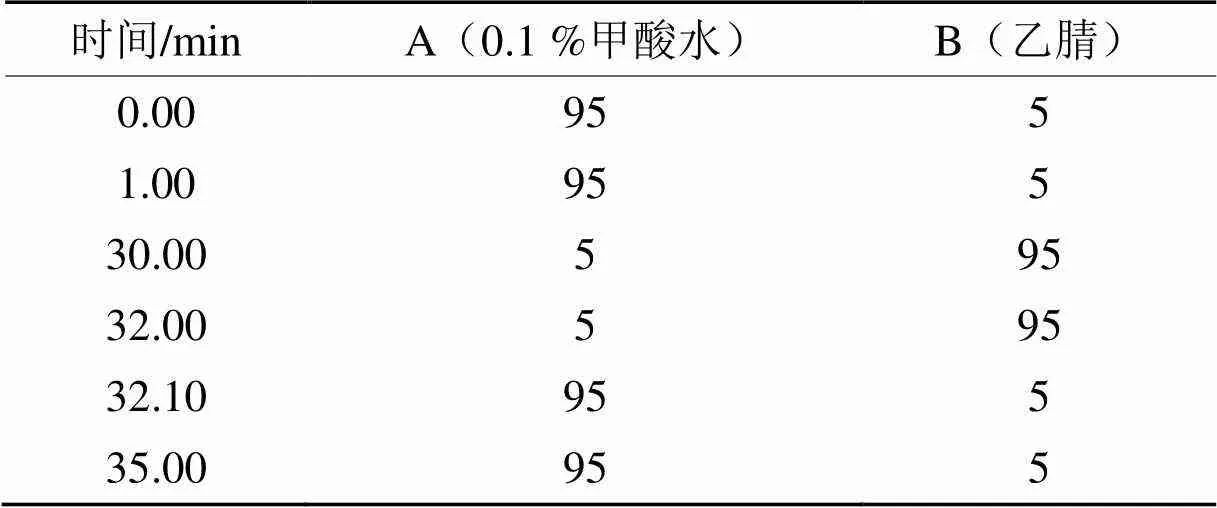
表1 流动相梯度洗脱程序
(2)检测指标。动物体质量:试验结束和开始时,称定动物体质量;脏器指数:取心、肝、脾、肺,肾称量,计算脏器指数;血清指标:血清钙、StrACP、AKP含量均按试剂盒说明进行测定;抗氧化指标:血清中MDA和T-SOD含量均按试剂盒说明进行测定;股骨计量学指标:小鼠股骨,用游标卡尺测量股骨长度(mm)及直径[12]。
1.2.3 网络药理学研究 (1)欧李果实类黄酮活性成分作用靶点的预测和筛选。通过文献查找,选取四乙酸-3-O-甲基槲皮素酯、橙皮素、2', 4', 5-三羟基-7-甲氧基异黄酮、5-O-甲基柚皮素、6-甲氧基柚皮素、5, 7, 4'-三羟基-8-甲基二氢黄酮、4'-羟基汉黄芩素、山奈素和2', 5, 7-三羟基-8-甲氧基黄烷酮9种成分,利用PubMed找取上述各活性成分的分子式,再用Swiss TargetPrediction数据库找取活性成分相关靶点。
(2)欧李果实类黄酮治疗骨质疏松靶点的预测和筛选。通过GeneCards、OMIM、TTD和PharmGKB数据库找取治疗骨质疏松的靶点,去除无效基因,汇总整理骨质疏松靶点。把骨质疏松作用靶点与欧李果实类黄酮成分作用靶点进行交集。
(3)蛋白质-蛋白质相互作用(PPI)数据。通过STRING获得与欧李果实类黄酮和骨质疏松的共同靶点直接或间接相互作用的相关蛋白。
(4)治疗骨质疏松靶点通路的注释分析。通过DAVID数据库进行KEGG通路分析计算和评价,探讨基因的功能注释和参与通路[13]。< 0.05时具有统计学意义。
(5)药物“活性成分-靶点”网络构建。把欧李果实类黄酮有效活性成分及其骨质疏松作用靶点的数据导入Cytoscape 3.7.1软件以构建欧李果实类黄酮抗骨质疏松的“活性成分-作用靶点”网络。
1.2.4 数据处理 计量资料以均数±标准差表示,采用SPSS16.0进行数据分析。
2 结果与分析
2.1 欧李果实类黄酮成分分析结果
通过数据库对活性成分目标物搜索:欧李黄酮提取物正离子模式下共检测到50种活性成分,按质谱响应强度排序依次为:四乙酸-3-O-甲基槲皮素酯、穗花杉双黄酮 7, 4', 7'', 4'''-四甲基醚、5,7-二羟基-3-(4-羟基苄基)色满-4-酮、巴西苏木素、樱花亭、5-O-甲基柚皮素、3-去氧苏木酮 B、异樱花亭、5, 7, 4'-三羟基-8-甲基二氢黄酮、Dihydrooroxylin、樱花素、异樱花素、瑞斯蒂酮、球松素、山姜素、美迪紫檀素、甘草甙元、异甘草甙元、2'-O-甲基异甘草甙元、2'-Methoxyisoliquiritigenin、4'-Hydroxy-4- methoxydalbergione、7, 3', 4'-三羟基-3-苄基-2H-苯并吡喃、羟基芫花素、鸢尾黄素、香叶木素、异山奈素、高车前素、4'-羟基汉黄芩素、山奈素、3'-O-甲基香豌豆苷元、2-羟基异樱黄素、koparin、鼠李柠檬素、金圣草(黄)素、3′-Hydroxymelanettin、2', 4', 5-三羟基-7-甲氧基异黄酮、小构树醇 B、光甘草醇、5,7-二羟基-6, 8-二甲基-3-(4'-羟基-3', 5'-二甲氧基苄基)色满-4-酮、麦冬二氢高异黄酮F、麦冬黄烷酮F、假马齿苋素 A3、艾纳香素、6-甲氧基柚皮素、2', 5, 7-三羟基-8-甲氧基黄烷酮、圣草酚-7-O-葡糖苷、橙皮素、苏木素、高圣草酚和3-Hydroxyvestitone(图1和表2)。
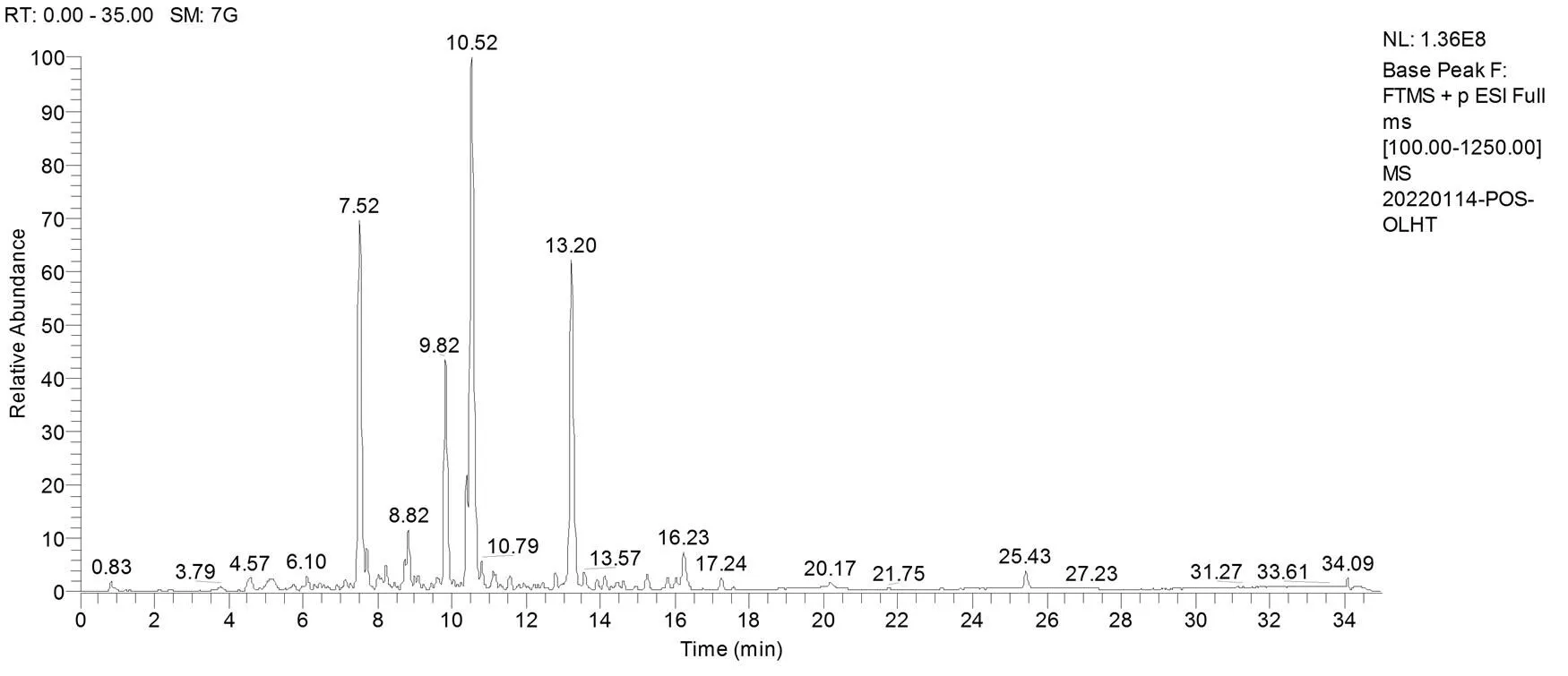
图1 欧李黄酮中药提取物正离子模式下总离子流图
Figure 1 Total ion flow diagram of flavonoid extracts fromunder positive ion mode
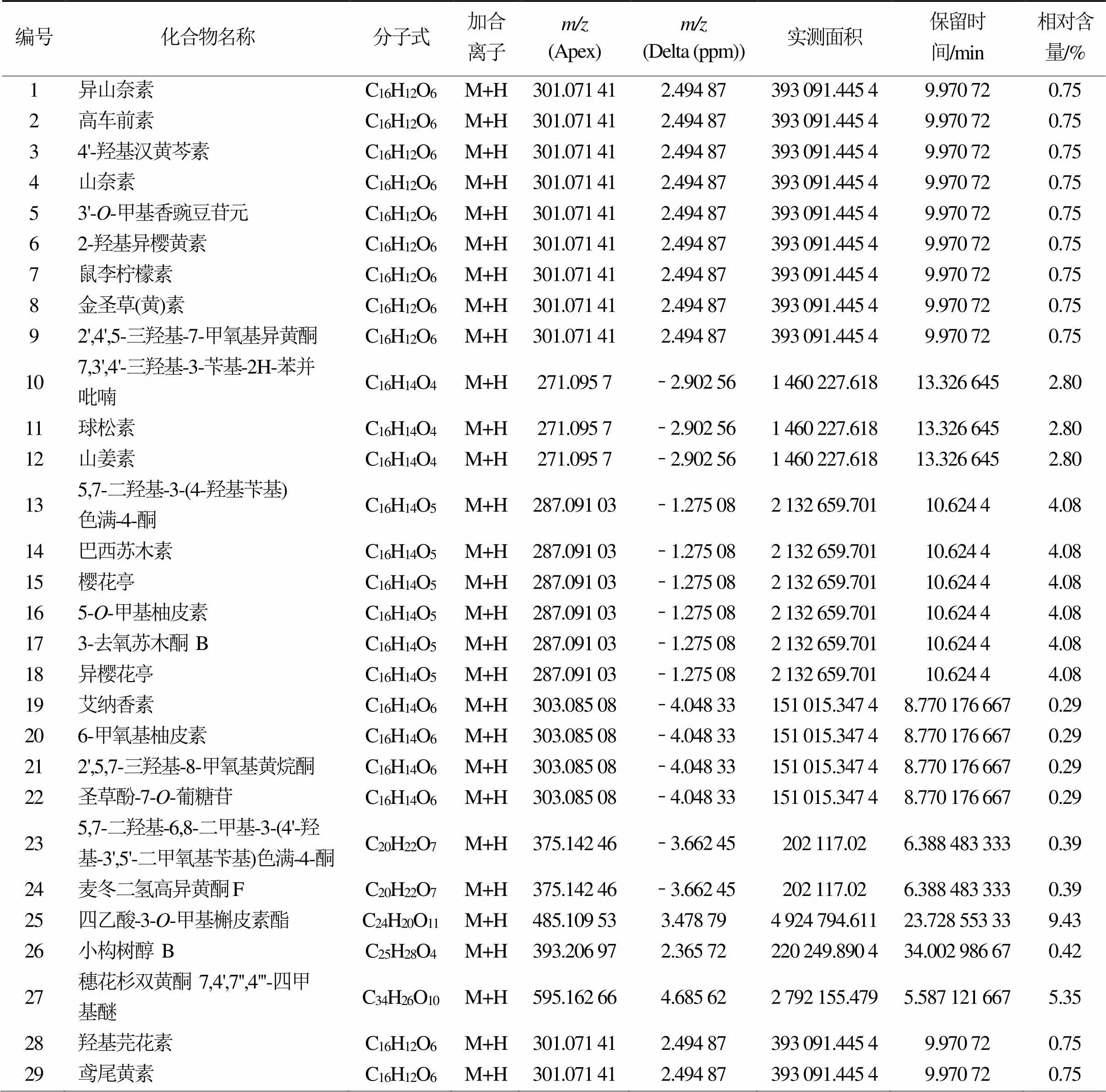
表2 黄酮检测成分详细信息
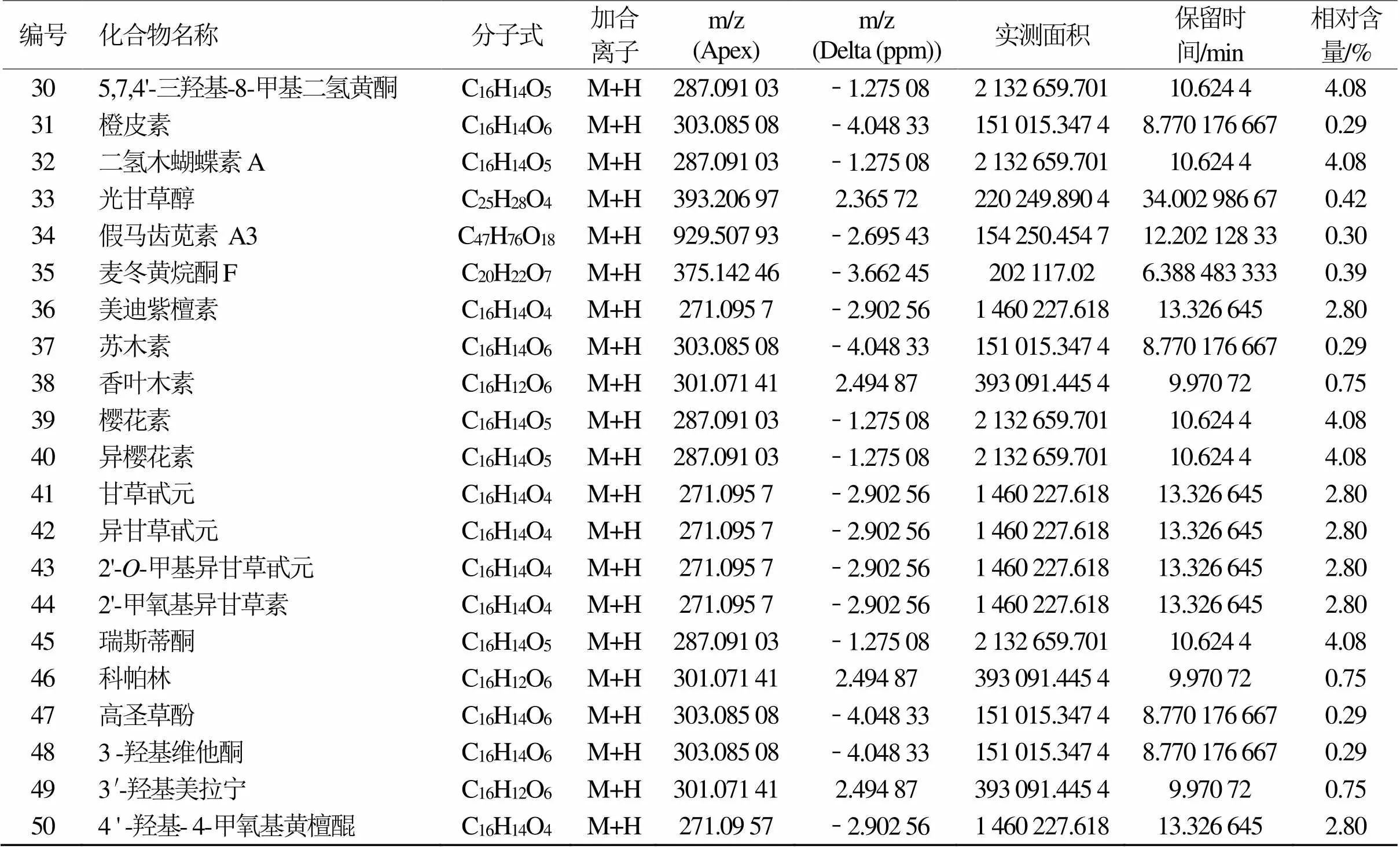
续表2
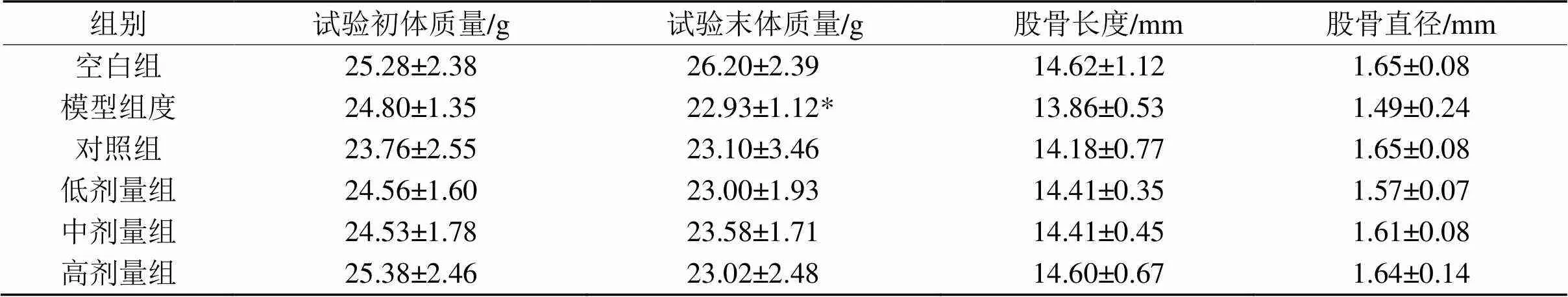
表3 小鼠体质量及股骨指标比较
注:与空白组相比,*<0.05,**<0.01;与模型组相比,#<0.05,##<0.01。下同。
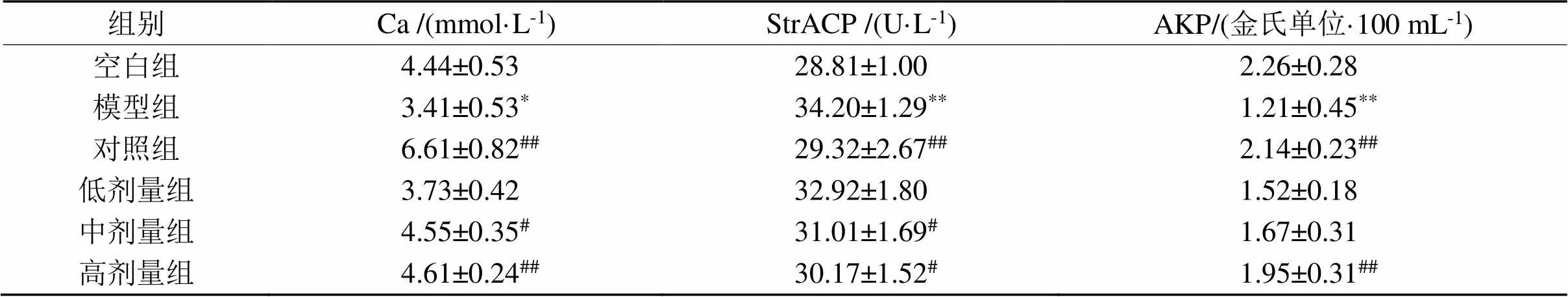
表4 欧李果实类黄酮对血清生化指标的影响

表5 欧李果实类黄酮对MDA和T-SOD的影响
2.2 欧李果实类黄酮抗骨质疏松试验结果
2.2.1 体质量、和股骨指标 如表3所示,试验末期,与空白组相比,模型组动物体质量下降,有显著性差异(< 0.05);股骨长度和股骨直径呈下降趋势,但无显著性差异;与模型组相比,欧李果实类黄酮低、中、高剂量组及对照组体质量无显著性差异,股骨长度和股骨直径呈上升趋势,但无统计学意义。
2.2.2 血液生化指标 如表4所示,与空白组比较,模型组血清Ca及AKP降低(< 0.05,< 0.01)StrACP升高(< 0.01)。与模型组相比,对照组血清Ca及AKP水平升高(< 0.01),StrACP降低 (< 0.01);欧李果实类黄酮中、高剂量组血清钙升高(< 0.05,< 0.01), AKP水平升高(< 0.01),StrACP水平均降低(< 0.05)。
2.2.3 血液抗氧化指标 由表5可知,与空白组相比,模型组MDA显著上升(< 0.01),T-SOD活性明显下降(< 0.01);与模型组相比,欧李类黄酮高剂量组MDA含量下降,T-SOD上升(< 0.05)。由此可知,欧李类黄酮能减少氧化应激及脂质过氧化所带来的损伤,达到较好的抗氧化作用。
2.2.4 脏器指数 如表6所示,与空白组相比,模型组肝脏指数有显著性差异(< 0.01),其余脏器指数无显著性差异;与模型组相比,阳性对照组、欧李果实类黄酮中、高剂量组肝指数都有显著性差异(< 0.05)。表明肝脏受到了一定的损伤。
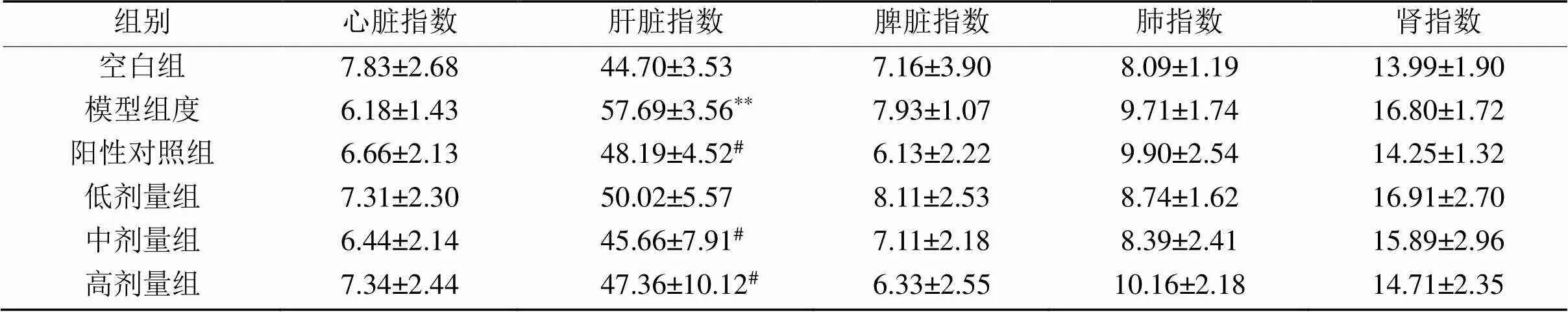
表6 各组脏器指数间比较

表7 欧李果实类黄酮有效化学成分

表8 欧李果实类黄酮与骨质疏松交集靶点
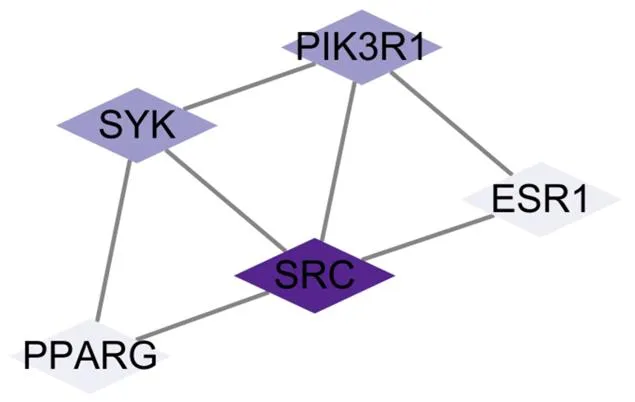
图2 欧李果实类黄酮治疗骨质疏松靶蛋白PPI网络图
Figure 2 PPI network of osteoporosis target protein treated with flavonoids fromfruit
2.3 网络药理学
2.3.1 欧李果实类黄酮潜在活性和靶点 将Swiss数据库的相关度设置值> 0,将目标预测方法给出的分数超过给定相关度分数的预测候选目标视为潜在目标,并将对其进行介绍和进一步分析。共得到4 个有效潜在目标(表7),并将每个潜在目标的靶点去除重复,共得到欧李果实类黄酮活性成分的靶点258 个(去除重复后)。
2.3.2 欧李果实类黄酮治疗骨质疏松靶点的预测和筛选 通过GeneCards数据库获得24 个靶基因,在线人类孟德尔遗传数据库(OMIM)数据库获得31 个靶基因、TTD数据库获得0 个靶基因和PharmGKB数据库获得3 个靶基因。为了更加精准的锁定骨质疏松疾病,把这4 个数据库进行整合,总共获得了58 个靶基因。为了获得欧李果实类黄酮对骨质疏松作用的候选靶点,我们将活性成分预测的258 个欧李果实类黄酮靶点与骨质疏松靶基因整合,得出欧李果实类黄酮活性成分与骨质疏松相关的潜在靶点(表8)。
2.3.3 蛋白质-蛋白质相互作用(PPI)数据 通过把欧李果实类黄酮活性成分对应的治疗骨质疏松的作用靶点导入STRING数据库,并结合Cytoscape软件构建欧李果实类黄酮治疗骨质疏松的PPI网络,具体见图2。共涉及节点数5 个,边数7 个,平均节点度为10.3,degree中位数为3。
2.3.4 KEGG通路分析 利用DAVID进行KEGG分析,共得到21 条KEGG通路。
通过DAVID软件数据库分析发现,该5 个靶点富集在21 条通路上(<0.05),将其结果绘制气泡图(图3),横坐标是富集在该条通路的基因数目,纵坐标是通路名称,颜色深浅代表值大小,点的大小代表通路富集基因的数量。KEGG富集分析中与骨质疏松相关的前五位KEGG通路分别是催乳素信号通路、内分泌抵抗、C型凝集素受体信号通路、甲状腺激素信号通路、血小板活化通路,详见表9。和参与了所有5 个途径。程度最高的靶向基因是。
Figure 3 KEGG enrichment analysis of flavonoids infruit against

表9 欧李类黄酮抗骨质疏松前5个KEGG通路和相关基因
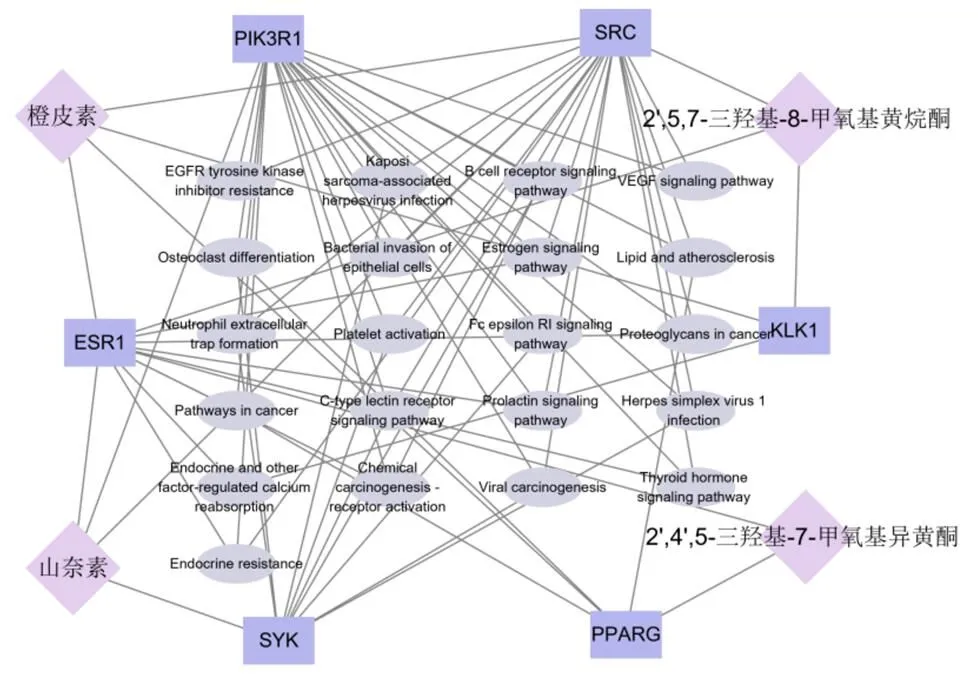
图4 欧李类黄酮治疗骨质疏松“活性成分-靶点”网络图
Figure 4 '' Active component - target '' network diagram offlavonoids in the treatment of
2.3.5 药物“活性成分-靶点”网络构建 利用Cytoscape软件构建欧李类黄酮治疗骨质疏松活性成分-靶点网络图。以58 个潜在作用靶点及4 个活性成分建立欧李类黄酮治疗骨质疏松活性成分-靶点网络图(图4),共包括31 个节点和70 个边条。
3 讨论与结论
骨质疏松症是一种代谢性骨病,由骨转换不平衡引起,导致骨折风险增加[14]。研究表明黄酮类化合物具有抗骨质疏松作用[15-16],晋楠[17]用欧李果实制品对改善大小鼠骨质疏松进行了实验,研究发现其可以促进小鼠对钙的吸收,改善骨质疏松。因此本研究采用液相色谱-质谱联用法分析欧李类黄酮成分,并在此基础上进行动物试验及网络药理学分析,进一步探讨其抗骨质疏松作用机制。
动物试验表明,欧李果实类黄酮可减少氧化所带来的的损伤,改善股骨长度和股骨直径;降低酸性磷酸酶活性,同时升高碱性磷酸酶活性,使成骨细胞骨合成与破骨细胞骨吸收处于平衡状态,达到抗骨质疏松的作用。碱性磷酸酶活性是成骨细胞早期发生的既定标志,在成骨细胞分化为成熟成骨细胞的整个过程中增加,随后在整个矿化期下降[18-19]。该蛋白在早期成骨形成过程中增长最快,被认为是筛选成骨活性的一个极好的标志物[20]。酸性磷酸酶活性被称为破骨细胞标志物,它的量在伴随病理性骨吸收的血清中被检测到升高。有证据表明,当破骨细胞以增加的速率被刺激进入吸收活动时,骨吸收的病理性增加就会出现,这破坏了骨吸收和骨合成之间的正常平衡[21]。
网络药理学研究发现欧李类黄酮靶向基因与骨质疏松症之间共有21 条KEGG通路。在21 条KEGG通路中,按值递增排名前5 位的分别是催乳素信号通路、内分泌抵抗、C型凝集素受体信号通路、甲状腺激素信号通路和血小板活化通路。基因和参与了所有5 条KEGG通路,因此它们被认为是中枢基因。可调节细胞代谢、存活和增殖。有研究表明,在巨噬细胞介导的先天免疫中发挥着多种作用,如吞噬作用、炎性细胞因子/介质的产生和细胞迁移的诱导。巨噬细胞参与多种免疫反应和炎症性疾病,包括动脉粥样硬化、糖尿病、癌症和骨质疏松症等[22]。是与骨形成密切相关的成骨细胞和破骨细胞分化的关键介质。Zhu等[23]发现的上调增强了成骨细胞分化,降低了破骨细胞相关基因的水平;相反,的下调降低了成骨细胞相关基因的水平,增加了破骨细胞相关基因的水平。通过调节成骨细胞分化和破骨细胞形成来维持骨稳态。
综上所述,欧李果实类黄酮可以通过促进成骨细胞生成和抑制破骨细胞生成来改善骨质疏松症。其主要可能通过调节催乳素信号通路、内分泌抵抗通路发挥其抗骨质疏松功能。
[1] SŁUPSKI W, JAWIEŃ P, NOWAK B. Botanicals in postmenopausal osteoporosis[J]. Nutrients, 2021, 13(5): 1609.
[2] 师建华, 曹军合, 徐立军. 欧李果实营养成分分析与评价[J]. 河北林业科技, 2021(2): 23-26.
[3] 曹慧琴, 刘姝韵, 王桂瑛, 等. 欧李营养与开发利用[J]. 农产品加工, 2015(24): 70-72.
[4] 张鑫, 李瑞玲, 孙学茹, 等. 超声波辅助提取欧李仁中苦杏仁苷的工艺优化[J]. 食品与机械, 2018, 34(10): 163-168.
[5] 李欧, 李卫东, 胡璇, 等. 欧李果实多酚含量的差异比较[J]. 中国实验方剂学杂志, 2012, 18(22): 53-56.
[6] YU J F, LOU Q, ZHENG X Y, et al. Sequential combination of microwave- and ultrasound-assisted extraction of total flavonoids fromlour. flowers[J]. Molecules, 2017, 22(12): 2216.
[7] 李宗朔, 吴大勇, 顾金瑞, 等. 中国特有植物欧李不同种质果肉中多酚含量和总抗氧化活性差异及其聚类分析[J]. 中国野生植物资源, 2018, 37(5): 10-15.
[8] KOZŁOWSKA A, SZOSTAK-WEGIEREK D. Flavonoids: food sources and health benefits[J]. Rocz Panstw Zakl Hig, 2014, 65(2): 79-85.
[9] CIUMĂRNEAN L, MILACIU M V, RUNCAN O, et al. The effects of flavonoids in cardiovascular diseases[J]. Molecules, 2020, 25(18): 4320.
[10] KANDASWAMI C, LEE L T, LEE P P H, et al. The antitumor activities of flavonoids[J]. In Vivo, 2005, 19(5): 895-909.
[11] 白东海. 欧李果实类黄酮物质提取、组分鉴定及抗氧化能力研究[D]. 太谷: 山西农业大学, 2015.
[12] 张念军, 区作明, 李雪, 等. 骨宝丸对维甲酸诱导小鼠骨质疏松的防治作用及机制探讨[J]. 中国骨质疏松杂志, 2020, 26(7): 937-941, 977.
[13] HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nat Protoc, 2009, 4(1): 44-57.
[14] YU T, XIONG Y, LUU S, et al. The shared KEGG pathways between icariin-targeted genes and osteoporosis[J]. Aging, 2020, 12(9): 8191-8201.
[15] PRASAIN J K, CARLSON S H, WYSS J M. Flavonoids and age-related disease: risk, benefits and critical windows[J]. Maturitas, 2010, 66(2): 163-171.
[16] WONG S K, CHIN K Y, IMA-NIRWANA S. The osteoprotective effects of kaempferol: the evidence from in vivo and in vitro studies[J]. Drug Des Dev Ther, 2019, 13: 3497-3514.
[17] 晋楠. 欧李果实制品预防及改善大小鼠骨质疏松研究[D]. 太谷: 山西农业大学, 2019.
[18] AUBIN J E, LIU F, MALAVAL L, et al. Osteoblast and chondroblast differentiation[J]. Bone, 1995, 17(2): 77S-83S.
[19] MIRON R J, ZHANG Y F. Osteoinduction: a review of old concepts with new standards[J]. J Dent Res, 2012, 91(8): 736-744.
[20] FOSTER L J, ZEEMANN P A, LI C, et al. Differential expression profiling of membrane proteins by quantitative proteomics in a human mesenchymal stem cell line undergoing osteoblast differentiation[J]. Stem Cells, 2005, 23(9): 1367-1377.
[21] YAM L T. Clinical significance of the human acid phosphatases: a review[J]. Am J Med, 1974, 56(5): 604-616.
[22] BYEON S E, YI Y S, OH J, et al. The role of Src kinase in macrophage-mediated inflammatory responses[J]. Mediators Inflamm, 2012, 2012: 512926.
[23] ZHU H T, CHEN H, DING D G, et al. Overexpression of PIK3R1 promotes bone formation by regulating osteoblast differentiation and osteoclast formation[J]. Comput Math Methods Med, 2021, 2021: 2909454.
Anti-osteoporosis effect of flavonoids frombased on network pharmacology and animal experiments
WANG Yao, XU Chunhui, ZHANG Fangrong, CHEN Fanghui, DU Junmin
(College of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 031619)
To study the anti-osteoporosis effect of flavonoids fromfruit by animal experiment and explore its mechanism based on network pharmacology, HPLC-MS was used to analyze the components of flavonoids powder fromfruit. The osteoporosis model of retinoic acid mice was established to detect the contents of Ca, StrACP, AKP, MDA, T-SOD in serum and physical indexes such as femur length. Swiss and PubMed were used to mine the target information of active components. The information of osteoporosis-related targets was obtained through GeneCards, OMIM, TTD and PharmGKB databases, and the component targets and osteoporosis targets were intersected. STRING was used to establish protein-protein interaction (PPI) networks. DAVID was used to analyze the KEGG pathway of flavonoids fromfruit in the treatment of osteoporosis, and the high-level bubble diagram of KEGG enrichment analysis was plotted. Cytoscape software was used to construct the “active ingredient-target” network diagram of flavonoids fromfruit in the treatment of osteoporosis. As results, a total of 50 active components were detected in the positive ion mode of flavonoids powder fromfruit. In the osteoporosis model of mice, the contents of serum calcium and AKP were significantly increased, the activity of T-SOD was enhanced, and the content of MDA and the level of StrACP were decreased. Based on network pharmacology analysis, the top five KEGG pathways in the treatment of osteoporosis by flavonoids fromfruit were mainly prolactin signaling pathway, endocrine resistance, C-type lectin receptor signaling pathway, thyroid hormone signaling pathway, and platelet activation pathway.andwere involved in these five pathways, and the target gene with the highest degree was. In conclusion, flavonoids can improve the osteoporosis induced by retinoic acid in mice, which may be related to target genes such asand.
; flavonoids; anti-osteoporosis; network pharmacology
R282.71; S662.309.9
A
1672-352X (2023)02-0356-08
2022-05-09
山西省科技厅重点研发项目(201703D221028-2)和校级项目(2020PY-ZH-05)共同资助。
王 瑶,硕士研究生。E-mail:y18795873421@163.com
通信作者:杜俊民,博士,教授。E-mail:dujmtcm@163.com
10.13610/j.cnki.1672-352x.20230511.004
2023-05-12 10:34:36
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230511.1150.008.html
