贮前热水处理对低温贮藏西葫芦不同组织抗冷性和抗氧化系统的影响
2023-05-30李奇勋李玉申王红婷
李奇勋,张 敏, 2, 3*,贾 淼,李玉申,王红婷
贮前热水处理对低温贮藏西葫芦不同组织抗冷性和抗氧化系统的影响
李奇勋1,张 敏1, 2, 3*,贾 淼1,李玉申1,王红婷1
(1. 上海海洋大学食品学院,上海 201306;2. 食品科学与工程国家级实验教学示范中心(上海海洋大学),上海 201306;3. 上海冷链装备性能与节能评价专业技术服务平台,上海 201306)
为探究热水处理对低温逆境下西葫芦不同组织活性氧代谢的影响,选用‘绿丰’西葫芦为供试材料,采用42 ℃热水中浸泡30 min,并以室温下(20 ± 1)℃未经处理的西葫芦为对照,处理后转移至(4 ± 0.5)℃、相对湿度(80 ± 5)%低温环境下贮藏,将西葫芦按不同组织划分为外果皮、中果肉和内果心进行测定。结果表明,中果肉和内果心有较高的可溶性固形物含量并得以有效维持,而内果心在同期组织中保持有显著最高的相对电导率,并且西葫芦在贮藏5 d后外表皮更容易积累过氧化氢(H2O2)和超氧阴离子自由基O2·-,同时带动抗坏血酸( ascorbic- acid,AsA)、谷胱甘肽(reduced glutathione,GSH)非酶物质含量的上升,并有效激发5 d后过氧化氢酶( catalase,CAT)、超氧化物歧化酶( superoxide dismutase,SOD)和过氧化物酶( peroxidase,POD)的活性,提升了可溶性蛋白含量。此外,研究发现该热处理可有效减轻西葫芦果实冷害,延缓果实衰老,减轻氧化损伤,提高贮藏品质。该研究结果可为果蔬采后贮藏保鲜提供一定的实验参考与技术借鉴。
西葫芦;不同组织;热水处理;活性氧;抗氧化酶
西葫芦(L. cv)俗称番瓜、白瓜等,为葫芦科南瓜属,于19世纪中叶引入栽培,是我国主要食用的蔬菜之一[1]。西葫芦具有清热止咳、提高免疫力的作用,并以营养丰富、口感脆嫩的特点深受人们青睐[2]。但西葫芦采摘后由于新陈代谢旺盛等因素,极易引起果实表皮皱缩、口感下降、营养物质流失等[3]。低温贮藏是目前最常见的果蔬保鲜方式,低温环境下可以减少水分流失,降低果蔬机体呼吸和代谢速率,一定程度上缓解果实的腐败衰老进程。但是西葫芦属于典型的冷敏性果实,温度过低或贮藏过久都会造成褐斑、凹陷、果肉失去弹性等冷害现象[4],因此对西葫芦进行采后低温贮藏的同时,还需要采取一定的措施。
热处理是低温贮藏减轻冷害常用的方法。程玉娇等[5]选用52 ℃热水处理血橙2 min后,显著提高了血橙果皮SOD、POD和CAT的活性,较好地维持硬度和营养品质;李英等[6]研究发现50 ℃热水处理红肉火龙果可以抑制果实SOD和POD活性的下降,有效缓解了可溶性固形物和失重率的降低;盖晓阳等[7]用不同湿度热空气处理西葫芦果实,抑制中果肉丙二醛( malondialdehyde,MDA) 、相对电导率的上升,缓解了AsA含量的下降;Endo等[8]通过45℃热水处理成熟青梅5 min增强了在低温贮藏期间果肉抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和CAT的活性,降低了果实表皮冷害,提高了采后品质。诸多研究表明热处理可以减轻冷害、提高抗冷性、延长货架期,这些在黄瓜[9]、青椒[10]、桃子[11]、柑橘[12]等果蔬中均有报道。然而,目前对于热处理的研究多局限于减轻低温贮藏果蔬冷害的整体影响,但热处理对果实不同组织之间抗冷性的影响却鲜有报道。
基于此,本研究以‘绿丰’西葫芦为供试材料,将西葫芦果实划分为内果心、中果肉和外果皮,选取42 ℃热水处理30 min,测定西葫芦膜脂氧化进程及相关活性氧清除酶活性,探究热处理对低温贮藏西葫芦不同组织抗氧化系统的影响,旨在为热处理对果实抗冷性机理及贮藏保鲜应用研究提供一定的参考。
1 材料与方法
1.1 供试材料与仪器
选用‘绿丰’西葫芦为供试材料,2021年12月采购于上海市浦东新区临港新城果蔬种植园,挑选果皮无机械损伤、成熟度一致、尺寸大小相近(直径为6 cm ± 0.5 cm,长度为19.5 cm ± 0.5 cm)的西葫芦,并在当天采摘送至实验室。
BPS-100CA 型恒温恒湿箱,上海一恒科学仪器有限公司;WT-B 型电子天平,杭州万特衡器有限公司;AUW320 型分析天平,上海亚津电子科技有限公司;WYA-2S 型数字型阿贝折射仪,上海精密仪器仪表有限公司;DDS-307 型电导率仪,上海笛柏实验设备有限公司;THZ-82A 型恒温振荡箱,江苏省金坛市环宇科学仪器厂;H-2050R-1 型高速冷冻离心机,长沙湘仪离心机有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 试验设计
取出样品西葫芦用清水冲洗后拭干表面,将西葫芦置于恒温水浴箱中,根据前期试验结果筛选,选用42 ℃热水处理30 min,取出后晾干表面,再于室温环境下(20 ± 1)℃复温2 h,用表面打孔、厚度约为0.03 mm的聚乙烯薄膜包装,每3根西葫芦装一个袋子,之后立即移至温度为(4 ± 0.5) ℃、相对湿度为(80 ± 5) %的低温冷库中贮藏,贮藏时间为15 d。每隔5 d分别测定冷害指数、相对电导率、可溶性固形物、可溶性蛋白、AsA、GSH、H2O2、O2·-、SOD、CAT和POD。冷害指数每个处理组随机选取6根,其余指标每个处理组随机选取3根,每次重复3次,共180根西葫芦,分别对西葫芦热处理组和CK组的内果心、中果肉、外果皮进行取样测定。
1.3 试验方法
1.3.1 冷害指数和相对电导率测定 冷害指数(chilling injury,CI)参照Zhang等[13]的方法进行测定,根据观察西葫芦出现的凹陷和水渍斑的面积进行分级(表1),再结合公式(1)进行冷害指数的计算。

表1 冷害等级的划分

相对电导率的测定方法参考李佳乐等[9]的略作修改。西葫芦切成均匀薄片,用打孔器取出10片大小相同的组织圆片,经去离子水反复冲洗3次后放入烧杯中,准确加入20 mL 0.25 mol·L-1的甘露醇溶液测定溶液电导率,记录为0(记录温度20±1)℃。室温下振荡1.5 h,再次测量溶液的相对电导率记录为1。测量后转移至100 ℃沸水中蒸20 min,取出后待溶液冷却至室温时,再次测量相对电导率并记录为2。根据式(1)计算相对电导率并重复3次。
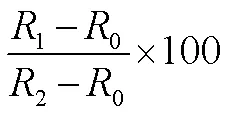
1.3.2 可溶性蛋白、可溶性固形物、AsA含量的测定 可溶性蛋白参照曹建康等[14]的方法进行测定。称取1 g西葫芦组织样品,加入2.5 mL蒸馏水充分研磨,于8 000×g离心20 min后,于280 nm处测量上清液吸光度,测量结果以mg·mL-1表示,重复3次。
可溶性固形物参照曹建康等[14]的方法进行测定。冰浴条件下研磨至匀浆,用阿贝折射仪测定样品液中的质量分数,测量结果用 % 表示,重复3次。
AsA含量参照曹建康等[14]的方法进行测定,采用 2,6-二氯酚靛酚滴定法,根据溶液滴定终点的消耗量计算出抗坏血酸含量,计算结果以mg·kg-1表示,重复3次。
1.3.3GSH、H2O2和O2·-含量的测定GSH含量测定参考南京建成试剂盒说明书,称取1 g西葫芦组织冰浴研磨,同时离心管中加入pH 7.2的磷酸钠缓冲液4 mL,经8 000×g离心20 min后吸取上清液,按操作表于420 nm处记录吸光度,测量结果以U·g-1表示,重复3次。
H2O2含量测定参考南京建成试剂盒说明书,称取1 g西葫芦组织冰浴研磨,同时离心管加入pH 7.2的磷酸钠缓冲液1 mL ,经8 000×g离心20 min后吸取上清液,按操作表于405 nm处记录吸光度,测量结果以mmol·g-1表示并重复3次。
O2·-含量测定参考南京建成试剂盒说明书,称取1 g西葫芦组织冰浴研磨,同时离心管加入pH 7.2的磷酸钠缓冲液4 mL,经8 000×g离心20 min后吸取上清液,按操作表于550 nm处记录吸光度,定义每克西葫芦组织抑制相当于1 mg的维生素C,所抑制的O2·-的变化值为一个活力单位,测量结果以U·g-1表示并重复3次。
1.3.4CAT、SOD和POD活性的测定CAT活性参考曹建康等[14]的方法进行测定。按照2.9 mL 20 mmol·L-1H2O2溶液和100 μL西葫芦组织提取液组成酶促反应体系,在波长240 nm处记录反应的吸光度值,定义每克组织样品每分钟吸光度变化值减少0.01为1个CAT活性单位,测量结果以U·g-1表示并重复3次。
SOD活性参考南京建成试剂盒说明书进行测定,称取0.5 g西葫芦组织冰浴研磨,同时离心管加入pH 7.2的磷酸钠缓冲液4.5 mL,经8 000×g离心20 min后吸取上清液,按操作表在550 nm处记录吸光度,测量结果以U·g-1表示并重复3次。
POD活性参考南京建成试剂盒说明书进行测定,称取1 g西葫芦组织冰浴研磨,同时离心管加入pH 7.2的磷酸钠缓冲液4 mL,经8 000×g离心20 min后吸取上清液,按操作表在420 nm处记录吸光度,定义1 μg底物被每毫克组织蛋白质每分钟催化的酶量为一个酶活单位,测量结果以U·g-1表示并重复3次。
1.4 数据分析
选用SPSS 24.0 对试验数据进行单因素方差分析并结合Duncan 多重比较,显著性水平设为0.05,采用WPS 2020处理数据并作图,图表结果均为平均值±标准差。
2 结果与分析
2.1 热水处理对西葫芦冷害指数的影响
西葫芦在低温贮藏中会出现凹陷、水渍斑等冷害症状,而冷害指数可以直接反映出果实受冷害而损伤的严重程度。如图1所示,冷害指数随着贮藏时间的延长呈现上升趋势,热处理组和CK组均在第5 天产生不同程度的冷害症状,并且在贮藏中后期,CK组冷害指数的上升速率明显增大,同比热处理组增长速率高出42.5%。在贮藏末期CK组冷害指数是处理组的1.6倍,并且两组之间有显著差异,说明在贮藏末期CK组西葫芦产生了更为严重的冷害症状,这也同样说明了果蔬经热处理后可有效减轻低温贮藏的冷害,保持果蔬品质。
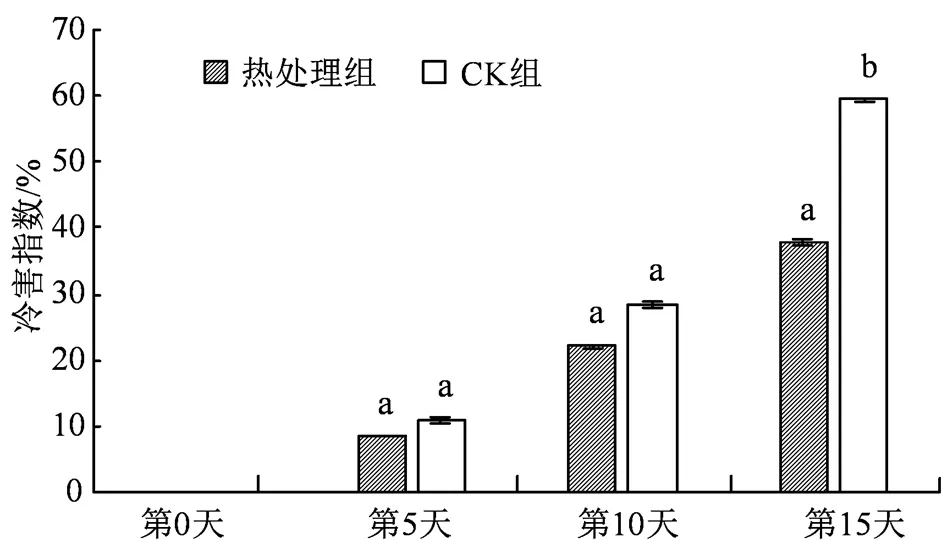
图中不同字母表示处理组间存在显著性差异(P<0.05),下同。
Figure 1 Effect of hot water treatment on chilling injury index of zucchini
2.2 热水处理对西葫芦不同组织电导率的影响
果蔬受到冷害时,会增大细胞膜的通透性,加剧电解质外渗,而相对电导率越大则表明细胞受损越严重[15]。如图2所示,处理组内果心在贮藏期间平均增长速率高达78.6%并始终保持着显著性上升(< 0.05),中果肉的平均增长速率为56.9%,且在5 d后有较为显著地升高,而外果皮以14.1%的平均增长速率处于最低水平且仅有轻微涨幅,并且内果心和中果肉均在第10 天后有较为明显的涨幅;此外,在同时期不同组织上存在显著差异,整体电导率从内部到外部逐渐降低,特别是内果心部分显著高于其余部分的电导率(< 0.05);在贮藏15 d时,处理组外果皮和中果肉部分的电导率分别为7.21%和12.62%,而内果心的电导率高达20.81%,CK组相比较则更高,比处理组内果心电导率高出16.1%。同CK组相比,同期的热处理组能一定程度上减缓电导率的上升,可能是因为热处理后降低了果实的冷害程度,果实整体状况优于未处理组,细胞膜的完整性得到了较好地维持,并且减缓了膜脂过氧化程度[16]。
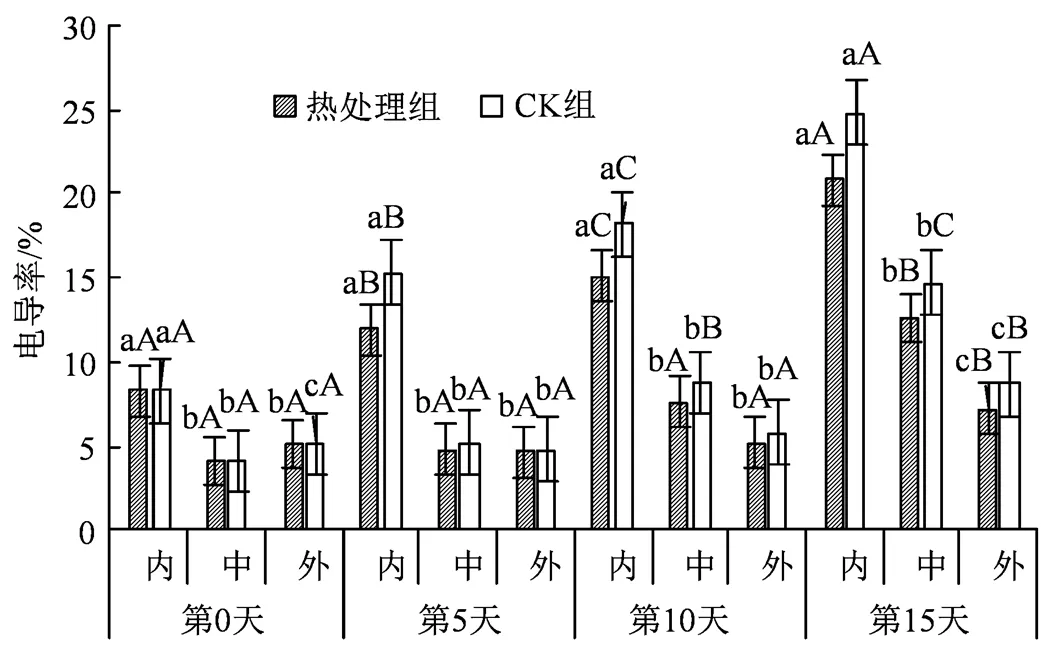
图2 热水处理对不同组织电导率的影响
Figure 2 Effects of hot water treatment on electrical conductiv- ity of different tissues
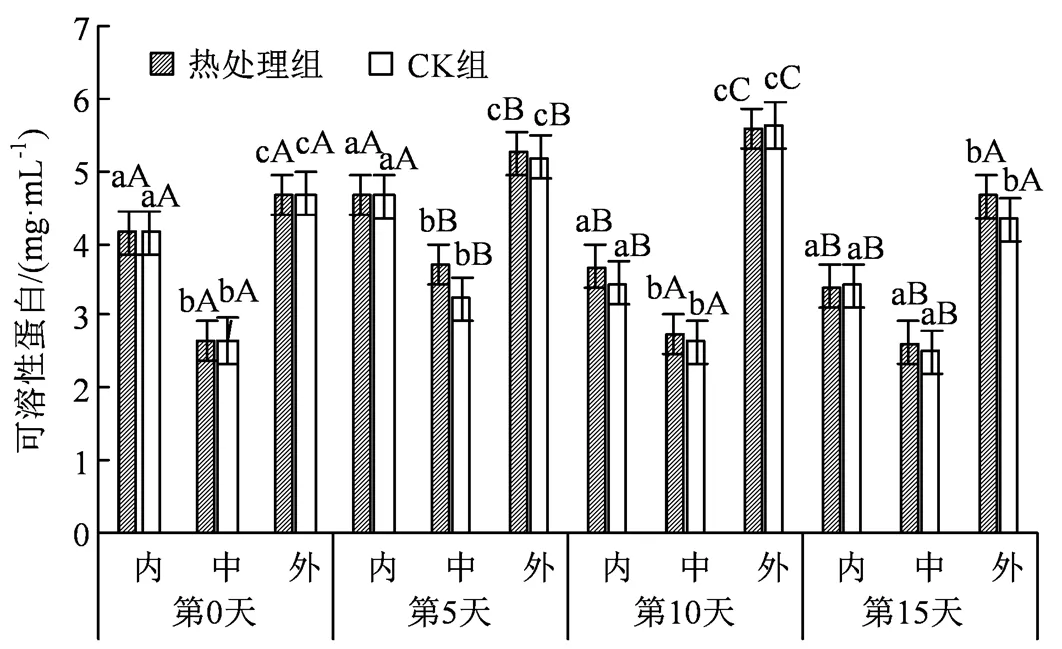
图3 热水处理对不同组织可溶性蛋白的影响
Figure 3 Effects of hot water treatment on soluble protein in different tissues
2.3 热水处理对西葫芦不同组织可溶性蛋白和可溶性固形物含量的影响
可溶性蛋白能够提高细胞的保水能力,同时也是植物体内不可缺失的营养物质,与果蔬的成熟衰老、抗冷性等密切相关,同时参与调控果蔬多种生理生化过程[17]。图3显示西葫芦果实可溶性蛋白在贮藏期间有先上升后下降的趋势,在贮藏第5天,所有组均有11.13%左右的涨幅,在处理组中果肉部分甚至有39.6%的涨幅,可能是西葫芦在面临逆境胁迫时机体自身合成了一些小分子蛋白[18]。由于持续的低温破坏了果实内部的合成酶系统,在贮藏中后期(5 ~ 15 d)时开始整体下滑,处理组内果心由第5天时的4.67 mg·mL-1下降到第15天时的3.40 mg·mL-1,下降了27.26%;处理组外果皮由第10天时的5.24 mg·mL-1下降到第15天时的4.65 mg·mL-1,下降了11.26%。
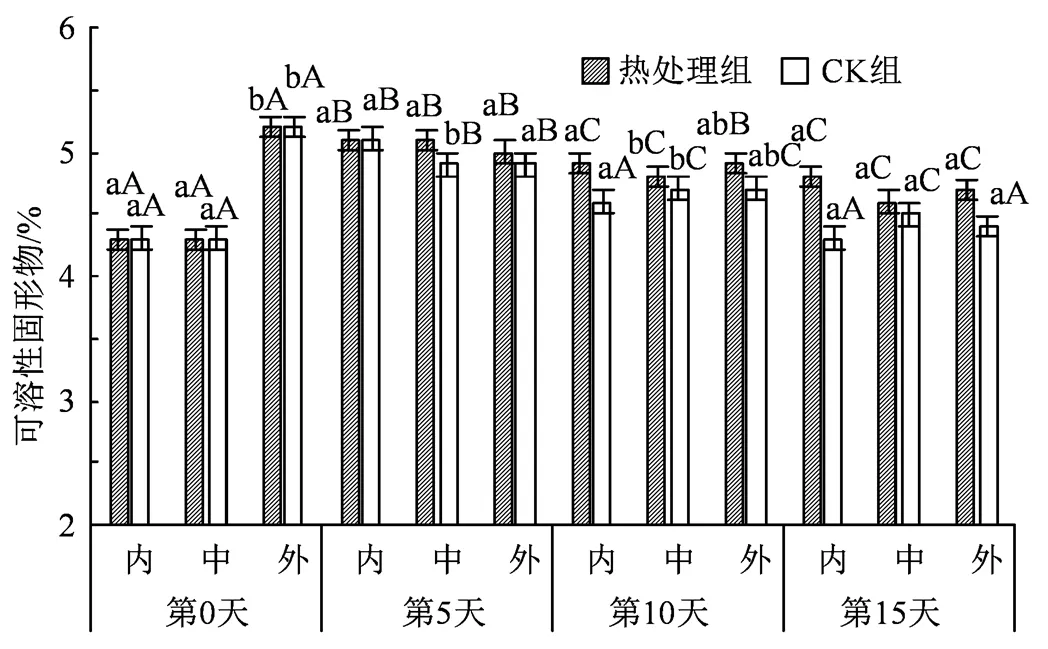
图4 热水处理对不同组织可溶性固形物的影响
Figure 4 Effects of hot water treatment on soluble solid in different tissues
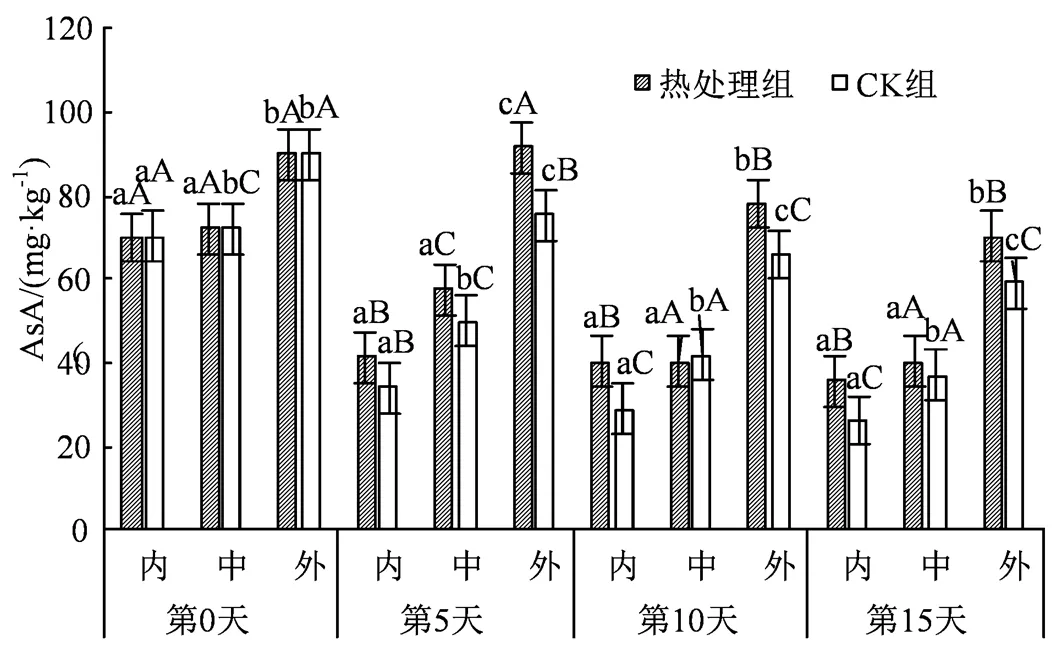
图5 热水处理对不同组织AsA含量的影响
Figure 5 Effects of hot water treatment on AsA content in different tissues
可溶性固形物的含量反映了机体贮藏过程中的物质变化,而较高的可溶性固形物含量也能增强果蔬在低温贮藏时产生的抗冷性[19]。从图4中可以看出,可溶性固形物在前期随贮藏时间的延长呈现出正相关,并于贮藏5 d后,开始有一定的下降,这一趋势同Nasef[21]采用短时热处理黄瓜果实的结果相似。贮藏中后期不同组织之间并无显著差异,内果心和中果肉在贮藏期间有6.9%左右的涨幅,而外果皮则在贮存期间持有轻微幅度下降,在第15天时可溶性固形物含量为4.7%,相较于0 天时下降了10.63%;同期同组织中,热处理后的西葫芦在可溶性固形物上优于未处理组,整体含量上高出4.97%。在贮藏末期,处理组内果心、中果肉和外果皮的可溶性固形物含量占比分别比CK组高出13.95%、2.22%和6.82%。结果说明处理组可溶性固形物得到较好地维持,这可能由于热处理降低了西葫芦果实内部物质降解和呼吸消耗综合速率,并在第5 天堆积达到可溶性固形物含量峰值。
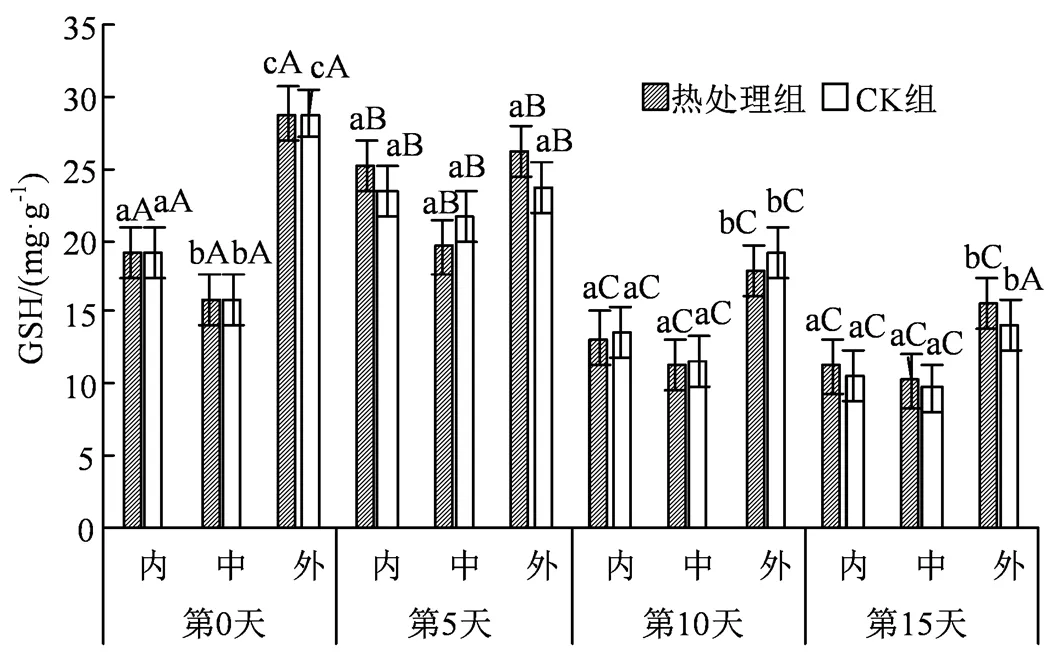
图6 热水处理对不同组织GSH含量的影响
Figure 6 Effects of hot water treatment on GSH content in different tissues
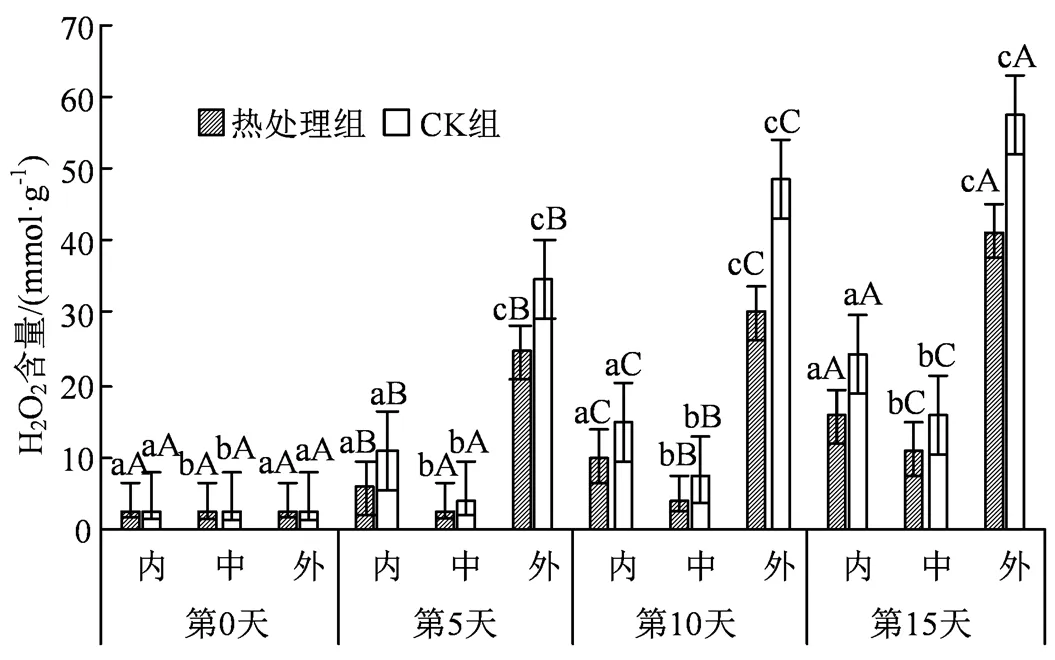
图7 热水处理对不同组织H2O2含量的影响
Figure 7 Effects of hot water treatment on H2O2content in different tissues
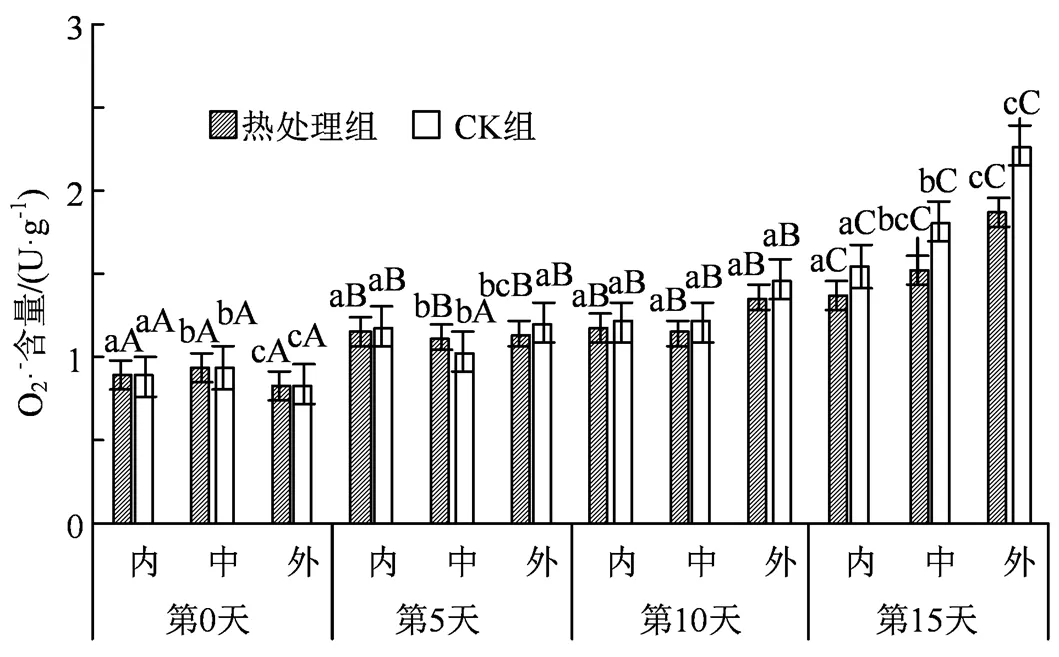
图8 热水处理对不同组织O2·-含量的影响
Figure 8 Effects of hot water treatment on O2·-content in different tissues
2.4 热水处理对西葫芦不同组织AsA和GSH含量的影响
AsA广泛存在于新鲜果蔬中,是一种高活性物质,有延缓果实衰老的效果,同时能保护组织细胞免受膜脂氧化作用,又可以作为抗逆境的重要生理指标。随着电导率的上升,可溶性固形物等的下降,AsA呈现出逐渐下降的走势,且内果心和中果肉在第5天左右有显著下降(< 0.05),而外果皮也在第5天后显著下降,并且处理后的西葫芦在AsA含量上有一定优势(图5)。结果说明热水处理可以减缓AsA的下降,缓解果实衰老。另外整体上可以看出AsA含量从外到内开始递减,外部AsA在同时期组中均处于最高水平,且下降幅度最慢,这一结论与周毅刚[22]、Bashir[23]等的研究结果相一致。
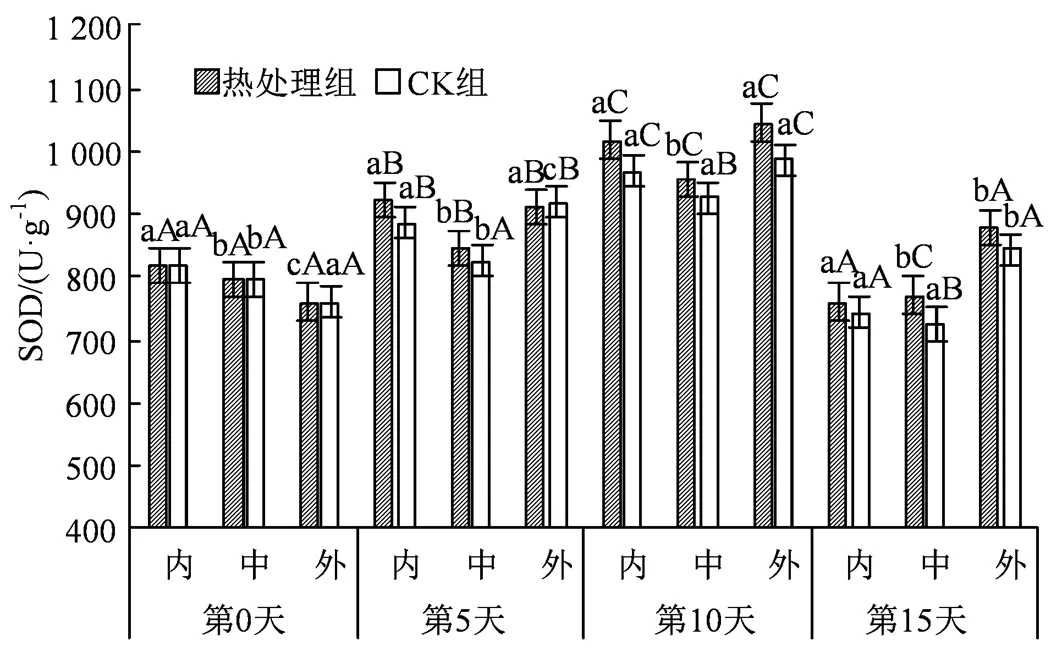
图9 热水处理对不同组织SOD活性的影响
Figure 9 Effects of hot water treatment on SOD activity in different tissues
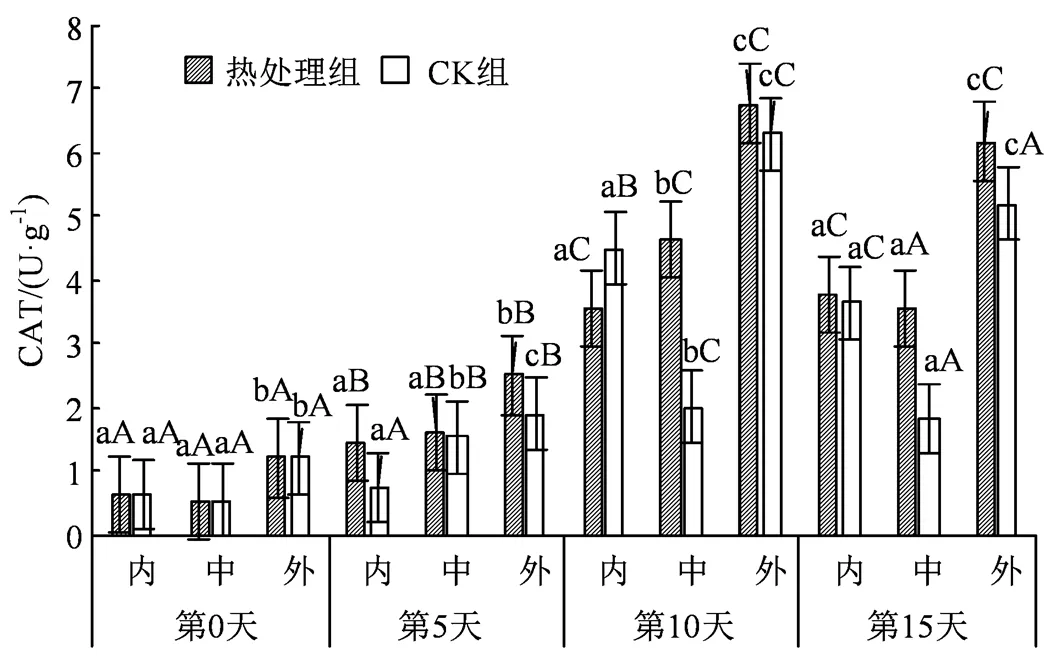
图10 热水处理对不同组织CAT活性的影响
Figure 10 Effects of hot water treatment on CAT activity in different tissues
GSH作为一种可以清除O2·-和H2O2的低分子非酶物质,既具有稳定酶的作用,同时能防止血红蛋白免受氧化损伤,因此GSH的含量表征了机体的抗氧化能力大小。如图6所示,GSH在贮藏期间均呈现先上升后快速下降的趋势,在贮藏前中期GSH含量有明显的激增,可能是持续累积的活性氧自由基刺激了GSH含量的上升[23];然而在贮藏5 d后,由于冷害的日益加剧导致果实整体品质的下滑,又推动GSH含量的下降。相较于第5 天,贮藏末期处理组内果心、中果肉和外果皮分别下降了10.71、9.31和14.03 mg·g-1,外果皮具有最低的降幅和最高的GSH含量,而内部和中部组织则并无显著差异。
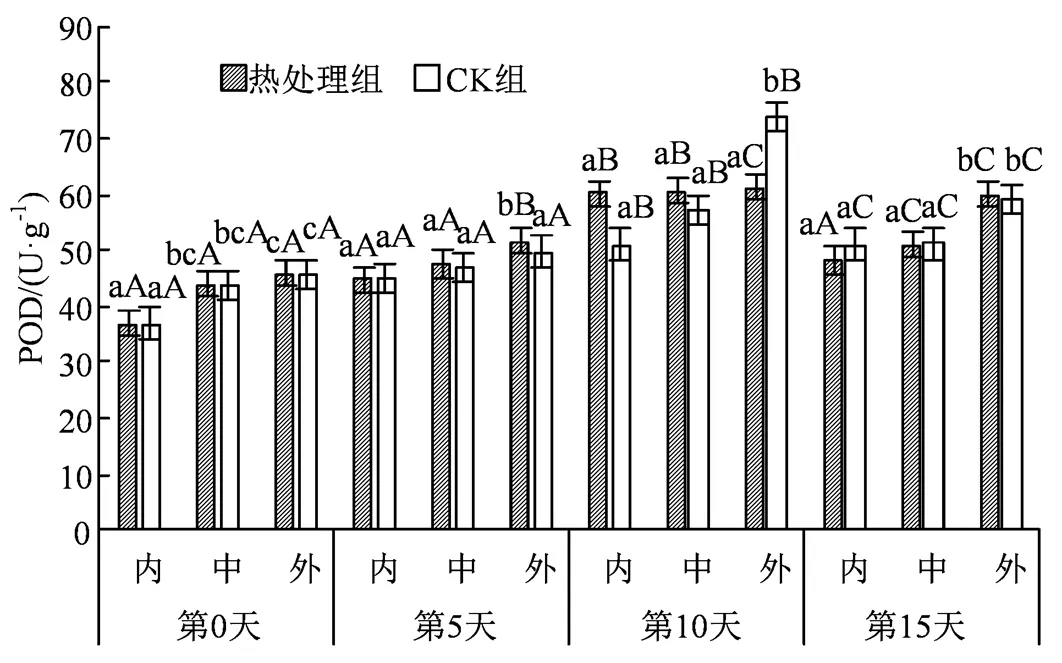
图11 热水处理对不同组织POD活性的影响
Figure 11 Effects of hot water treatment on POD activity in different tissues
2.5 热水处理对西葫芦不同组织H2O2和O2·-含量的影响
果蔬遭受逆境胁迫时,会使得细胞内的自由基代谢失衡,果蔬内部大量积累的活性氧自由基将会加剧膜脂过氧化作用,造成细胞膜损伤,加速果蔬衰老。由图7可知,试验各组内果心、中果肉和外果皮在贮藏前期并无显著性差异,处理组外果皮在第5 天时的H2O2含量比第0天时增长10.3倍,在第15天时的H2O2含量比内果心和中果肉高2.62和3.79倍;同时第15 天时CK组的H2O2含量比处理组的内果心、中果肉、外果皮部分高出55.66%、44.47%和39.81%。结果说明热处理后的果实中的过氧化程度得到一定的缓解。另外,处理组外果皮的O2·-含量从第0天时的0.837 U·g-1上升到第15 天时的1.875 U·g-1,说明低温下果实的膜脂过氧化在不断加剧;到贮藏第15 天时,CK组内果心、中果肉和外果皮的O2·-含量比处理组的内果心、中果肉和外果皮的O2·-含量高出12.73%、18.63%和21.17%(图8),并且在贮藏中后期,外果皮和内果心部分均大幅度上涨(< 0.05),相比较中果肉则上升较缓,说明了中果肉对H2O2和O2·-的上升抑制效果明显。
2.6 热水处理对西葫芦不同组织SOD、CAT和POD酶活性的影响
SOD作为消除机体在新陈代谢过程中产生有害物质的首要酶,可以及时修复受损细胞,维持细胞膜的完整性,调节活性氧平衡,参与植物体内调节。如图9所示,所有试验组在贮藏0 ~ 10 d期间均有上升,在贮藏中期有较为明显的涨幅,CK组在0 ~ 10 d的内果心、中果肉和外果皮活性分别提高了18.33%、16.33%和29.91%,说明低温可以短暂地刺激SOD活力的上升。与此同时,处理组和未处理组的外果皮在贮藏末期相较于其他组均保持有最高的SOD活性,比中部和内部组织活力高出100 U·g-1左右,处于最高水平。
CAT 是果蔬中活性氧清除系统的重要酶之一,当果蔬面临逆境胁迫产生氧化应激反应时被激活,可以减轻机体产生的不良反应[24]。如图10所示,西葫芦果实在贮藏期间保持着先上升后下降的趋势,在贮藏10 d时有显著涨幅(< 0.05)并达到活力峰值。外果皮在热处理后CAT活力涨幅可达5.58 U·g-1,而中果肉和内果心则分别提升4.117和2.917 U·g-1;在贮藏15 d时,除内果心其余组均有较大降幅,而中果肉、外果皮相较于贮藏10 d分别降低1.15和0.65 U·g-1,其中外果皮始终保持最高的CAT活力。
POD 是植物体内广泛存在的一种重要膜脂保护酶,当受到逆境胁迫时会做出相应的应答反应,对清除O2·-与 H2O2有重要作用。由图11可知,所有组在贮藏5 d后POD活力有显著上升(< 0.05)。该结果表明在后期活性氧积累增多,持续的低温环境下细胞膜完整度下降严重,在第10 天时处理组内果心和中果肉POD含量分别为60.03和60.63 U·g-1,而CK组内果心和中果肉含量分别为51.04和57.14 U·g-1,这也说明热处理对西葫芦中POD高活性的维持起着重要作用。另外,POD活性也反映了组织的受损程度,在第15 天时,热处理外果皮的POD活性达峰值59.78 U·g-1,同比其余组织高出10 U·g-1左右,也表明了在贮藏后期果皮的组织受损程度比内部要严重。
3 讨论与结论
果蔬在采后贮藏中由于低温胁迫容易导致膜的形状发生变化和膜透性增大,降低细胞膜的选择性,引起可溶性物质外渗,破坏胞内离子平衡,进而影响果蔬的一系列代谢进程。诸多研究表明,在低温贮藏过程中黄瓜[25]、蜜柚[26]等果蔬会出现通透性增大,胞内电解质外渗等现象。同样,在本试验中,果实在贮藏期间内部电导率从0 d的8.3%左右上升到15 d的20.81%,并且出现中果肉次之、外果皮最低的现象,一方面可能是因为外果皮附着于果实表面,整体水分含量小于其余组织,且大致上由外到内含水量递增,这也导致了细胞外渗少,电导率低;另一方面外果皮细胞结构致密、层次紧实,存在大量厚角组织,对细胞结构都有一定程度的支撑和加强,而中果肉细胞主要是由多层大型薄壁细胞构成,内果心部分则一般由表皮细胞构成[27],这也解释了内部电导率在同时期中显著高于其余组。此外,可溶性蛋白和可溶性固形物也有类似的差异,由于持续的低温贮藏,导致果实内部蛋白质合成酶遭到破坏[28],而外果皮在贮藏期间可以保持一定高度甚至出现上升趋势。这可能是果蔬在遭受低温逆境胁迫时,果实表面的小分子热激蛋白蓄积sHSP(small heat shock proteins,分子量为12 ~ 42 kDa),增强了细胞膜的流动性,提高了细胞膜之间的相互作用,进而提高果皮抗冷性[29]。
AsA、GSH等非酶物质可以通过清除自由基,维持细胞生理功能,而SOD、CAT和POD等抗氧化酶,能通过歧化反应清除O2·-生成H2O2和O2,二者相辅相成进而维持内部活性氧平衡。本研究中,热水处理可有效地缓解AsA、GSH含量的减少,同时与CK组相比,提升了SOD、CAT、POD等活性,这与赵昱瑄等[15]通过39.4 ℃热水热激黄瓜果实 24.4 min提高了抗氧化酶活力的结论相一致。由图5和图6可知,不同组织在非酶物质的含量上存在着显著差异,AsA和GSH在同期组织中外果皮含量最高,比中果肉和内果心高出25%左右,在部分时期甚至是其余组织的2倍,这可能是由于叶绿素含量在西葫芦果实中由外到内逐渐减少,而叶绿素本身也一定程度上存在抗氧化和抗冷性,并且APX一般存在于线粒体和叶绿体上。结果说明APX更多地存在于果实表皮,而APX可以利用抗坏血酸分子将H2O2还原成水,同时减缓AsA的下降[30],这也解释了上述差异。此外AsA-GSH循环是植物机体清除活性氧的主要途径之一,而这一途径广泛分布于植物细胞的多种细胞器中,例如叶绿体、细胞质、线粒体等,因此果实内中外组织的差异也可能与AsA-GSH循环[31]有关,此循环在分布位置上的差异导致了外果皮在含量上、下降幅度上异于其余组织。
另外研究中发现,果蔬在低温逆境下会刺激H2O2和O2·-的大量积累,加剧膜脂过氧化进程,同时二者也可能作为信号分子[32],诱导CAT、SOD等抗氧化酶活性的增强。如图9所示,SOD在应对胁迫时会有明显的活性上升,并且与H2O2、O2·-含量变化趋势保持一致,均在第5天左右开始有显著激增。结果显示贮藏中后期外果皮在SOD含量上高于其余部位,可能是因为SOD广泛存在于叶绿体、线粒体、细胞质等多个部位,而外果皮部分叶绿体分布较多,因此在第15天时外果皮可以保持有最高的SOD活力。同时短暂的活性氧激增也刺激了CAT活力的升高,SOD先将O2·-歧化生成 H2O2和O2,CAT再将H2O2清除,二者协同作用共同应对应激[33]。图7显示H2O2含量在贮藏中后期大幅上升,而SOD活性在中后期随氧化应激的增强也有较大幅度的提升,在协同作用下刺激了CAT活力的升高,这也符合实验后期CAT活力显著上升的结果。同时,SOD较多存在于果实表面,这也带动了CAT较多的聚集于外果皮,这与中同期组织外部活性高于其余组织的差异相符。果实在贮藏期间除了存在清除H2O2等活性氧外,还与伤口愈合和木质化等生理过程有关[34],而POD正是执行这一操作的酶。本研究所有组冷害的发生部位均集中在果实表面,因此伤口愈合等生理过程主要体现在西葫芦表皮。正如图11所示,同期组外果皮部分POD活性高于其他部分,相比较而言,内部果肉受其余部分的包裹,加上冷害影响较小,因而POD活性得到较好地维持。
本研究表明,采用42 ℃热水处理30 min,可以有效减轻冷害症状,缓解氧化损伤,减缓衰老进程,改善细胞膜完整性。不同组织中,外表皮相较于其余部位更容易积累活性氧自由基,对冷害也表现得更为敏感,SOD、CAT、POD等抗氧化酶的活性也相对较高;而中果肉、内果心受到果皮的包裹,对逆境胁迫的程度相对较缓,因此非酶物质含量和酶活性上也相对较低。总的来说,各层组织耐冷性上:外果皮>中果肉>内果心。另外,根据研究结果,建议在测定电导率、可溶性蛋白、可溶性固形物、O2·-和H2O2时可采用果实中果肉,能够较为清晰地反映贮藏期间的变化;而外果皮方便取样,同时对冷害表现相对于其他组织更为敏感,在测定AsA、GSH、SOD、POD、CAT等指标时,可以考虑选取果实外表皮进行取样测定。由于内果心部分较难取样,并且过氧化程度存在一定的延迟,对准确反映果实的冷害程度存在一定影响,建议选取果实其他部位进行指标测定。
[1] 乔宁, 焦彦生, 武青山, 等. 籽用西葫芦新品种比较试验[J]. 蔬菜, 2021(6): 75-78.
[2] 丁克明, 张光全, 康蓉. 西葫芦品种比较试验[J]. 现代农业科技, 2019(15): 89, 91.
[3] 郑剑超, 董飞, 陈烨华, 等. 不同基质配比对西葫芦生长发育的影响[J]. 浙江农业科学, 2019, 60(8): 1415-1417.
[4] 唐建新, 王佳莉, 英丽美, 等. 果蔬采后生理代谢变化及调控机制研究进展[J]. 包装工程, 2022, 43(5): 91-99.
[5] 程玉娇, 李云云, 张敏. 热处理对‘塔罗科’血橙物流变温环境下的保鲜效果[J]. 食品科学, 2016, 37(6): 254-260.
[6] 李英, 廖以金, 从心黎. 热处理对红肉火龙果果实保鲜效果的影响[J]. 江苏农业科学, 2020, 48(8): 218-222.
[7] 盖晓阳, 张敏, 胡均如, 等. 不同湿度对热处理西葫芦传热过程及低温贮藏品质和抗氧化系统的影响[J]. 食品与发酵工业, 2022, 48(2): 94-102.
[8] ENDO H, OSE K, BAI J H, et al. Effect of hot water treatment on chilling injury incidence and antioxidative responses of mature green mume () fruit during low temperature storage[J]. Sci Hortic, 2019, 246: 550-556.
[9] 李佳乐, 张敏, 盖晓阳, 等. 梯度热水处理减轻低温贮后的黄瓜果实冷害[J]. 安徽农业大学学报, 2021, 48(3): 373-381.
[10] 邵婷婷, 张敏, 刘威, 等. 采后热水处理对青椒果实低温贮藏期间活性氧代谢及抗氧化物质的影响[J]. 食品与发酵工业, 2019, 45(12): 133-139.
[11] HUAN C, HAN S, JIANG L, et al. Postharvest hot air and hot water treatments affect the antioxidant system in peach fruit during refrigerated storage[J]. Postharvest Biol Technol, 2017, 126: 1-14.
[12] 陈晓彤, 叶先明, 潘艳芳, 等. 间歇热处理对柑橘冷害调控研究[J]. 包装工程, 2019, 40(17): 8-13.
[13] ZHANG M, LIU W, LI C, et al. Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J]. Sci Hortic, 2019, 249: 219-227.
[14] 曹建康,姜微波,赵玉梅. 果蔬采后生理生化实验指导[M]. 北京: 中国农业大学,2007.
[15] ZHANG M, LIU W, LI C H, et al. Postharvest hot water dipping and hot water forced convection treatments alleviate chilling injury for zucchini fruit during cold storage[J]. Sci Hortic, 2019, 249: 219-227.
[16] 赵昱瑄, 张敏, 姜雪, 等. 短时热处理对低温逆境下黄瓜不同部位的冷害及活性氧代谢影响[J]. 食品与发酵工业, 2020, 46(7): 180-187.
[17] 韩帅, 朱玉雯, 吴酉芝. 果蔬冷害及其控制研究进展[J]. 现代食品, 2021(12): 39-42.
[18] SALAZAR-SALAS N Y, VALENZUELA-PONCE L, VEGA-GARCIA M O, et al. Protein changes associated with chilling tolerance in tomato fruit with hot water pre-treatment[J]. Postharvest Biol Technol, 2017, 134: 22-30.
[19] 罗玲, 许肖恒, 杨康, 等. 非生物胁迫下植物衰老和热激蛋白响应[J]. 草业科学, 2020, 37(11): 2320-2333.
[20] KAHRAMANOĞLU İ, CHEN C Y, CHEN Y, et al. Improving storability of “Nanfeng” mandarins by treating with postharvest hot water dipping[J]. J Food Qual, 2020, 2020: 8524952.
[21] NASEF I N. Short hot water as safe treatment induces chilling tolerance and antioxidant enzymes, prevents decay and maintains quality of cold-stored cucumbers[J]. Postharvest Biol Technol, 2018, 138: 1-10.
[22] 周毅刚, 许文天, 马小卫, 等. 芒果果皮和果肉的抗氧化能力分析[J]. 广东农业科学, 2013, 40(24): 87-90.
[23] BASHIR H A, ABU-GOUKH A B A. Compositional changes during guava fruit ripening[J]. Food Chem, 2003, 80(4): 557-563.
[24] 顾思彤, 姜爱丽, 李宪民, 等. 不同贮藏温度对软枣猕猴桃采后生理品质及抗氧化性的影响[J]. 食品与发酵工业, 2019, 45(13): 178-184.
[25] BUSSARIN W, KANOGWAN S. Effects of putrescine treatment on the quality attributes and antioxidant activities of ‘Nam Dok Mai No. 4’ mango fruit during storage[J]. Sci Hortic, 2018,233:22-28.
[26] 贾雯茹, 赵紫迎, 左小霞, 等. 高湿贮藏减轻黄瓜果实冷害的效果研究[J]. 南京农业大学学报, 2020, 43(3): 529-536.
[27] 张珅, 张翼翔, 叶洪, 等. 热处理对采后琯溪蜜柚果实汁胞粒化的影响及其与细胞壁代谢的关系[J]. 食品科学, 2021, 42 (11): 17-25.
[28] SOKOLOFF D D, TOANNA J M, LANA Z, et al. Plant anatomy: at the heart of modern botany[J]. Bot J Linn Soc, 2021, 195(3): 249-253.
[29] ELKELISH A, QARI H S, MAZROU A S Y, et al. Exogenous ascorbic acid induced chilling tolerance in tomato plants through modulating metabolism, osmolytes, antioxidants, and transcriptional regulation of catalase and heat shock proteins [J]. Plants, 2020, 9(4): 431.
[30] 俞佳虹, 冯坤, 程远, 等. 植物小热激蛋白的研究进展[J]. 分子植物育种, 2017, 15(8): 3016-3023.
[31] 胡均如, 张敏. 热处理提高采后果蔬低温贮藏期间活性氧清除能力的机制[J]. 食品与发酵工业, 2021, 47(12): 269-276.
[32] UMMARAT N, MATSUMOTO T K, WALL M M, et al. Changes in antioxidants and fruit quality in hot water-treated ‘Hom Thong’ banana fruit during storage[J]. Sci Hortic, 2011, 130(4): 801-807.
[33] ZHANG Z K, ZHU Q G, HU M J, et al. Low-temperature conditioning induces chilling tolerance in stored mango fruit[J]. Food Chem, 2017, 219: 76-84.
[34] 姜雪, 张敏, 赵昱瑄, 等. 不同初始机体温度对热水处理西葫芦果实低温贮藏品质和活性氧代谢的影响[J]. 食品与发酵工业, 2020, 46(5): 231-239.
[35] 杨舒贻, 陈晓阳, 惠文凯, 等. 逆境胁迫下植物抗氧化酶系统响应研究进展[J]. 福建农林大学学报(自然科学版), 2016, 45(5): 481-489.
Effects of pre-storage hot water treatment on cold tolerance and antioxidant system of different tissues of zucchini during low temperature storage
LI Qixun1, ZHANG Min1, 2, 3, JIA Miao1, LI Yushen1, WANG Hongting1
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306; 2. National Experimental Teaching Demonstration Center for Food Science and Engineering (Shanghai Ocean University), Shanghai 201306; 3. Shanghai Professional Technology Service Platform on Cold Chain Equipment Performance and Energy Saving Evaluation, Shanghai 201306)
To investigate the effect of hot water treatment on active oxygen metabolism of different tissues of zucchini under low temperature stress, ‘Lvfeng’ zucchini was selected as experimental materials, which was soaked in hot water at 42 ℃ for 30 min, taking untreated zucchini at room temperature (20 ± 1) ℃ as the control. Stored in cold storage [ (4 ± 0.5) ℃, (80 ± 5)% RH] after the treatment, zucchini was divided into exocarp, mesocarp and endocarp according to different tissues. The results showed that the soluble solid content in the mesocarp and endocarp was higher and could be effectively maintained, while the endocarp maintained the highest relative electrical conductivity in the tissue at the same time, and the exocarp of zucchini was more likely to accumulate H2O2and superoxide anion radical O2·-,and drived ascorbic acid (AsA) and glutathione (GSH) to increase. The activities of catalase (CAT), superoxide dismutase (SOD) and peroxidase (POD) were effectively stimulated, and the soluble protein content was improved. In addition, the treatment of zucchini in this experiment could effectively delay chilling injury and fruit aging, alleviate oxidative damage and improve the storage quality. The results can provide some references for storage and preservation of fruits and vegetables after harvest.
zucchini; different tissues; hot water treatment; reactive oxygen; antioxidant enzyme
TS255.36
A
1672-352X (2023)02-0235-08
2022-04-15
国家自然科学基金面上项目(31371526)资助。
李奇勋,硕士研究生。E-mail:3104048983@qq.com
通信作者:张 敏,教授。E-mail:zhangm@shou.edu.cn
10.13610/j.cnki.1672-352x.20230511.017
2023-05-12 10:20:33
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20230511.1337.034.html
