器官信号“串话”在代谢综合征分子机制及潜在治疗应用中的研究进展
2023-05-30郑美华杨明艳孟祥婷齐栋范华英
郑美华 杨明艳 孟祥婷 齐栋 范华英
[摘要] 外周代谢器官和中枢神经系统间的多向性相互作用在维持全身代谢平衡、感知营养物质水平以及应对自然环境挑战具有重要作用。为了响应不同的代谢需求,人类在长期进化过程中形成一套器官间“相互交流”的生物通信系统。通过该系统,一些组织可以影响远处组织的代谢功能。然而,当器官间“相互交流”的信号通路失调,可能导致代谢性疾病的发生,如肥胖、糖尿病、肝脏疾病等。肝脏、脂肪组织和胃肠道-内分泌腺是该系统中主要的内分泌器官,除了经典的营养和能量存储/利用作用外,这些器官还分泌大量生物活性分子,参与机体代谢调节。本文就机体各器官间信号通路“串话”作用进行综述,重点讨论肝脏、脂肪组织以及胃肠道-内分泌腺分泌因子协调全身代谢平衡以及器官间信号网络,改善代谢综合征的作用。
[关键词] 代谢综合征;肝因子;脂肪因子;胃肠道-内分泌腺因子;串话机制
[中图分类号] R589 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.02.033
人类的新陈代谢涉及一系列复杂的过程,机体各器官间的交流可以维持内环境稳态。为维持全身动态平衡,响应不同的代谢需求,机体的不同器官/组织之间可通过多种信号分子相互“串话”协调代谢稳态,若协调失败可导致肥胖、糖尿病等代谢性疾病的发生。
1 概述
代谢综合征(metabolic syndrome, MetS)是一种广泛存在的慢性疾病,严重影响机体健康和生命安全。肥胖是代谢综合征的核心[1]。MetS由一组复杂的代谢紊乱疾病群组成,包括肥胖、高血压、血脂异常、胰岛素抵抗等,表现为代谢组织能量摄取和利用失衡。据估计,全球约有超过10亿人患有MetS[2]。在我国,60岁以上人群MetS患病率达到50%以上。我国人口老龄化程度的持续加深,使得MetS人群基数越来越大[3]。目前MetS发病机制仍未完全清楚,尚无相关治疗药物获批,现有的药物干预手段仅针对MetS单个疾病组成部分,虽能缓解MetS相关症状,但治疗方案复杂且效果有限,长期联合应用不良反应较大,且这些药物均没有针对MetS的病因进行治疗[4]。因此,临床仍急需开发新的治疗性药物,可以同时针对MetS的所有关键特征。
2 器官信号通路“串话”
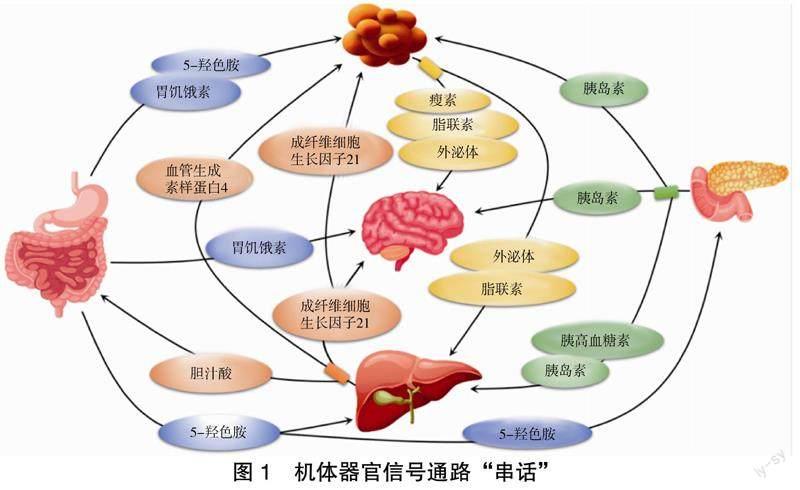
机体各器官/组织,如肝脏、脂肪、肠道等,在调节糖脂代谢方面具有重要的作用。这些器官通过分泌组织因子,如肝脏分泌血管生成素样蛋白4(angiopoietin-like protein 4,Angptl4)、成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)、胆汁酸(bile acids, BA)等,脂肪组织分泌瘦素、脂联素、外泌体等,胃肠道-胰腺分泌胰岛素、胃饥饿素、5-羟色胺等,与远处器官进行交流,影响其生理功能,从而协调全身代谢[5],见图1。
2.1 肝脏分泌因子
肝脏是一个中枢代谢器官,在维持全身能量稳态方面发挥重要作用。肝脏分泌因子进入血液循环,可对肝脏和外周组织甚至中枢神经系统等靶器官产生强大的影响。肝脏即通过这些分泌因子与其他器官系统进行“串话”。
2.1.1 Angptl4 主要由肝脏和脂肪组织分泌,与胰岛素抵抗、血脂异常、肥胖等代谢性疾病相关。研究发现,Angptl4作用于脂肪组织,过表达会抑制脂肪组织中脂蛋白脂肪酶(lipoprotein lipase,LPL)的催化活性,减少循环脂蛋白中的三酰甘油(triglycerides,TG)水解为游离脂肪酸(free fatty acids,FFA),血浆TG水平升高,导致患心血管代谢疾病的风险升高[6]。据报道,Angptl4过表达可导致葡萄糖耐量受损[7],这与激活胰岛素相关信号通路细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinase1/2,ERK1/2)及磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/丝氨酸苏氨酸蛋白激酶(protein kinase B,AKT)信号通路有关;相反,肝脏Angptl4缺乏可以改善葡萄糖稳态并增强代谢组织中的胰岛素敏感性[8]。因此,Angptl4可能是用于改善人类代谢性疾病有希望的靶标。
2.1.2 FGF21 由肝脏分泌,通过成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFRs)发挥作用,但是FGF21与FGFRs的结合需辅助受体β-klotho(KLB)的介导,在调节糖脂代谢稳态方面具有重要作用[9]。在肝脏中,FGF21通过抑制编码甾醇调节元件结合蛋白1c(sterol regulatory element-binding transcription factor 1c,SREBP1c)和脂肪酸合酶的脂肪生成基因,抑制肝脏中脂肪的从头生成[10],可通过结合肝脏中的FGFR2/KLB复合物,调节肝脏胆固醇代谢。除了影响脂代谢外,FGF21也可抑制肝葡萄糖输出并增加肝糖原的储存[11],调节葡萄糖代谢。脂肪组织是FGF21的主要靶标,白色脂肪组织(white adipose tissue,WAT)内具有高表达的FGFR1c和KLB,FGF21与其结合,促进脂肪分解;此外,在WAT中,FGF21调节PPARγ的活性并刺激产热反应,从而促进能量的消耗[12]。Ge等[13]研究显示葡萄糖转运蛋白1(glucose transporter type 1,GLUT1)基因通過ERK1/2、血清反应因子和Ets样蛋白1的转录激活,致使FGF21刺激脂肪细胞中的葡萄糖摄,FGF21还可以促进WAT褐变而增加葡萄糖摄取。在大脑中,FGF21通过调节下丘脑中视交叉上核(suprachiasmatic nucleus,SCN)和后脑背迷走神经复合体(dorsal vagal complex,DVC)中的KLB表达,增加代谢率以及改善胰岛素敏感性[14]。
2.1.3 BA 通过法尼醇X受体(farnesoid X receptor,FXR)发挥作用,控制BA、糖脂代谢、能量消耗等,主要作用于肝肠道组织。在肝脏中,FXR可通过FXR-小异二聚体伴侣(orphan nuclear receptor small heterodimer partner,SHP)通路抑制肝脏SREBP1c的表达来减少脂肪生成,还可通过增加LPL激活剂载脂蛋白C-Ⅱ(apolipoprotein C-Ⅱ,ApoCⅡ)的表达而降低LPL抑制剂ApoCⅢ的表达来增强LPL的活性[15],刺激富含TG的脂蛋白的血管内脂解作用。此外,FXR还可下调葡萄糖合成途径中的磷酸烯醇丙酮酸羧激酶(phosphoenolpyruvate carboxylase,PEPCK)和葡萄糖-6-磷酸酶(glucose- 6-phosphatase,G6Pase),减少糖异生,影响葡萄糖代谢[16]。在胃肠道组织中,肠道FXR的激活可以促进全身脂肪细胞的褐变,增强脂肪分解,防止因饮食引起的肥胖,但是FXR在维持葡萄糖稳态中的作用具有争议,激活和抑制FXR都可能提高葡萄糖耐量和胰岛素敏感性,降低肝糖异生[17]。目前,FXR特异性激动剂奥贝胆酸正在研究中。在一项随机对照试验中,患者接受奥贝胆酸治疗72周,其肝脏功能显著改善,体质量减轻约2kg,提高了胰岛素敏感性[18]。
2.1.4 其他分泌因子 肝脏的其他分泌因子,如胎球蛋白A/B,其表达增加可导致胰岛素抵抗;硒蛋白可以激活AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK),其水平过高时亦可导致胰岛素抵抗[19]。
总之,肝脏在控制机体代谢动态平衡方面起核心作用。肝臟通过分泌肝脏因子,以各种方式影响远处器官的新陈代谢。了解肝脏代谢失调如何影响其他器官系统,可能会为MetS带来新的治疗策略。
2.2 脂肪分泌因子
脂肪组织作为能量储存和释放的主要场所,在控制全身新陈代谢方面具有重要的调节作用。脂肪分泌因子对全身新陈代谢有重要影响,瘦素和脂联素是经典的脂肪因子,在肥胖和代谢并发症的发病机制中具有重要关系。
2.2.1 瘦素 主要作用于大脑,由皮下WAT分泌,通过与其受体结合发挥负向调节食物摄入量、糖脂代谢稳态以及增加能量消耗的作用[20]。在大脑中,瘦素通过激活阿黑皮质素原(pro-opiomelanocortin,POMC)表达神经元、抑制下丘脑刺鼠相关蛋白(agouti-related neuropeptide,AgRP)和食欲神经肽Y(neuropeptide Y,NPY)的表达,降低机体食欲;瘦素与其受体结合后,可激活多种细胞内信号通路,包括信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路[21],还可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和PI3K信号通路,协调食物的摄入和能量的调节来维持机体平衡。
2.2.2 脂联素 主要作用于肝脏和大脑,由成熟脂肪细胞分泌,具有增强胰岛素敏感性、改善肥胖等作用,在肝脏中,通过激活AMPK和PPARα信号通路改善胰岛素抵抗[22-23];可通过减少糖异生底物的水平,抑制葡萄糖的产生,从而影响葡萄糖代谢。脂联素还可影响脂质代谢,通过促进ApoAI和ATP结合和转运蛋白A1(ATP binding cassette transporter A1,ABCA1)的产生,使高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平相较与对照组增加30%左右,脂联素可能与HDL-C水平呈独立且正相关,通过激活LPL、改善胰岛素抵抗,诱导HDL-C上调,TG水平可显著降低[24],脂联素还可通过诱导血清ApoC Ⅲ降低,使血清TG水平降低[23]。在大脑中,脂联素在能量稳态中起重要作用。下丘脑中的脂联素信号会影响饱腹感及能量稳态[25],还可增强瘦素的影响,增加下丘脑促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)的表达,增加产热,减轻体重,降低血糖血脂水平;脂联素在脑室内递送,可激活下丘脑胰岛素信号通路,通过减弱胰岛素抵抗改善葡萄糖稳态[26]。
2.2.3 其他分泌因子 近年来研究发现,脂肪组织可分泌外泌体,调控肝脏脂质代谢,促进炎症因子分泌,导致胰岛素抵抗的发生[27]。外泌体可作用于下丘脑,调节机体的食欲[28]。抵抗素是肥胖相关胰岛素抵抗的介质[29],在葡萄糖代谢中,抵抗素与胰岛素信号传导抑制剂的激活有关。
总之,脂肪组织在调节机体新陈代谢方面发挥核心作用,而脂肪组织的失调会引起其他器官系统的新陈代谢失调。因此,研究脂肪组织在代谢性疾病中的作用,将为MetS的治疗提供进一步的见解。
2.3 胃肠道-内分泌腺分泌因子
胃肠道-内分泌腺分泌的激素包括胃饥饿素、胰岛素、5-羟色胺等,作用于中枢神经系统,可改变食物的摄入量,对肝脏、脂肪组织等靶器官也有影响。
2.3.1 胰岛素 由胰岛β细胞释放,可作用于肝脏、脂肪组织和大脑,抑制肝脏葡萄糖生成,调节脂质代谢。在肝脏中,胰岛素直接作用于肝细胞,通过改变肝脏糖异生基因的表达以及抑制PEPCK和G6Pase的活性,减少糖异生;同时还可与其肝脏受体结合,抑制细胞内信号,导致糖原分解迅速减少;通过对PI3K/Akt信号通路的调节,控制肝脏中的脂质代谢与葡萄糖代谢[30]。在脂肪组织中,胰岛素通过脂解作用抑制肝葡萄糖的产生[31],作用机制主要包括:①FFA氧化减少使乙酰辅酶A的含量降低,从而减少了丙酮酸羧化酶的变构活化,导致糖异生减少[32];②FFA损害胰岛素受体信号传导,导致胰岛素介导的糖原合成减少,G6Pase的活性受到抑制,使糖异生减少;③FFA减少增强葡萄糖介导的对糖原分解的抑制[31]。此外,胰岛素还可以通过触发GLUT4葡萄糖转运体移位到细胞膜,促进葡萄糖的吸收并迅速降低血糖[33]。
2.3.2 胃饥饿素 由胃黏膜释放,主要作用于大脑和脂肪组织,具有促食欲特性,在调节体重方面具有重要作用,可影响食物摄入及减少能量消耗。在大脑中,胃饥饿素通过激活下丘脑AMPK信号通路发挥其促食欲作用[34],胃饥饿素还可以降低BAT交感神经活动[35],调节脂肪细胞代谢,通过促进葡萄糖和TG摄取、增加脂肪生成和抑制白色脂肪细胞中的脂质氧化,促进脂肪储存。在脂肪组织中,胃饥饿素可增加WAT的储存,降低BAT中与产热相关的解偶联蛋白的表达[36]。
2.3.3 其他分泌因子 5-羟色胺由肠道分泌,对胰腺、肝脏和脂肪组织中的葡萄糖代谢具有重要影响[37];胰高血糖素由胰島α细胞分泌,可促进糖原分解和糖异生,提示胰高血糖素是治疗MetS的一种途径[38]。胃肠道-内分泌腺分泌因子在治疗MetS方面具有潜在的作用。胃饥饿素和胰岛素的调节作用目前正在研究中,作为一种治疗方法,已显示出在治疗MetS方面的希望。
2.4 “串话”和代谢影响
除了单独了解每种肝因子、脂肪因子和胃肠道-内分泌腺因子的作用之外,重要的是这些组织因子在机体各器官间“串话”的共同作用,在不同的组织中形成复杂的作用网络,改善机体葡萄糖及脂质代谢紊乱,从而对肥胖、2型糖尿病、代谢综合征等疾病产生影响。了解这种“串话”机制对于制定预防和治疗措施以更好地管理其所涉及的并发症是有效的。
3 总结与展望
肝脏、脂肪组织及胃肠道-内分泌腺分泌因子,通过器官间“串话”进行交流,可作为体内平衡紊乱的生物标志物,在控制全身新陈代谢的过程中具有重要作用。从多肽激素到小分子再到脂质,这些分泌因子协调靶器官的生理过程,作为潜在的治疗靶点发挥作用。本文讨论了与经典代谢相关器官的分泌因子,这些器官系统间可相互作用,影响机体新陈代谢。因此,了解肝脏分泌因子、脂肪组织分泌因子和胃肠道-内分泌腺分泌因子的释放和相互作用,或可成为改善MetS新的治疗选择。
[参考文献]
[1]WANG H H, LEE D K, LIU M, et al. Novel insights into the pathogenesis and management of the metabolic syndrome[J]. Pediatr Gastroenterol, 2020, 23(3): 189–230.
[2]SAKLAYEN M G. The global epidemic of the metabolic syndrome[J]. Curr Hypertens Rep, 2018, 20(2): 12.
[3]LI R, LI W, LUN Z, et al. Prevalence of metabolic syndrome in Mainland China: a meta-analysis of published studies[J]. BMC Public Health, 2016, 16(1): 1–10.
[4]PRIEST C, TONTONOZ P. Inter-organ cross-talk in metabolic syndrome[J]. Nat Metab, 2019, 1(12): 1177–1188.
[5]de OLIVEIRA DOS SANTOS A R, DE OLIVEIRA ZANUSO B, MIOLA V F B, et al. Adipokines, myokines, and hepatokines: crosstalk and metabolic repercussions[J]. Int J Mol Sci, 2021, 22(5): 2639.
[6]SINGH A K, CHAUBE B, ZHANG X, et al. Hepatocyte-specific suppression of ANGPTL4 improves obesity-associated diabetes and mitigates atherosclerosis in mice[J]. J Clin Invest, 2021, 131(17): e140989.
[7]HARADA M, YAMAKAWA T, KASHIWAGI R, et al. Association between ANGPTL3, 4, and 8 and lipid and glucose metabolism markers in patients with diabetes[J]. PLoS One, 2021, 16(7): e0255147.
[8]GUSAROVA V, O'DUSHLAINE C, TESLOVICH T M, et al. Genetic inactivation of ANGPTL4 improves glucose homeostasis and is associated with reduced risk of diabetes[J]. Nat Commun, 2018, 9(1): 2252.
[9]GENG L, LAM K S L, XU A. The therapeutic potential of FGF21 in metabolic diseases: from bench to clinic[J]. Nat Rev Endocrinol, 2020, 16(11): 654–667.
[10]ZHANG Y, LEI T, HUANG J F, et al. The link between fibroblast growth factor 21 and sterol regulatory element binding protein 1c during lipogenesis in hepatocytes[J]. Mol Cell Endocrinol, 2011, 342(1–2): 41–47.
[11]LIU J, YANG K, YANG J, et al. Liver-derived fibroblast growth factor 21 mediates effects of glucagon-like peptide-1 in attenuating hepatic glucose output[J]. EBioMedicine, 2019, 41: 73–84.
[12]HAN M S, PERRY R J, CAMPOREZ J P, et al. A feed-forward regulatory loop in adipose tissue promotes signaling by the hepatokine FGF21[J]. Genes Dev, 2021, 35(1-2): 133–146.
[13]GE X, CHEN C, HUI X, et al. Fibroblast growth factor 21 induces glucose transporter-1 expression through activation of the serum response factor/Ets-like protein-1 in adipocytes[J]. J Biol Chem, 2011, 286(40): 34533–34541.
[14]BONDURANT L D, AMEKA M, NABER M C, et al. FGF21 regulates metabolism through adipose- dependent and independent mechanisms[J]. Cell Metab, 2017, 25(4): 935–944.e4.
[15]CLAUDEL T, INOUE Y, BARBIER O, et al. Farnesoid X receptor agonists suppress hepatic apolipoprotein CⅢ expression[J]. Gastroenterology, 2003, 125(2): 544–555.
[16]SHAPIRO H, KOLODZIEJCZYK A A, HALSTUCH D, et al. Bile acids in glucose metabolism in health and disease[J]. J Exp Med, 2018, 215(2): 383–396.
[17]TICHO A L, MALHOTRA P, DUDEJA P K, et al. Intestinal absorption of bile acids in health and disease[J]. Compr Physiol, 2019, 10(1): 21–56.
[18]MCGLONE E R, BLOOM S R. Bile acids and the metabolic syndrome[J]. Ann Clin Biochem, 2019, 56(3): 326–337.
[19]MISU H, TAKAYAMA H, SAITO Y, et al. Deficiency of the hepatokine selenoprotein P increases responsiveness to exercise in mice through upregulation of reactive oxygen species and AMP-activated protein kinase in muscle[J]. Nat Med, 2017, 23(4): 508–516.
[20]ABELLA V, SCOTECE M, CONDE J, et al. Leptin in the interplay of inflammation, metabolism and immune system disorders[J]. Nat Rev Rheumatol, 2017, 13(2): 100–109.
[21]CHEN Y, WU R, CHEN H Z, et al. Enhancement of hypothalamic STAT3 acetylation by nuclear receptor Nur77 dictates leptin sensitivity[J]. Diabetes, 2015, 64(6): 2069–2081.
[22]MATSUDA M, SHIMOMURA I. Roles of adiponectin and oxidative stress in obesity-associated metabolic and cardiovascular diseases[J]. Rev Endocr Metab Disord, 2014, 15(1): 1–10.
[23]OKU H, MATSUURA F, KOSEKI M, et al. Adiponectin deficiency suppresses ABCA1 expression and ApoA-I synthesis in the liver[J]. FEBS Lett, 2007, 581(26): 5029–5033.
[24]YANAI H, YOSHIDA H. Beneficial effects of adiponectin on glucose and lipid metabolism and atherosclerotic progression: mechanisms and perspectives[J]. Int J Mol Sci, 2019, 20(5): 1190.
[25]BLOEMER J, PINKY P D, GOVINDARAJULU M, et al. Role of adiponectin in central nervous system disorders[J]. Neural Plast, 2018, 2018: 4593530.
[26]PARK S, KIM DS , KWON D Y, et al. Long-term central infusion of adiponectin improves energy and glucose homeostasis by decreasing fat storage and suppressing hepatic gluconeogenesis without changing food intake[J]. J Neuroendocrinol, 2011, 23(8): 687–698.
[27]XIE Z, WANG X, LIU X, et al. Adipose-derived exosomes exert proatherogenic effects by regulating macrophage foam cell formation and polarization[J]. J Am Heart Assoc, 2018, 7(5): e007442.
[28]GAO J, LI X, WANG Y, et al. Adipocyte-derived extracellular vesicles modulate appetite and weight through mTOR signalling in the hypothalamus[J]. Acta Physiol (Oxf), 2020, 228(2): e13339.
[29]MUSOVIC S, SHRESTHA M M, KOMAI A M, et al. Resistin is co-secreted with adiponectin in white mouse adipocytes[J]. Biochem Biophys Res Commun, 2021, 534: 707–713.
[30]TITCHENELL P M, LAZAR M A, BIRNBAUM M J. Unraveling the regulation of hepatic metabolism by insulin[J]. Trends Endocrinol Metab, 2017, 28(7): 497–505.
[31]LEWIS G F, CARPENTIER A C, PEREIRA S, et al. Direct and indirect control of hepatic glucose production by insulin[J]. Cell Metab, 2021, 33(4): 709–720.
[32]PETERSEN M C, SHULMAN G I. Mechanisms of insulin action and insulin resistance[J]. Physiol Rev, 2018, 98(4): 2133–2223.
[33]KLIP A, MCGRAW T E, JAMES D E. Thirty sweet years of GLUT4[J]. J Biol Chem, 2019, 294(30): 11369–11381.
[34]LV Y, LIANG T, WANG G, et al. Ghrelin, a gastrointestinal hormone, regulates energy balance and lipid metabolism[J]. Biosci Rep, 2018, 38(5): BSR20181061.
[35]SOVETKINA A, NADIR R, FUNG J N M, et al. The physiological role of ghrelin in the regulation of energy and glucose homeostasis[J]. Cureus, 2020, 12(5): e7941.
[36]THEANDER-CARRILLO C, WIEDMER P, CETTOUR-ROSE P, et al. Ghrelin action in the brain controls adipocyte metabolism[J]. J Clin Invest, 2006, 116(7): 1983–1993.
[37]MARAZZITI D, BETTI L, BARONI S, et al. The complex interactions among serotonin, insulin, leptin, and glycolipid metabolic parameters in human obesity[J]. CNS Spectr, 2022, 27(1): 99–108.
[38]AL-MASSADI O, FERN? J, DI?GUEZ C, et al. Glucagon control on food intake and energy balance[J]. Int J Mol Sci, 2019, 20(16): 3905.
(收稿日期:2022–07–22)
(修回日期:2022–12–07)
