肝移植术后早期急性肝动脉血栓介入治疗的临床应用*
2023-05-23刘文浩黄湘荣朱文科王立非
冯 凯 刘文浩 黄湘荣 朱文科 赵 东 王立非
1.深圳市第三人民医院放射介入科 (广东 深圳 518100)
2.深圳市第三人民医院肝移植科 (广东 深圳 518100)
肝脏移植术后早期移植肝动脉并发症是影响移植手术成功率及患者死亡率的重要因素。肝移植术后早期常见的血管并发症包括有移植肝动脉血栓形成、肝动脉狭窄等,其中移植肝动脉血栓形成为肝移植术后早期最严重并发症[1]。血管介入治疗由于其创伤小、疗效明确,已经成为处理肝移植术后血管并发症的一种常用方法。我院在2017年7月至2021年5月进行肝脏移植手术患者中有8例术后早期发现移植肝动脉血栓形成并行血管介入治疗。通过回顾性分析8例患者临床资料,对血管介入治疗在肝移植术后早期移植肝动脉血栓形成治疗的临床价值进行评估分析。
1 资料与方法
1.1 病例资料2017年7月至2021年5月在深圳市第三人民医院行肝脏移植手术共291例,其中8例患者术后早期(肝移植手术后1月内)出现移植肝动脉血栓。8例移植肝动脉血栓患者中男性患者7例,女性患者1例;年龄31~69岁;原发疾病中终末期肝硬化4例,肝细胞癌2例,胆管细胞癌1例,肝豆状核变性1例;所有患者均为同种异体肝移植,其中1例为劈离式肝移植;患者接受肝动脉造影时间为移植术后0~9d;所有患者均在介入治疗前接受了彩色多普勒超声/超声造影检查,其中3例患者同时行肝动脉CT血管成像检查;介入术后患者定期随访复查,随访时间截止至2022年1月31日。8例患者临床资料详见表1。

表1 患者基本资料
1.2 介入治疗操作经过患者仰卧于DSA检查台,常规心电监护,采用Seldinger’s穿刺法穿刺右/左股动脉,穿刺成功后导入导丝及血管鞘,在导丝导引下引入5F Yashiro导管或RH导管进入腹腔干或者移植肝-腹主动脉吻合血管开口处进行造影,造影明确肝动脉病变情况,若存在肝动脉血栓,则予术中行尿激酶溶栓(10万单位/10分钟缓慢匀速泵入溶栓,复查造影,必要时再次追加,最大术中用量至30万单位尿激酶),溶栓结束后留置微导管于吻合血管受体侧,固定包扎安返病房继续予尿激酶持续泵入维持溶栓(24小时尿激酶量不超过80万单位),溶栓24小时后复查DSA造影,若血管通畅,则拔除引流管;若不通畅,则继续溶栓,必要时植入血管支架,溶栓最长时间不超过7d。
1.3 统计学处理非正态分布的计量资料用M(范围)描述。
2 结 果
2.1 近期疗效291例肝移植患者中,共有8例在肝移植术后早期出现移植肝动脉血栓闭塞,急性肝动脉血栓闭塞发生率为2.7%(8/291)。8例患者中7例患者血栓位于主干血管吻合口附近,1例位于肝右动脉;8例患者DSA造影均存在不同程度的吻合口狭窄,其中4例患者移植肝动脉过于迂曲。8例动脉血栓闭塞患者经介入治疗后有7例患者术中血管部分开通或完全开通(图1),介入治疗有效率为87.5%,其中2例溶栓效果欠佳,术中予植入动脉支架,5例患者为单纯溶栓治疗开通闭塞血管,溶栓持续时间为1-7d;另外1例患者持续溶栓治疗次日出现腹腔大出血,后停止溶栓,并急诊行二次肝移植。
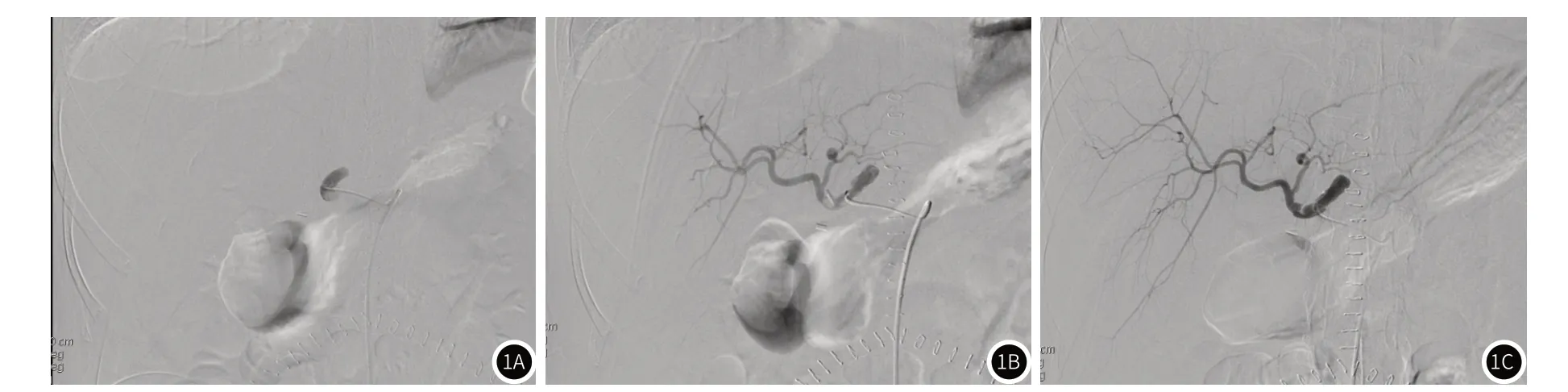
图1 图1A:病例4,肝移植术后4d,常规彩超检查提示HAT,急诊行DSA造影移植肝动脉主干近端显影,以远血管未见显影;图1B:术中予尿激酶20万单位溶栓20分钟后造影移植肝动脉主干吻合口处局部稍狭窄,血栓大部分消失,但肝动脉分支末梢显影稍欠佳;图1C:溶栓2d后再次造影,移植肝动脉主干吻合口处局部稍狭窄,血栓消失,肝动脉分支末梢显影良好。
2.2 中远期疗效8例患者随访时间为10~27月,中位随访时间为12月。7例溶栓治疗有效患者至随访截止时有3例患者血管通畅,1例患者血管狭窄,3例患者血管闭塞;有3例患者出现胆道并发症,其中1例患者因胆道感染死亡。1例二次移植患者血管通畅,无胆道并发症发生。所有患者至最后1次随访,7例患者肝功能(ALT/AST均正常),1例患者胆道感染肝功能衰竭死亡,见表2。

表2 患者治疗情况
3 讨 论
肝移植已成为许多急慢性终末期肝病及部分肝脏恶性肿瘤患者最有效的治疗方法之一。伴随肝移植的开展,肝移植相关的并发症在临床日益多见。肝动脉血栓形成(Hepatic Arterial Thrombosis,HAT)是肝移植术后较为常见和较为可怕的血管并发症,其可导致肝脓肿、胆管缺血,最终导致早期移植物丢失和晚期缺血性胆道并发症[2]。HAT通常分为两类:早期(发生在肝移植术后不到1个月)和晚期(发生在肝移植术后1个月以上)[3]。目前肝移植术后HAT的发病率差异很大,报道的频率为2%~5%[1]。本组研究中,早期HAT发生率为2.7%,与文献报道大致相仿。
HAT发生的常见原因有供受体吻合血管直径不匹配、血管内膜受损、血管斑块、吻合口狭窄以及血管扭曲过长等[4]。本组研究中,8例早期HAT患者均存在不同程度的吻合口狭窄,其中87.5%(7/8)患者血栓形成位于吻合口附近,提示吻合口狭窄与血栓形成有密切关系。HAT的诊断方法常见有多普勒超声、选择性腹腔血管造影、计算机断层扫描动脉造影、剖腹探查或尸检来证实[5];其中多普勒超声检查是最常用诊断方法,其操作简便,能及早准确地识移植术后HAT,因此多普勒超声检查已成为肝移植术后血管并发展筛查的首选方法[6],本组研究中,所有8例患者均为在肝移植术后常规彩超检查中发现存在HAT,后行DSA造影证实。
再次器官移植被认为是HAT治疗的最有效方法,但现实中面对器官短缺,再次移植时间不确定,在等待过程中可能导致患者死亡;紧急外科或介入手术血运重建成为抢救移植物的有效选择,可减少再次移植的发生。其中介入手术由于创伤小,作为手术干预入性较小的替代方案,目前已经成为早期HAT的首选治疗方式[7]。HAT介入治疗常见方法包括:经导管置管溶栓、球囊扩张成形、支架植入等。对于HAT溶栓的治疗时间窗、溶栓剂及剂量、给药方法、治疗持续时间或肝素的辅助使用,目前国内国际尚无共识,更多推荐为个体化使用;本组研究中;有文献报道经导管溶栓治疗HAT溶栓成功率为68%~80%[8-9];本组研究中采用的溶栓方案为:术中10万单位/10分钟尿激酶泵入溶栓,复查造影,必要时再次追加,最大术中用量至30万单位尿激酶,后留置微导管于吻合血管受体侧,继续予80万单位尿激酶/24小时持续泵入维持溶栓,最长不超过7d;5例患者经导管溶栓后可达到完全开通,2例患者部分开通,溶栓成功率为87.5%,溶栓成功率高于文献报道,考虑主要原因我们术中溶栓尽可能开通大部分闭塞血管,对于合并严重狭窄,单纯溶栓开通不理想的联合支架植入,增加肝脏血流,从而提高了溶栓成功率,因此建议在早期HAT治疗用,经导管溶栓治疗应根据术中造影结果必要时联合球囊扩张或支架植入术等,提高治疗成功率。HAT溶栓治疗主要风险为出血,严重者可能导致患者死亡;林婷等报道9例溶栓患者中有5例患者发生不同程度出血,出血风险为55.5%[4],本组研究中有1例患者溶栓第2天出现腹腔大出血,被迫中止溶栓,后急诊行二次肝移植,出血风险为12.5%,相比报道的出血风险稍低,考虑主要与我们术中及术后溶栓尿激酶剂量相对减少有一定关系。张华等人报道HAT介入治疗后肝动脉1年通畅率为82%[10],而本组研究中7例患者至随访截止为止,肝动脉1年通畅率为57.1%,相比文献报道偏低,考虑主要与样本量过少有关,同时与我们较少使用支架植入有一定关系。
HAT发生可能导致胆道缺血;既往有研究报道,胆管上皮由胆管细胞组成,其动脉血供来源于肝动脉[11];在体外研究中观察到,在肝细胞中,与肝细胞或 Kuppfer 细胞相比,胆管细胞似乎对缺血更敏感,当肝脏血流量中断数小时,即可以导致了胆管细胞缺血坏死[12],从而引起胆道相关并发症如胆道狭窄、胆道扩张、胆道感染等发生。HAT经积极治疗后开通肝动脉,但由于可能存在缺血时间超过数小时,患者在长期随访中扔可能出现较高的胆道并发症风险,有研究表明,非吻合口处胆道并发症主要与HAT有关[13]。本组研究中,7例溶栓治疗有效患者,至随访截止时,有3例患者出现胆道相关并发症,其中1例因胆道感染最终移植肝功能衰竭死亡,其余4例患者未出现胆道相关并发症,进一步分析3例出现胆道并发症患者均为第一次造影术中未完全溶通血栓,可能导致缺血时间延迟,最终导致了胆道并发症出现,因此HAT发生后应尽快行介入治疗,开通血管,并尽可能在第一次治疗术中溶通血管,减少缺血时间,从而减少后期胆道并发症的发生。在溶栓有效地7例患者中,除外1例患者因胆道感染最终死亡,其余6例患者截止最后随访时肝功能均无明显异常,提示及时介入治疗能够有效挽救移植肝,改善患者预后。
综上所见,血管内介入治疗对肝移植术后早期HAT有较好的临床治疗作用,能及时开通血管,挽救移植肝,减少移植肝失功能,可作为肝移植术后早期HAT的常规治疗方法。但由于本研究样本量偏小,数据可能存在一定的偏差,有待进一步扩大样本量进行研究。
