高脂饲料对草鱼生长、肝脏脂肪蓄积、脂肪酸组成及肠道微生物的影响
2023-05-12高科迪任艳华樊海莹张玉茹
高科迪,任艳华,樊海莹,张玉茹*
(1.河南师范大学水产学院,河南 新乡 453007;2.河南省水产动物养殖工程技术研究中心,河南 新乡 453007)
随着我国经济的发展,淡水鱼养殖市场需求不断增加,再加上养殖者对经济效益的更高追求,我国淡水鱼养殖业正朝着密度增高、投入增多和集约化养殖的方向阔步进发。但在高密度养殖模式下,草鱼肝脏中脂肪的过度蓄积会诱导脂肪肝等代谢性疾病的产生,影响草鱼肝脏的代谢功能,进而影响草鱼肉质,降低养殖效益[1]。哺乳动物中的研究表明,高脂饮食可显著破坏小鼠的脂质代谢能力[2];鱼类中的研究也发现,高脂日粮对鲤鱼肌肉中粗蛋白含量无显著影响,但对粗脂肪含量的影响则相反,同时也发现,饲料中适量降低蛋白质、添加脂肪可以促进鲤鱼生长,降低饲料成本[3]。此外,高脂食物饲喂导致小鼠结肠屏障功能受损、肠道微生物菌群失调[4],进而引起代谢紊乱和疾病的发生。
作为“四大家鱼”之一,草鱼(Ctenopharyngodon idellus)是我国主要的养殖鱼类,由于其养殖成本低、养殖技术完善、成活率高等特点,广受渔民青睐。2017年以来,我国草鱼养殖产量逐年递增,2020年达到了5.57×103kt[5]。为了探究高脂食物对草鱼幼鱼的影响,本研究以草鱼幼鱼(10.22±0.10 g)为研究对象,设置对照组和高脂组共两组实验,养殖草鱼8周后,分别对草鱼的生长性能、血清生化指标、肝脏脂肪蓄积、不同组织脂肪酸成分及肠道微生物进行检测,以期阐明高脂饲料对草鱼营养成分、脂肪蓄积和肠道微生物菌群等的综合影响,为草鱼饲料配方优化、营养品质改良等提供借鉴和参考。
1 材料与方法
1.1 实验鱼和饲料
本实验草鱼均购自郑州市金水区兴达水产养殖场,在河南师范大学水产学院养殖基地驯养两周,然后选取120尾初始体重为10.22±0.10 g的健康的幼草鱼,随机分为两个组,每组设置三个重复,每个重复20尾。正式养殖8周,每天饲喂三次,时间为8:00、12:00和18:00,整个养殖期间保证光照周期为12 L:12 D,温度保持在23±1℃。采样前禁食24 h。
配置两组等蛋白的饲料,其中对照组脂质含量为2%(实测值为2.53±0.38%),试验组脂质含量为6%(实测值为5.97±0.88%),用鱼油和大豆油作为高脂添加源,其他成分两组保持一致(表1)。
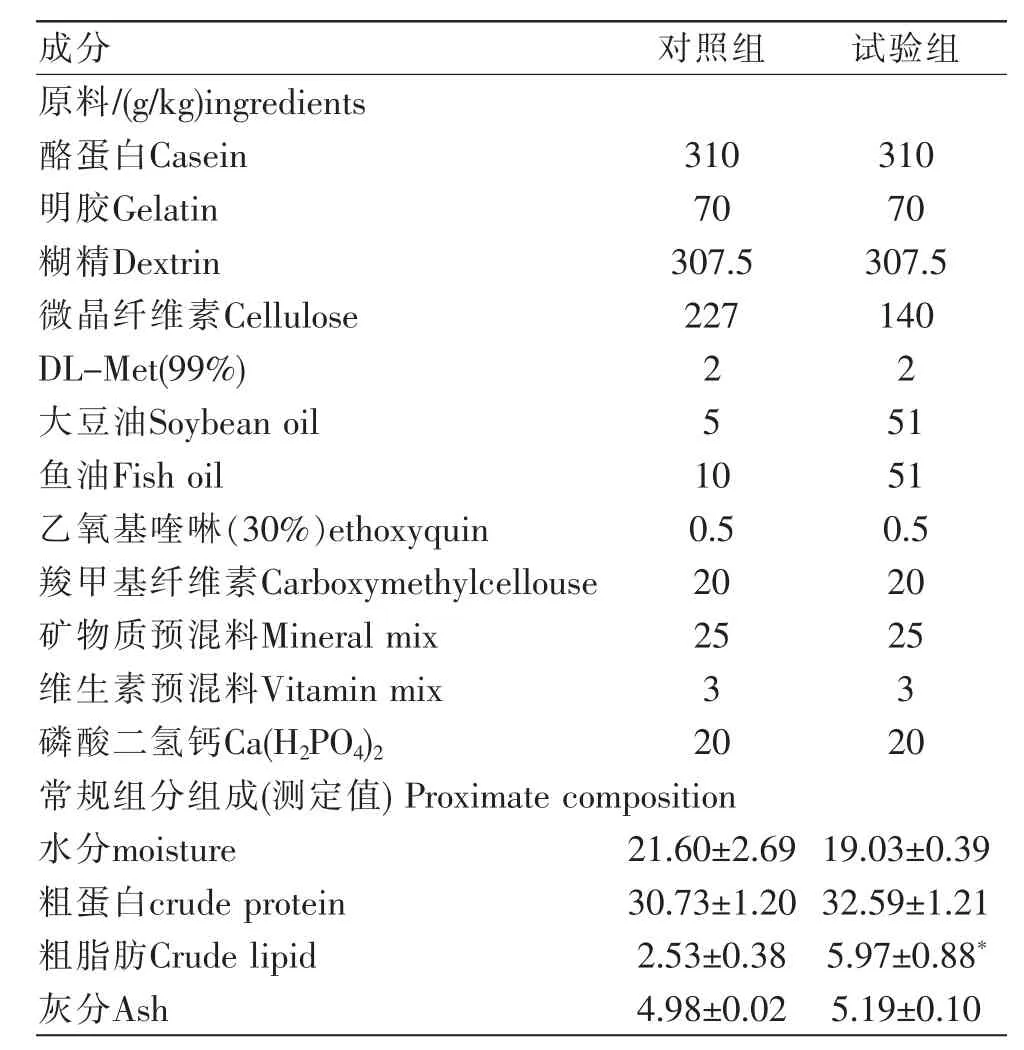
表1 饲料配方及营养成分组成
1.2 样品收集
养殖实验结束后,样本采集前,用MS-222(100 mg/L)对草鱼进行麻醉处理,然后对体表进行消毒并测量其体长;每桶随机取3条鱼进行解剖,取其肝脏、肠道、肌肉液氮速冻,然后置于-80℃中保存,之后冷冻干燥24 h,研磨粉碎,用于脂肪酸成分测定;另外,每桶随机取3条鱼,进行腹部解剖,取肝脏用于切片的制作,并解剖肠壁,取肠道内容物,用于肠道微生物检测。
1.3 生长性能测定
各生长指标计算公式如下:
增重率WGR/%=(Wt-Wo)/Wo×100
特定生长率SGR/%=[Ln Wt-Ln Wo]/(d)×100
饲料系数FCR=F/(Wt-Wo)
脏体指数VSI/%=Wv/Wt×100
肝胰指数HIS/%=WL/Wt×100
肥满度CF/(g/cm3)= Wt/ L3×100
存活率SR/%=成活尾数/总尾数×100
式中—Wt末体质量(g),Wo初体质量(g),d饲养天数,F饲料消耗量(g),Wv内脏重(g),WL肝胰重(g),L体长(cm)
1.4 血清生化指标检测
实验结束后,分别从对照组和试验组随机挑选6尾草鱼进行尾静脉采取血液,放在常温下静置30分钟,于4℃冰箱中放置3小时,4℃、3000 rpm离心15分钟,分层后取上清液,将其置于-80℃的冰箱内保存,各项指标的检测方法参考试剂盒说明 (均购买自南京建成生物工程研究所)。
1.5 脂肪酸成分分析
按照课题组已发表文章方法[6],称取3.0 g左右的样品,用氯仿/甲醇(2:1)溶液萃取组织中脂质,使用美国Agilent 7890B气相色谱仪测定肝脏、肠道和肌肉中的脂肪酸成分,采用百分比的方法计算组织中脂肪酸含量。
1.6 肝脏组织切片
取适当的肝脏,用4%多聚甲醛固定24 h,对草鱼肝脏组织样品进行石蜡包埋、切片,并用苏木精-伊红(HE)染色和油红染色,于显微镜下对草鱼肝脏形态的变化进行观察和拍照。
1.7 微生物组测序
按照试剂盒(Takara)使用说明书提取肠道微生物组DNA,使用紫外分光光度计(nanodrop)测定肠道微生物组DNA浓度。实验以V3-V4区通用引物进行PCR扩增[7],经纯化和定量后,送至检测公司(美吉生物)进行高通量测序及测序结果生物信息学分析。本实验共构建6个测序文库,其中对照组3个平行(C-1、C-2、C-3),试验组3个平行(T-1、T-2、T-3)。
1.8 数据统计分析
用Excel 2010对实验结果进行分析,结果用平均值±标准差表示,各项指标对应的数值运用SPASS 22.0进行单因素方差分析,P<0.05视为存在显著性差异。
2 结果与分析
2.1 高脂饲料对草鱼生长性能的影响
饲喂8周之后,分析草鱼生长性能指标发现,试验组草鱼的增重率和特定生长率高于对照组;而试验组饲料系数、脏体指数、肝胰指数和肥满度均低于对照组,其中肝胰指数和肥满度具有统计学差异(P<0.05)(表2)。
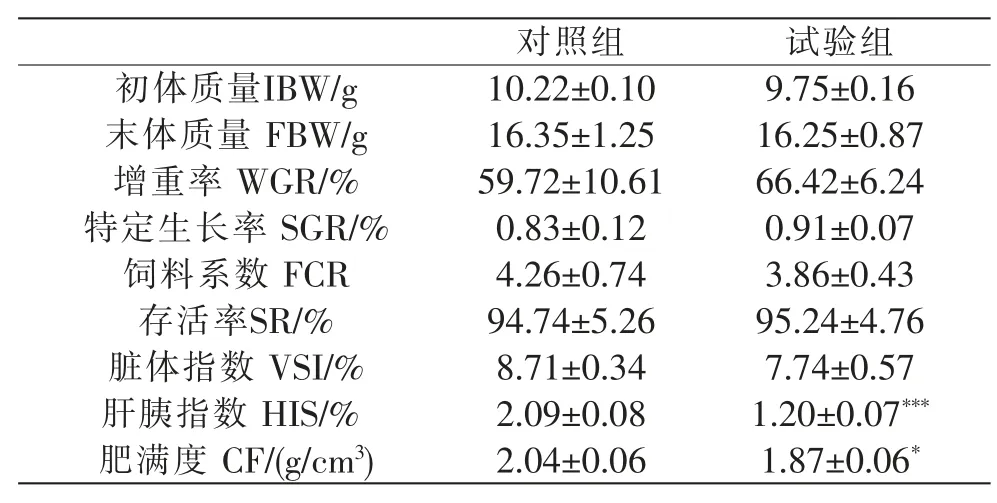
表2 草鱼生长性能和生物学指标
已有研究表明适当提高饲料中的脂质含量可以促进鱼类的生长[8,9]。但本研究中草鱼的生长性能差异不显著,这可能是由于养殖系统不完善等环境因素造成的。比如,本研究使用的简易养殖系统没有自动杀菌、水体清洁及过滤等功能,实验过程中,为了保证水体质量,每天更换桶内1/3的养殖水,频繁的换水会造成鱼体应激反应,进而导致摄食下降,由此可能会对鱼正常生长带来不利影响。此外,也有研究表明,在饲料中添加不同种类的脂肪源,草鱼的生长程度不同,说明不同脂肪源对草鱼的生长性能有不同的影响[10]。
2.2 高脂饲料对草鱼常规生理生化指标的影响
试验组草鱼血清中TG含量显著低于对照组。同时,实验组草鱼的TC、ALT、LDL-C、MDA、CAT、TAOC和T-SOD含量显著高于对照组(P<0.05)(表3)。
TG是血脂的主要成分之一,在动物机体中具有存储能源物质、保护机体脏器的作用。但是过量的TG是常见代谢性疾病的成因之一。在本实验中,试验组的TG含量降低,可能是我们使用的鱼油当中含有多聚不饱和脂肪酸,多聚不饱和脂肪酸可促进鱼体的生长发育并且可以降低过多的TG的含量,因此在试验组草鱼TG的含量会降低。同时,已有研究也发现随着草鱼饲喂高脂饲料时间的增加,草鱼体内的各项生化指标(TC、ALT、ALT、MDA、T-SOD和CAT)的水平普遍显著升高(P<0.01)[11],与本实验所得结果一致。
2.3 高脂对草鱼肝胰脏脂肪蓄积的影响
观察HE切片发现,对照组肝细胞形态正常,细胞核位于近中央位置,但试验组肝细胞脂质空泡增大,且细胞变形。与之类似,油红切片显示,试验组草鱼肝细胞中脂滴的数量和大小显著大于对照组。说明高脂食物饲喂草鱼可增加草鱼肝胰脏中脂肪的蓄积(图1)。
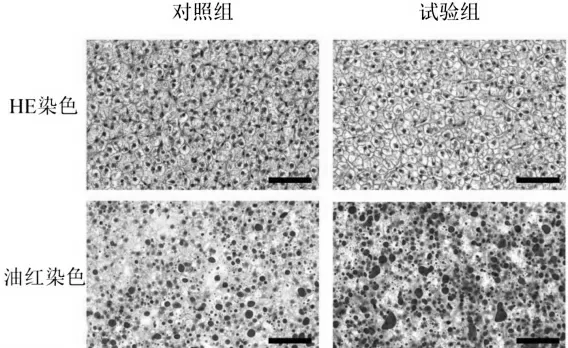
图1 草鱼肝胰脏HE染色切片及油红染色切片标尺:50μm
众多研究发现,在高脂饲料的长期胁迫下,草鱼的肝胰脏代谢紊乱,且肝胰脏组织也有脂肪的蓄积,从而出现病理上的损伤[12,13]。同时,黄春红[14]对草鱼的研究发现,肝胰脏的部分基因会随着肝胰脏脂肪含量的增加而增多,而机体内关于脂肪的分解的过程被慢慢阻止,脂肪合成的路径活跃,这可能也是肝胰脏的脂肪蓄积的原因之一。与之类似,本实验研究肝胰脏细胞脂肪的蓄积增加,但具体的分子机制还需要作进一步的研究。
2.4 高脂饲料对草鱼脂代谢关键组织脂肪酸成分的影响
肌肉是脂肪酸蓄积的主要组织,其脂肪酸成分主要由肝脏和肠道转运而来,肌肉内的脂肪酸组成直接反应了鱼体的营养价值。因此,本实验分析了对照组和试验组草鱼肌肉、肠道和肝脏中的脂肪酸组成及含量(表4)。
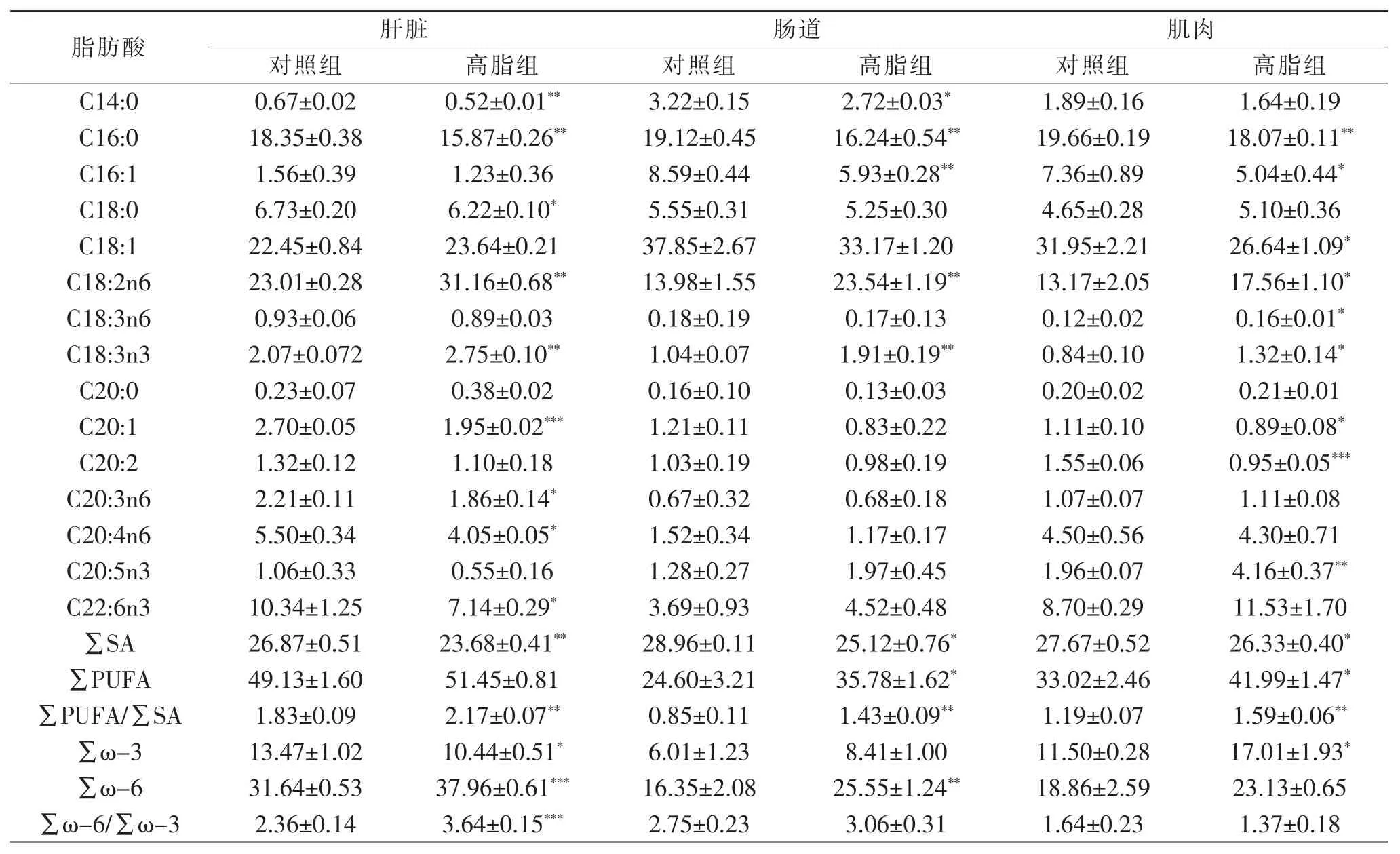
表4 草鱼肝脏、肠道、肌肉脂肪酸组成
试验组草鱼肌肉中C16:1、C18:1和C20:1等单不饱和脂肪酸 (MUFA)的含量均显著低于对照组 (P<0.05);试验组EPA的含量显著高于对照组(P<0.01);试验组饱和脂肪酸(∑SA)含量显著低于对照组(P<0.05),而多不饱和脂肪酸(∑PUFA)和∑PUFA/∑SA的含量显著高于对照组(P<0.05)。草鱼肠道中∑SA、∑PUFA和∑PUFA/∑SA的变化趋势和肌肉中相同。试验组草鱼肝脏内∑SA和∑ω-3含量显著低于对照组,而∑ω-6含量显著高于对照组(P<0.05);同时,试验组肝脏中C18: 2n6和C18: 3n3的含量显著高于对照组,而C20: 3n6、C20:4n6和C22:6n3的变化趋势与之相反(P<0.05)。
综上,在草鱼肝脏、肌肉和肠道中,试验组∑SA含量显著降低;而C18: 2n6和C18: 3n3等PUFA含量显著增加(P<0.05)。韩光明等[11]在研究中发现,随着饲料中脂肪水平提高,肌肉中∑PUFA含量显著升高,这与Wang[12]等对中华绒螯蟹的研究、Gao[13]等对泥鳅的研究和Xu[14]等对青蟹的研究结果是一致的,本研究结果与上述结果一致。同时,本研究中高脂组主要是增加大豆油和鱼油的含量来提高脂肪含量,而大豆油中亚油酸含量高达50%-60%[15],鱼油中的∑PUFA尤其是EPA和DHA含量也较高[16],因此,本研究中草鱼肌肉、肠道和肝脏中不饱和脂肪酸含量的显著性增加可能是由于高脂饲料中大豆油的亚油酸含量过高以及鱼油中∑PUFA含量较高造成的。
2.5 高脂食物对草鱼肠道微生物菌群的影响
本实验共共得到333919条高质量序列,平均每一个样本测序量为55653条序列(表5)。大多数序列长度在410-420 bp之间,也有一部分序列为420-440 bp之间。
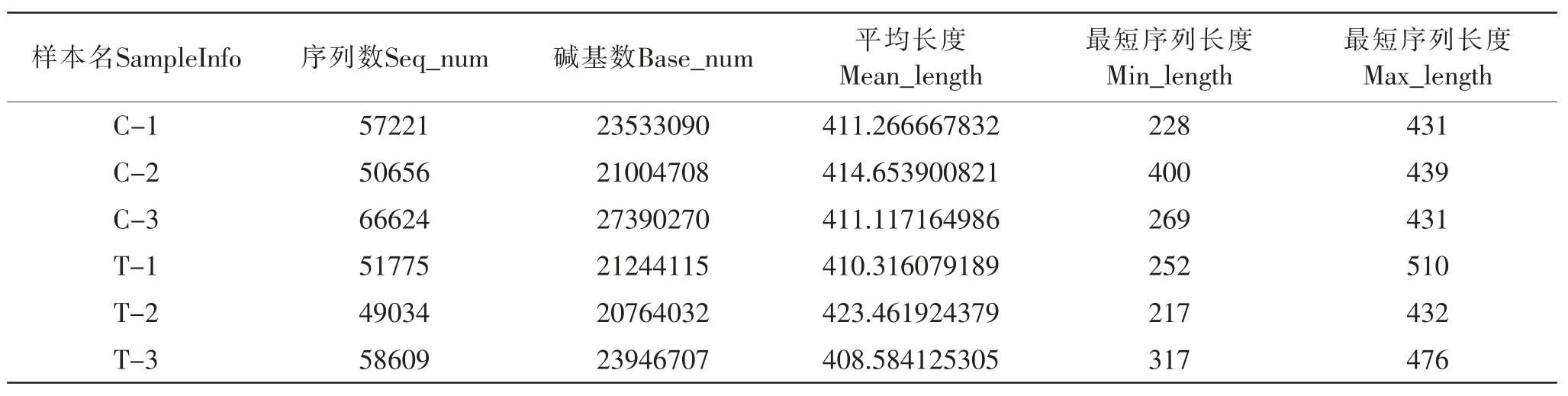
表5 16S rRNA高通量测序数据统计
统计样品中的OTU数目及其对应比例,构建OTU丰度曲线(Rank-abundance曲线),发现OTU丰度曲线平滑下降,表明样本的物种多样性高(图2 A)。从测序深度来看,coverage指数趋近于1(图2 B),表明测序结果能反映样本的实际结果。试验组OTU水平香浓指数比对照组高,但差距不大。说明本次测序的质量比较好,可以代表送样样本肠道微生物菌群的普遍情况。
从OTU水平分析来看,试验组的OTU数量多于对照组,且试验组的肠道菌群的群落多样性较高,但无统计学差异(图2 C);试验组与对照组共有595个重复OTU,试验组有135个独特的OTU,而对照组有194个独有的OTU(图2 D)。
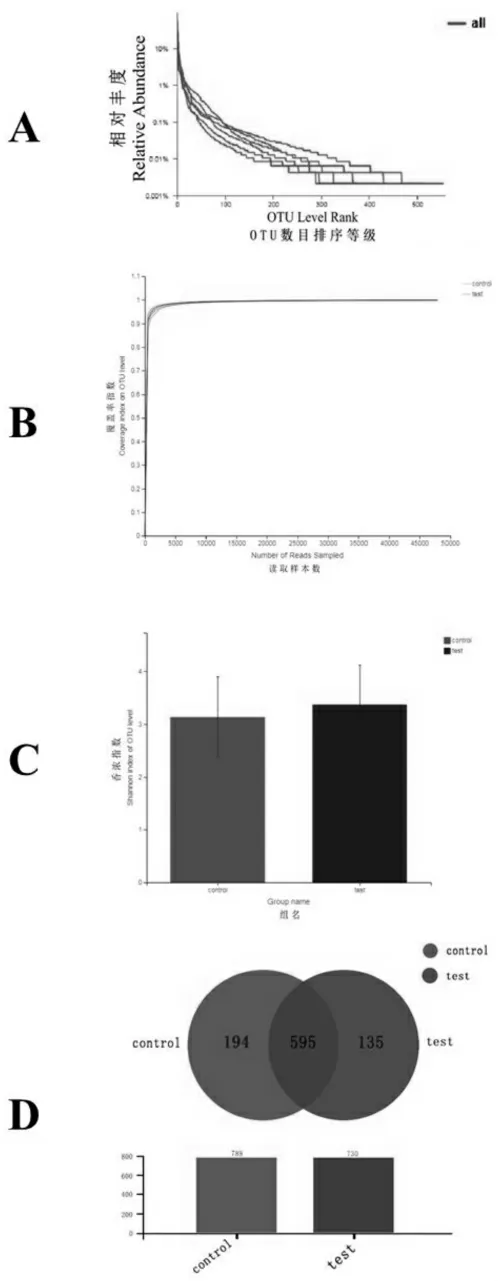
图2 Rank-abundance曲线(A)覆盖率指数图(B)香浓指数分析(C)维恩图(D)
从菌种分析来看,对照组中变形菌门(42%)、梭杆菌门(15%)和拟杆菌门(17%)为优势菌群,实验组中的优势菌群为变形菌门(61%)和放线菌门(13%)(图3 A)。PCA分析发现(图3 B),C-2/C-3以及T1/T3呈现聚集分布的特点。轶和检测分析发现对照组与实验组在变形菌、放线菌、梭杆菌和拟杆菌上均有含量变化,但差异具有不显著性(P>0.05)(图3 C)。这可能是对照组中C-1样本差异太大造成的,具体的原因仍需在未来的研究中进一步深入阐明。
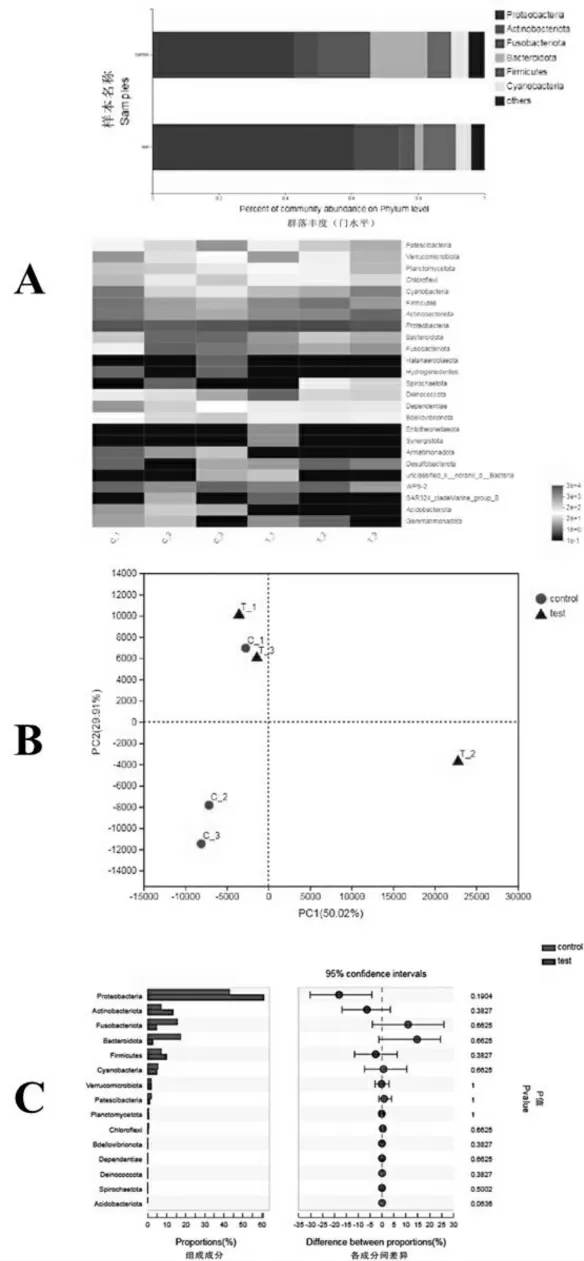
图3 样本间菌种差异分析(A)PCA分析(B)轶和检测分析图(C)
变形菌具有碳的代谢功能,与食物消化吸收有关,其次还具有降解角蛋白的功能[17]。变形菌作为对照组与试验组共有的绝对优势菌群,其益生作用体现较为明显。梭杆菌为对照组的优势菌群,它是一类极具潜力的鱼类土著益生菌,梭杆菌门丰度的高低与鱼体健康状态存在显著关联[18]。若机体受到外来病毒攻击时,梭杆菌的数量和丰度就会明显下降。实验结果也印证了试验组草鱼肠道中梭杆菌的含量远低于对照组,推测在高脂食物添加的情况下,由于各种代谢性疾病或其他原因导致鱼体免疫力降低,从而使潜在病毒或外来病毒侵染鱼体进而导致梭杆菌数量降低。
4 结论
饲料中脂肪含量为6%时,草鱼的生长性能并未出现显著变化,肝脏脂肪蓄积显著增加,但肝脏、肌肉和肠道中∑SA含量显著降低,而∑PUFA含量显著增加(P<0.05),在一定程度上提升了草鱼肌肉品质。与对照组相比,试验组草鱼在肠道微生物菌群数量上无统计学差异。上述研究结果可为草鱼的健康养殖提供依据,但高脂食物对草鱼脂肪酸组成及肠道菌群的具体影响机制在未来的研究中仍需深入阐明。
