心血管植介入体表面抗凝涂层近十年进展
2023-05-10王禹贺蒙奎霖李永健陈皓生
王禹贺, 李 燕, 蒙奎霖, 满 佳, 李永健, 陈皓生*
(1.清华大学 摩擦学国家重点实验室, 北京 100084;2.山东大学 高效洁净机械制造教育部重点实验室, 山东 济南 250061)
心血管疾病已成为全世界范围内首要的致死原因.世界卫生组织的数据显示,每年有1 790万人死于心血管疾病[1].为应对心血管疾病及带来的器官和组织病变,心血管植介入体,如人工心脏瓣膜[2]、血管支架[3]、心室辅助装置[4]和导管[5],已被广泛用作退化器官的替代物.心血管器械中的摩擦学问题根据摩擦副的不同可分为3类[6]:(1)心血管设备中的运动部件产生的机械磨损和摩擦;(2)血流在各种心血管设备的表面产生的流体摩擦;(3)在植入或原位正常功能过程中,装置与人体软组织之间发生的摩擦.其中,血流在植介入体表面形成的流体摩擦会触发异常的凝血机制,从而形成血栓,这给心血管植入器械的设计和应用带来巨大的挑战.
1964年,Davie等[7]和Macfarlane等[8]首次描述了凝血行为,并概述了通过蛋白水解剪切激活的酶原级联的基本原理.在正常人体内,凝血和纤溶系统之间复杂的相互作用维持着体内止血行为的平衡,然而,心血管植介入体的人工表面会打破这种平衡,并通过凝血机制中的接触激活途径引发血栓[9].植介入体的表面由一系列相互关联的过程促进凝血,包括蛋白质吸附、血小板和白细胞黏附、凝血酶生成和补体激活[10].血浆蛋白在植介入体表面的快速吸附是形成血栓的第一步,一般在几分钟内完成;随后,凝血酶在材料表面产生并促进凝血级联反应,如纤维蛋白原转换成纤维蛋白.随后,血流在植介入体表面产生流体摩擦,表面吸附的纤维蛋白原与血液中的血小板发生黏附,并进一步引起血小板的激活,并为凝血酶的生成创造1个病灶,最终形成血栓.目前,主要通过口服抗凝药物与对植介入体表面进行抗凝修饰来预防血栓[11].
根据植介入体表面与血液接触的异常凝血机理,其抗凝路线可分为阻断凝血路径和实现介入器械周围组织正常化两类.阻断凝血路径主要包括药物涂层和生物惰性涂层,其中药物涂层是将活性抗凝药物固定在植介入体表面上,调节凝血和补体系统,并减少进一步的炎症反应;生物惰性涂层通过减少植介入体表面和血液成分之间的相互作用来抑制血液活化.而植介入器械周围组织正常化通过模拟天然细胞内皮的表面来实现抗凝.
抗凝药物涂层主要包括肝素、血栓调节素和水蛭素等.其中,肝素是目前最重要的抗凝药物之一.肝素于1963年首次作为涂层被应用于人工心脏瓣膜[12],现在已广泛应用于商业心血管植介入体.肝素的五糖序列可以与抗凝血酶结合,从而改变抗凝血酶的构象,并将抗凝血酶介导的各种丝氨酸蛋白酶凝血因子的抑制率提高100~1 000倍.在相关文献[13]中可以找到关于医用肝素涂层的详细论述.血栓调节素(Thrombomodulin, TM)是一种由内皮细胞(Endothelial cell, EC)表达的跨膜蛋白,于1992年首次应用[14],其原理是通过凝血酶-血栓调节蛋白复合物激活蛋白C,激活的蛋白C使凝血因子Va和VIIIa失活,从而抑制凝血酶的产生[15].生物惰性涂层包括有机惰性涂层和无机惰性涂层,作为血液中最为丰富的蛋白质,白蛋白自1984年以来,已被广泛用于减少纤维蛋白黏附和减少聚乙烯材料上的血小板激活[16].另一种有机聚合物,聚乙二醇(Polyethylene glycol, PEG),于1991年开始应用[17].PEG通过“接枝”的方法共价连接到表面,形成线性聚合物刷,进而排斥蛋白质吸附.1991年以来,两性离子,如2-甲基丙烯酰氧乙基磷酰胆碱(2-Methacryloyloxyethyl phosphorylcholine, MPC)也被开发出来,其具有减少补体激活和蛋白质黏附效果[18].这类涂层最突出的特点是显著减少蛋白质黏附和血小板活化.此外,尽管聚多巴胺(Polydopamine, PDA)不直接参与抗凝,但其可以自发吸附到不同的表面上,并为涂层材料提供优异的生物相容性[19].随后,受猪笼草的启发,Wong等[20]在2011年开发了润滑、注入液体和多孔表面(Slippery, liquid-infused, porous surface, SLIPS)的概念.在针对血液的SLIPS技术中,通过将平滑且无缺陷的液体全氟化碳(Liquid perfluorocarbons, LP)固定在植介入体表面,涂层可以实现排斥血液中的蛋白和血小板[21]的功能,并具有自修复能力.无机生物惰性涂层的材料主要包括类金刚石(Diamond-like carbon, DLC)[22]、热解炭(Pyrolytic carbon, PyC)[23]和钛[24]等.DLC是无定形碳的亚稳态形式[25],该材料于1953年被研制出来,并在1971年首次被命名为DLC[22].由于DLC的疏水性和表面光滑性,已广泛应用于心室辅助装置[26].另一种碳基涂层PyC是一种由碳氢化合物气体热解形成的合成材料,自1969年以来已成为机械心脏瓣膜上最受欢迎的涂层.这些无机涂层一般具有较好生物相容性和优异的物理性能.
实现植介入体周围组织正常化一般通过模拟血管壁表层的天然构造或功能以实现优异的血液相容性.如将EC预先接种在植介入体表面,可以有效降低植介入体血栓形成和新生内膜纤维增生.这种方法于1978被首次报道[27].此外,1997年发现的内皮祖细胞(Endothelial progenitor cell, EPC),可以快速实现自我内皮化[28].然而,直接固定EC十分复杂.因此,纤连蛋白[29]和胶原蛋白[30]等细胞外基质蛋白以及能够在体内捕获EC的抗体或特异性生长因子,如CD34抗体[31]也得到广泛应用.此外,TiO2涂层也可以用来诱导(引导)内皮细胞黏附及增殖[32].
典型抗凝涂层的历史以及四种常见的心血管植介入体如图1所示,相关抗凝涂层的原理列于表1中.在本文中,我们重点介绍了近10年来四种常见心血管植介入体抗凝涂层的研究进展,包括人工心脏瓣膜、血管支架、心室辅助装置和导管.为了便于读者根据其感兴趣的植介入体查阅信息,本文中按照抗凝涂层技术所应用的植介入体分别进行综述.
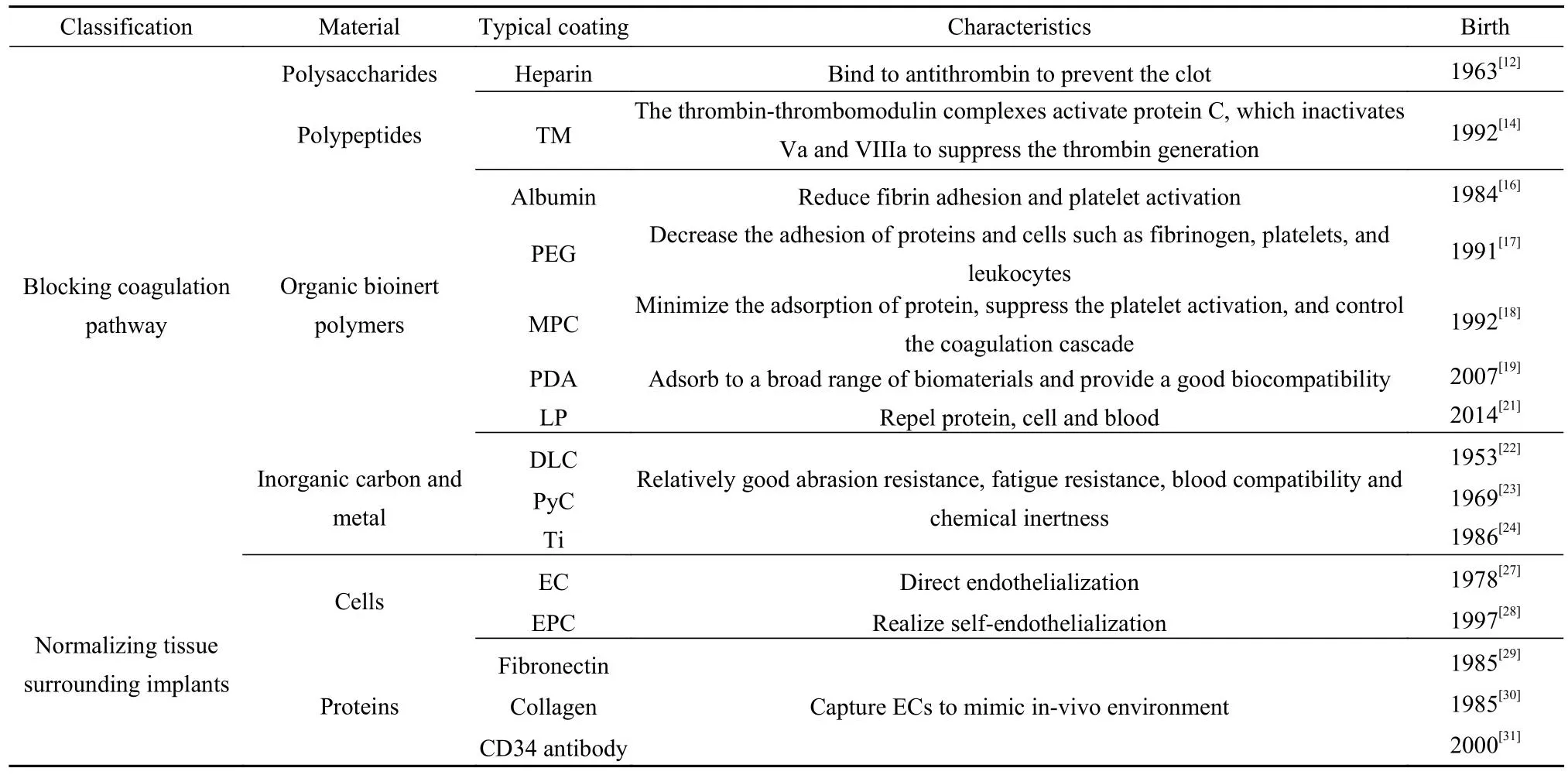
表1 心血管植介入体上典型抗凝涂层的原理Table 1 Principle of typical anticoagulant coatings on cardiovascular implants
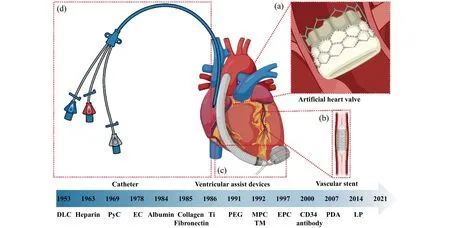
Fig.1 The cardiovascular implants and history of anticoagulant coatings: (a) artificial heart valve; (b) vascular stent;(c) ventricular assist devices; (d) catheters (created with BioRender.com.)图1 心血管植介入体和抗凝涂层的历史:(a)人工心脏瓣膜;(b)血管支架;(c)心室辅助装置;(d)导管
1 人工心脏瓣膜
人工心脏瓣膜已被广泛用于替代病理性心脏瓣膜[33].自1952年第一个人工心脏瓣膜被植入体内以来[34],人们已开发出多种人工心脏瓣膜.如图2所示,根据其材质和制作工艺可以分为机械心脏瓣膜(Mechanical heart valve, MHV)、生物心脏瓣膜(Bioprosthetic heart valve, BHV)和组织工程心脏瓣膜(Tissue engineered heart valve, TEHV)[35].但是,人工心脏瓣膜表面与血液的接触很容易引起血栓,并导致瓣叶运动减少、瓣叶接合受损、瓣叶增厚、有效通道面积改变、跨瓣压力梯度增加和经瓣反流等情况[36].如果缺乏抗凝手段,患者很容易发生中风[37].因此,人工心脏瓣膜置换后需要长期抗凝,目前有很多研究尝试通过抗凝涂层来实现人工心脏瓣膜表面的全面抗凝.
1.1 阻断凝血路径
肝素是人工心脏瓣膜上使用最重要的抗凝涂层之一[41].最近的研究集中在肝素和生物分子联用策略,以实现抗凝血和增强生物相容性.与肝素联用的碱性成纤维细胞生长因子(Basic fibroblast growth factor,bFGF)通过逐层沉积技术作为多种功能分子被包被在脱细胞的猪主动脉心脏瓣膜瓣叶上[42].结合到瓣叶上的肝素和bFGF的量与培养介质中的浓度成比例,在生理条件下,肝素和bFGF从包被的瓣叶中释放可以保持生物活性持续4天以上.此外,肝素-壳聚糖[43]、肝素-血管内皮生长因子(Vascular endothelial growth factor,VEGF)[44]和肝素-基质细胞衍生因子(SDF-1α)[45]也被用作多重抗凝药物表面.体内试验结果表明,这类多层膜可以减少血小板的黏附和活化,并被血液中的内皮祖细胞覆盖.此外,研究发现单独的肝素涂层可以减少生物瓣膜上的组织钙化[41].
利伐沙班(Rivaroxaban, RIVA)是一种口服Xa因子抑制剂,通过抑制游离Xa因子和凝血酶原酶活性以及凝块结合的Xa因子,可以有效阻断凝血酶生成从而提供持续的抗凝作用.王云兵等[38]将载有RIVA的纳米凝胶和可分离的PEG修饰在生物瓣膜表面,建立了一种多合一的方法来修饰生物瓣膜,使其具有长期抗血栓形成性能,并能加速由葡萄糖触发的内皮化.图2(a)所示为该涂层的抗凝原理,葡萄糖氧化酶催化葡萄糖氧化产生H2O2和局部酸性环境,产生的H2O2刺激纳米凝胶释放RIVA以获得持续的抗血栓功能.结果表明,该表面黏附的血小板很少,证明了RIVA的纳米凝胶涂层具有良好的持续抗凝能力.此外,Wang等[46]进一步通过RIVA结合抗炎药物涂层在生物瓣膜上实现了材料和组织良好的相容.
有机和无机生物惰性涂层均已应用于人工心脏瓣膜.对于有机生物惰性涂层,PEG基的水凝胶被用来防止蛋白质黏附.Grande等[47]首先将表面胺基与NHS-PEG-丙烯酸酯反应,同时让葡萄糖吸收到瓣膜主体中.之后,将葡萄糖氧化酶、PEG二丙烯酸酯(PEGDA)和铁离子加入到体系中,引发自由基聚合,将PEGDA水凝胶结合到表面的丙烯酸酯位点.结果显示在瓣膜样品上形成的薄层能够有效避免蛋白质黏附,而不显著影响表面机械性能.此外,Roseen等[48]还尝试了在表面沉积PEG双丙烯酰胺的水凝胶涂层.在本研究中,将表面黏附性、机械性能和固定性能方面对涂覆的样品与生理组织和未涂覆的戊二醛固定的组织进行比较.研究结果显示沉积的涂层在整个瓣膜瓣叶表面是连续的,并且样品显示其在蛋白质黏附和机械硬度方面可恢复至生理水平.此外,已知稳定交联的纤维蛋白较难形成血栓.因此,通过孵育15 min可以将纤维蛋白凝胶涂覆在快速降解的冠形聚醚醚酮增强环上[49],该方法制备的瓣膜在长期试验中功能良好,移植物的重塑导致瓣膜组织具有较佳的稳定性.
无机涂层,如PyC[50]、超纳米晶金刚石[51]、石墨烯[52]以及氧化钛和氮化钛[53]已应用于机械瓣膜中.尽管PyC由于其相对良好的耐磨性、抗疲劳性、血液相容性、化学惰性和无毒而成为机械瓣膜中最受欢迎的涂层,但目前基于PyC的机械瓣膜仍需要配合使用华法林来预防血栓.另一方面,超疏水涂层在抗凝方面也显示出潜力.Hatoum等[39]在瓣膜表面沉积了商业化的超疏水涂层[Rust-oil never wet clear spray,图2(b)],该涂层的超疏水效应减少了血凝块的黏附.但是,由于瓣膜表面承受较高的剪切应力,涂层的血液动力学性能没有得到改善[39,54],进而影响了瓣膜的性能,超疏水抗凝涂层技术仍需要进一步改进.
1.2 组织正常化
EC预接种是一种有效的内皮化方法.例如,EC和成纤维细胞已经被成功接种到聚氨酯心脏瓣膜支架上[55].另外,固定SDF-1α和碱性成纤维细胞生长因子可以改善去细胞异种心脏瓣膜上内皮祖细胞的再细胞化,在搅拌生物反应器中得到了验证,可以促进再细胞化[56].然而,目前的预接种方法较为复杂.是将多种不同的细胞标记物应用于体内吸引EPC或EC.Jordan等[57]在猪肺动脉瓣的基底上涂覆了内皮祖细胞标记物CD133抗体.在移植到绵羊肺部位置之前,用自体内皮祖细胞重新接种基底或与CD133抗体结合.结果显示CD133抗体组在植入1个月后在涂层表面结合了EC,而未处理组和细胞接种组结合较少的EC或间质细胞.Schmidt等[58]实现了基于羊水来源祖细胞的心脏瓣膜.他们在研究中将胎儿人羊膜祖细胞从常规采样的羊水中分离出来,并通过CD133磁珠分选;之后,将CD133衍生的细胞接种到由可快速生物降解的聚合物制成的心脏瓣膜瓣叶支架上.分化的CD133+细胞通过内皮NO合成酶和TM表现出了EC的功能性特征,结果显示内皮化组织随细胞外基质成分的产生而形成.
除了抗体,细胞外基质蛋白涂层也可以加速自体体内的内皮化.图2(c)展示了一种细胞基质涂层的方法,该方法可增强聚苯乙烯-嵌段异丁烯-嵌段苯乙烯(SIBS)的生物相容性[40].细胞外基质涂层不仅减少了蛋白质和血小板的吸附,还抑制了免疫反应,并诱导了组织再生.此外,Lintas等[59]开发了基于细胞外基质的经导管主动脉瓣置换技术,通过绵羊的体外研究和体内急性研究,证明了包被细胞外基质的组织工程心脏瓣膜的可行性.此外,脱细胞心血管植介入体上的纤连蛋白表面涂层已被证明是可行的,并在体循环中持续至少8周[60].血管内皮生长因子已被用作细胞标志物,并与不同的生物相容性材料偶联用于内皮化.通过1,4-丁二醇二缩水甘油醚的交联,可以开发具有血管内皮生长因子-透明质酸水凝胶涂层的杂化心包[61].通过在体大鼠皮下植入模型,研究了人脐静脉EC在心包、血小板黏附和钙化上的黏附和生长潜力,研究结果显示有较少的血小板黏附.在另一项研究中,内皮生长因子-岩藻依聚糖的聚电解质多层膜被用于开发功能性生物心脏瓣膜[62],评估聚电解质多层膜涂层瓣膜的血液相容性、EC的黏附和生长潜力,结果展现了抗血栓形成和非钙化特性的能力.此外,Theodoridis等[63]研究发现,细胞通讯网络因子1 (Cellular communication network factor 1)被用于支持再内皮化.所有表面均未观察到血栓生成,老年绵羊中瓣膜基质细胞的再增殖显示了基质引导再生的能力,并证实了脱细胞基质对于老年个体心脏瓣膜置换的适用性.
1.3 挑战与展望
尽管人工心脏瓣膜已经发展了50多年,但依然需要面对复杂的血流动力学环境[64].人工心脏瓣膜上的抗凝涂层面临的主要挑战是长期承受由瓣叶运动和高剪切应力引起的机械磨损、摩擦以及动态流动条件,这将导致抗凝涂层的损失,并增加了抗凝涂层的工艺难度.药物或内皮化涂层因此很难牢固地修饰在机械瓣膜的表面,大多数机械瓣膜都是通过化学气相沉积法涂覆抗凝效果相对较差的无机涂层,机械瓣膜仍然容易形成血栓,更重要的是,机械瓣膜的设计使得其剪应力(150~380 Pa)超过了血小板的阈值,导致血小板的异常激活.因此,植入机械瓣膜后,患者通常需要长期口服抗凝剂和维生素K拮抗剂,如华法林,但这将增加出血风险.然而,由于使用寿命更长,机械瓣膜依然是大多数年轻患者的首选.对于生物瓣膜,由于戊二醛在制造过程中被用作基底,因而目前具有更好的生物相容性涂层的生物瓣膜在植入多年后容易钙化,直接影响了瓣膜的寿命.虽然有研究开发了一些抗钙化的策略,但仍缺乏长期实践检验,因此,生物瓣膜大多被老年病人选用.近年来,大量研究集中在新兴的组织工程心脏瓣膜的设计,由于其持续时间和抗凝作用的效果更均衡,因此在改善现有的瓣膜使用状况方面非常具有潜力,但是该方面的研究尚不成熟,仍缺乏有力的临床实践数据.
本节中涉及的抗凝涂层列于表2中.目前的抗凝涂层尚不能完全满足人工心脏瓣膜的要求,在过去的10年里,复合涂层因其多元的抗凝机理而备受关注,该涂层可以实现前期的阻断凝血途径和后期的组织正常化的有机结合,在抗凝效果和寿命上实现兼顾,尽管缺少有力的临床实践,但仍不失为一种有潜力的彻底解决人工心脏瓣膜凝血问题的理想抗凝涂层.
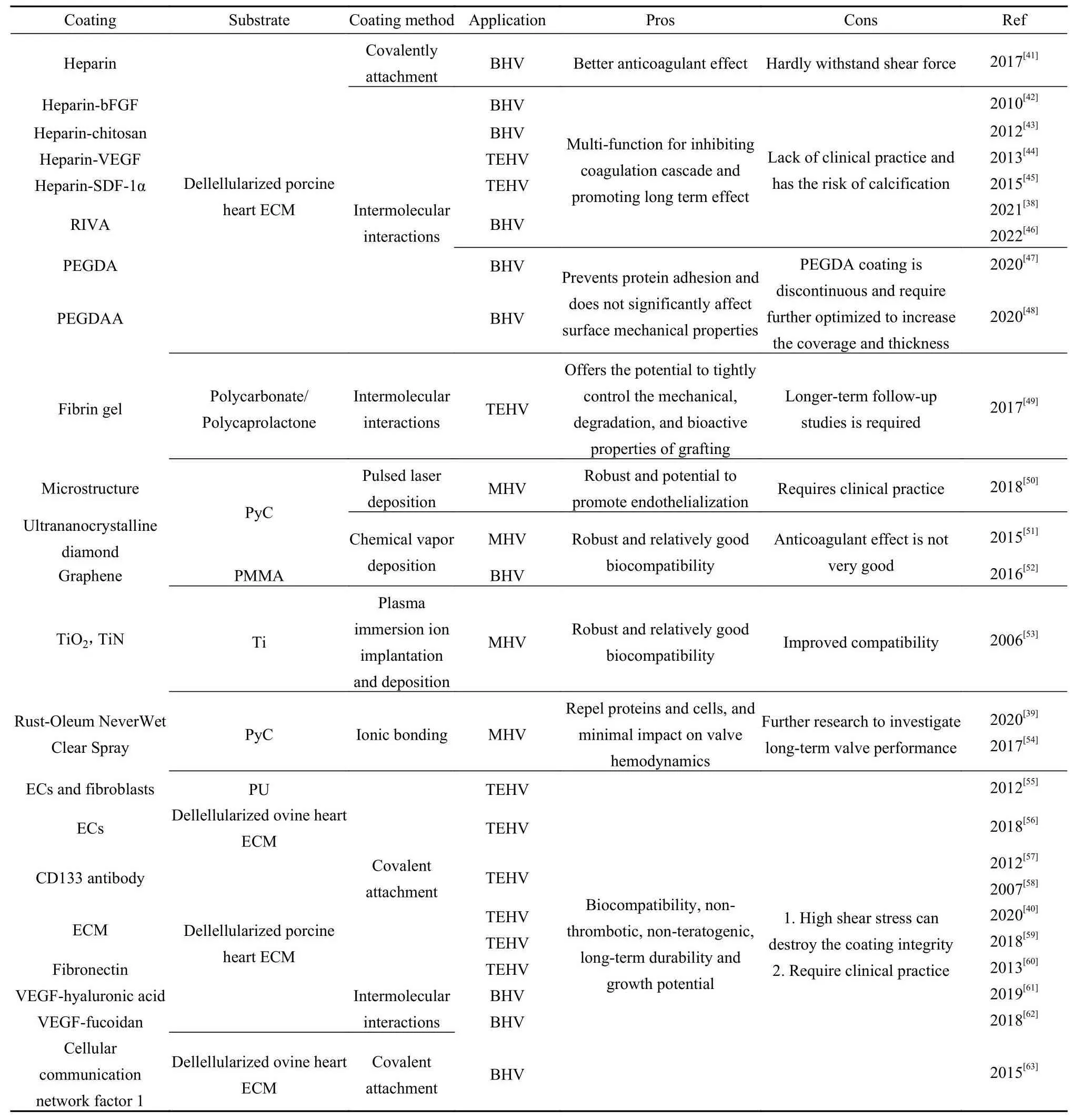
表2 人工心脏瓣膜的抗凝涂层Table 2 Anticoagulant coatings on artificial heart valves
2 血管支架
冠状动脉疾病是当前世界上三大致死原因之一[65-66],其特征为内皮下斑块破裂诱发血栓最终导致动脉狭窄.心血管支架作为一种支撑血管的植入器械,已经成为患者的“救命神器”,被列为本世纪十大医学突破之一[67].在结构上,支架是一种小型、复杂的圆柱形中空结构,其中包括一系列的支柱和连接元件[68-69].植入的支架起到维持体内血管内腔形状的作用[70].
经过科学家的努力,已经开发了三代支架以减少支架植入手术后的不良反应.从裸金属支架(Bare-metal stent, BMS)到药物洗脱支架(Drug-eluting stent, DES),再到最近研发的生物可吸收支架,该领域正在不断发展[71].遗憾的是,由于晚期再狭窄、血栓形成等临床并发症,目前的支架在很大程度上仍不能完全满足临床的需求.目前,在临床上首选的是金属支架,因为其比聚合物支架具有更好的机械性能和射线不透性[72].为了解决支架植入后血栓形成的问题,表面涂层技术得到广泛的研究,以提高血管支架的血液相容性,减少病人对全身抗凝的需求.黄楠等[32,73-76]在通过涂层药物或生物分子对金属支架进行修饰,以增强抗血栓形成、抗再狭窄和/或内皮化方面进行了大量研究,并在临床中得到广泛的应用.
2.1 阻断凝血路径
目前,血管支架中已经出现了一系列商业化的肝素涂层技术,如CORLINE® Heparin Surface[77]、Hepamed™涂层[78]以及Carmeda肝素结合[79]等.CORLINE®肝素表面由未分级肝素大分子复合物组成,其通过交联剂与多胺载体链共价连接[77].在Hepamed™涂层的设计中,聚乙烯基硅氧烷首先共价连接到支架表面,然后将表面接枝到聚乙烯基硅氧烷上,然后嫁接聚乙烯亚胺.最后,肝素与聚乙烯亚胺共价偶联[78].Carmeda肝素涂层使用肝素分子还原端和材料底物之间的单个共价键进行连接[79],进而生成稳定的非浸出涂层,厚度为数百纳米.
除了商业肝素涂层技术外,还有几种新型涂层技术.如图3(a)所示,使用内皮生理功能中的关键分子:肝素和NO来模拟内皮的涂层,即将肝素和产生NO的化合物硒代胱胺依次结合在含胺膜上[80].此外,还可以使用仿生三明治状逐层沉积来模拟EC功能.在该项研究中,壳聚糖和肝素作为聚电解质,同时使用儿茶素/铜(EGCG/Cu)复合物[81].该策略为心血管植入式医疗器械的改造提供了一种便捷、通用的方法.在另一项研究中,两个血管活性部分:可以生成NO的有机硒(SeCA)以及EPC靶向肽,通过生物正交缀合到支架表面[82],结果显示可以显著抑制血栓形成和平滑肌细胞(Smooth muscle cells, SMC)迁移,促进EPC募集和增殖,防止支架内再狭窄.
此外,受植物酚胺化学策略的启发,Qiu等[83]结合了植物多酚、单宁酸(TA)和凝血酶抑制剂比伐卢定(BVLD)的生物学功能,定制了具有多种表面功能的心血管支架.他们首先在支架表面制备了等离子体聚合烯丙胺的含胺涂层,然后基于酚胺化学(即迈克尔加成反应)在碱性溶液中依次偶联TA和BVLD,以实现TA和BVLD在支架表面的协同改性.结果表明,TA和BVLD的联合作用促进了支架的快速再内皮化,减少了体内的内膜增生,并减少了与再狭窄和晚期支架血栓形成相关的临床并发症.此外,结合抗凝和抗炎药物的血管支架涂层技术正在迅速发展.通过肝素/NONOate纳米颗粒(Hep/NONOates)为支架表面开发双药物缓释涂层以实现原位抗凝和促内皮化[84],其具有良好的稳定性和抗凝活性,可有效促进内皮化,提高药物洗脱支架的安全性和有效性.此外,还开发了具有亲水性(肝素)和疏水性(雷帕霉素)药物的介孔二氧化硅涂层,用于快速抗凝和长期抗组织增殖.结果表明,肝素和雷帕霉素的释放可持续30天以上,表明介孔二氧化硅和疏水性药物涂层具有应用于BMS表面改性的潜力[85].
生物相容性聚多巴胺在血管支架的生物惰性涂层方面得到应用.最近,在裸金属冠状动脉支架表面涂上1层稳定的聚多巴胺层,然后将2-溴异丁酰溴(BIBB)共价固定在聚多巴胺层表面,以引入聚合反应所需的烷基溴引发基团[86].如图3(b)所示,通过表面诱导原子转移自由基聚合(SI-ATRP)进而在裸316L不锈钢(SS)金属支架上构建甲基丙烯酸磺乙酯(SBMA)/甲基丙烯酸缩水甘油酯(GMA)双功能复合涂层.然后作为NO供体的二亚乙基三胺(NONOate)通过GMA单元的活性环氧基团连接到聚合物刷上以产生NO释放[87-91].改进后的支架表面保持高水平的抗凝活性和NO的持续释放,显著抑制血栓形成,促进EC生长.
2.2 组织正常化
内皮不仅可以预防血栓形成,还可以介导SMC的迁移和增殖.支架上的快速再内皮化为预防支架内再狭窄和晚期支架血栓形成提供了一种可行性方法.近年来,预接种ECs的方法已经产生了一些有希望的实验室结果.然而,制备涂层的过程既昂贵又耗时[92-93].此外,ECs的来源、种植后的脱落以及细胞培养过程中的感染仍然是其进一步发展的障碍.在血管愈合过程中,内皮层的再生可以来自邻近ECs迁移或循环中ECs的募集[94-96].自然愈合方法为植入后材料的体内/原位内皮化提供了一种良好的替代策略[95-97].制造具有化学和物理性质的材料以诱导相邻ECs迁移或直接从循环中捕获内源性循环ECs的方法对于原位内皮化尤为重要.CD34是一种细胞表面抗原,表达在血管EC[98]、EPCs[99]和造血祖细胞[100]中.最近,开发了一种EPC捕获支架,其表面涂有CD34抗体以捕获循环EPC,进而实现快速原位内皮化[99,101].CD34抗体涂层支架已表现出显著减少新内膜形成的效果.然而,临床试验结果表明,由于循环EPCs的含量极低[99],使得EPCs的增殖和分化难以准确控制[102],因此抗再狭窄作用并不如预期的那样显著.如图3(c)所示,将ECs特异性配体固定到基底上的方法,以刺激EPC和血管ECs的优先黏附和生长,这对于快速原位内皮化至关重要.
Lin等[103]通过将CD34抗体固定在肝素/胶原蛋白多层膜上,制备了涂有EC选择性的涂层.将CD34抗体固定在细胞相容性和抗凝剂基底上表现出EC选择性并快速实现原位再内皮化.此外,Sun等[104]采用Ni-Ti合金片模拟支架,他们以聚多巴胺为基础构建了生物因子涂层的镍钛合金片,嫁接肝素并涂附VEGF和CD34抗体.结果表明,所构建的支架具有良好的生物相容性,能有效促进表面内皮化.
EPC的特征是表达CD133、CD34和VEGF受体-2(VEGFR2、Flk-1)[105-106].根据EPC在支架表面的黏附强度,已开发了明胶、VEGFR2、CD34或CD133抗体等几种底物[107-108].结果表明,EPCs在抗CD133涂层支架表面的附着力显著高于抗VEGFR2和抗CD34涂层支架.此外,剪切应力在一定程度上可以促进EPC增殖和NO分泌.与其他两种底物相比,EPC在抗CD133抗体的底物上表现出更强的黏附性[109].此外,与BMS相比,抗CD133抗体涂层支架(CD133支架)可以通过其优异的EPC捕获能力加速再内皮化[110-111].最近,已经报道了一种用于生化表面修饰的多步骤策略,合成了一种新的、有效且生物相容性的血管内植介入体,该植介入体涂有固定的抗CD133抗体[112],能有效捕获EPC并减少SMC增殖.
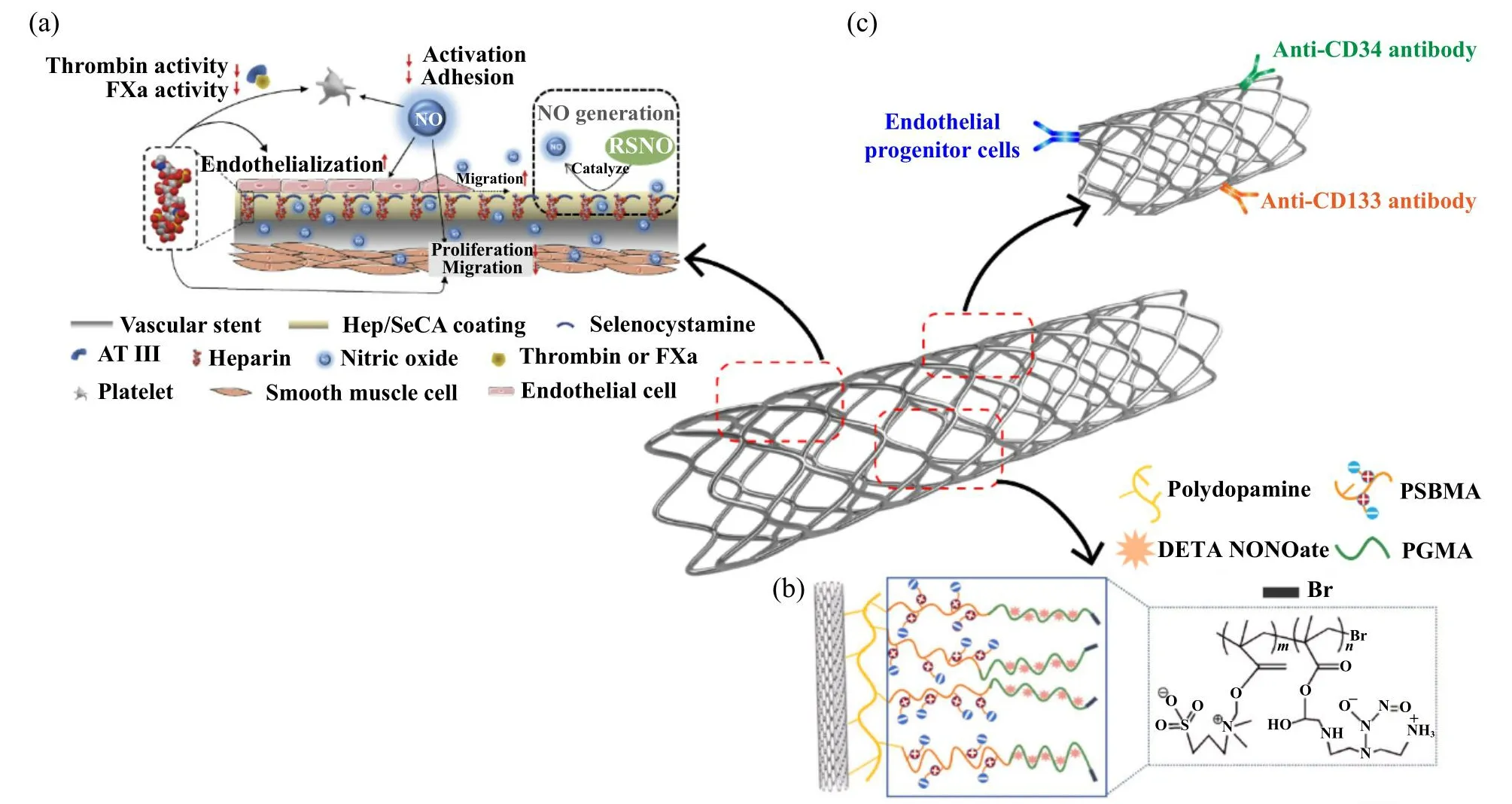
Fig.3 Schematic of three coatings on the vascular stent: (a) a sequential co-immobilization strategy to realize a heparinized surface[80]; (b) the schematic of SS-PSBMA-PGMA-NONOate copolymer brushes grafting on 316L SS stent[86](PSBMA,polyglycidyl sulfoethyl methacrylate; PGMA, polyglycidyl methacrylate); (c) the vascular stent coating with immobilized EPCs, anti-CD344 or anti-CD133 antibodies图3 血管支架上的三种涂层示意图:(a)肝素化表面的依次固定策略[80];(b) SS-PSBMA-PGMA-NONOate共聚物刷接枝在316L不锈钢支架上的示意图[86](PSBMA为聚缩水甘油基磺乙基甲基丙烯酸酯;PGMA为聚甲基丙烯酸缩水甘油酯);(c)带有固定化 EPC、抗CD34或抗CD133抗体的血管支架涂层
2.3 挑战与展望
理想的支架应具有良好的生物相容性、柔韧性、运输性、较强的径向力和透视下良好的射线不透性.其几乎对血管壁不造成创伤,炎症反应小,促进再内皮化,并最终促进血管愈合和重塑[113-116].
本节中涉及的用于血管支架上的抗凝涂层列于表3中.BMS上的涂层主要用于控制生物相容性、降解率以及蛋白质吸附,并允许足够的内皮化以确保更好的临床效果以减少再狭窄和血栓形成.目前该技术的研究重点是面向钛合金、镍钛合金和316L不锈钢进一步增强EC的迁移或附着.特别是联合使用多种涂层技术,例如在肝素/胶原多层膜上固定抗CD34抗体,可能是有效延缓支架血栓形成的可行手段.然而,一些临床问题尚未得到解决,如BMS和DES的新生内膜增生、晚期支架血栓形成和炎症反应以及响应性和生物可吸收支架力学性能的不足[117].要克服这一不足,需科学家进一步开发支架装置,进而对其长期稳定性和失效机理进行深入分析.
表3 血管支架上的抗凝涂层Table 3 Anticoagulant coatings on vascular stents
第二代血管支架——药物洗脱支架具有靶向性好、局部组织中药物浓度高以及副作用小等特点,使得其在冠脉支架市场占据主导地位.然而,裸金属支架进行表面涂层处理或药物洗脱支架,大多都基于金属作为支架材料,这是因为金属材料具有良好的机械特性,可以在保持装置形状和完整性的同时提供狭窄血管所需的支撑力,但金属材料的不可降解性是一、二代血管支架最大的局限性.因此,第三代血管支架—聚合物或金属基生物可吸收支架应运而生.生物可吸收支架即可对狭窄血管提供支撑力,又可在一段时间后进行自降解,并在重塑过程后溶解或吸收,然而,这项技术目前仍处于临床试验阶段[118].因此,目前仍然尚未完全解决支架表面血栓形成等问题,还需对支架材料及涂层技术在其力学性能、促内皮化、抑制炎症发生以及抑制内膜增生等方面进行深入研究.
3 心室辅助装置
由于左心室收缩功能障碍引起心力衰竭的发病率呈现指数增长,已经成为一种全球性的流行病[119].心脏移植供体的供应短缺使得心室辅助装置(VADs)和全人工心脏(TAHs)作为一种替代治疗方法得到快速发展[120].
VADs可以根据其机械作用方式(即脉动流、连续流)或其工作原理(即轴流泵、离心泵)进行分类[120].第一代心脏泵是脉动流泵,如Berlin heart excor, thoratec TCI pump,Heartmate PVAD以及Heartmate XVE等.第二代心脏泵是连续流泵,例如HeartMate (HM) II和Jarvik 2000[121].第三代心脏泵是磁悬浮泵,如Heartware HVAD, Berlin heart incor LVAD, DuraHeart,VentrAssist LVAD[119,122-124].
20世纪30年代,TAH第一次在试验中被植入到动物体内.然而,由于TAH的几何形状、供电、生理和生物因素等方面的缺陷,目前只有一种TAH被批准用于临床应用[125].最近,又出现了多款创新性的TAH模型,包括:CardioWest SynCardia TAH[126],AbioCor TAH[127]和Carmat TAH[128].TAHs的材料包括涤纶、硅橡胶、钛、聚乙烯、PyC、ePTFE、AngioFLEX和PU等.
血栓栓塞、出血和感染是VADs的主要并发症.血栓的形成涉及到VADs表面与血液接触后引起的凝血酶和血小板的激活,以及高剪切率导致的血小板激活[129].以HeartMate II LAVD为例,植入后3个月内血栓发生率高达8.4%.如果这类血栓患者未进行心脏移植手术或心脏泵置换的话,其死亡率高达48%[130].为了避免VADs的相关并发症,研究人员设计了各种抗凝涂层,用于改善VADs的血液相容性.
3.1 阻断凝血路径
Carmeda生物活性表面已被应用于由Berlin Heart GmbH开发的心脏泵,用以避免血栓在泵内沉积,使心脏泵能够在患者体内长期稳定地运行.Koster等[136]使用Carmeda表面技术在Berlin Heart VAD上制备PU和未分离肝素的涂层.结果表明,肝素包覆VAD未引起血栓形成反应或免疫反应.此外,Hetzer等[122]还针对用Carmeda法涂有肝素的Berlin Heart Incor轴流泵进行了研究,没有在冠状动脉中发现任何血栓栓塞事件.在植入患者体内近1年以后,有活性的肝素涂层仍可以与VADs表面紧密结合[137-138].
另一种基于生物抗凝剂的涂层是将经过基因工程改造的,能产生NO的SMC种植在LVADs上,可以构建NO释放的涂层[139].与EC层相似,经过GTP环水解酶基因转染NO合成酶的SMC通过释放NO可以显著地降低血小板对表面的黏附.将能产生NO的基因工程SMC植入左室导管后,试验结果表明,在体内和体外流动条件下,SMC能很好地黏附在泵表面[139].
MPC聚合物已应用于VAD,图4(a1)所示为磷脂在MPC聚合物表面的吸附原理图[132].Yamazaki等[140]将经MPC涂层改性的EVAHEART离心血泵植入7头小牛体内,对其进行评估,没有发现MPC涂层表面有血栓形成.从长期来看,EVAHEART心脏泵具有良好的血液相容性.此外,Kihara等[141]对MPC涂层和DLC涂层的EVAHEART LVADs进行了研究.在这项研究中,他们将4个MPC涂层的LVAD和8个DLC涂层的LVAD植入小牛体内,结果表明MPC涂层具有较高的生物相容性水平,有利于避免血栓的形成,与DLC涂层类似.此外,MPC涂层由于其易于应用和可以减少抗凝治疗,显示出更大的潜力,可以有效提高LVADs的抗凝性能.Someya等[142]用MPC涂层对一种名为MedTech Dispo的离心式心脏泵的血液接触表面进行了改良,并将该泵植入了7头左心搭桥的小牛体内.体内试验结果表明,MPC涂层可以在至少2周内有效防止血栓的形成.此外,他们还研究了等离子体诱导MPC接枝聚合技术,并将MPC链连接到TiAl6V4钛合金表面[143].试验结果表明,相对于对照组,MPC表面血小板的沉积和活化减少.然而,由于MPC涂层的生物降解性,其寿命有限,这意味着植入一段时间后,患者仍需要接受抗凝治疗.与TiN和DLC涂层相比,MPC涂层在VADs上的强度和稳定性较差[141].因此,MPC涂层应通过中间层和连接剂与VADs表面形成强共价键连接,提高涂层的耐久性和稳定性.
贻贝可以黏附几乎所有类型的基底,包括钛基底.如图4(a2)所示,树突状聚甘油(MI-dPG)和线性聚甘油(lPG)的仿生贻贝组合涂层具有细胞排斥特性、生物相容性和补体激活功能[133].Kulka等[133]研究表明,lPG功能化的MI-dPG涂层可以防止细胞黏附,包括人肺泡基底上皮癌细胞和鸡成纤维细胞.此外,涂层对血小板的黏附和活化有一定的抑制作用.最后,MI-dPG涂层在Berlin Heart GmbH上具有较好的抑制细胞和血小板黏附的作用.
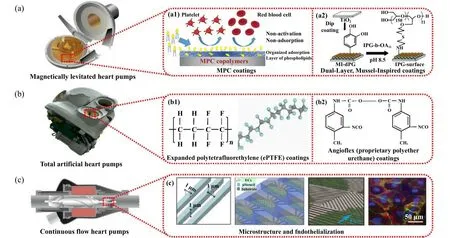
Fig.4 The anticoagulation coatings on VADs: (a) magnetically levitated pumps[131]: (a1) MPC coatings could adsorb phospholipids from the blood, producing a surface with good natural blood compatibility[132]; (a2) mussel-inspired coatings could prevent the primary adhesion of protein and cells from the bloodstream[133]; (b) total artificial heart[125]: (b1) expanded polytetrafluorethylene(ePTFE) [134]; (b2) angioflex (proprietary polyether urethane)[127]; (c) continuous-flow pumps[131]: the feature size of the microstructure (gratings) was designed to maximize cell adhesion and migration[135].图4 VADs上的抗凝涂层:(a)磁悬浮泵[131]:(a1) MPC涂层可以从血液中吸附磷脂,产生具有良好自然血液相容性的表面[132].(a2)仿生贻贝设计的涂层可以防止血液中蛋白质和细胞的初次黏附[133];(b)全人工心脏[125]:(b1)膨胀聚四氟乙烯(ePTFE)[134];(b2) angioflex (一种专用的聚醚聚氨酯)[127];(c)连续流心脏泵[131]:微结构(光栅)特征尺寸的设计可以最大化EC的黏附和迁移[135]
膨化聚四氟乙烯(ePTFE)已广泛用于与血液接触的表面,并显示出低凝血性.因此,应用这种材料研制出了CARMAT TAHs的人工心室的弹性隔膜,其血小板活化和纤维蛋白沉积的水平与肝素包被的医用级聚氯乙烯(PVC)相似[图4(b1)][134].Angioflex是一种专有的聚醚聚氨酯,也被用于光滑心室和三叶瓣膜的血液接触表面[图4(b2)]所示[127].AbioCor TAH 通过在体外试验[144]和体内试验[145]的测试证明了这种材料在长期试验中的可行性,未发生血栓形成、栓塞事件或血液损伤的事件.
DLC是一种亚稳态的无定形碳,包含类金刚石位点和石墨位点的组合,其中一些键由氢终止[25].常见的DLC薄膜沉积工艺有脉冲激光沉积、阴极电弧沉积、直接离子束沉积以及等离子体增强化学气相沉积等方法.由于疏水性和表面光滑性,DLC涂层具有优秀的生物相容性和良好的血液相容性(血小板黏附最小)[26,146-147].自1998年以来,DLC涂层已被用于VAD.Yamazaki等[148]将DLC涂层应用于Sun Medical离心泵的血液接触面,以提高该产品的血液相容性.体内试验表明,这款心脏泵长期血液相容性良好,可无故障连续工作6个月以上.VentrAssist公司生产的可植入旋转血泵,在与血液接触的表面涂有DLC涂层[149].EVAHEART VADs也涂有DLC涂层.在动物试验中,将EVAHEART VADs植入20头牛体内,心脏泵的持续工作时间为30~196天[150].由于VADs的高转速和高剪切速率,DLC涂层技术应用于VADs的主要局限性是存在微裂纹和膜破裂的风险[120].一种具有弹性特征的改性DLC涂层有望改善VAD的血液相容性[151].
钛合金是VAD的主要材料之一.氧化钛涂层不仅能提高心脏泵的耐磨性,而且具有与抛光钛相似的血液相容性[152].Klein等[152]测试了等离子体电解氧化(PEO)、抛光钛(Ti Gr 5)和未进行表面处理钛的血液相容性,发现在分析的血液相容性标志物中,材料之间几乎没有显著差异.BioMedFlexreg(BMF)涂层是一种硬碳薄膜涂层,具有高弯曲强度、抗辐射性和耐磨性.Mielke等[153]在VAD轴承表面涂覆了2~4 μm厚的Bio-MedFlexreg涂层,发现BMF涂层表面没有出现涂层失效,而57%的DLC轴承出现了划痕.因此,BMF涂层被Cleveland heart pumps应用作为替代的轴颈轴承材料.超晶金刚石(Ultrananocrystalline diamond)是一种极其光滑、低成本、高生物相容性、低磨损、低摩擦以及化学惰性的金刚石涂层,应用于Jarvik 2000心室辅助装置.Jarvik Heart公司的VAD组件经过了机械和模拟血液流体力学测试.结果表明,超晶金刚石界面具有优秀的耐久性和抗血栓性[154].Carmat TAHs是将生物与合成物的混合膜纳入TAHs的首次成功尝试.Jansen等[134]用戊二醛处理过的牛心包在Carmat TAHs的人工心室中修饰了膈膜的血接触面.他们发现血小板活化和在心包组织上的纤维蛋白和血细胞沉积与医用肝素包覆PVC相似.
3.2 组织正常化
与其他的表面形貌相比,细长的、阵列型的纳米尺度或微米尺度的表面形貌可以增强EC的附着力和功能[131,155].在高剪切应力的动态环境下,具有表面织构的接触面可以有效地提高EC附着的稳定性[156].此外,具有表面织构的血液接触表面可以提高血液相容性,因为血液成分会保留在表面织构之中,形成1个生物层,避免血栓栓塞事件的发生,降低长期LVADs患者血栓栓塞的风险[157].
将含有PU和二甲基乙酰胺颗粒的织构表面作为LVAD血接触面的一部分,表面织构会捕获血液成分,形成稳定的新生内膜层[158].Potthoff等[159]通过选择和优化衬底的纳米几何结构,最大限度地提高ECs的迁移和对于流动诱导剪切力的抵抗效果.适当的表面微观结构可以提高内皮化在超高壁面剪切应力水平下的稳定性,这种环境恰恰与由心脏泵诱导的高剪切应力流动环境类似[160].Stefopoulos等[135]设计并验证了一种新的诱导内皮化的策略,将表面织构和种植EC的区域设计相结合[图4(c)].与没有表面织构的对照组相比,这种策略只用了一半的时间就达到完全内皮化.利用合理设计的模板可以在2 mm厚的PDMS上进行最初始的EC种植.
表面织构技术作为增强内皮化的有效方式,已被应用于商用VAD产品,如HeartMate I LVAD的烧结钛纹理表面和完整的PU线状纹理.试验证明,HeartMate I LVAD的表面织构能促进EC的稳定黏附,有助于改善血液相容性[161].此外,还有一种EC快速播种的技术,将烧结Ti与EC连接起来,通过降低血小板的黏附,最大限度地降低了血栓形成的风险[162].
3.3 挑战与展望
VADs涂层仍面临许多挑战,其中两个最主要的挑战分别是由心脏泵产生的高剪切应力所引起的涂层损伤以及涂层的耐久性和长期有效性.本节中提及的VADs抗凝涂层列于表4中.虽然抗凝药物涂层比惰性涂层表现出更好的血液相容性,但对于长期或永久植入的VADs而言,TiN涂层和DLC涂层在高流速或剪切应力下更稳定和持久.表面织构可诱导EC层的形成,实现良好的血液相容性,但表面织构的设计不当会导致严重血栓形成[163].诱导EC涂层在体内的功能活性和细胞黏附的可靠性仍然是需要关注的主要问题.基于现有的涂层技术,DLC涂层是一种相对长期稳定可靠的选择,可以与适当的表面微观结构设计相结合,实现更好的血液相容性.在未来,有机惰性涂层、梯度和多层聚合物涂层的发展有望加强聚合物涂层与钛基基体之间的界面结合.对于内皮化涂层,最重要的工作是增强生物材料和EC层的结合,以适应VADs的高壁面剪切应力.
表4 心室辅助装置上的抗凝涂层Table 4 Anticoagulant coatings in VADs
4 导管
随着全球人口老龄化和人类医疗水平的提高,对医用导管的需求不断增加.医用导管主要分为介入导管和非介入导管.介入导管是可以插入体内的细导管,为药物输送[164]或手术设备植入[165]创造通道,非介入导管是粗导管,主要用于外部血液运输或循环.当医用导管暴露在血液中时,血浆蛋白和血小板会黏附在导管表面.之后,凝血因子会在不溶性纤维蛋白网络形成之前被激活,这将导致血栓的形成[166],血栓并发症,甚至死亡[167].在临床治疗中,静脉注射肝素通常用于预防血栓形成和减少凝血相关并发症.然而,大量使用肝素会诱发出血、超敏反应、血小板增多、呼吸困难和其他不良反应[168].因此,已经有许多研究尝试在医用导管的壁面上构建涂层,以实现有效的抗凝,同时减少抗凝药物的使用.
4.1 阻断凝血路径
通过在医用导管表面涂覆抗凝药物,可以有效改善导管的生物相容性,减少血栓形成,减轻术后全身炎症反应.此外,抗凝药物涂层可以避免抗凝药物直接注射到血液中引起的不良后果,如出血、超敏反应、血小板减少和呼吸困难等.如图5(a1)所示,Gao等[169]通过用海藻酸钠/肝素复合物固定表面来修饰聚氯乙烯导管.聚氯乙烯导管表面经浓硫酸酸化后,浸入含多氨基的聚乙烯亚胺中,用氨基进行修饰,然后用磷酸氢二钠将海藻酸钠和肝素直接固定在修饰表面,构建海藻酸钠-肝素复合涂层.海藻酸盐-肝素复合涂层可以改善聚氯乙烯导管的亲水性,增强生物相容性.涂层还可以减少血小板对表面的黏附和活化,以改善抗血栓形成性能.与体内的无涂层导管移植物相比,表面涂有肝素的膨体聚四氟乙烯导管的闭塞性血栓明显减少,流通性显著改善.Bae等[171]采用等离子辉光放电法制备肝素固定化聚氨酯导管.通过将聚氨酯导管接枝羧基,并依次与聚环氧乙烷和肝素反应,得到肝素涂层导管.因此,肝素涂层导管具有很好的抗凝血性和血液相容性.
Yau等[172]研究了玉米胰蛋白酶抑制剂在导管表面构建抗凝血涂层.玉米胰蛋白酶抑制剂能可逆地与人凝血因子FXIIa的活性位点相互作用,而不抑制其他蛋白酶.因此,玉米胰蛋白酶抑制剂可以阻断凝血因子XII,以减轻导管在血浆系统中引起的凝血,从而减少血栓形成.此外,Brisbois等[173]在Elast-eon E2As聚合物中掺入了S-硝酰基-乙酰青霉胺,利用浸涂法制造了可释放NO的导管,这种导管可以在长达20天的时间内稳定释放生理水平的NO.由于NO具有减少血小板黏附和活化的特性,导管可以实现抗凝.结果表明,与对照组相比,S-亚硝基-n-乙酰丙胺/E2As导管能显著减少血栓和细菌的黏附.
生物惰性有机涂层因其良好的血液相容性和抗血栓性而被广泛应用于医用导管的抗凝.由于化学键的存在,生物可降解聚合物涂层可以稳定地与导管基底结合,因此涂层可以在血液的高压力和高剪切速率下工作.一些可生物降解的聚合物涂层可以改变导管表面的亲水性和疏水性,以减少血液成分(如纤维蛋白原和血小板)的黏附.对可生物降解聚合物涂层的研究有很多,在抗血栓和抗菌性能方面显示出巨大的潜力.如图5(a2)所示,Smith等[170]通过用聚合磺基甜菜碱(polySB)修饰PU导管构建了一种稳定的聚合物涂层,此涂层可以将水分子配位到导管表面.两性离子聚合物涂层可以减少蛋白质和细胞对导管表面的黏附,因为两性离子基团协调了游离水和结合水.结果表明,涂层能显著减少血液与导管表面的相互作用,减少血栓形成和炎症.Li等[174]通过将一种键合单体,N-丙烯酰甘氨酰胺(NAGA)或N-丙烯酰亚胺-碳酰二肼(NASC)与一种抗菌单体和甲基丙烯酸锌(ZMA)共聚,构建了一种二元共聚物水凝胶导管.由于ZMA有很强的亲水性,可以抵抗纤维蛋白和血小板的黏附,因此,导管可以减少血栓的形成.
磷酰胆碱和季铵通过传统的自由基共聚被用于合成可生物降解的聚合物涂层,并使用简单的浸涂来实现共聚物涂层的长期稳定性[175].由于磷酰胆碱的细胞膜仿生基团,磷酰胆碱和含阳离子的共聚物涂层具有很好的抗血栓性.此外,季铵的阳离子基团也提供了很好的杀菌性能.在另一项研究中,通过使用丙烯酰胺和丙烯酸构建了一种保形适配的载有抗菌剂的多合一水凝胶涂层[176].通过体外血液循环试验证实了水凝胶涂层的抗凝血性能,结果表明,该涂层可以减少血小板的吸附和活化,并且没有溶血的风险.此外,抗血栓形成的聚-2-甲氧基乙基丙烯酸酯(PMEA)涂层已经应用于心肺机回路.Kariya等[177]评估了用于中心静脉端口导管系统的PEMA涂层的抗血栓形成性.PEMA涂层可以减少积聚,并通过冲洗促进血栓从系统中冲洗出来,以实现抗凝.
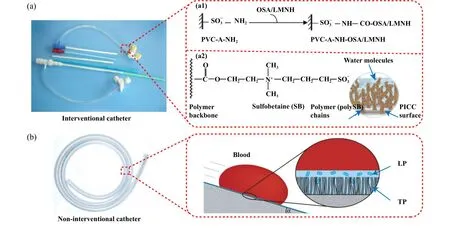
Fig.5 The anticoagulation coatings on catheters: (a1) immobilization of composite SA/HEP[169]; (a2) polySB modification of PICC surface[170]; (b) schematic of blood repellency on TLP surfaces[21]图5 导管上的抗凝涂层:(a1)复合SA/HEP的固定化[169];(a2) PICC表面的PolySB修饰[170];(b) TLP表面排斥血液的示意图[21]
Li等[178]制备了一种基于高碘酸钠存在条件下PDA纳米粒子和银纳米粒子快速形成和累积的超亲水涂层.在亲水化学成分和纳米颗粒堆叠表面形貌的协同作用下,该涂层具有超亲水性,通过排斥蛋白质来实现抗凝.同时,由于银离子的存在,涂层具有抗菌性能.此外,SLIPS涂层能有效减少血栓的形成.如图5(b)所示,Leslie等[21]使用改进的SLIPS技术构建了一种应用于医用导管光滑表面的抗凝血涂层.导管的光滑表面与栓系的全氟化碳共价结合,然后涂上1层可移动的液态全氟萘烷.SLIPS涂层可应用于几乎任何导管材料表面,有效排斥全血,减少血液成分和细菌的黏附,实现体内外抗凝.在动脉血的高压和高剪切速率下,SLIPS涂层可以保持稳定.Wang等[179]开发了一种基于自适应液体门控膜的导管,该导管可以适应导管尺寸,减少血栓形成并定位释放药物.采用静电纺丝法构建导管的微孔聚偏氟乙烯基底,提供毛细作用力吸附门控液.由于基底亲和力强,生物相容性好,液态全氟萘烷、Krytox 100、Krytox 103以及硅油500是常用的门控液.由于流体的独特能力,SLIPS涂层可以根据压力调整尺寸.因此,采用SLIPS涂层包覆的导管可以抵抗血液成分的黏附,减少血栓形成,并控制药物在指定位置的释放.
4.2 挑战与展望
医用导管与流动的血液直接接触并长期暴露在血液的剪切作用下.因此,导管上的抗凝涂层需要在血液剪切下保持稳定,并且不从导管表面脱落.同时,导管的原材料和涂层均应具有生物相容性,对人体无害,不释放有毒物质.此外,由于对导管的需求量较大,抗凝导管或涂层的制备工艺应适合大规模生产,并应考虑大量使用过的医用导管的回收情况.本节中导管上应用的抗凝涂层列于表5中,尽管文献中报道的涂层具有各自良好的效果,但是这些涂层缺点的共性问题是缺乏实践的检验.

表5 导管上的抗凝涂层Table 5 Anticoagulant coatings on catheters
目前,减少导管内血栓形成和实现导管抗凝最广泛使用的方法是通过共价键将肝素固定在导管表面,但仍有一定的局限性.表面结合的肝素不稳定且容易浸出,由于细长管表面的剪切力,导致抗凝活性逐渐降低.大多数生物惰性涂层在抗凝效果方面略逊于肝素涂层,但具有更好的抗菌性能.SLIPS策略最有可能实现抗凝作用,且具有自愈功能,但使用寿命仍需要更多实践来加以验证和改善.通过与抗凝药物的分子间相互作用来改变导管原材料很可能是实现导管高效稳定抗凝的最佳方法.
5 展望
随着心血管植介入器械的不断发展,其表面的抗凝涂层研究引起了广泛关注.现有研究对植介入体表面的涂层和改性技术进行了许多尝试,然而,涂层或植介入体本身的效果或持续时间仍未能完全令人满意,因此目前临床中大多仍需要配合抗凝药物使用.
抗凝涂层的选择首先需要考察植介入体本身的应用场景,如人工心脏瓣膜、血管支架以及心室辅助装置需要长期的不断使用,因此其寿命和稳定性十分重要,在设计时需要考虑其血液流场、植介入体基底和涂层坚固程度等影响;而对于短期使用的植介入体,如部分导管,则可以更多考虑其抗凝效果,尽量减少抗凝药物的使用,同时兼顾炎症等其他问题.
抗凝药物涂层是目前使用最广泛的阻断凝血途径的涂层之一,具有优异的抗凝性能.肝素作为最成功的涂层之一,已广泛用于商业植介入体,并在血管支架上取得巨大成功.然而,对于人工心脏瓣膜和心室辅助装置,由于持续的打开、关闭和泵送,表层的肝素链容易在非生理流动和高剪切应力下从载体链上撕下.目前,新型的肝素涂层多与其他生物分子偶联,实现抗凝过程中前期优秀的抗凝效果以及结合后期的组织正常化,这是多功能和高效抗凝的主要发展思路.人工机械心脏瓣膜一般选用PyC和DLC等更为耐用的惰性涂层,尽管这些涂层的抗凝效果不够理想,但仍无法被其他抗凝涂层替代.随着人工合成聚合物的发展,通过设计兼顾多种特性的表面性质,有希望实现抗凝和耐用的平衡.另一方面,植介入体周围组织恢复正常化的涂层理论上可以承受生理血流并防止多种并发症,包括出血、再狭窄和闭塞的风险,因此得到了极大关注.在组织工程心脏瓣膜和血管支架上涂覆细胞外基质,以及在机械心脏瓣膜、血管支架和心室辅助装置上制作微结构的无机PyC、DLC是目前正在研究加速内皮化的常用方法.然而,内皮化的过程较为复杂,目前临床上尚未取得积极的结果.
目前,抗凝涂层的应用还受到多方面的制约.首先,涂层在剪切下的剥离以及基底的疲劳是实现长期抗凝面临的主要问题.涂层和基底之间需要具有强大的附着力,同时基底的材料需要很好的耐用度.然而,坚固的涂层通常缺乏良好的抗凝效果.其次,必须了解材料表面形成血栓的明确机制.尽管血液和植介入体间的相互作用已经研究了一百多年,但是复杂的血液成分,如纤维蛋白原、血小板和红细胞等在其表面形成血栓的机制仍然未被完全揭示.第三,具有不同机械性能的植介入体的基底,如软导管、刚性血管支架以及弹性支架等,限制了抗凝涂层的通用性.最后,植介入体上的工况,如静态、旋转和往复等不同运动情况,使涂层处于不同的工作条件.血液流动和剪切力不仅会导致血栓形成,还会破坏涂层.以双叶机械瓣膜为例,真实的生理条件是脉动的,但在打开和关闭阶段有时会伴随射流.更复杂的是,该心脏瓣膜在开启阶段有正向射流,在关闭阶段有外围射流、基准射流和铰链反向射流,这些都导致在设计其表面涂层时需要额外考虑.从我们的角度来看,植介入体表面的抗凝涂层尚未有通用的策略,植介入体材料和结构设计的协同改进才能实现理想的抗凝涂层.
