替吉奥仿制药与原研药疗效与安全性的真实世界研究
2023-05-06董宪喆王之舟冯英楠栾家杰孔树佳岳小林
王 可,董宪喆,王之舟,冯英楠,庄 伟,栾家杰,孔树佳,岳小林*,张 兰*
0 引言
胃癌是我国最主要的癌症病种之一,其发病率在我国居恶性肿瘤第3位[1]。根据国际癌症研究中心数据,2020年我国胃癌的死亡率为15.9/10万,远高于全球水平(7.7/10万)[2]。胃癌早期常无特异的症状和体征,大部分患者发现时已是进展期[3]。替吉奥是一种复方制剂,它是氟尿嘧啶衍生物,其活性成分包括替加氟、吉美嘧啶和奥替拉西[4],可用于复发或转移性胃癌的姑息化疗、新辅助化疗和术后辅助化疗等[5]。
替吉奥原研药(商品名:爱斯万)由日本大鹏药品生产,且于2009年在我国上市。目前替吉奥仿制药的生产企业有江苏恒瑞医药、齐鲁制药、山东新时代药业。2020年5月第二批国家集中带量采购中选药品中包含了替吉奥,大大降低了胃癌患者的用药负担。带量采购政策的重要基础是中选药品已经通过了与原研药的一致性评价[6],但由于研究人群病理生理状态的不同以及患者在真实诊疗环境中用药情况的不同,中选药品与原研药是否真实等效需更多研究证实[7]。受国家医保局委托,本研究对比了集中带量采购中选替吉奥仿制药与原研药在真实世界中的疗效与安全性,为临床应用提供客观依据。
1 对象和方法
1.1 对象 研究对象选自2019年1月1日至2021年12月31日在首都医科大学宣武医院、皖南医学院弋矶山医院和云南省肿瘤医院使用替吉奥原研(大鹏药品工业株式会社生产)或仿制药(江苏恒瑞医药股份有限公司、齐鲁制药有限公司生产)治疗的住院患者。纳入标准:因治疗胃癌使用替吉奥的住院患者;排除标准:无法从病历系统中提取到关键数据的病例。本研究通过首都医科大学宣武医院伦理委员会审批(批件号:临研审[2022]063号)。
1.2 方法 通过医院电子病历系统调取数据,收集患者的年龄、性别、身高、体重、是否有医保、吸烟史、饮酒史、肿瘤家族史等基本信息,患者诊断、胃癌分期、是否手术、病程、合并慢性病、癌症是否转移复发、肿瘤标志物和血红蛋白检验值等疾病信息,以及含替吉奥的治疗方案、化疗方式、疗程数等用药信息及不良反应发生情况。
1.3 分析指标 疗效:分别比较两组患者使用原研药与仿制药开始治疗前及使用含替吉奥治疗方案2个疗程后糖类抗原19-9(CA19-9)、癌胚抗原(CEA)、糖类抗原(CA72-4)、血红蛋白检验值的差异。比较两组患者使用含替吉奥治疗方案至随访结束是否复发、转移及无进展生存时间。随访时间截至2022年3月31日。无进展生存时间指从治疗开始至疾病进展、复发或患者死亡的时间。
安全性:提取两组患者含替吉奥治疗方案化疗期间的不良反应,比较两组不良反应的发生率和因不良反应停药的情况。
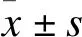
2 结果
2.1 患者基本情况 共收集符合纳入标准的患者758例。比较使用替吉奥原研药及仿制药两组患者的基本情况,见表1。原研药组男44例,女19例,平均年龄为(63.03±11.16)岁,胃癌分期IV期患者19例(30.2%);手术患者38例(60.3%)。仿制药(江苏恒瑞)组男236例,女74例,平均年龄(65.62±9.42)岁,胃癌分期IV期患者61例(19.7%),手术患者230例(74.2%)。两组患者在体重、体表面积、医疗类型、吸烟史、是否进行手术、合并慢性病和病程方面差异有统计学意义(P<0.05)。仿制药(齐鲁制药)组男275例,女110例,平均年龄(59.44±11.31)岁,胃癌分期IV期患者141例(36.6%),手术患者245例(63.6%)。两组患者在年龄、体重、体表面积、医疗类型、吸烟史、饮酒史、合并慢性病方面差异有统计学意义(P<0.05)。
2.2 药物应用情况 比较使用替吉奥原研药及仿制药两组患者的药物应用情况,见表1。患者采用的化疗方式有姑息化疗、术后辅助化疗、新辅助化疗和介入治疗。仿制药(江苏恒瑞)组患者采用术后辅助化疗方式的患者占比为71.3%,高于原研药组的52.4%,且差异有统计学意义(P=0.002),含替吉奥方案以替吉奥联合其他化疗药为主,联合用药情况及使用疗程数差异无统计学意义(P>0.05)。与原研药组相比,仿制药(齐鲁制药)组采用术后辅助化疗方式的患者占比为58.2%,高于原研药组的52.4%,差异有统计学意义(P<0.001)。含替吉奥方案联合用药情况两组差异无统计学意义(P=0.437),但中位使用疗程数仿制药(齐鲁制药)组高于原研药组,差异有统计学意义(P=0.011)。

表1 仿制药(江苏恒瑞和齐鲁制药)组和原研药组患者基本情况及药物应用情况
2.3 安全性比较 选择年龄、性别、身高、体重、体表面积、医保类型、有无吸烟史、饮酒史、肿瘤家族史、肿瘤分期、是否手术、病程、有无慢病进行1∶3 PSM后,原研药与仿制药(江苏恒瑞)组患者的基本情况见表2-1。匹配后两组患者的基本情况差异均无统计学意义(P>0.05)。本研究含替吉奥的治疗方案使用过程中出现的不良反应主要表现为恶心呕吐等胃肠道不适以及白细胞减少等骨髓抑制。原研药组不良反应发生率为30.8%(12/39),仿制药(江苏恒瑞)组不良反应发生率为23.6%(17/72),两组差异无统计学意义(P=0.412)。原研药组因不良反应停药发生率为5.1%(2/39),仿制药(江苏恒瑞)组因不良反应停药的发生率为1.4%(1/72),两组差异也无统计学意义(P=0.585)。
匹配后原研药组与仿制药(齐鲁制药)组患者的基本情况差异均无统计学意义(P>0.05),见表2-2。原研药组不良反应发生率为21.8%(12/55),仿制药(齐鲁制药)组不良反应发生率为32.5%(38/117),两组差异无统计学意义(P=0.151)。原研药组因不良反应停药发生率为3.6%(2/55),仿制药(齐鲁制药)组未发生因不良反应停药的案例,两组差异也无统计学意义(P=0.189)。
2.4 疗效比较 原研药与仿制药(江苏恒瑞)组1∶3 PSM匹配后的111例患者中仅有20例有到随访截止时间的治疗记录,其中原研药组11例,仿制药组9例。原研药组中位无进展生存时间为9个月,仿制药组中位无进展生存时间为6个月,两组差异无统计学意义(P=0.319)。此外,至随访结束,两组复发率和转移率的差异无统计学意义(P>0.05),见表3-1。原研药与仿制药(齐鲁制药)组1∶3 PSM匹配后的172例患者中仅有32例有到随访截止时间的治疗记录,其中原研药组13例,仿制药组19例。原研药组中位无进展生存时间为7个月,仿制药组中位无进展生存时间为8个月,两组差异无统计学意义(P=0.940)。此外,至随访结束,复发率和转移率两组差异无统计学意义(P>0.05),见表3-2。
原研药与仿制药(江苏恒瑞)组373例患者中仅有204例患者同时有治疗前以及治疗2个疗程后CA19-9、CEA、CA72-4或血红蛋白的检验结果。经过1∶3 PSM后,该亚组原研药与仿制药(江苏恒瑞)组的基本情况差异均无统计学意义(P>0.05),见表4-1。治疗前CA19-9的达标率原研药组为75.9%(22/29),仿制药(江苏恒瑞)组为89.7%(35/39),差异无统计学意义(P=0.228);治疗2个疗程后,CA19-9达标率原研药组为79.3%(23/29),仿制药(江苏恒瑞)组为89.7%(35/39),差异无统计学意义(P=0.392)。治疗前CEA的达标率原研药组为69.0%(20/29),仿制药(江苏恒瑞)组为87.2%(34/39),差异无统计学意义(P=0.066);治疗2个疗程后,CEA达标率原研药组为69.0%(20/29),仿制药(江苏恒瑞)组为84.6%(33/39),差异无统计学意义(P=0.124)。CA72-4仿制药(江苏恒瑞)组仅2例患者有治疗前及治疗2个疗程后的结果,因样本量原因与原研药未进行对比。两组CA19-9、CEA、血红蛋白的检验值在治疗前和治疗2个疗程后差异均无统计学意义(P>0.05),见表4-2。
原研药与仿制药(齐鲁制药)组484例患者中有326例患者同时有治疗前以及治疗2个疗程后CA19-9、CEA、CA72-4或血红蛋白的检验结果。经过1∶3 PSM后,该亚组原研药与仿制药(齐鲁制药)组的基本情况差异均无统计学意义(P>0.05),见表5-1。治疗前CA19-9的达标率原研药组为77.8%(35/45),仿制药(齐鲁制药)组为81.3%(39/48),差异无统计学意义(P=0.678);治疗2个疗程后,CA19-9达标率原研药组为77.8%(35/45),仿制药(齐鲁制药)组为87.5%(42/48),差异无统计学意义(P=0.214)。治疗前CEA的达标率原研药组为62.2%(28/45),仿制药(齐鲁制药)组为71.4%(35/49),差异无统计学意义(P=0.343);治疗2个疗程后,CEA达标率原研药组为64.4%(29/45),仿制药(齐鲁制药)组为65.3%(32/49),差异无统计学意义(P=0.930)。治疗前CA72-4的达标率原研药组为77.3%(34/44),仿制药(齐鲁制药)组为68.8%(33/48),差异无统计学意义(P=0.359);治疗2个疗程后,CA72-4达标率原研药组为68.2%(30/44),仿制药(齐鲁制药)组为66.7%(32/48),差异无统计学意义(P=0.877)。两组CA19-9、CEA、CA72-4、血红蛋白的检验值在治疗前和治疗2个疗程后差异均无统计学意义(P>0.05),见表5-2。

表2-1 1∶3倾向性评分匹配后仿制药(江苏恒瑞)组与原研药组患者的基本情况比较
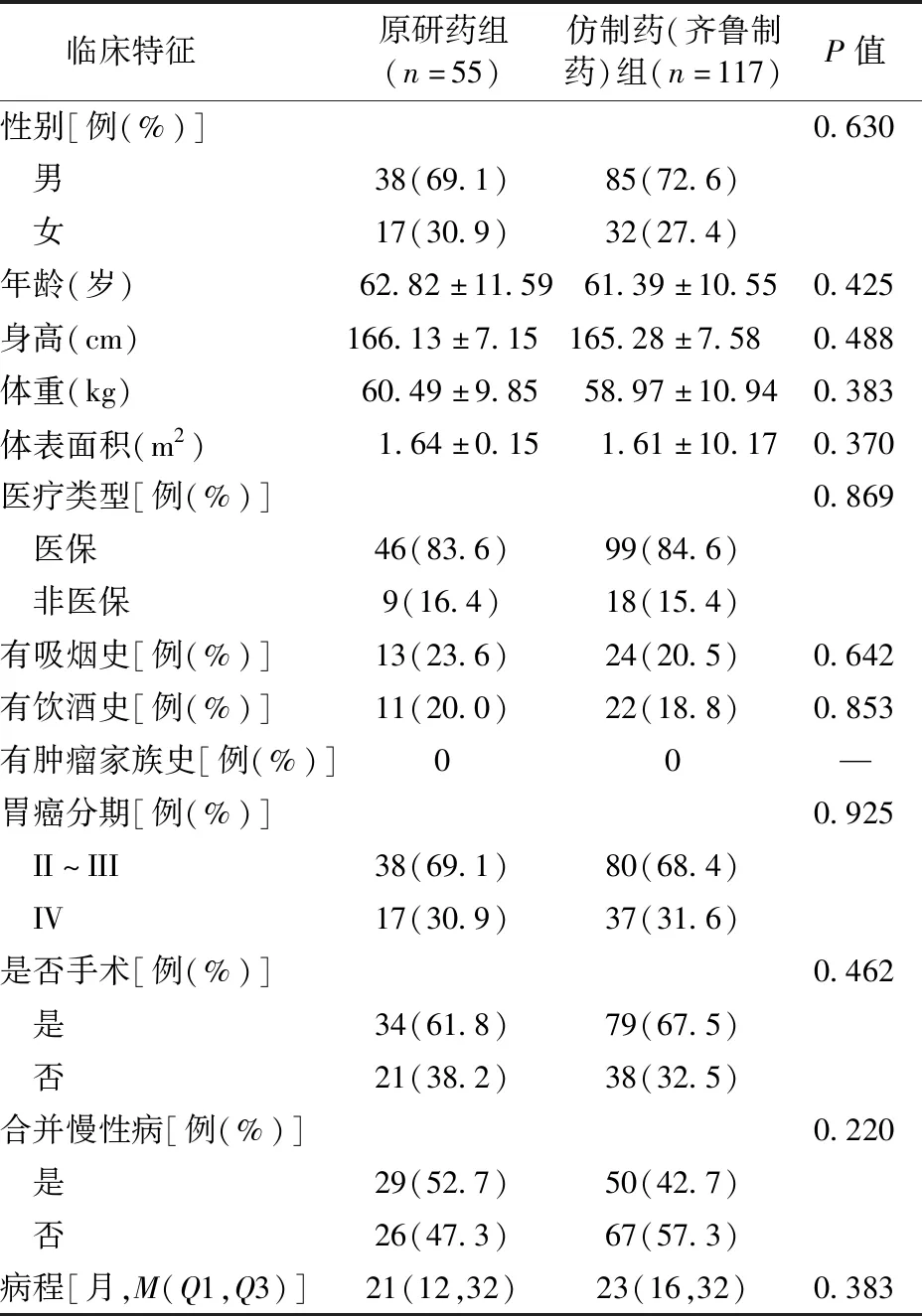
表2-2 1∶3倾向性评分匹配后仿制药(齐鲁制药)组与原研药组患者的基本情况比较
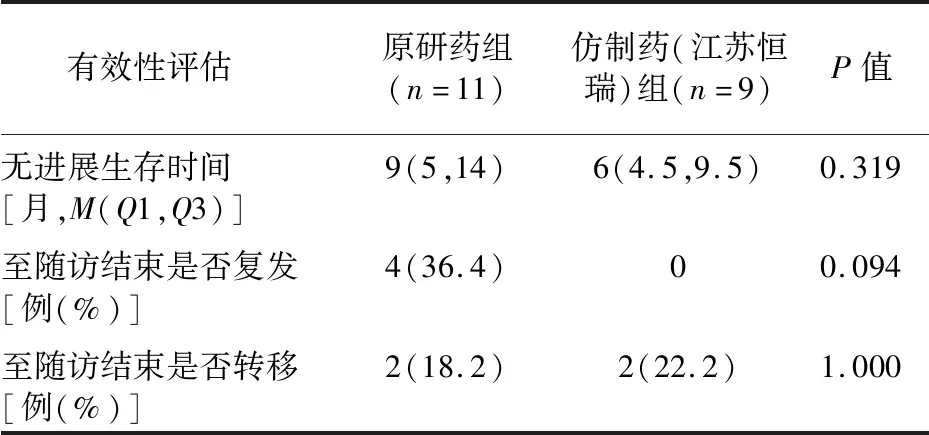
表3-1 仿制药(江苏恒瑞)组与原研药患者治疗有效性比较

表3-2 仿制药(齐鲁制药)组与原研药患者治疗有效性比较
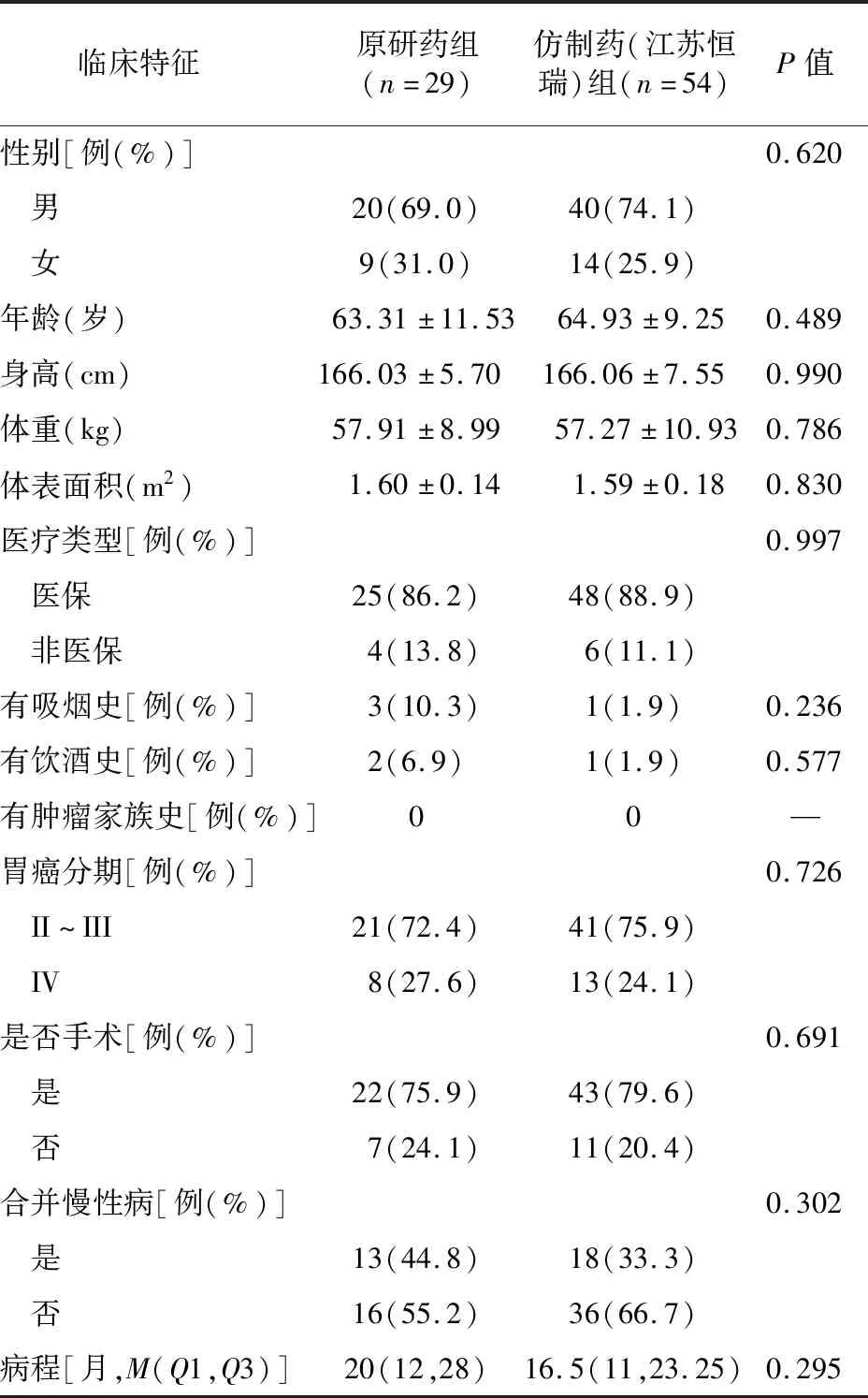
表4-1 仿制药(江苏恒瑞)与原研药组1∶3倾向性评分匹配后有检验值患者的基本情况比较
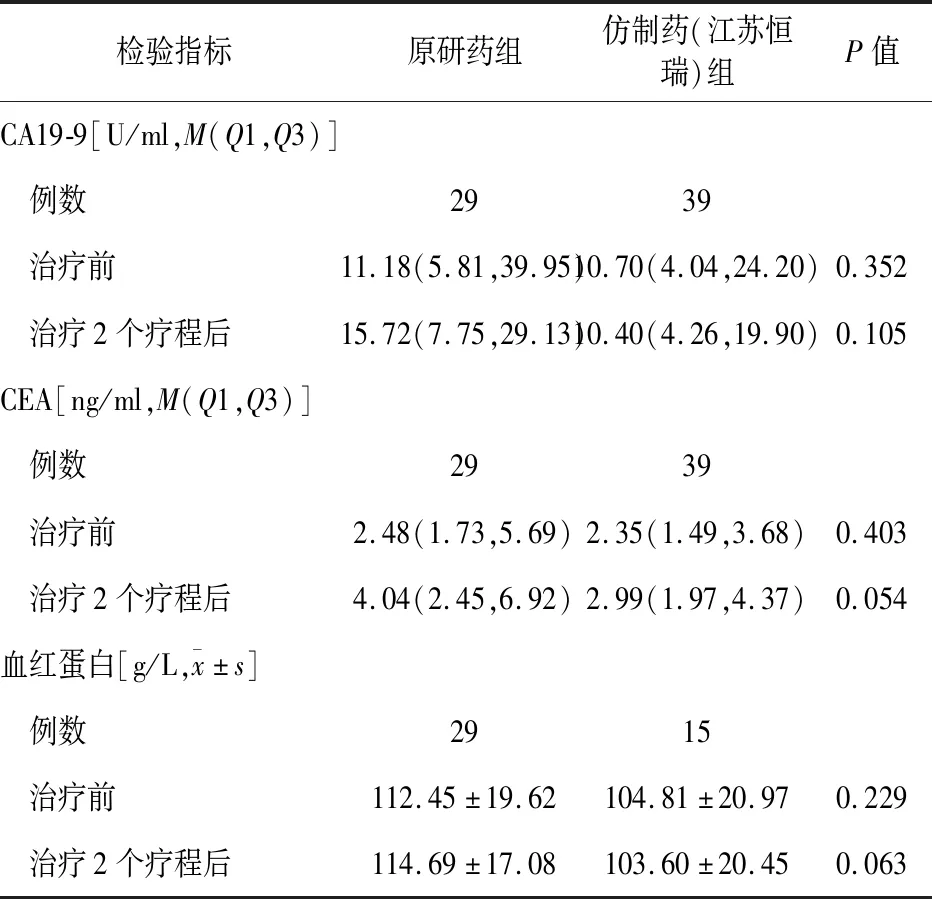
表4-2 仿制药(江苏恒瑞)组与原研药组检验指标的比较
表5-1 仿制药(齐鲁制药)与原研药组1∶3倾向性评分匹配后有检验值患者的基本情况比较

表5-2 仿制药(齐鲁制药)组与原研药组检验指标的比较
3 讨论
国家药品集中带量采购政策的实施,通过“带量采购、以量换价”,大幅降低中选药品价格,显著减轻了患者的用药经济负担[9-10]。2019年首批中选药品在全国11个城市进行了集中带量采购,且相关研究已证实了其疗效与安全性与原研药相比差异无统计学意义[7]。替吉奥作为第2批带量采购中选药品,既往研究报道了其仿制药与原研药的药代动力学和生物等效性情况[11-12],但缺少对临床疗效和安全性的直接比较结果。本研究收集了3个研究中心使用替吉奥原研药或中选仿制药的病例信息,分析在真实世界中二者的疗效与安全性差异,研究结果对带量采购中选药物的临床应用具有重要参考意义。
本研究中江苏恒瑞和齐鲁制药生产的仿制药分别与原研药组患者在体重、医保类型、合并慢性病等多项基本情况组间存在统计学差异。采用倾向性评分匹配后,原研药组与仿制药组患者的基本情况差异均无统计学意义,基线可比,有效减少了偏倚和混杂因素的影响,使得研究结果更可靠[13]。各组的化疗方式均以术后辅助化疗占比最高,该方式适用于手术后胃癌病理分期为II期及III期的患者[3],与各组患者胃癌分期大部分为II~III期分布一致,但仿制药组采用术后辅助化疗的患者比例高于原研药组。本研究通过将胃癌分期作为倾向性评分匹配因素之一进行匹配,避免了原研药组与仿制药组因患者胃癌的疾病严重程度不同造成对疗效和安全性评估的偏差。此外,本研究各组患者含替吉奥治疗方案均以联合用药为主,且仿制药组与原研药组联合用药情况无显著差异。各组含替吉奥治疗方案中位使用疗程数均在2个疗程及以上。原研药组与仿制药组患者的药物应用情况的差异对评估2个疗程含替吉奥治疗方案的疗效与安全性影响较小。
肿瘤标志物广泛应用于恶性肿瘤的临床诊断以及预后的评估。其中,CA19-9、CEA和CA72-4是临床上评估胃癌患者预后及化疗疗效的常用指标[14-15]。本研究结果显示,原研药组与仿制药组患者在治疗前及治疗2个疗程后,CA19-9、CEA和CA72-4的水平及达标率差异均无统计学意义,提示两个厂家的中标替吉奥仿制药与原研药在疗效方面没有明显差异。胃癌患者随着疾病进展,因肿瘤消耗、骨髓浸润等因素,可能导致血红蛋白降低,既往研究报道了含替吉奥治疗方案有助于减缓血红蛋白水平的降低[16]。因此,本研究比较了两组血红蛋白水平的变化情况,结果显示,治疗前和治疗2个疗程后,原研药与仿制药组血红蛋白水平差异均无统计学意义,进一步提示了两组在疗效方面没有明显差异。本研究也观察了两组使用含替吉奥治疗方案至随访结束复发率、转移率及无进展生存时间疗效指标,但最终纳入分析的病例较少,仍需收集更大样本得出可靠结果。安全性方面,本研究原研药与仿制药两组患者的不良反应发生率和因不良反应停药发生率差异均无统计学意义,提示中标仿制和原研替吉奥在安全性方面没有明显差异。
本研究基于真实世界数据,分析了替吉奥中选仿制药与原研药疗效与安全性的差异,采用PSM,有效控制了混杂变量,减少了偏倚。但也存在一些局限,本研究为回顾性研究,研究数据从医院电子病历系统中收集,由于电子病历记录的不全面,可能低估了不良反应发生率,且无法收集到直接疗效指标,如治疗缓解率等。另外,本研究由3个研究中心完成,收集2019年至2021年使用替吉奥的住院病例,已通过对数据提取者进行培训,使用统一的数据提取表以及由各中心进行数据质控等措施减少偏倚,但收集的各组病例匹配前基线不可比,根据数据情况匹配处理后,纳入分析的样本仍较少,需进行大样本多中心的研究验证本研究的结论。
利益冲突:所有作者均声明不存在利益冲突。
