鲟鱼内源丝氨酸蛋白酶对肌原纤维蛋白凝胶性能的影响
2023-05-06罗永康谭雨青
周 猛,洪 惠,罗永康,谭雨青
(中国农业大学食品科学与营养工程学院,北京 100083)
鲟(Acipenser sinensis)又称鲟龙,是现存历史最久远的鱼类之一,2020 年中国鲟鱼总产量达104 280 t[1]。鲟鱼肉质鲜美,蛋白质丰富,无肌间刺和硬骨,冷冻及加工制品也便于运输,因此冷冻鲟鱼及鲟鱼加工制品的消费群体尤为庞大。目前已尝试以产籽鲟鱼肉为原料进行鱼糜制品加工[2],但鲟鱼鱼糜制品凝胶强度低的问题亟待解决[3]。在鱼糜制品加工中,原料种类、加热条件、擂溃条件及内源酶等均影响鱼糜凝胶性能[4],而内源酶是极为重要的因素之一[5]。鱼糜加工过程中,通过漂洗可有效提高鲟鱼鱼糜凝胶的凝胶性能[6]。但漂洗鱼糜在50~60 ℃的升温过程中依然出现凝胶劣化现象。
耐热型且不易在漂洗过程中除去的肌原纤维结合型丝氨酸蛋白酶(Myofibril-bound serine proteinase,MBSP)是导致鱼糜凝胶劣化的关键内源酶[7]。研究表明,当鳄蛇鲻(Saurida wanieso)肌原纤维蛋白与其MBSP在55~60 ℃下孵育时,肌球蛋白重链降解最为明显[8],鲢鱼(Hypophthalmichthys molitrix)肌原纤维蛋白与其MBSP 孵育的最适降解温度是50~60 ℃[7]。金线鱼(Nemipterus virgatus)鱼糜经过6 次漂洗后MBSP 活力仍无显著降低[9]。即使在冷冻鳄蛇鲻鱼糜中,MBSP稳定性仍很高,因此MBSP 对冷冻鱼糜的品质也造成巨大影响[10],但目前对于鲟鱼MBSP的研究较少。笔者研究鲟鱼内源丝氨酸蛋白酶对肌原纤维蛋白凝胶性的影响与作用机制,为鲟鱼鱼糜加工及其品质提升提供基础。
1 材料与方法
1.1 材料与试剂
鲜活鲟鱼购自北京健翔桥农贸市场。3 种蛋白酶抑制剂:丝氨酸蛋白酶抑制剂,4-(2-氨基乙基)-苯-磺酰氟(Pefabloc SC);半胱氨酸蛋白酶抑制剂,E-64(L-trans-3-Carbo xyoxiran-2-carbonyl-L-leucylagmatine)、Pepstatin A(N-(3-methyl-1-oxobutyl)-L-valyl-L-valyl-(3S,4S)-4-amino-3-hydroxy-6-methylheptanoyl-N-[(1S)-1-[(1S)-2-carboxy-1-hydroxyethyl]-3-methylbutyl]-Lalaninamide);金属蛋白酶抑制剂,乙二胺四乙酸(EDTA)。Pefabloc SC 购自上海麦克林生化科技有限公司,E-64、Pepstatin A、EDTA 购自北京索莱宝科技有限公司,所有抑制剂均溶解在0.6 mol/L NaCl的20 mmol/L Tris-HCl 的缓冲液(pH 8.0)中。7-氨基-4-甲基香豆素(AMC)、Bradford 蛋白浓度测定试剂盒购自北京索莱宝科技有限公司,Boc-Leu-Arg-Arg-MCA 购自Peptide Inst,溴化钾购自阿拉丁试剂(上海)有限公司,其余试剂均为国产分析纯。
1.2 主要仪器与设备
UV-2600 紫外分光光度计(上海美普达仪器有限公司);F97pro 荧光分光光度计(上海棱光技术有限公司);Frontier傅里叶红外光谱仪(帕金埃尔默股份有限公司);TA DHR-2 流变仪[美国TA 仪器沃特世科技(上海)有限公司]。
1.3 蛋白酶抑制剂对蛋白质降解的影响与粗酶制备
1.3.1 肌原纤维蛋白(Myofibrillar protein,MP)制备 根据曹敏杰等[11]方法并稍作调整,取鱼肉,按质量(g)体积(mL)比1∶4 加入20 mmol/L Tris-HCl(pH 8.0),在10 000 r/min 速度下均浆1 min,在4 ℃、8 000g条件下离心15 min,转速,收集沉淀。重复上述操作3 次后,所得沉淀按质量(g)体积(mL)比1∶4 加入0.6 mol/L NaCl 的20 mmol/L Tris-HCl 缓冲液(pH 8.0)溶解,进一步均质,得鲟鱼MP 溶液。所有实验步骤如无特殊要求均在4 ℃下完成。
1.3.2 蛋白酶抑制剂对蛋白降解的影响 抑制剂浓度选择:根据不同抑制剂选择有效抑制浓度范围内最高浓度与最低浓度[12],E64中间加设10 mmol/L的浓度梯度,即Pefabloc SC,0.4、4.0 mmol/L;EDTA,1、10 mmol/L;E64,1、10、100 μmol/L;Pepstatin A,1、10 μmol/L。
实验方法:根据Takahashi 等[12]方法并稍作调整。取MP 溶液2 mL,分别与2 mL 不同浓度的3 种蛋白酶抑制剂溶液充分混合。将混合物在55 ℃水浴锅中分别孵育2、4 h,立即在冰水中冷却,与1 mL 150 mg/mL 预冷的三氯乙酸(TCA)混合,在冰水中放置30 min,离心(10 000g,4 ℃,15 min)。上清液中的TCA 可溶性肽含量通过考马斯亮蓝法测定,抑制率(%)计算:
式中,ρI为含蛋白酶抑制剂的加热样品上清液中TCA 可溶性肽质量浓度(mg/mL);ρC为不含蛋白酶抑制剂的加热样品上清液中TCA 可溶性肽质量浓度(mg/mL);ρB为不含蛋白酶抑制剂的未加热样品上清液中TCA可溶性肽质量浓度(mg/mL)。
1.3.3 鲟鱼内源丝氨酸蛋白酶粗酶制备 根据Cao等[13]方法并稍作修改,取鱼肉,按质量(g)体积(mL)比1∶4 加入20 mmol/L Tri-HCl(pH 8.0),均浆1 min,在8 000g下离心20 min。取沉淀,按质量(g)体积(mL)比1∶4加入去离子水,均质,用1 mol/L HCl将均浆液pH调至6.0,离心,取沉淀,上述操作重复3次,以从MP中洗脱肌浆酶(收集洗脱4次的上清液,即为漂洗液)。按质量(g)体积(mL)比1∶4加入去离子水,均质,将匀浆液在沸水浴中加热并搅拌,温度达到55 ℃5 min 后迅速冷却,离心,取最终的上清液并冻干。用去离子水溶解3 g冻干粉,定容至1 mL并均质,用1 mol/L HCl调pH至4.0。离心,取上清液,用1 mol/L NaOH调pH至7.0,得粗鲟鱼内源丝氨酸蛋白酶。
1.3.4 丝氨酸蛋白酶活力测定 以1.3.3 中4 次漂洗液、粗酶液以及粗酶液与Pefabloc SC 混合样品为样,Boc-Leu-Arg-Arg-MCA 为底物。在850 μL 50 mmol/L Tris-HCl 缓冲液(pH 8.0)中,添加50 μL 样品、100 μL 10 mmol/L底物,在55 ℃下反应20 min,加入1.5 mL 终止剂(甲醇、正丁醇、去离子水体积比为35∶30∶35)停止反应。用荧光分光光度计在380 nm激发波长和450 nm 发射波长下测量释放的AMC荧光强度。酶活力定义为每min释放0.1 nmol/L AMC的酶量为1单位(U)。
1.4 内源丝氨酸蛋白酶对MP凝胶的影响
1.4.1 MP 凝胶制备 1.3.1 中的均质、离心步骤重复3次,取最终沉淀,分为对照组(C)、额外添加蛋白酶组(H),各组蛋白调到80 mg/mL。C 组:将MP 放入厨师机中4档空斩1 min,按质量分数2%加入NaCl,再擂溃9 min;H 组:在C 组的基础上,加入鲟鱼内源丝氨酸蛋白酶粗酶液[m(MP)/V(粗酶液)=450 g/1 mL]。取擂溃后的MP 于50 mL 离心管,于1 000g条件下离心5 min 以排出空气。在正常二段加热(40 ℃30 min+90 ℃20 min)模式上,增设劣化二段加热模式(55 ℃30 min+90 ℃20 min)。各组命名为:CC,正常加热模式对照组;HC,正常加热模式额外添加酶组;CM,劣化加热模式对照组;HM,劣化加热模式额外添加酶组。热处理后迅速冰水浴降温,置于2 ℃下24 h 后,分初始阶段、第1 段加热结束、第2段加热结束3个时间点测定以下指标。
1.4.2 对MP 凝胶裂解水平的影响 以TCA 可溶性肽含量表征MP裂解程度,参照Benjakul等[14]方法测定TCA 可溶性肽含量并稍作修改。取1.0 g 样品,加入5 mL 质量分数10%三氯乙酸溶液,均质。于4 ℃、10 000g条件下离心10 min,取上清液,以考马斯亮兰法测蛋白浓度,结果表示为每克样品的TCA可溶性肽质量(mg/g)。
1.4.3 对MP 凝胶化学作用力的影响 参照Pérez-Mateos等[15]方法测定MP凝胶化学作用力。准确称取0.7 g 凝胶样品,分别与7 mL 0.05 mol/L NaCl、0.6 mol/L NaCl、0.6 mol/L NaCl+1.5 mol/L 尿素、0.6 mol/L NaC1+8 mol/L 尿素、0.6 mol/L NaCl+8 mol/L尿素+0.05 mol/L β-巯基乙醇溶液混合(分别记为SA、SB、SC、SD、SE溶液),在10 000 r/min 条件下均质1 min,在4 ℃条件下反应1 h,在10 000g条件下离心15 min,取上清液,用双缩脲法测定蛋白质浓度。化学作用力计算:
1.4.4 对MP 二级结构的影响 以傅里叶红外光谱测定蛋白质二级结构,测定条件参考柴智等[16],将溴化钾研磨细后,于120 ℃下烘干24 h。取2 mg 肌原纤维蛋白冻干粉与200 mg溴化钾,研磨混合,压片。利用PeakFit 软件(v4.12)处理1 600~1 700 cm-1的图谱,根据各子峰积分面积及其对应关系计算蛋白质二级结构的相对含量(%)。
1.4.5 对MP 储能模量的影响 通过流变特性实验测定储能模量(G'),测定方法参照姜鹏飞等[17]并稍作修改。样品蛋白质量浓度为80 mg/mL,夹具直径为40 mm,平板间距1.0 mm,在夹具周围滴加二甲基硅油。采用变温扫描,正常二段加热模式设置温度从25 ℃升至40 ℃,在40 ℃保持30 min,再从40 ℃升至90 ℃,在90 ℃保持20 min;劣化二段加热模式设置温度从25 ℃升至55 ℃,在55 ℃保持30 min,再从55 ℃升至90 ℃,在90 ℃保持20 min。升温速率均为1 ℃/min。
1.4.6 对凝胶微观结构的影响 参考Zhou 等[18]方法并稍作修改,将凝胶(5 mm×5 mm×1 mm)在体积分数2.5%戊二醛中固定24 h,依次在体积分数为30%、50%、70%、80%、90%的乙醇中脱水15 min。用100%乙醇脱水2 次,每次10 min。将样品置于真空干燥器中干燥12 h。将干燥后的样品喷金后,置于场发射扫描电子显微镜下观察鱼糜凝胶的微观结构。
1.5 统计分析
用SPSS 23.0软件对实验数据进行单因素方差分析(ANOVA),通过Duncan法分析差异的显著性,置信区间为95%(P<0.05)。所有图表均用GraphPad Prism 8软件绘制。
2 结果与讨论
2.1 引起鲟鱼MP降解的主要蛋白酶分析
蛋白凝胶加热时会经过凝胶化、凝胶劣化和鱼糕化3 个过程,而引起凝胶性能下降的主要集中凝胶劣化阶段(55~70 ℃)[19]。通过漂洗等手段可去除鱼肉中大部分肌浆酶,降低肌浆蛋白酶对凝胶性能的影响,但即使经过6次漂洗,依然存在凝胶劣化现象[9],引起凝胶劣化的原因可能与MP中结合的某种蛋白酶有关。
由表1 可见,各处理组中,低、高浓度的丝氨酸蛋白酶特异性抑制剂Pefabloc SC 对鲟鱼MP 在55 ℃降解的抑制率均高于其他3 类抑制剂,而金属蛋白酶抑制剂EDTA 也有一定的抑制效果。依据Cao 等[20]的研究,鱼类骨骼肌中存在肌原纤维蛋白MBSP,且活力最适温度条件约为55 ℃,其活力可随Ca2+或Mg2+的额外加入而提升,亦可因EDTA 加入而被部分抑制。因此,丝氨酸蛋白酶是引起鲟鱼MP在55 ℃降解的主要作用酶。
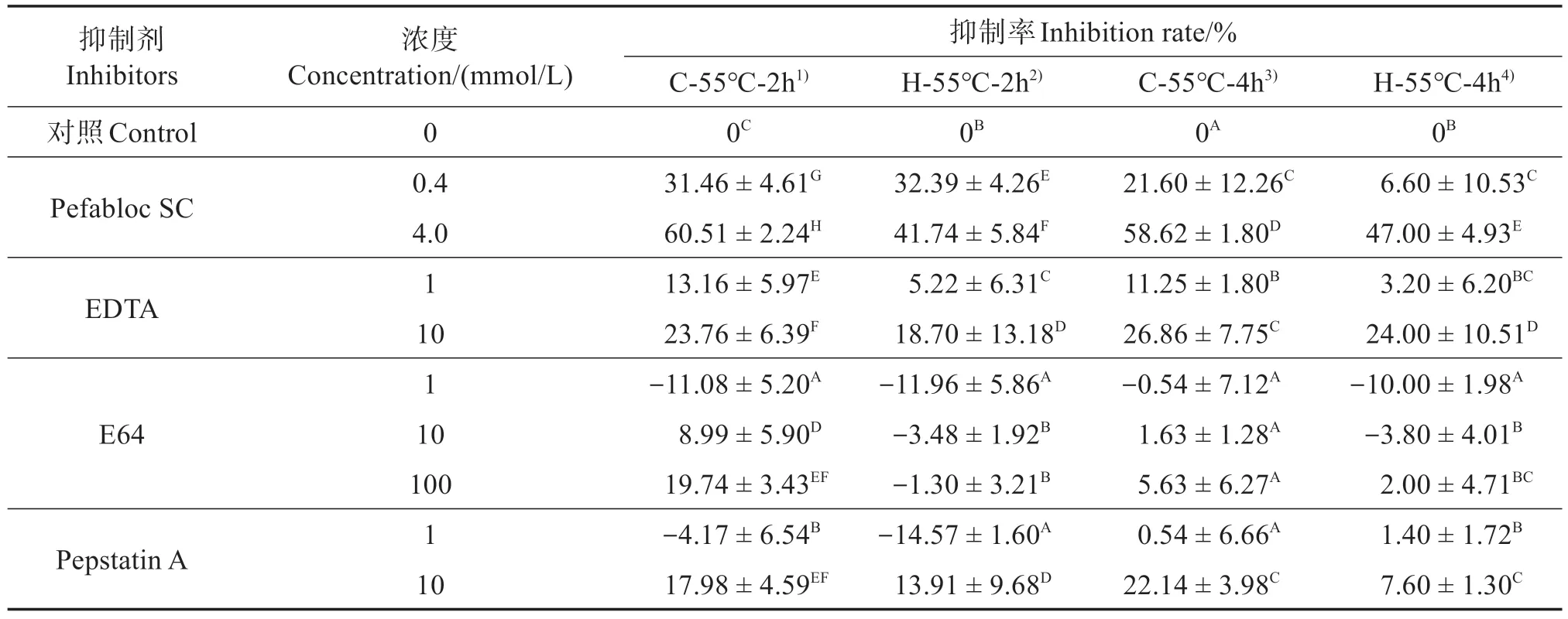
表1 在不同浓度和加热条件下不同类型蛋白酶抑制剂对粗酶的抑制率Table 1 Inhibition rate of different types of protease inhibitors on the crude enzyme derived from Sturgeon under different concentrations and heating conditions
2.2 丝氨酸蛋白酶活力分析
经过4 次漂洗,大部分肌浆丝氨酸蛋白酶已去除(表2)。经过加热、离心、冻干等步骤,丝氨酸蛋白酶最终为肌原纤维蛋白MBSP,每mg蛋白的粗酶活力为0.012 U。将Pefabloc SC 加入粗酶中,加入0.4 mmol/L Pefabloc SC 的酶活力为0.000 14 U/mL,加入4 mmol/L Pefabloc SC的酶活力为0 U/mL。
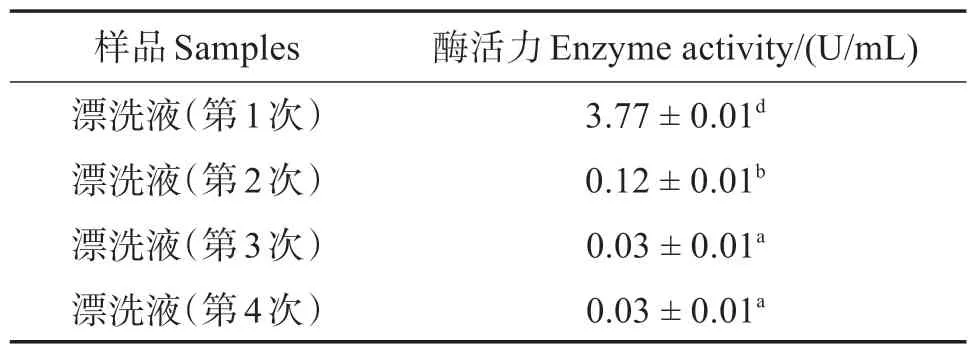
表2 漂洗液中丝氨酸蛋白酶活力Table 2 Serine proteinase activity of liquid for bleaching
2.3 内源丝氨酸蛋白酶对鲟鱼MP裂解水平的影响
TCA-可溶性肽含量是鱼糜凝胶中小分子蛋白含量,反映蛋白质在内源性蛋白酶作用下的降解程度,与蛋白质降解程度呈正相关[21]。表3 是凝胶形成过程中,TCA-可溶性肽含量变化。在第1 段加热过程中,HC组TCA-可溶性肽质量分数从1.26 mg/g增加到1.88 mg/g,而HM组则从1.26 mg/g 增加到3.15 mg/g,存在显著差异(P <0.05),到第2 段加热阶段,HC组TCA-可溶性肽质量分数增加0.83 mg/g,而HM组则增加1.00 mg/g。相比对照组,额外添加内源丝氨酸蛋白酶组在正常加热模式和劣化加热模式下,随着蛋白凝胶的形成,TCA-可溶性肽显著上升(P <0.05),主要与额外添加MBSP降解MP有关。

表3 各组鱼糜凝胶的三氯乙酸可溶性肽质量分数Table 3 TCA-soluble protein mass fraction of each surimi-gel group mg/g
2.4 内源丝氨酸蛋白酶对鲟鱼MP化学作用力的影响
维持蛋白凝胶网络结构的化学作用力主要为离子键、氢键、二硫键作用,疏水相互作用[22],凝胶在加热的过程中各化学作用力的变化,可能导致凝胶性能变化。图1 是MP 凝胶加热过程中离子键、氢键、二硫键作用及疏水相互作用的变化。
图1(A)可见,初始阶段,CC与CM组离子键为8.57 mg/mL,HC与HM组为10.74 mg/mL,表明离子键作用为维持蛋白结构的主要作用力,占比最大;至第1 段加热结束,各组离子键比例迅速下降(P <0.05),这是因为随着温度的上升,疏水相互作用的增加,导致离子键断裂[23]。
图1(B)可见,与其他3 组氢键逐渐下降趋势不同,HC组氢键初始为1.21 mg/mL,经过40 ℃加热30 min后增加至3.91 mg/mL,差异显著(P <0.05),第2段加热结束后方降至0.49 mg/mL(P <0.05),可能与额外添加的粗酶有关,该条件的凝胶形成过程中,额外添加的粗酶阻止了蛋白质分子分散,氢键虽在蛋白质受热变性时发生断裂,但在鱼糜凝胶冷却后会重新形成[19]。
在凝胶加热的过程中,疏水氨基酸的暴露导致疏水相互作用快速增加。图1(C)表明,在第1 段加热结束后,CC、CM、HM组疏水相互作用增加(P <0.05),而HC组疏水相互作用力从2.24 mg/mL 仅增至2.50 mg/mL,差异不显著(P >0.05),这是由蛋白质内部的疏水基团未完全暴露出来所致;HM组虽同样添加了额外的粗酶,但较高的温度会导致更多的疏水基团暴露,疏水相互作用力从2.24 mg/mL 增至5.61 mg/mL,这也是与HC组存在显著差异(P <0.05)的原因之一。由于MBSP 最适温度在55~60 ℃,属于耐热型蛋白酶[8],在此条件下,蛋白酶可降解部分蛋白,使更多的疏水性基团暴露出来,这也与表3结果相一致。
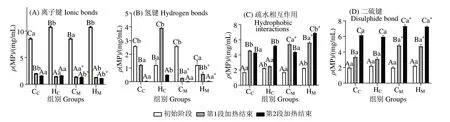
图1 加热过程中化学键含量变化Fig.1 Change of chemical bond content during heating
图1(D)表明,各组在加热过程中,随着加热温度的提升,二硫键作用增加(P <0.05),但相同加热模式的2 组之间差异不显著(P >0.05)。这是因为二硫键作用为主要的共价作用力,主要与温度有关[4],更高的温度促使二硫键的形成,而粗酶的添加对二硫键形成无显著作用。
2.5 内源丝氨酸蛋白酶对鲟鱼MP二级结构的影响
光谱中吸收最强的区域为酰胺I区(1 600~1 700 cm-1)[24],这是蛋白质肽键的特征振动模式之一,可定量分析而获得各种二级结构的相对含量。图2可见,初始阶段各组α-螺旋含量偏低,这是由添加NaCl和擂溃作用所致[4],在加热过程中,H组相比C 组的α-螺旋结构破坏更为明显,HC、HM组α-螺旋比例分别从13.7% 降至10.7%,从13.7% 降至10.5%,而CM、CM组则分别从13.9%降至12.7%,从13.9%降至11.7%。凝胶形成的过程中,主要支撑天然蛋白质结构的α-螺旋结构遭到破坏,含量逐渐减少,这与袁凯等[25]研究结论相一致。
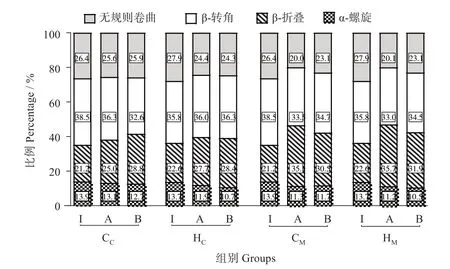
图2 蛋白质二级结构变化Fig.2 Secondary structure changes of proteins
在第1 段加热后,CM、HM组的β-折叠含量相比于CC、HC组增加更为明显,但HC组在第一段加热结束β-折叠含量从22.6%增加到27.7%,而CC组则是从21.2%增加到25.0%。说明温度是β-折叠形成主要因素,较高的温度会削弱氢键的相互作用,温度导致蛋白质变性、α-螺旋结构解旋展开、β-折叠形成[26],但内源丝氨酸蛋白酶会在一定程度上促进该过程。结合图1 的结果,在第一段加热结束后,HC、HM组维持凝胶结构的非共价键氢键存在显著差异(P <0.05),HC组氢键显著高于HM组,但氢键主要存在于β-折叠部分,其形成主要受温度影响,HC组在该阶段下β-折叠含量却低于HM组。所以造成HC组第1加热阶段结束后,氢键增加、疏水相互作用未明显增加的原因,更可能是在40 ℃下,由于额外添加内源丝氨酸蛋白酶降解了某些关键蛋白基团,阻止蛋白质分子内部的疏水基团暴露,且凝胶冷却后重新形成氢键。而在第2 加热阶段,相比HC组,HM组的疏水相互作用显著增加(P <0.05),这是因为在55 ℃条件下,高温使蛋白质分子充分变性,大部分氢键遭到破坏,且在凝胶冷却后不再重新生成,α-螺旋遭到破坏,疏水基团暴露,疏水相互作用相比正常加热模式组显著增加(P <0.05)。
2.6 内源丝氨酸蛋白酶对鲟鱼MP储能模量的影响
图3(A、B)表明,随着温度从25 ℃上升到40 ℃,各组凝胶的G' 均迅速提高,在温度40~55 ℃区间内急速下降,而HC、HM组在60 ℃后的升温过程中,G'升高趋势均分别低于CC、CM组,这可能与在第1段恒温加热时期有关。经模拟凝胶二段式加热过程,G'从小到大依次为:HM(35 198 Pa)组、HC组(50 046 Pa)、CM组(65 100 Pa)、CC组(84 495 Pa)。图3(C、D)表明,90 ℃恒温加热阶段,HM组与HC的G'相比于同种加热模式下的CM组、CC组均增加缓慢。这是由于额外添加内源丝氨酸蛋白酶在40 ℃恒温加热的条件下可能使部分关键蛋白降解[5],肌球蛋白头部与部分螺旋形尾部结构相连的部分肽链解离不完全[27],且包埋的疏水基团未能完全暴露,导致在后续的升温过程中,蛋白质分子不够分散,不能形成较好的凝胶网络结构,G'上升缓慢,降低了最终的凝胶流变性能。而在劣化加热模式下,由于55 ℃加热30 min 条件,使得MP 分子充分变性并伴随着内源丝氨酸蛋白酶对蛋白质降解作用,使得H组与C组在55~75 ℃升温区间内相比于正常加热模式,G'增加缓慢,甚至HM组在此温度区间内G'出现下降趋势。
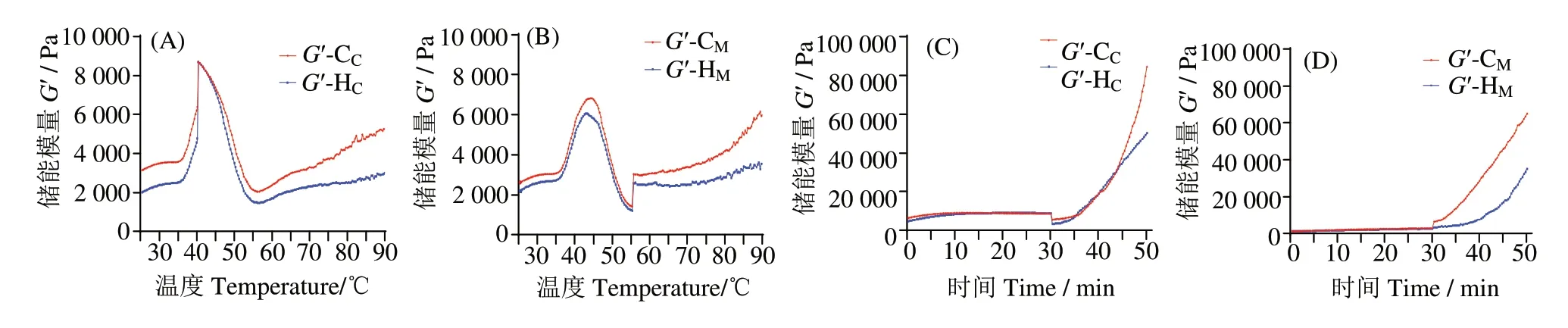
图3 储能模量(G')变化Fig.3 Change of the stored modulus(G')
2.7 内源丝氨酸蛋白酶对鲟鱼MP 凝胶微观结构的影响
图4 表明,在正常加热模式下,图4(C)中孔径比图4(A)变大。这是由于MP 在加热的过程中,初始时肌球蛋白头部通过二硫键聚集,而在凝胶化的后续阶段,则因肌球蛋白尾部的疏水相互作用而形成网状结构,达到凝胶形成的目的[19]。相比劣化加热模式,正常加热模式凝胶分子团更大,且更为聚集。在两种加热模式下,蛋白酶粗酶的额外添加,均会导致凝胶结构更为松散,三维网络结构松散。

图4 凝胶微观结构变化Fig.4 Microstructure of myofibrillar protein gels treated with different concentrations of endogenous serine protease
3 结论
鲟鱼内源丝氨酸蛋白酶引起肌原纤维蛋白在55 ℃条件下降解的主要蛋白酶,金属蛋白酶对蛋白降解也有一定作用。在肌原纤维蛋白凝胶形成的过程中,由于内源丝氨酸蛋白酶作用导致蛋白质降解。在凝胶化阶段,伴随疏水相互作用与氢键发生变化,蛋白质二级结构发生改变,使得此阶段中储能模量增幅缓慢,最终导致凝胶三维网络结构疏松。
