凡纳滨对虾过氧化物还原酶3基因的分子克隆与功能分析
2023-05-06张秀霞鲁耀鹏张泽龙李军涛郑佩华冼健安
郭 慧,李 腾,,张秀霞,鲁耀鹏,张泽龙,李军涛,郑佩华,冼健安
(1.广东海洋大学水产学院,湛江市海洋生态与养殖环境重点实验室,广东 湛江 524088;2.中国热带农业科学院热带生物技术研究所,海南省海洋生物资源功能性成分研究与利用重点实验室/海南热带农业资源研究院海南省热带农业生物资源保护与利用重点实验室,海南 海口 571101;3.中国热带农业科学院湛江实验站,广东 湛江 524013)
过氧化物还原酶(Peroxiredoxin,Prx)是多数生物的一类多功能抗氧化酶[1],在生物体免疫、发育、炎症、蜕皮、繁殖和细胞凋亡等过程发挥关键作用[2,3]。Prx 由六个亚家族(Prx1~Prx6)构成,通过半胱氨酸(Cys)残基的数目和保守程度分为三类:Prx1~Prx4,典型的2-Cys Prx;Prx5,非典型2-Cys Prx;Prx6[5-7]。其中,典型2-Cys Prx 是甲壳动物中分布较多的Prx 类型,有较高的催化效应[8],主要通过同源二聚体的方式清除过氧化氢、烷基过氧化氢等过氧化物。
目前,已在脊尾白虾(Exopalaemon carinicauda)[9]、中国明对虾(Fenneropenaeus chinensis)[10]、斑节对虾(Penaeus monodon)[11]和中华绒螯蟹(Eriocheir sinensis)[12]等甲壳动物中获得Prx基因及其编码的氨基酸序列。然而,这些研究仅发现Prx基因的其中一个或几个亚型[13],其表达模式也有一定物种差异和基因亚型差异,虾蟹类中许多物种的Prx信息还有待挖掘和深入探究[12]。迄今,关于凡纳滨对虾Prx的研究较少,其在凡纳滨对虾遭受病原菌感染及逆境胁迫时的生理功能尚不清楚。
凡纳滨对虾(Litopenaeus vannamei)是我国最重要的养殖虾种之一。然而,工厂高密度集约化的养殖模式严重破坏了对虾的养殖环境,引起种质资源退化、病害频发,造成虾类免疫功能受损及抗应激能力下降,给水产养殖经济造成较大损失[14-15]。鉴于Prx基因在机体免疫过程中的重要作用,笔者研究其在对虾抗胁迫和抗病原体免疫防御中的作用,为研究甲壳动物Prx基因的生理功能及作用机制提供参考,并为培育抗病高产对虾新品种提供理论基础。
1 材料与方法
1.1 供试对虾的管理和饲养
凡纳滨对虾购自于海南省文昌市对虾养殖场,体质量(7.56±0.79)g,体长(9.86±0.28)cm,生长状况良好。实验在中国热带农业科学院文昌实验基地进行。所有对虾暂养在盐度15、温度(24±2)℃、pH 7.9~8.0 的循环海水系统中,连续曝气增氧,并进行循环过滤处理。在实验前,每天定时定点定量投喂对虾商业饲料(基本成分质量分数:蛋白质40%,脂肪5%,纤维5%,灰分16%)。
1.2 对虾总RNA提取及cDNA合成
取健康虾3尾,剖取肝胰腺,放入液氮中进行研磨,按TRIzol 法提取组织总RNA,利用NanoDrop 2000 分光光度计(Thermo Scientific,USA)检验RNA 的纯度和质量,并通过琼脂糖凝胶电泳评估其完整性。选取质量良好的总RNA 用反转录试剂盒PrimeScript RT reagent Kit With gDNA Eraser(TaKaRa,大连)反转录合成第一链cDNA。
1.3 Prx基因cDNA序列克隆
从凡纳滨对虾肝胰腺4-NP 胁迫转录组中得到LvPrx3基因的部分序列,设计中间片段的扩增引物Prx-F和Prx-R(表1)。以凡纳滨对虾肝胰腺cDNA为模板,经过第1 轮PCR 扩增,扩增程序:94 ℃3 min;94 ℃30 s,58 ℃30 s,72 ℃1 min,35 个循环;72 ℃10 min。PCR 产物经琼脂糖凝胶电泳检验后,用SanPrep 柱式DNA 胶回收试剂盒(生工生物工程(上海)股份有限公司)回收、纯化,连接至pMD18-T 载体(TaKaRa,大连),转化到大肠埃希菌(Escherichia coli)DH5α 感受态细胞(TaKaRa,大连)中。挑选阳性单克隆质粒,送至深圳华大基因公司测序。
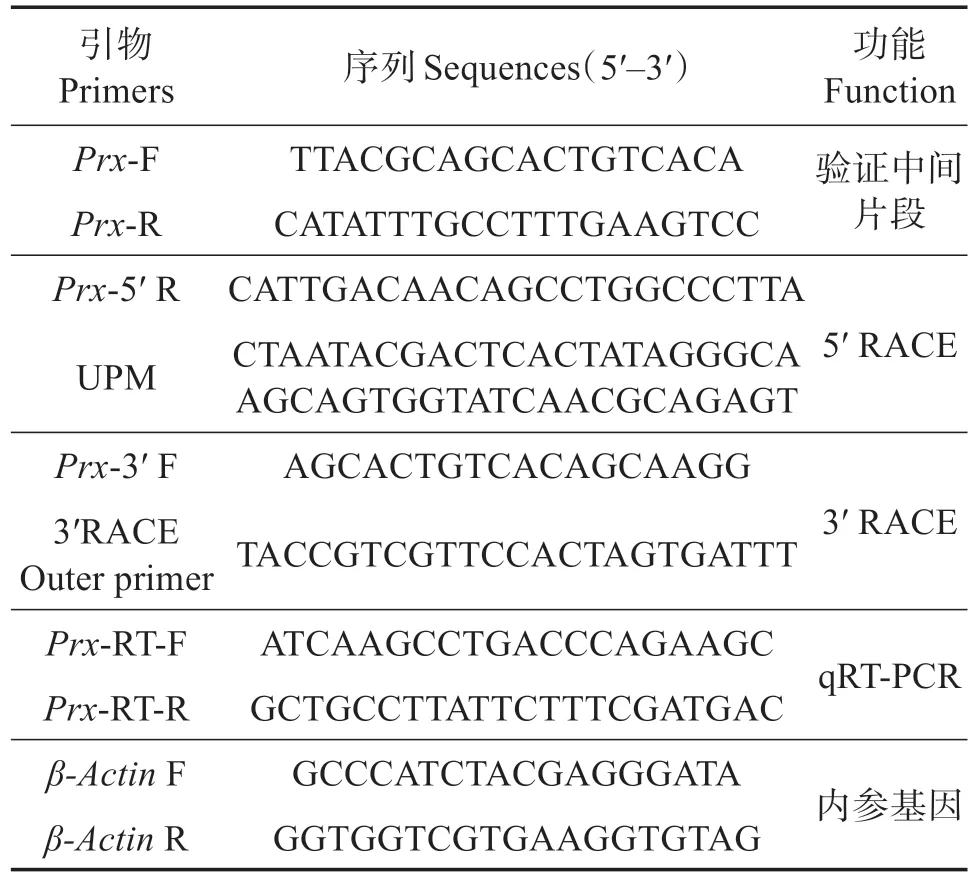
表1 实验中所用引物序列Table 1 Oligonucleotide primers used in experiments
LvPrx3基因5' 末端片段按照SMART RACE cDNAAmplification Kit试剂盒(Clontech,USA)说明书进行扩增,用Primer Premier 6.0 设计基因下游引物Prx-5'R 和Universal Primer Mix(UPM)进行配对扩增,扩增程序:94 ℃30 s,68 ℃30 s,72 ℃3 min,30 个循环。Prx3'末端,使用3'-Full RACE Core Set with PrimeScript RTase 试剂盒(Clontech,USA),根据已知中间片段设计基因上游引物Prx-3'F,然后与3' RACE Outer Primer 进行PCR 扩增,扩增程序:94 ℃3 min;94 ℃30 s,58 ℃30 s,72 ℃1 min,35个循环;72 ℃10 min。5'-RACE 和3'-RACE 产物经凝胶回收纯化,与克隆载体连接、转化感受态细胞,测序。将目的基因5'和3'端测序结果联合中间片段进行拼接,取得最终的LvPrx3基因cDNA 全长序列。
1.4 LvPrx3基因序列分析
通过DNAStar 中的EditSeq 软件分析LvPrx3的开放阅读框(ORF)及其推导的氨基酸序列,利用NCBI 数据库 的BLAST(http://www.ncbi.nlm.nih.gov/blast)查找LvPrx3的同源核酸序列及其氨基酸序列并进行比对。用ExPASy(http://au.expasy.org/tools/)程序预测LvPrx3的蛋白理化性质,以SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测其信号肽,运用TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白跨膜结构域;Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)预测蛋白的亚细胞定位;再通过NCBI 的保守结构域(CDD)(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测其保守区和特殊位点;运用Clustal X 和MEGA 6.0 对不同物种来源的Prx 氨基酸序列进行多重比对及聚类分析,并以邻接法(NJ)构建系统发育树(置信度:Bootstrap=1000)。
1.5 LvPrx3基因组织分布特征分析
随机选取15 尾健康虾,取其血细胞以及眼柄、鳃、肝胰腺、肠道、肌肉组织,提取其总RNA并进行半定量PCR。以内参基因的β-ActinF和β-ActinR为引物,各组织cDNA为模板进行半定量PCR扩增,程序:94 ℃3 min;94 ℃30 s,58 ℃30 s,72 ℃1 min,30个循环;72 ℃10 min。扩增产物用琼脂糖凝胶电泳评估。根据条带亮度调整各组织cDNA模板使用量,使内参基因扩增的片段亮度基本一致,最终确定各组织cDNA用量。在相同状态下,以Prx-RT-F和Prx-RT-R为引物扩增LvPrx3,产物用琼脂糖凝胶电泳检测。
1.6 脂多糖(LPS)注射和4-壬基酚(4-NP)胁迫实验
将150尾健康对虾随机分成LPS组和对照组,每组3 个重复组,每重复组25 尾。将LPS(2 mg·mL-1,E.coliL2880,Sigma)溶解于无菌生理盐水,配制成2 μg·μL-1的LPS 注 射液。根据Xian 等[16]的研究,LPS 组按每g 虾8 μg 的用量注射LPS 溶液,对照组注射等量的无菌生理盐水。在注射后的0、3、6、12、24、48 h 时,实验组和对照组各随机采样9 尾,取其眼柄和肠道在液氮速冻,置于-80 ℃下保存备用。
根据本课题组的前期研究确定4-NP 胁迫质量浓度500 μg·L-1[17]。用4-NP(标准品,纯度最低为99%)和无水乙醇制备1 mg·mL-1的4-NP 母液。在海水中加入4-NP 母液,使4-NP 最终质量浓度为500 μg·L-1。对照组中加入等量的无水乙醇。无水乙醇在4-NP实验组中的最终体积分数小于0.002%。设置实验组和对照组,每组设3个平行,每个平行组随机放置健康虾30 尾。为保证水体的实验浓度稳定,每24 h换水1次,每次换水量为50%,加入4-NP工作溶液,保持4-NP 最终质量浓度为500 μg·L-1,在水体中的实际质量浓度为(467.18 ± 28.56)μg·L-1。在对照组中未检测到4-NP。4-NP暴露0、24和48 h后,每个平行分别随机采集9尾虾,取其眼柄和肠道在液氮速冻保存。
1.7 LvPrx3基因相对表达量分析
用Bio-Rad T100(Bio-Rad,USA)仪器进行qRTPCR检测,以Prx-RT-F、Prx-RT-R和β-ActinF、β-ActinR为引物,PCR 反应体系设置为20 μL。扩增程序:94 ℃3 min,95 ℃15 s,58 ℃15 s,72 ℃20 s,40个循环。采用2-ΔΔCt法计算表达量,数据以平均值±标准差表示,用SPSS 19.0进行t检验,分析LPS刺激和4-NP胁迫下,LvPrx3基因在相应组织中的表达变化。
2 结果与分析
2.1 LvPrx3基因序列分析
通过5'/3'-RACE 技术分别克隆得到585 bp 的5'末端和682 bp 的3'末端,经拼 接获得962 bp 的LvPrx3cDNA 全长序列。该序列含有45 bp 的5'端非编码区(5' UTR)、233 bp 的3' 端非编码区(3' UTR)和684 bp 的ORF,可编码227 个氨基酸。其3'末端处有1 个终止密码子TAA,多聚腺苷酸加尾信号AATAAA 和poly A 尾(图1)。LvPrx3 蛋白的分子质量为25.09 ku,pI 为6.22。LvPrx3具有“FYPLDFTFVCPTE”的N 端和“GEVCPA”的C 端,为典型2-Cys Prx的特殊结构域。此外,LvPrx3还有以下的特殊结构域:催化三联体结构(T77-C80-R156),二聚体界面(V37-F78-V79-T82-G145-L155-K168-H169-M170-V172-N173-D174-G178-R179-R186-C201-P202-A203-N204),十聚体(五个二聚体)界面(F76-F110-S111-F136-K138-D150),过氧化和可溶性半胱氨酸(C80-C201)(图2)。SignalP 5.0预测结果表明,LvPrx3蛋白为跨膜信号肽。Cell-PLoc 2.0预测结果显示,LvPrx3蛋白主要定位于线粒体中。

图1 凡纳滨对虾Prx3及其推导的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequences of Prx3 gene of Litopenaeus vannamei
2.2 LvPrx3基因同源性及进化树分析
LvPrx3基因与凡纳滨对虾基因组对应核苷酸序列(GenBank 登录号XR_003477980.1)的相似性达99%;LvPrx3基因可编码227个氨基酸,而基因组对应核苷酸序列编码的氨基酸(ROT83170.1)仅为186个,两者的覆盖率(Coverage)为72%。LvPrx3与报道的凡纳滨对虾Prx 蛋白序列(ACX53642)的相似性为65%;与Prx4(AET36895)的相似性为57%。同其他物种相比,LvPrx3 与斑节对虾(P.monodon,XP_037784347.1)的Prx 相似性最高,为98%;与日本对虾(Penaeus japonicus,XP_042874112.1)和美国龙虾(Homarus americanus,XP_042239359.1)的相似性次之,分别为94%和86%;与拟穴青蟹(Scylla paramamosain,ASS34530.1)的相似性为82%。与无脊椎动物日本扇贝(Mizuhopecten yessoensis,OWF43851.1)、蚤状溞(Daphnia pulex,EFX63892.1)和大型溞(Daphnia magna,KZS17058.1)的相似性分别为75%、75%和70%,与红树林鳉(Kryptolebias marmoratus,XP_017259545.1)、虎尾海马(Hippocampus comes,XP_019737549.1)、长鳍叉尾鮰(Ictalurus furcatus,ADO27790.1)、斑点叉尾鮰(I.punctatus,NP_001188127.1)、黄颡鱼(Tachysurus fulvidrac,XP_027030673.1)的相似性分别为74%、72%、72%、72%和68%。
多重序列比对结果表明,催化三联体与过氧化和可溶性Cys结构在所比对物种的Prxs序列中高度保守,但二聚体界面结构和十聚体界面结构在不同物种的序列中有差异。在典型的2-Cys型Prx中,包含两个保守且有还原活性的Cys:过氧化Cys和可溶性Cys,且为结构域交叠的同源二聚体。可溶性Cys位于C 端,由五个二聚体按特定规则形成一个环状十聚体[18-20]。由此推断,本研究克隆的LvPrx3基因属于典型的2-Cys 型Prx;同时结合Cell-PLoc 2.0 预测结果,该基因定位于线粒体中,属于Prx3亚型(图2)。

图2 LvPrx3蛋白的多序列比对Fig.2 Multiple sequence alignment of LvPrx3 protein
由Prx 序列相似性构建的系统进化树显示,凡纳滨对虾先与同为节肢动物门甲壳纲的斑节对虾聚为一支,再与软甲纲的拟穴青蟹聚成一小分支;而节肢动物门切甲亚纲的两种水溞和软体动物门双壳纲日本扇贝聚为一小分支后再与凡纳滨对虾所在分支形成无脊椎动物的两大分支。Prxs的变化趋势符合从低等无脊椎动物发展到高等脊椎动物的进化历程(图3)。
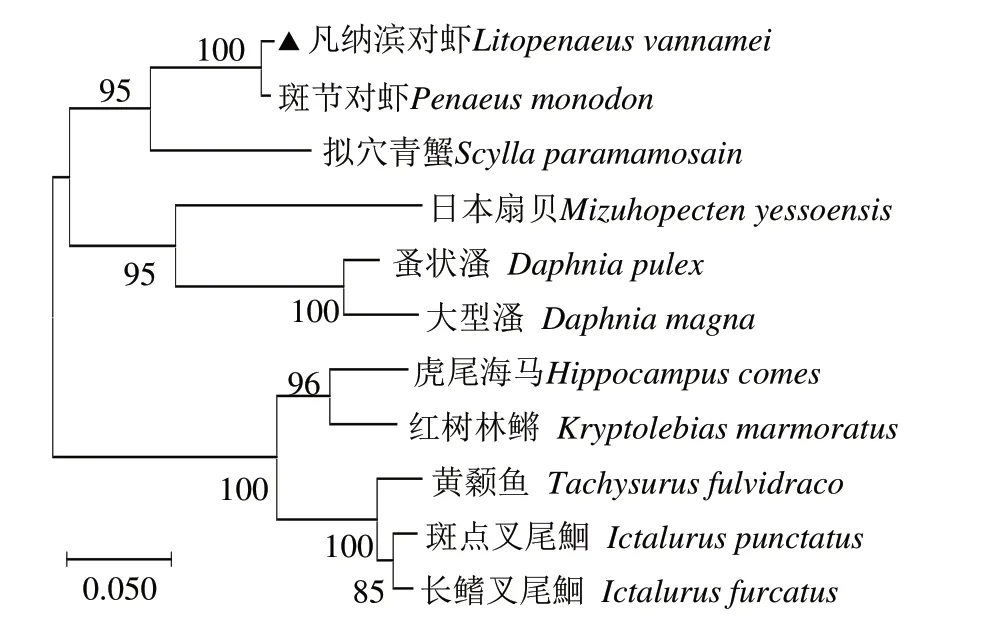
图3 LvPrx3基因的系统进化分析Fig.3 Phylogenetic analysis of LvPrx3 gene
2.3 LvPrx3基因在不同组织中的表达量
图4 可见,LvPrx3基因在所有检测组织中均有不同程度的表达,在眼柄中表达量最高,肠道次之,其他4种组织中的表达量无明显区别。
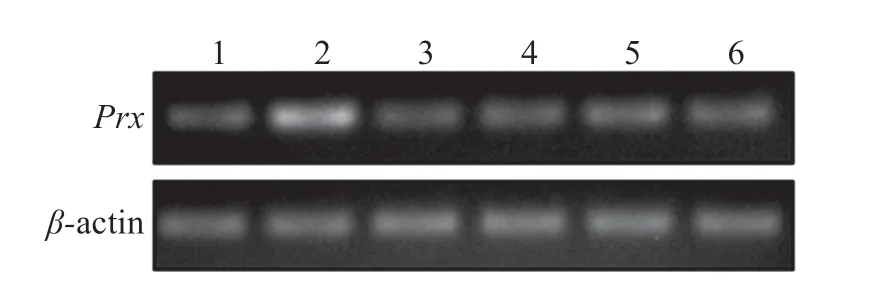
图4 LvPrx3在不同组织中的相对表达Fig.4 Expression levels of LvPrx3 gene in different tissues
2.4 LPS刺激及4-NP胁迫后LvPrx基因的表达量
如图5(A)所示,LPS 刺激3 h 时,对虾眼柄中的LvPrx3表达量显著上升(P<0.05),6 h时恢复到对照组水平(P>0.05),12~48 h 时出现长时间上升(P<0.05)。在刺激12 h 时表达量最大,是对照组的1.79倍。图5(B)表明,LPS 刺激后凡纳滨对虾肠道中的LvPrx表达量在3~24 h时持续性显著下调(P<0.05),而在LPS刺激48 h时升至对照组水平(P>0.05)。
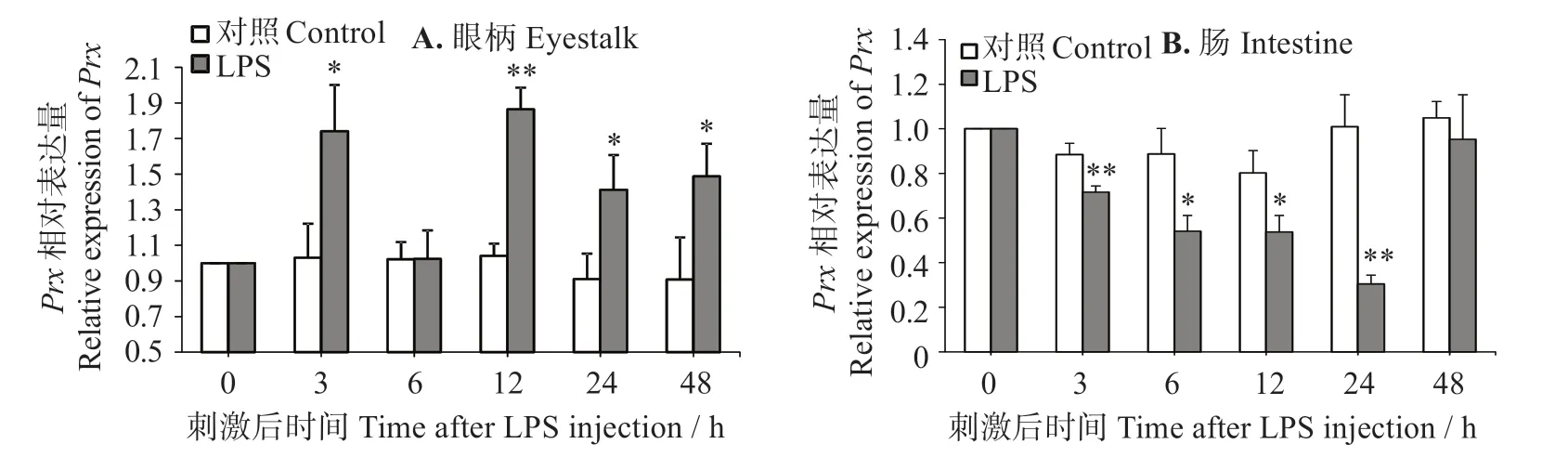
图5 LPS注射后LvPrx3在虾眼柄和肠道中的表达量Fig.5 Expression levels of LvPrx3 gene in eyestalk and intestine after LPS injection
图6(A)可见,凡纳滨对虾眼柄中LvPrx3表达量在4-NP 胁迫后6~24 h 逐渐上调(P<0.01),24 h 时最大,为对照组的4.11倍;胁迫至48 h时LvPrx3表达水平的增加量减少,但仍显著高于对照组(P<0.05)。图6(B)表明,凡纳滨对虾肠道中LvPrx3表达量在胁迫6 h 时与对照组无明显区别(P>0.05),胁迫12 h时显著上升(P<0.05),24 h 时降低至对照组水平(P>0.05),胁迫48 h时出现明显下调(P<0.05)。
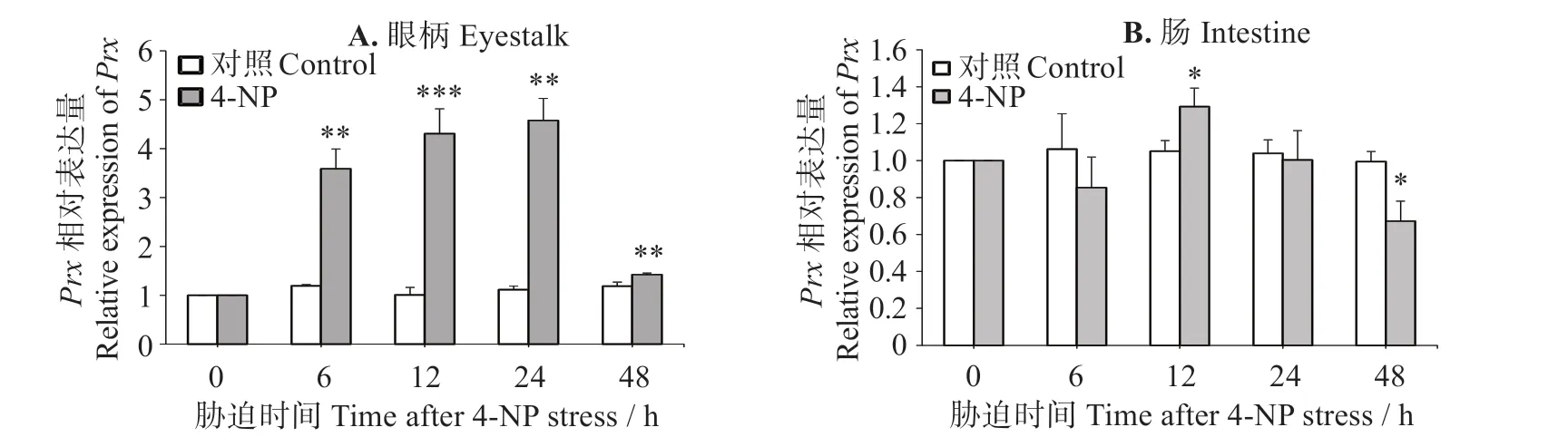
图6 4-NP胁迫下LvPrx3在眼柄和肠道中的表达量Fig.6 Expression levels of LvPrx3 gene in eyestalk and intestine under 4-NP stress
3 讨论
从凡纳滨对虾中克隆到962 bp 的LvPrx3基因cDNA 全长序列,通过蛋白特异性结构域分析和BLAST 比对,确定其属于典型的2-Cys Prx,有特异的“FYPLDFTFVCPTE”N 端和“GEVCPA”C 端,与多种物种的Prx 氨基酸序列相似性较高。LvPrx3与先前报道的凡纳滨对虾Prx(ACX53642)[21-22]和Prx4(AET36895)[13]的相似性分别为65%、57%。这3 个不同亚型Prx 的序列差异较大,表明它们在对虾中可能发挥了不同的生理作用。
通过对LvPrx3的蛋白结构进行预测,发现其不仅有典型的2-Cys Prx 的C 端和N 端,还包含催化三联体结构,二聚体、十聚体界面,过氧化、可溶性半Cys。其中催化三联体与LvPrx3的蛋白酶促反应相关,而过氧化和可溶性Cys 是使LvPrx3蛋白更易与氧化还原信号分子反应的调节开关。目前特殊的蛋白结构二聚体界面与十聚体界面的功能尚不明确,但蛋白质的聚合状态对蛋白质的活性有影响,对其表达和激活有决定性作用。Jang等[23-24]研究发现,当生物体内过氧化物浓度处于低水平时,Prx会以单体或二聚体状态存在;当氧化物浓度处于高水平时,Prx则折叠成稳定的环状十聚体结构,作为分子伴侣行使抗氧化功能。另外,对LvPrx3进行亚细胞定位分析,发现它主要存在于易聚集活性氧的线粒体中,这与Prx的功能相对应,与中华绒螯蟹EsPrx3[12]的结果一致,表明LvPrx3可能具有抗氧化功能。
基因的组织分布和病理相关表达量变化与其行使的功能密切相关[25]。中国明对虾(F.chinensis)Prx主要在肝胰腺、卵巢和肠道中有较高的表达量[10],Prx4则在性腺和肝胰腺中高表达[26]。脊尾白虾(E.carinicauda)Prx5在肝胰腺和卵巢中出现高表达,在眼柄、胃和肠道中低表达[9]。在斑节对虾(P.monodon)中,Prx1主要在脑、肠道、鳃和肌肉中高表达,而Prx5在肌肉中高表达,在胃、心脏和鳃中的表达量逐渐降低[11]。在日本沼虾(Macrobrachium nipponense)中,Prx表达量最高的组织是肝胰腺和鳃,最低的是肠道[27]。中华绒螯蟹(E.sinensis)的4种Prx(Prx、Prx3、Prx4和Prx5)均在肝胰腺中有较高的表达水平[12]。在拟穴青蟹(Scylla paramamosain)和远海梭子蟹(Portunus pelagicus)中,Prx3在肝胰腺中的表达量最高,肌肉(拟穴青蟹)和性腺(远海梭子蟹)中次之[28-29]。中华新米虾(Neocaridina denticulata sinensis)Prx3在鳃组织中表达量最高,眼柄中次之,在肝胰腺、性腺和肠道中几乎无表达[30]。本研究中,LvPrx3在所检测的6 个组织中均有表达,其中在眼柄中表达量最高,肠道中次之。可见,不同物种及不同亚型Prx的表达具有一定的组织特异性,不同物种各种亚型的Prx主要在特定组织中发挥关键作用。本研究的LvPrx3主要在眼柄和肠道的抗氧化过程中发挥作用。
Prx是一类重要的过氧化物酶,主要在清除过氧化物,防止过量活性氧(ROS)引起的氧化损伤中起关键作用[7]。甲壳动物Prx在大多数环境胁迫和病原体感染过程中均被诱导并发挥作用[31]。斑节对虾(P.monodon)在病原菌[哈维弧菌(Vibrio harveyi)、无乳链球菌(Streptococcus agalactiae)]感染、盐度胁迫、pH 胁迫状态下,鳃中Prx5表达量均一定程度上调,在重金属铜和镉胁迫时则被显著抑制[11]。中国明对虾(F.chinensis)在受到弧菌(Vibrio anguillarum)刺激时,肝胰腺和血细胞中的Prx转录水平均明显上调[32];在对虾感染白斑综合征病毒(WSSV)后,Prx4在这两种组织中mRNA 表达量显著升高[26]。在日本囊对虾(Marsupenaeus japonicus)中,Prx6在感染鳗弧菌(V.anguillarum)后被诱导上调表达,通过调节过氧化物还原酶活性,提高了对虾的抗细菌能力[33];在感染WSSV后,Prx4被诱导分泌到血淋巴中,促进转录因子Dorsal 入核,后诱导抗菌肽基因的表达,抑制WSSV的复制[34]。脊尾白虾(E.carinicauda)被鳗弧菌(V.anguillarum)和WSSV 胁迫后,肝胰腺和血细胞的Prx5表达量出现先上调后下调趋势[9]。拟穴青蟹(S.paramamosain)在受到重金属镉胁迫时Prx表达量在刺激前期显著上调[28]。中华绒螯蟹(E.sinensis)在感染嗜水气单胞菌(Aeromonas hydrophila)的状态下,Prx、Prx3、Prx4和Prx5表达水平均显著升高[12]。本研究中,经LPS刺激后,眼柄和肠道的LvPrx3表达量表现出相反的表达模式,眼柄LvPrx3的表达量被显著诱导上调,肠道LvPrx3表达水平则被显著抑制,表明LvPrx3在革兰阴性菌感染时,在眼柄中起重要的抗氧化保护作用,而在肠道中可能不是主要免疫防御因子。4-NP 胁迫结果显示,眼柄LvPrx3的表达量在所有检测的时间点被显著诱导上调,肠道LvPrx3表达量在胁迫中期略有上升,在后期被抑制。这些结果表明LvPrx3在4-NP胁迫时,在眼柄的抗氧化防御中发挥重要作用,也参与了肠道的免疫防御。LPS 刺激和4-NP 胁迫后,均可发现LvPrx3在眼柄中有高度的表达量,表明LvPrx3主要在眼柄中发挥抗氧化保护功能,与LvPrx3在眼柄中基础表达量最高的结果相吻合。
4 结语
LvPrx3全长cDNA 序列962 bp,ORF 为684 bp,能编码227个氨基酸。氨基酸序列推导的蛋白分子质量为25.09 ku,pI 为6.22。LvPrx3基因属于典型的2-Cys Prx,主要定位于线粒体中,包含高度保守的“FYPLDFTDVCPTE”N 端和“GEVCPA”C 端。还具有催化三联体、二聚体界面、十聚体界面、过氧化和可溶性半胱氨酸等结构域。LvPrx3 与斑节对虾P.monodon的Prx 氨基酸序列相似性最高。基因LvPrx3在凡纳滨对虾所有检测的组织中均有表达,在眼柄中表达量最高,肠道次之。LPS 刺激和4-NP胁迫后,LvPrx3在眼柄的表达量均显著上调,表明LvPrx3主要在眼柄中发挥抗氧化保护功能。
