miRNA-155靶向SOCS5对无乳链球菌诱导罗非鱼脑星形胶质细胞炎症的影响
2023-05-06简纪常
张 祥,黄 瑜,蔡 佳,简纪常,王 蓓
(广东海洋大学水产学院/广东省水产动物病害防控与健康养殖重点实验室/水产经济动物病害控制广东省普通高等学校重点实验室,广东 湛江 524088)
无乳链球菌(Streptococcus agalactis)属革兰阳性菌,是一种人、畜及水产动物共患的致病菌,近年在罗非鱼养殖中呈高暴发态势,造成巨大的经济损失[1,2]。脑是无乳链球菌感染的一个重要靶器官[3],感染机制是无乳链球菌通过黏附吞噬细胞逃避免疫,后随巨噬细胞游走侵染其他组织,并透过血-脑屏障引发脑膜炎破坏脑-神经系统,最终由于过度炎症反应,鱼体免疫系统崩溃[4]。
微小核糖核酸155(microRNA-155,miR-155)是由23 个核苷酸组成的一组单链小分子RNA,在基因表达的转录后水平上起着重要的调节作用[5],其在炎症反应的发生发展过程中具有重要意义。研究发现,miRNA-155通过与靶mRNA的3'-非翻译区(3'-untranslated region,3'-UTR)碱基互补配对,阻碍靶mRNA的翻译或导致其降解[6],miR-155与炎症反应等病理过程息息相关[7,8]。本课题组前期工作发现,感染无乳链球菌后包括miR-155 在内的多个miRNA 在尼罗罗非鱼(Oreochromis niloticus)脑及免疫器官中呈显著的时间依赖性表达,这进一步说明miR-155 的表达水平与炎症反应密切相关[9]。目前关于miR-155 与靶基因互作调控机体炎症反应的报道多集中于哺乳动物中,如在小鼠的特应性皮炎和人体的溃疡性结肠炎中均有miR-155参与并发挥作用[10,11]。细胞因子信号转导抑制因子5(Suppressor of cytokine signaling 5,SOCS5)属于免疫抑制分子家族,是一类调控细胞因子信号通路的负反馈调节剂,可以被多种细胞因子诱导而产生,又可反过来抑制众多促炎症因子[12,13]。如TNF-α、IL-6等是JAK/STAT 通路上重要的负性调节因素。目前关于SOCS5参与炎症反应的相关报道主要集中在人、小鼠等哺乳动物中[14,15],关于SOCS5与miRNA 互作参与炎症反应的机制尚未见报道。
基于此,本研究通过生物信息学分析和qRTPCR、双荧光素酶报告基因实验,检测无乳链球菌感染后尼罗罗非鱼脑星形胶质细胞中miR-155 和SOCS5基因表达模式,预测miR-155 和SOCS5的靶结合位点,构建尼罗罗非鱼SOCS5基因野生型和突变型报告质粒,验证miR-155和SOCS5的靶向关系,通过进一步过表达和敲降miR-155,检测miR-155对SOCS5基因表达的影响和调控模式,为后续深入研究miR-155靶向SOCS5在无乳链球菌诱导机体炎症反应中的作用机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞及菌株 尼罗罗非鱼星形胶质细胞系TA-02 由本课题组分离并建系成功[16]。细胞在含体积分数10%的胎牛血清、体积分数1%青链霉素混合液的L15 培养基中培养。HEK-293T 细胞系由广东省水产动物病害防控与健康养殖重点实验室保存。细胞在含体积分数10%胎牛血清、体积分数1%青链霉素混合液的DMEM 培养基中培养。无乳链球菌ZQ0910 株由广东省水产动物病害防控与健康养殖重点实验室保存[17]。
1.1.2 主要试剂 pGL3-Basic、PRL-TK 双荧光素酶质粒(本实验室保存);双荧光素酶报告基因检测试剂盒(碧云天生物技术公司);RNA 提取(TransZol Up Plus RNA Kit)、cDNA合成(TransScript One-Step gDNA Removal and cDNA Synthesis Super Mix)及荧光定量(TransStart Green qPCR Super Mix)试剂(北京全式金生物公司);DMEM高糖培养基和胎牛血清(Gibico);LipofectamineTM3000(赛默飞世尔科技);Endo-free Plasmid Mini Kit I质粒小提试剂盒、Universal DNA Purification Kit DNA 纯化回收试剂盒(Omega Bio-Tek);KpnI、SmaI 内切酶(宝日生物技术(北京)有限公司);所有引物和尼罗罗非鱼miR-155 mimics、miR-155 inhibitor 及其mimics NC、inhibitor NC 均购自生工生物工程(上海)股份有限公司。
引物由生工生物工程(上海)有限公司合成,见表1。

表1 引物序列Table 1 Primer sequence
1.2 方法
1.2.1 无乳链球菌感染TA-02 细胞实验 将无乳链球菌ZQ0910 菌株和培养基按体积比1∶100 的比例接种到BHI 液体培养基中进行活化、扩大培养,37 ℃震荡培养至饱和,离心收集菌体,用1×磷酸盐缓冲液(PBS,pH 7.3±0.1)沉淀菌体,重复两次将培养液清洗干净,用PBS重悬菌体至终浓度为1×107cfu/mL 备用。取生长状态良好的TA-02 细胞,消化,计数,接种于6 孔细胞培养板中,细胞密度达80%时。每孔加入5 μL无乳链球菌菌悬液与TA-02细胞共孵育,分别在0、2、4、6 h收集细胞。吸去培养液,用PBS(pH 7.3 ± 0.1)洗涤2次,每孔加1 mL Trizol Reagent混匀,室温放置5 min,转移到无RNase 的EP 管中,-80 ℃冻存,待同一批各个时间点收集完毕后一并提取RNA。
1.2.2 TA-02 细胞RNA 提取与反转录 根据TransZol Up Plus RNA Kit 说明书提取罗非鱼脑星形胶质细胞RNA。取1 μL 的RNA 检测其浓度,琼脂凝胶电泳检测RNA 的质量。按照TransScript One-Step gDNA Removal and cDNA Synthesis Super Mix说明书将提取的罗非鱼脑星形胶质细胞总RNA 反转成cDNA。
通过NCBI 设计尼罗罗非鱼SOCS5定量引物,从miRNA Base 数据库(http://www.mirbase.org)获取尼罗罗非鱼miR-155 成熟体序列,茎环法合成miR-155 茎环引物和定量引物。miRNA 须加入特异茎环引物进行逆转录为模板,miRNA 逆转录方法参考廖宁馨[18]的方法进行。
1.2.3 无乳链球菌诱导TA-02 细胞中miR-155、炎症因子和SOCS5基因表达量检测 通过罗氏LightCycler96实时荧光定量PCR 仪检测感染无乳链球菌的TA-02中miR-155和SOCS5基因的相对表达量,观察其随时间变化而变化的规律。以TA-02 细胞cDNA为模板,qPCR 反应体系参考TransStart Green qPCR Super Mix 说明书进行,反应程序为:95 ℃预热60 s;95 ℃10 s、60 ℃20 s、72 ℃20 s,40 个循环。检测SOCS5基因和miR-155 的相对表达量,以β-actin 为内参基因,每组设3 个重复,用2-ΔΔCT法计算结果。
1.2.4 生物信息学分析 从miRNA Base 数据库(http://www.Mirbase.org)获得尼罗罗非鱼miR-155成熟体序列,对比在各个物种间的保守性,利用生物信息学方法(TargetScan、PicTar、miRanda)分析预测SOCS5与miR-155 的靶向关系及靶位点,NCBI数据库(https://www.ncbi.nlm.nih.gov/)获取尼罗罗非鱼SOCS5基因3'UTR序列。
1.2.5 引物设计与PCR 扩增 根据NCBI 中查找的尼罗罗非鱼SOCS5基因3'UTR 序列设计PCR 扩增引物,在序列两端添加KpnI、SmaI 酶切位点,克隆得到野生型序列(WT)。同时对SOCS5结合位点碱基进行突变,使用搭桥法(重叠PCR)设计SOCS5基因PCR 扩增引物,克隆得到突变型序列(mut)。并根据SOCS5基因3'UTR 序列设计定量引物(包含结合位点),送生工生物工程(上海)有限公司合成,扩增片段大小为533 bp。以TA-02细胞cDNA为模板,扩增SOCS53'UTR 序列,PCR 扩增体系:(总体积20 μL)Extaq 酶10 μL,上下游引物(33 μg/mL)添加各1 μL,模板1 μL,ddH2O 7 μL。扩增程序:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸20 s,共34个循环;72 ℃再延伸5 min。PCR 扩增产物进行质量分数1%琼脂糖电泳分析。
1.2.6 产物纯化与酶切 根据Universal DNA Purification Kit DNA 纯化回收试剂盒说明书进行产物纯化,用限制性内切酶KpnI、SmaI分别对纯化产物和pGL3-Basic 质粒进行双酶切,对酶切产物进行回收纯化。酶切体系(50 μL):载体和SOCS5纯化产物各1 000 ng/μL,KpnI、SmaI 各2 μL,10×Buffer 5 μL,ddH2O 补足50 μL。37 ℃酶切30 min。酶切后的载体和SOCS5基因片段纯化步骤同产物纯化。
1.2.7 连接转化和测序鉴定 根据T4 DNA Ligase说明书将酶切纯化后的目的片段与pGL3-Basic载体进行连接,产物转入DH5α 感受态细胞,加入LB(无抗生素)培养基,37 ℃、150 r/min 震荡培养1~2 h。离心后留100 μL 菌液混匀沉淀,涂于含100 μg/mL Amp 抗生素的LB 固体琼脂培养基上,37 ℃倒置培养12~16 h。挑取单菌落,进行菌落PCR。对阳性克隆进行测序,序列比对分析正确后,提取质粒保存,质粒提取根据Endo-free Plasmid Mini Kit I 质粒小提试剂盒说明进行。
2011年,在立足博爱竹林资源现状的基础上提出的博爱竹林发展目标、总体布局和保护利用等重点工程,通过了我国首个国家级专家评审的县级产业规划——《博爱县竹林资源保护利用总体规划》,对于保护利用竹林稀缺资源、弘扬竹产业文化具有重要意义[29]。
1.2.8 细胞转染与双荧光素酶活性检测 对数生长期的HEK-293T细胞在细胞密度达到80%左右时接种到24 孔细胞培养板中,每孔加入500 μL 在37 ℃(含体积分数5% CO2)的细胞培养箱培养(浓度为1×106mL-1)。细胞汇合度70%~90%时进行转染。转染方法和用量按照Lipofectamine™3000转染说明书进行。实验共分为6组:pGL3-Basic-NC+miR-155 mimics-NC 组、pGL3-Basic-NC+miR-155 mimics组、SOCS5-3'UTR-WT+miR-155 mimics-NC 组、SOCS5-3'UTR-WT+miR-155 mimics 组、SOCS5-3'UTR-mut+miR-155 mimics-NC 组、SOCS5-3'UTRmut+miR-155 mimics组,每组设3个复孔,每孔总体积50 μL。6 h 后,更换含血清的新鲜培养基继续培养,48 h 后收集细胞培养物。转染48 h 后吸出培养基,根据双荧光素酶报告基因检测试剂盒说明书检测各组荧光素酶活性。
1.2.9 miR-155 对SOCS5 表达量的影响 将miR-155 mimics、mimics NC、miR-155 inhibitor、inhibitor NC 分别转染HEK-293T 细胞,48 h 后收集细胞样本,进行RNA 提取和反转录,荧光定量PCR 检测miR-155 的表达量,评估mimics 及inhibitor 的效果。将miR-155 mimics、mimics NC、miR-155 inhibitor、inhibitor NC 分别和SOCS5共转染HEK-293T 细胞,48 h 后收集细胞样本,进行RNA 提取和反转录,利用荧光定量PCR 检测SOCS5基因的相对表达量。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,每组设置3 个重复,用2-ΔΔCT方法计算结果。
1.2.10 质粒和miR-155 inhibitor 共转染HEK-293T细胞 将miR-155 mimics 和miR-155 inhibitor 以及SOCS5野生型质粒共转染HEK-293T 细胞。miR-155 mimics/inhibitor转染浓度为20 μmol/μL,每孔以体积比1:1 的比例将miR-155 mimics/inhibitor 与SOCS5-WT-3'UTR 质粒共转染HEK-293T 细胞,共转染miR-155 mimics 和SOCS5-WT-3'UTR 质粒做对照。分别在转染后6 h 和12 h 收集细胞样本,实时荧光定量PCR检测miR-155和SOCS5表达量。
1.2.11 HEK-293T 细胞RNA 提取与反转录 吸去细胞培养液,PBS(pH 7.3±0.1)洗涤2 次,加入1 mLTrizol Reagent,充分混匀,室温放置5 min,转移到无RNase 的EP 管中,-80 ℃冻存,待同一批各个时间点样品收集完毕后一并提取RNA,反转录后cDNA放-20 ℃保存。
1.2.12 转染miR-155 inhibitor 后尼罗罗非鱼miR-155 和SOCS5 表达量检测 通过罗氏LightCycler96实时荧光定量PCR 仪检测共转染miR-155 inhibitor后HEK-293T 细胞中miR-155 和SOCS5基因的相对表达量。以上述反转录的HEK-293T 细胞cDNA 为模板,检测SOCS5和miR-155 的相对表达量,以GAPDH 为内参,每组设置3 个重复,用2-ΔΔCT方法计算结果。
1.3 数据处理与分析
每组实验进行3 次重复,数据采用SPSS 23.0 分析数据,结果用均值± 标准差表示。采用单因素方差分析进行多组间比较,采用t检验进行组间比较,以P<0.05 作为差异显著的标准,使用GraphPad Prism 8.0.1软件作图。
2 结果
2.1 无乳链球菌感染对TA-02 细胞中miR-155 和SOCS5基因表达的影响
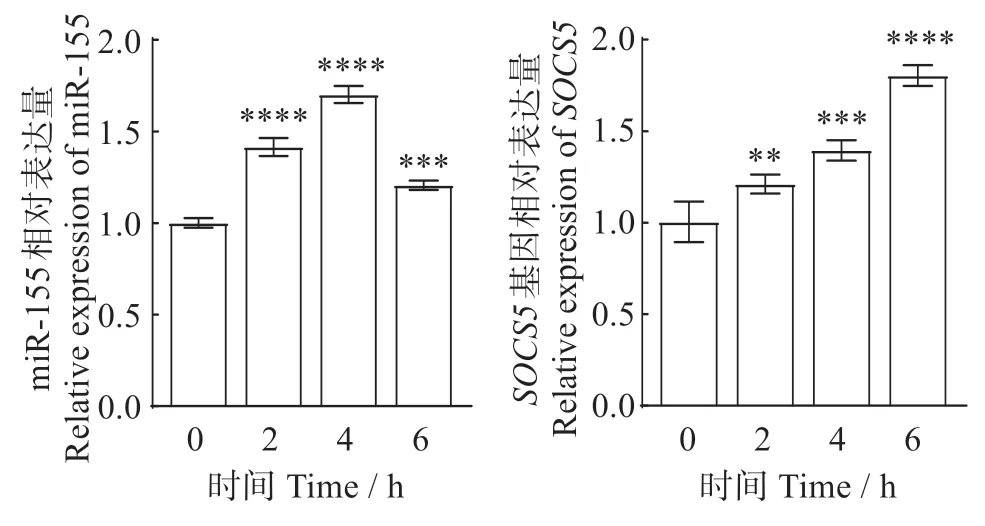
图1 无乳链球菌感染TA-02细胞中的miR-155和SOCS5表达Fig.1 Expression of miR-155 and SOCS5 in TA-02 cells infected with Streptococcus agalactiae
2.2 无乳链球菌感染对TA-02细胞中炎症因子表达的影响
无乳链球菌ZQ0910感染TA-02细胞0、2、4、6 h,实时荧光定量PCR 检测炎症因子表达量如图2 所示。随着感染时间增长,促炎症因子IL-1β和TNF-α表达量与对照组相比逐渐升高,IL-1β在2、4 和6 h分别升高0.74、0.62和0.39倍,TNF-α分别升高0.04、0.51 和0.42 倍。而抑炎症因子TGF-β和IL-10与对照组相比逐渐降低,TGF-β在2、4 和6 h 分别降低0.06、0.10 和0.40 倍,IL-10在2、4 和6 h 分别降低0.22、0.30和0.52倍。
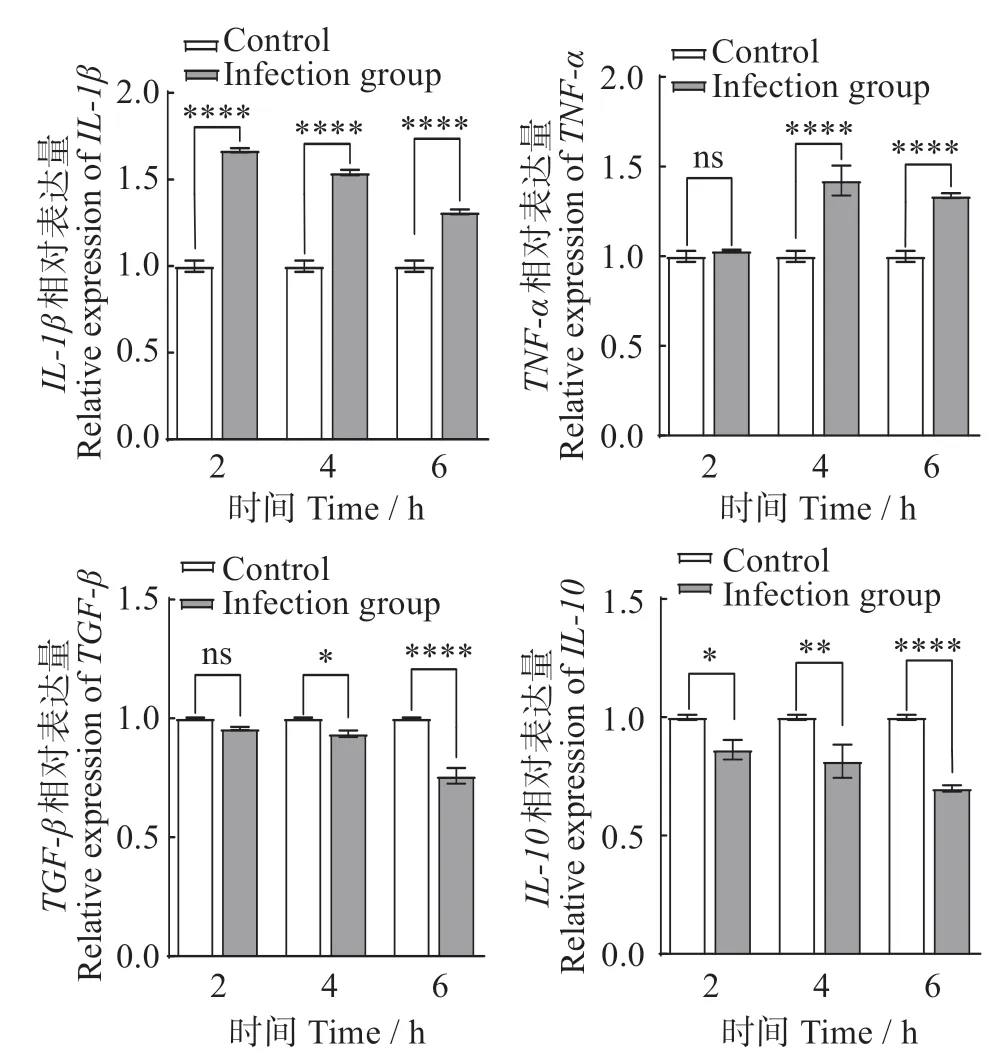
图2 无乳链球菌感染TA-02细胞中的炎症因子表达Fig.2 Expression of inflammatory cytokines in TA-02 cells infected with Streptococcus agalactiae
2.3 miR-155和SOCS5靶向结合位点预测
通过比对证明miR-155成熟体序列在包括人在内的多个物种间具有高度保守性,通过TargetScan等数据库查询到miR-155与SOCS5存在碱基互补序列,具有一个潜在结合位点(图3),这提示SOCS5可能是miR-155的靶基因。
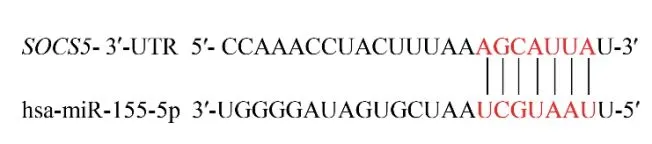
图3 miR-155-5p与SOCS5结合位点预测Fig.3 Prediction of binding sites between miR-155-5p and SOCS5
2.4 PCR扩增与酶切产物鉴定
PCR 扩增尼罗罗非鱼SOCS5野生型和突变型目的片段长度应为533 bp,琼脂糖凝胶电泳检测表明经酶切纯化后的SOCS5野生型和突变型片段大小与预期片段长度一致,为533 bp,将目的片段构建至pGL3-Basic载体中,挑取单菌落进行菌落PCR 鉴定,将符合目标片段大小的样品送生工进行测序分析,测序结果与预期片段一致(图4)。
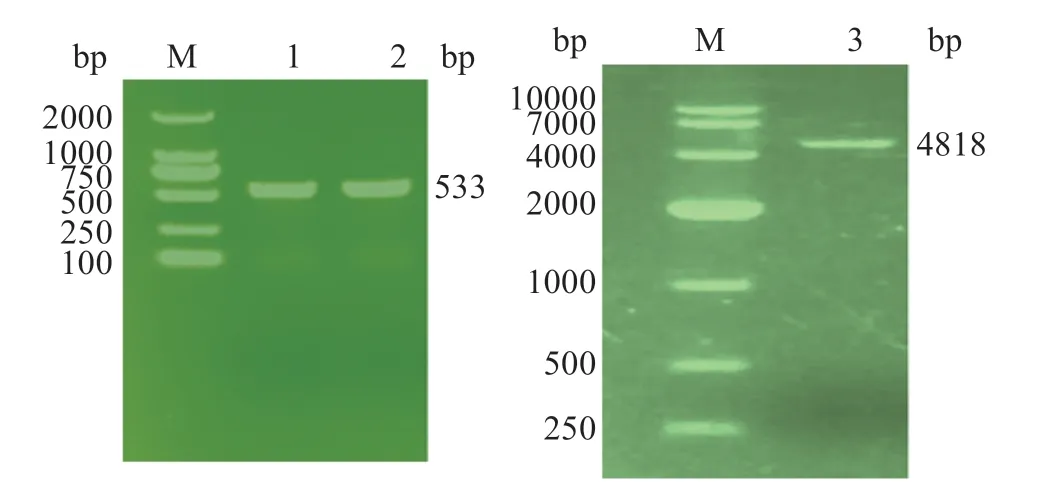
图4 SOCS5基因3'UTR区和pGL3-Basic载体酶切纯化产物电泳条带Fig.4 Electrophoretic map of the 3'UTR region of SOCS5 gene and the purified product digested by pGL3-Basic vector
2.5 测序分析
对含有尼罗罗非鱼SOCS5基因结合位点的野生型序列及缺失尼罗罗非鱼SOCS5基因结合位点的突变型序列进行克隆测序,尼罗罗非鱼SOCS5-WT 载体和SOCS5-mut 载体经测序验证均构建成功,成功将靶序列TGCATTA 突变为CTAGCGC,可用于后续靶点验证实验(图5)。
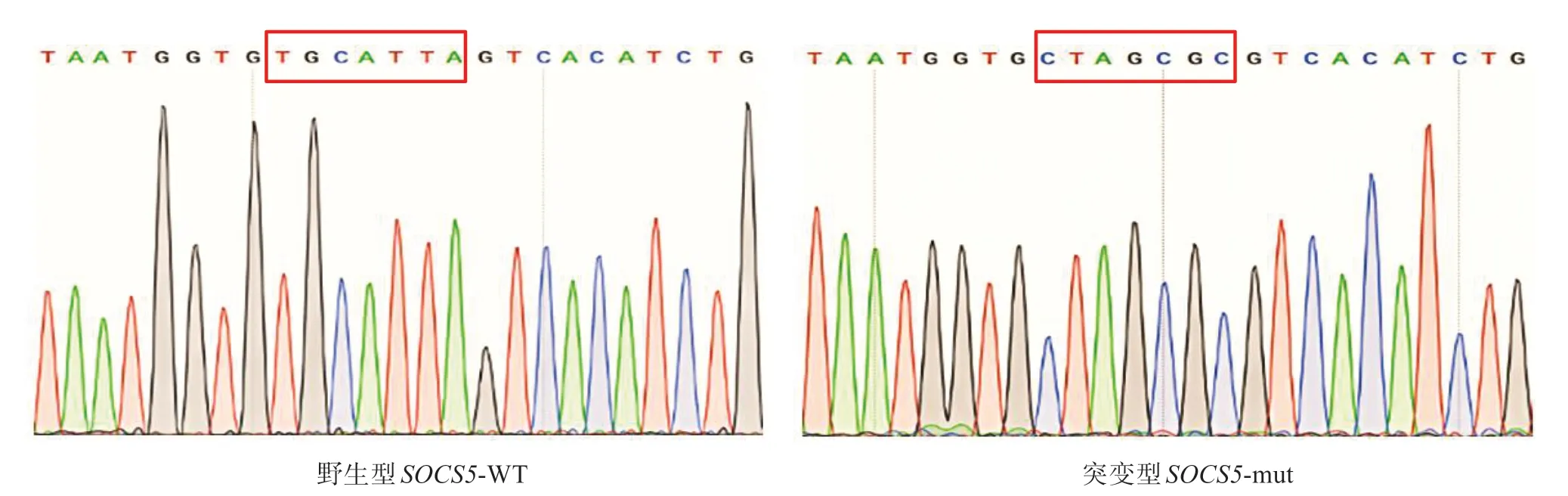
图5 SOCS5野生型与突变型重组质粒部分测序结果Fig.5 Partial sequencing of SOCS5 wild type and mutant recombinant plasmid
2.6 miR-155对SOCS5的调控作用
双荧光素酶实验结果表明(图6),共转染miR-155 模拟体和野生型报告质粒后,与转染的miRNA的阴性对照相比,miR-155 模拟物可极显著(P<0.000 1)抑制其活性,抑制效果达72.9%。miR-155模拟体在和突变型报告质粒共转染的情况下,miR-155模拟体抑制作用显著(P<0.000 1)减弱,与野生型组相比减弱53.7%。以上结果初步表明miR-155可以靶向调控尼罗罗非鱼SOCS5基因。

图6 各组转染后细胞的荧光素酶表达Fig.6 Luciferase expression of cells after transfection in each group
2.7 miR-155对SOCS5表达量的影响
如图7所示,与mimics NC 组相比,miR-155 mimics 极显著(P<0.000 1)的提高miR-155 表达量,升高5.24倍。与inhibitor相比,miR-155 inhibitor极显著(P<0.01)的抑制miR-155 的表达,降低2.05倍。
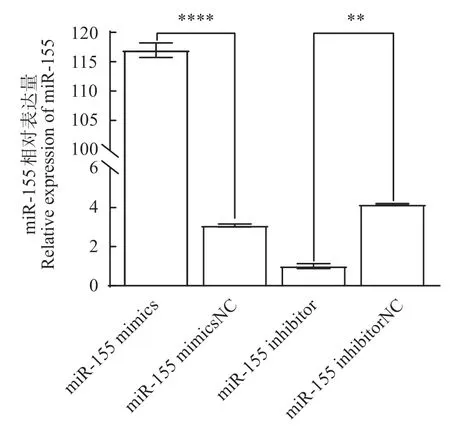
图7 miR-155相对表达量Fig.7 Relative expression of miR-155
miR-155 mimics、mimics NC、miR-155 inhibitor、inhibitor NC 分别和SOCS5-WT-3'UTR 共转染HEK-293T 细胞,实时荧光定量PCR 检测尼罗罗非鱼SOCS5基因表达量,实验结果如图8 所示。与mimics NC组相比,miR-155 mimics组SOCS5的表达量极显著(P<0.001)下调,降低0.93 倍,表明miR-155 能显著抑制尼罗罗非鱼SOCS5基因的表达。而加入miR-155 inhibitor 后,SOCS5的表达量显著(P<0.05)上调,升高0.62倍,证明miR-155 inhibitor能抑制miR-155的表达,从而降低对SOCS5的调控作用。
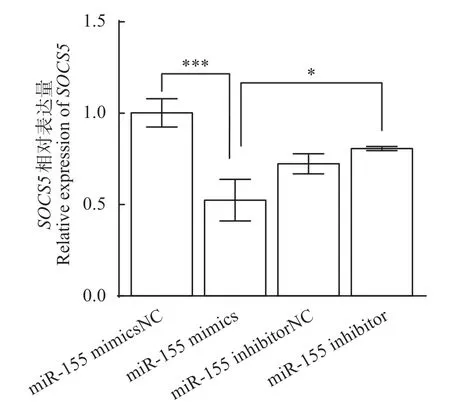
图8 SOCS5基因相对表达量Fig.8 Relative expression of SOCS5 gene
2.8 转染miR-155 inhibitor 后尼罗罗非鱼miR-155对SOCS5的调控作用
miR-155 mimics和miR-155 inhibitor以及SOCS5野生型质粒共转染HEK-293T 细胞,实时荧光定量PCR 结果表明,与对照组相比,实验组在6、12 h 时极显著降低了miR-155 的表达量(P<0.01),分别降低0.43 和0.64 倍,表明转染miR-155 inhibitor 后,能成功抑制miR-155 表达。而SOCS5表达量在6 h 时显著上调(P<0.05),12 h 时表达量极显著上调(P<0.000 1),分别升高0.42和2.47倍(图9)。

图9 转染miR-155 inhibitor后尼罗罗非鱼中miR-155和SOCS5基因相对表达量Fig.9 Relative expression of miR-155 and SOCS5 genes in Oreochromis niloticus after miR-155 inhibitor transfection
3 讨论
无乳链球菌感染罗非鱼可以诱导大量炎症反应的发生,导致急性死亡从而增加致病性[19,20],其中脑是无乳链球菌感染的一个重要靶器官,当无乳链球菌感染细胞后,细胞的模式识别受体与病原体相关分子模式结合,启动固有免疫应答[21,22]。因此本实验以TA-02 细胞为实验模型,探究无乳链球菌感染尼罗罗非鱼脑细胞诱发炎症反应的炎症水平变化及miR-155靶向SOCS5基因参与机体炎症反应的调控机制。目前无乳链球菌感染罗非鱼主要有两种途径:一种是通过在宿主血液中增殖后侵染其他组织引发病变;另一种是透过血-脑屏障,侵入罗非鱼脑组织诱发脑膜炎,进而引发一系列生理和病理变化[23,24]。本研究通过无乳链球菌感染尼罗罗非鱼脑星形胶质细胞实验发现,miR-155 在不同时间点的表达上调,证明在清除无乳链球菌病原菌的免疫反应中,miR-155 确实参与了尼罗罗非鱼脑星形胶质细胞的免疫反应。同时在无乳链球菌诱导的脑星形胶质细胞中,检测到炎症因子IL-1β、TNF-α的释放,并且这两种炎症因子的表达模式与miR-155一致,其表达量都是随着时间增加。这说明在应对无乳链球菌入侵时,miR-155 是起到保护机体、对抗其入侵的作用。同时检测到IL-10、TGF-β的表达量降低,这与陈秀慧等[25]关于子宫内膜炎研究中对IL-10的表达水平检测结论一致;另赵瑾[26]研究证明经治疗后的膝骨性关节炎患者体内TGF-β表达水平下调,说明IL-10、TGF-β的下调可以适量减轻炎症反应,使炎症水平维持在一个适度范围内。
研究发现,miRNA主要通过与靶基因mRNA的3'-UTR碱基互补配对,来阻碍靶基因mRNA 翻译成蛋白质或导致其降解,即参与基因转录后的表达,实现对靶基因的调控作用[27,28]。已有研究证明miR-155 与炎症反应密切相关,在机体先天性免疫和获得性免疫中均发挥重要调控作用[29,30],广泛参与炎症反应等多种生理活动,因此对靶基因预测和相互作用关系掌握是了解miR-155参与机体炎症反应的前提[31]。目前关于miR-155与SOCS5靶向关系的研究报道较少,石瑜等[32]通过实验证明miR-155-5p 靶向调控SOCS5促进大鼠(Rattus norvegicus)脑缺血-再灌注损伤。本研究通过生物信息学方法成功预测尼罗罗非鱼miR-155与SOCS5之间存在一个靶位点,并利用双荧光素酶报告基因实验验证发现miR-155 能极显著抑制SOCS5基因的表达,但突变结合位点后,miR-155 对SOCS5基因的抑制能力显著减弱。这证明SOCS5是miR-155 的靶基因。将miR-155 mimics、mimics NC、miR-155 inhibitor、inhibitor NC 分别转染HEK-293T 细胞过表达miR-155 后,检测到SOCS5表达量与对照组相比下降0.93 倍,而敲降miR-155后,SOCS5表达量上调0.62倍,证明miR-155 能靶向调控SOCS5的表达,结合双荧光素酶报告基因实验进一步说明miR-155可以通过与SOCS5基因3'UTR特异性结合,从而抑制SOCS5基因表达。
SOCS5属于免疫抑制分子家族(包括SOCS1-7和CIS),是由细胞因子诱导产生并反馈性调控细胞因子信号传递过程的负调节因子[33]。SOCS 家族基因的异常表达与机体炎性疾病及恶行肿瘤的发生发展密切相关[34,35],已有研究证明SOCS5在机体癌症等疾病中发挥重要作用[36,37],而癌症发展早期都伴有炎症反应的发生,二者有潜在联系,这提示未来SOCS5可能作为癌症诊断和治疗的切入点。陈景行等[15]发现SOCS5在小鼠气道炎症反应中发挥重要作用。本研究在无乳链球菌感染的TA-02细胞中检测到SOCS5表达量升高,提示SOCS5参与了TA-02 细胞炎症反应,有研究表明,SOCS5是一种对细胞因子调节通路有负性调节作用的因子,能有效抑制炎症因子表达[38]。这说明在信号通路中可能存在某种抑制SOCS5过度激活的机制,正是这种机制的协同作用,才避免在病原菌感染后产生的炎症反应初期,miR-155过度调控SOCS5表达,抑制抗炎因子的产生,从而导致免疫失衡。本研究与廖宁馨[18]关于新生隐球菌(Filobasidiella bacillispora)介导的巨噬细胞炎症反应中SOCS1的表达模式相同。
本研究通过转染miR-155 的inhibitor 抑制尼罗罗非鱼脑细胞中miR-155 的表达,观察miR-155 对靶基因SOCS5的调控作用,在转染miR-155 inhibitor后,成功抑制了miR-155 的表达,相对应时间点SOCS5表达量升高,说明在敲降miR-155 表达后能部分解除对靶基因SOCS5的抑制作用。miRNA 调控靶基因参与机体生命活动是一个较为复杂的过程,研究表明[39,40],SOCS5是JAK-STAT 通路中起关键作用的负调控因子,而JAK-STAT 通路参与了多种与中枢神经系统疾病相关的炎症反应,因此推测miR-155 可能通过调控SOCS5来调节下游JAKSTAT 信号通路。张琴和张贺[39,40]研究中关于SOCS5参与机体炎症反应的报道与本研究中SOCS5的研究结果一致,这说明在无乳链球菌介导的TA-02 细胞炎症反应的早期阶段,正是由于miR-155 对SOCS5的这种负向调控机制,才将炎症水平控制在在一个合理范围内,从而避免过度抑制炎症因子产生使免疫系统损伤,不能有效清除病原体。
综上所述,本研究证实miR-155 与靶基因SOCS5在无乳链球菌诱导的TA-02细胞炎症反应中发挥重要作用,且miR-155 负向调控SOCS5参与炎症发应的发生发展。目前关于miRNA 与靶基因互作参与机体炎症反应的研究多集中于哺乳动物中[41,42],在鱼类中的对其调控机制的研究处于初级阶段。但miR-155靶向调控SOCS5的蛋白表达机制及miR-155靶向SOCS5与相关信号通路的关系还有待进一步研究。
4 结论
本研究证实miR-155和SOCS5参与了无乳链球菌介导的TA-02细胞炎症反应。通过生物信息学方法获得尼罗罗非鱼miR-155和SOCS5基因的靶向结合位点,并成功构建尼罗罗非鱼SOCS5基因3'-UTR双荧光素酶报告基因野生型和突变型载体,证明SOCS5基因是miR-155 直接作用的靶基因,且miR-155 结合于SOCS5基因的3'-UTR 区域,在转录后水平对SOCS5有直接抑制作用。通过敲降尼罗罗非鱼miR-155 表达,证明miR-155 可以靶向负调控SOCS5表达,从而影响炎症变化的发生发展。
