肝硬化合并骨质疏松症的危险因素、发病机制及治疗进展
2023-04-29金秋杨婧马红琳刘清清李苹菊胡绍山
金秋 杨婧 马红琳 刘清清 李苹菊 胡绍山
摘要:骨质疏松症是肝硬化常见的肝外并发症,合并骨质疏松不仅增加患者经济负担而且给患者的生活质量和预后带来不良影响。近年研究发现肌肉减少症、脂联素、瘦素、鸢尾素和炎症因子等参与了肝硬化骨质疏松的发生,常用的抗骨质疏松药物有钙剂、维生素D和双膦酸盐等。本文总结了肝硬化合并骨质疏松的危险因素、发病机制和治疗的研究进展,指出部分因子对骨质疏松的影响尚存争议,仍需进一步探究相关发病机制以及探索更多安全有效的治疗方案。
关键词:肝硬化; 骨质疏松; 肌减少症; 脂联素; 鸢尾素
基金项目:昆明医科大学2022年研究生创新基金(2022S275); 昆明医科大学第二附属医院院内临床研究项目(ynllT2021012)
Advances in the risk factors, pathogenesis, and treatment of liver cirrhosis with osteoporosis
JIN Qiu, YANG Jing, MA Honglin, LIU Qingqing, LI Pingju, HU Shaoshan. (Department of Gastroenterology, The Second Affiliated Hospital of Kunming Medical University, Kunming 650000, China)
Corresponding author:
YANG Jing, yangjing_dl@163.com (ORCID:0000-0003-3305-8893)
Abstract:
Osteoporosis is a common extrahepatic complication of liver cirrhosis, and it not only increases the economic burden of patients, but also brings adverse effects on their quality of life and prognosis. Recent studies have shown that sarcopenia, adiponectin, leptin, irisin, and inflammatory factors are involved in the development of osteoporosis in patients with liver cirrhosis, and commonly used anti-osteoporosis drugs include calcium supplement, vitamin D, and bisphosphonates. This article reviews the advances in the risk factors, pathogenesis, and treatment of liver cirrhosis with osteoporosis and points out that there are still controversies over the influence of some factors on osteoporosis, and further studies are needed to explore related pathogeneses and safe and effective treatment regimens.
Key words:
Liver Cirrhosis; Osteoporosis; Sarcopenia; Adiponectin; Irisin
Research funding:
Postgraduate Innovation Fund of Kunming Medical University in 2022(2022S275); Hospital Clinical Research Project of The Second Affiliated Hospital of Kunming Medical University(ynllT2021012)
骨質疏松症(osteoporosis,OP)是指骨量和矿物质密度降低,骨组织宏观和微观结构发生变化,导致骨脆性和骨折易感性增加的全身性骨病。无论病因如何,肝硬化本身是OP的危险因素,肝硬化合并OP的发生率为12%~55%[1]。目前推荐双能X线骨密度检查作为OP的诊断方法,骨密度值常用T值表示,T值=(实测值-同性别、同种族健康青年峰值骨密度)/同性别、同种族健康青年峰值骨密度标准差,T值≤-2.5可诊断OP[2]。本文将围绕近年肝硬化合并OP的危险因素、发病机制和治疗等方面进行综述,旨在帮助临床医生及时识别肝硬化发生OP的高危人群,早期进行OP防治。
1 危险因素
1.1 低握力 握力测定是评估肌肉力量的简便方法,肝硬化患者肌肉力量下降和OP的发生密切相关。Santos等[3]对肝硬化患者进行握力测定,发现低握力和腰椎T值降低相关,低握力能够有效预测腰椎骨质疏松,截断值和受试者工作特征曲线下面积分别为23.5 kg和0.70。对肝硬化患者测定握力有助于筛查骨骼疾病,握力降低反映机体活动能力减少,与肝硬化长期的分解代谢消耗有关。
1.2 肝纤维化和肝功能 肝纤维化是由基质和纤维瘢痕组织包裹修复损伤的肝细胞所形成,肝纤维化分期与骨密度值呈负相关,骨形成和骨吸收标志物水平随肝纤维化程度增加而升高,表明肝纤维化患者骨密度降低可能和骨转换增加有关[4]。Zhang等[5]对189例乙型肝炎肝硬化患者的研究指出,骨质疏松组的肝脏硬度值明显高于骨量正常组,高肝脏硬度是OP的独立危险因素。同时,Child-Pugh评分升高和骨密度降低相关[6],恶化的肝功能是OP的危险因素之一。
1.3 脂肪组织 脂肪组织具有储能、产热和内分泌等功能,一项观察性研究[7]通过CT图像计算肝硬化患者腹部皮下脂肪组织指数(subcutaneous adipose tissue index,SATI)指出,低SATI和女性患者的病死率升高相关,反映了肝硬化能量消耗所致的不良预后。Huldén等[8]的研究进一步表明,低皮下脂肪量是肝硬化发生OP的危险因素。慢性炎症和骨量丢失有关,皮下脂肪细胞可分泌抗炎细胞因子抑制炎症反应,可能参与OP发生发展,但目前相关研究较少,尚需大量研究肯定其价值。
1.4 肌肉减少症 肌肉减少症又称肌少症,是一种随年龄增长而出现肌量减少和/或肌肉力量下降或肌肉生理功能衰退的疾病,肌少症使骨折、摔倒的风险增加。骨骼-肌肉之间相互作用受到重视,最近研究[9]发现,肌少症是OP的独立危险因素。Saeki等[10]将肝硬化患者分为OP组和非OP组,OP组合并肌少症比例明显升高(63.3% vs 18.3%, P<0.001),且骨骼肌质量指数是OP的有效预测因子。肌少症与OP密切相关,在合并肌少症的肝硬化人群中应注意筛查OP。
1.5 其他 肝硬化发生OP的其他危险因素包括:年长、绝经女性和不良生活方式(如体力活动减少、吸烟和过量饮酒),长期蛋白质营养摄入不足、低BMI、钙、维生素D和维生素K缺乏等营养相关因素[11],胆汁淤积致胆红素和石胆酸升高损害成骨细胞[12],长期使用糖皮质激素、抗病毒药物如富马酸替诺福韦二吡呋酯和免疫抑制剂等药物,合并内分泌和风湿免疫系统疾病等。
2 发病机制
2.1 骨微结构改变 肝硬化使得患者的骨微结构发生相应变化,骨小梁微结构的改变导致椎体强度降低。Jadzic等[13]使用micro-CT对腰椎结构分析发现,与健康对照组相比,酒精性肝硬化患者骨小梁数目、小梁厚度和骨体积分数降低,证明肝硬化骨小梁结构退化,但并未发现骨皮质微结构改变。相关研究[14]进一步表明,肝硬化患者的皮质骨厚度降低而皮质骨孔隙明显增加,证明骨小梁和皮质骨微结构均有明显受损。骨微观结构的改变直接影响骨骼的强度,并增加骨折风险。
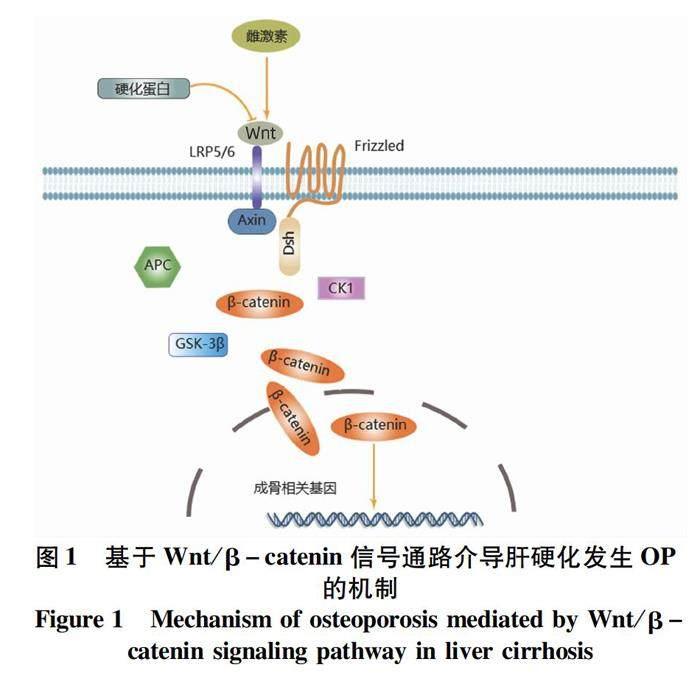
2.2 硬化蛋白 骨硬化蛋白是由sost基因编码,骨细胞产生的抑制骨形成的糖蛋白。Wnt/β-catenin通路能够促进成骨细胞增殖分化,Wnt与细胞膜上卷曲蛋白(Frizzled)、低密度脂蛋白受体相关蛋白5/6(LRP5/6)受体结合形成复合物从而激活散乱蛋白,促使糖原合酶激酶-3β、轴蛋白、酪蛋白激酶1和腺瘤性结肠息肉病基因复合物解体,促进细胞质中的β-catenin进入胞核,激活成骨相关基因表达(图1)。硬化蛋白是Wnt/β-catenin通路的调节因子,其阻碍Wnt和其受体结合而抑制骨形成[15]。Moradi等[16]通过结扎胆管诱导小鼠发生肝硬化,发现肝硬化小鼠股骨强度减低,肝硬化组小鼠的硬化蛋白水平明显高于正常对照组,证明高水平硬化蛋白和肝硬化的低骨量有关。有研究的結论与之相反,Wakolbinger等[17]使用ELISA法检测与LRP5/6相互作用位点的硬化蛋白,肝硬化组的硬化蛋白水平略低于健康对照组,在酒精性肝硬化中显著降低。上述结果产生矛盾的原因可能和酒精促进骨细胞凋亡以及更多的硬化蛋白片段未被ELISA法检测到有关,未来还需大样本前瞻性研究。
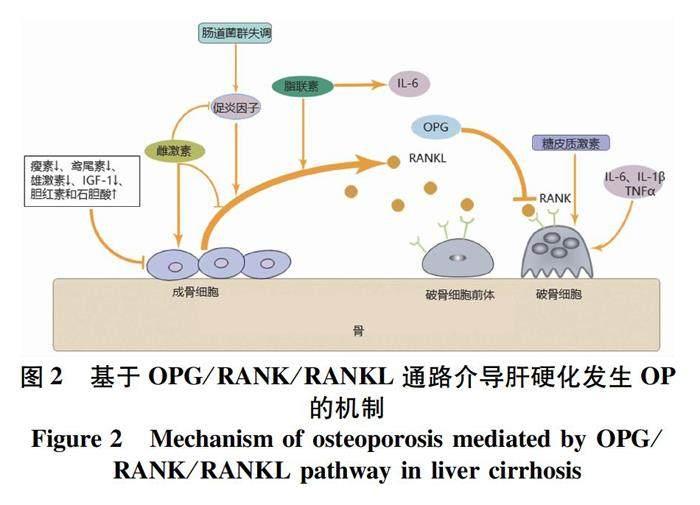
2.3 胰岛素样生长因子-1(insulin-like growth factor -1,IGF-1) IGF-1主要在肝脏合成,参与骨形成和骨吸收的过程。骨保护素(osteoprotegerin,OPG)/核因子-κB受体活化因子(receptor activator of nuclear factor κB,RANK)/RANK配体(RANK ligand,RANKL)系统是调节破骨细胞成熟和分化的经典途径。RANKL可由成骨细胞产生,与破骨细胞表面RANK结合激活破骨细胞来调控骨吸收,OPG竞争性与RANKL结合减少破骨细胞增殖分化(图2)。IGF-1可通过OPG/RANK/RANKL途径减少骨破坏,也可以通过Wnt/β-catenin通路增加成骨细胞生成[15]。关于原发性胆汁性胆管炎(primary biliary cholangitis,PBC)的研究[9]显示,OP组的IGF-1水平显著低于非OP组,Saeki等[10]针对肝硬化患者的研究亦得出相同结论。生长激素参与IGF-1合成,肝硬化由于肝脏合成能力下降以及肝细胞表面生长激素受体减少,导致IGF-1水平降低。
2.4 促炎因子 肝硬化患者体内多种促炎因子表达上调,如IL-6、IL-1β、IL-17、前列腺素和TNFα,这些促炎因子均可刺激RANKL的表达来促进破骨细胞分化,IL-6、IL-1β和TNFα还能直接作用于破骨细胞致骨吸收增加[18]。
2.5 脂肪因子
2.5.1 脂联素 脂联素是由脂肪细胞分泌的细胞因子,不仅能够调节胰岛素抵抗、糖类和脂肪代谢,还具有促进骨形成和骨吸收的双重作用,其通过脂联素受体1/c-Jun氨基端激酶和脂联素受体1/p38丝裂原活化蛋白激酶途径促进成骨细胞增殖分化,还通过增加RANKL/OPG比值促进骨吸收[19]。脂联素水平升高是普通人群发生OP的危险因素[20]。血清脂联素主要由肝脏清除,Moradi等[16]发现,与无肝硬化的小鼠相比,肝硬化小鼠血清脂联素水平升高和骨量丢失相关,进一步研究[21]表明,脂联素水平随着肝硬化患者Child-Pugh分级恶化而升高。以上研究证明了高脂联素水平和肝硬化发生OP相关,其可能通过OPG/RANK/RANKL途径和以浓度依赖性诱导软骨细胞增加IL-6的释放从而促使骨吸收有关[22]。
2.5.2 瘦素 瘦素是脂肪细胞分泌的另一种激素,能够与中枢系统特殊位点结合来调控体质量和能量代谢,还可激活肝星状细胞促进肝脏炎症和纤维化[23]。它对骨密度的影响可能通过与下丘脑相关受体结合,兴奋交感神经系统并激活成骨细胞表面β2肾上腺素能受体从而抑制成骨细胞增殖分化,还能增加RANKL和骨组织局部炎症因子的表达,促进破骨细胞生成。瘦素还通过促进骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)向成骨细胞分化以及上调OPG来增加骨量[24]。研究[25]表明慢性肝病(chronic liver disease,CLD)患者体内瘦素水平降低,其对骨密度主要以正向调节为主,特别是在PBC患者中。
2.5.3 鸢尾素 鸢尾素是纤维连接蛋白Ⅲ型结构域包含蛋白5的裂解片段,由脂肪和肌肉组织分泌,是具有抗肝脏炎症和氧化应激的细胞因子[26]。鸢尾素能够促进骨生成,通过上调BMSC自噬水平从而激活Wnt/β-catenin信号通路,促进BMSC向成骨细胞分化[27],也可上调编码骨桥蛋白基因、下调骨硬化蛋白基因表达最终促进骨形成[28]。对CLD患者的研究[29-30]表明,鸢尾素浓度取决于肝脏组织病理学损伤的严重程度,其浓度随着肝硬化严重程度增加而降低,鸢尾素水平降低还可能加快肝纤维化进展。综上,肝硬化患者低水平的鸢尾素可能参与了OP的发生机制,目前相关研究尚少,未来仍需进一步探索。
2.6 肠道菌群 人体肠道菌群在维持机体免疫稳态、营养平衡和避免病原菌侵入等方面发挥作用。健康人肠道菌群产生的代谢产物(如短链脂肪酸)抑制核因子κ轻链增强子的激活发挥抗炎效应,益生菌可产生抗氧化产物来减少氧化应激,肠道菌群还能够调节机体IGF-1水平和微小RNA的表达来维护骨骼发育[31]。肝硬化由于肠黏膜屏障损伤和胆汁排泄障碍等原因导致肠道通透性增加、肠道菌群多样性减少、固有菌减少、潜在致病菌增加以及细菌移位,使肝脏暴露于大量细菌及其代谢产物中,上调了机体炎症反应。肠道菌群的紊乱使骨密度降低[32],增加OP的发生风险。
2.7 其他 肝硬化肝功能减退使雌激素灭活减少,雌激素反馈抑制垂体促性腺激素释放导致睾酮水平降低。雌激素能够促进成骨细胞生成以及通过OPG/RANK/RANKL、Wnt/β-catenin通路和抑制促炎细胞因子等途径防止骨质流失,而雄激素可通过其受体直接促进成骨,也可增加雌激素水平间接促进成骨[15]。但相较于绝经女性、男性性腺功能减退和恶化肝功能等加速骨质流失的因素,雌激素对骨保护能力较弱。单核苷酸多态性(single-nucleotide polymorphisms,SNP)可能参与OP,Tang等[33]发现PBC患者CLDN14基因表达减少和骨密度降低有关,多种SNP和骨密度相关。另有研究[34]认为维生素D受体基因的BsmI GG基因型增加了肝移植患者OP风险,但目前对SNP的观点尚未统一。
3 治疗
3.1 维生素D和钙剂 对于OP高风险患者,建议每日在饮食中补钙和维生素D剂量分别为1 000~1 500 mg和800 IU[35]。Grover等[36]的研究发现,补充维生素D 1年可提高肝硬化患者的维生素D水平但并未改善骨密度,但目前仍建议维生素D和钙剂用于肝硬化合并OP的预防及治疗。
3.2 双膦酸盐 绝经后OP使用双膦酸盐治疗可减少骨吸收,当前治疗CLD合并OP的主要药物仍然是双膦酸盐,包括利塞膦酸钠、阿仑膦酸钠和唑来膦酸等[37]。既往认为该类药物具有刺激消化道,增加食管静脉曲张破裂出血风险,使其在肝硬化患者中使用受限。Lima等[38]对120例肝硬化患者进行为期1年的研究,发现每周口服35 mg利塞膦酸钠能够有效提高患者骨密度,且在定期内镜随访的情况下可安全用于伴有食管静脉曲张的患者,目前认为含氮双膦酸盐是CLD合并OP的一线治疗。
3.3 激素替代 雌激素通过抑制破骨细胞活性而具有良好的抗骨吸收作用,被长期应用于绝经后OP的治疗[39],雌孕激素在CLD的证据主要来源于PBC患者,激素替代疗法可能改善肝病患者骨密度。既往认为该疗法存在加重胆汁淤积的风险,Rudic等[40]表明激素替代治疗并未影响PBC患者血清胆红素水平和病死率。由于该疗法存在增加门静脉血栓、钠水潴留和乳腺癌等风险,并不常规推荐在肝硬化患者中使用。
3.4 RANKL抑制剂 地诺单抗是哺乳动物细胞中产生的人源化IgG2单克隆抗体,是首个获批的靶向RANKL抑制剂。与OPG作用相似,地诺单抗能够阻止RANKL与RANK结合从而抑制骨吸收。近期研究[41]对合并OP的CLD患者每6个月注射1次地诺单抗,在治疗1年时发现无论是否存在肝硬化,地诺单抗均能增加CLD患者的骨密度,其治疗CLD合并OP是安全有效的。Gkoufa等[42]报道了1例失代偿期肝硬化患者首次使用地诺单抗60 mg后出现严重的低钙血症,肝硬化患者使用地诺单抗治疗前需纠正低钙血症,使用期间应注意监测血钙水平。
3.5 其他 降钙素能够抑制破骨细胞生成并增加成骨,在钙磷调节中发挥重要作用。一项前瞻性研究[43]证明鲑鱼降钙素联合钙剂治疗后的骨密度显著高于单纯钙剂治疗,鲑鱼降钙素有效提高肝硬化OP患者的骨密度。治疗OP的药物还包括甲状旁腺素类似物、氟化钠和选择性雌激素受体调节剂,相关研究集中于PBC人群,现有研究数目以及所纳入的样本量较少,缺乏高质量证据支持其能够用于肝硬化患者的治疗。四烯甲萘醌和雷奈酸锶分别为维生素K类和锶盐,可提高OP患者的骨量,目前暂无针对肝硬化患者的相关研究。肝硬化經支持治疗无法改善的唯一有效方法是肝移植,由于糖皮质激素和免疫抑制剂的使用,骨密度丢失多发生于移植后的3~6个月,后期骨密度可逐渐恢复至移植前水平。
4 小结
OP是肝硬化不容忽视的并发症,其危险因素和机制尚未完全阐明,炎症、激素和肠道菌群等均参与了OP的发生发展,同时,肌少症、脂肪因子以及SNP等为探索肝硬化合并OP的机制提供了新思路。肝硬化继发OP和原发性OP在治疗上均以预防为主,但治疗方案仍有一定差别,前者在于治疗肝脏原发病来延缓肝功能恶化,减少OP危险因素以及适当补充钙、维生素D和双膦酸盐等防治OP,且地诺单抗被证实是有效的。目前部分药物研究较少,未来仍需大量研究给予循证医学证据支持。同时,PBC、肝硬化和肝移植后的患者应注意监测骨密度。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:金秋负责文献检索、文章构思并撰写论文;杨婧负责指导论文撰写与修改;马红琳、李苹菊、胡绍山、刘清清参与文献检索和文献分析。
參考文献:
[1]XIAO HJ, HAN T. Prevention and treatment of malnutrition, sarcopenia, and osteoporosis in patients with liver cirrhosis[J]. J Clin Hepatol, 2021, 37(1): 26-30. DOI: 10.3969/j.issn.1001-5256.2021.01.006.
肖慧娟, 韩涛. 肝硬化患者营养不良、肌肉减少症及骨质疏松的防治[J]. 临床肝胆病杂志, 2021, 37(1): 26-30. DOI: 10.3969/j.issn.1001-5256.2021.01.006.
[2]Chinese Society of Osteoporosis and Bone Mineral Research. Guidelines for the diagnosis and management of primary osteoporosis(2017) [J]. Chin J Osteoporos, 2019, 25(3): 281-309. DOI: 10.3969/j.issn.1006-7108.2019.03.001.
中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2017)[J]. 中国骨质疏松杂志, 2019, 25(3): 281-309. DOI: 10.3969/j.issn.1006-7108.2019.03.001.
[3]SANTOS LA, LIMA TB, AUGUSTI L, et al. Handgrip strength as a predictor of bone mineral density in outpatients with cirrhosis[J]. J Gastroenterol Hepatol, 2016, 31(1): 229-234. DOI: 10.1111/jgh.13062.
[4]ZHU X, YAN H, CHANG X, et al. Association between non-alcoholic fatty liver disease-associated hepatic fibrosis and bone mineral density in postmenopausal women with type 2 diabetes or impaired glucose regulation[J]. BMJ Open Diabetes Res Care, 2020, 8(1): e000999. DOI: 10.1136/bmjdrc-2019-000999.
[5]ZHANG W, GONG H, SU Z, et al. Risk factors associated with hepatic osteopathy in HBV related cirrhosis measured by liver stiffness: An Observational study [J]. Medicine (Baltimore), 2019, 98(31): e16628. DOI: 10.1097/MD.0000000000016628.
[6]ZHANG Y, GAO X, LIU T, et al. Association between osteoporosis and hepatitis B cirrhosis: a case-control study[J]. Afr Health Sci, 2020, 20(4): 1610-1616. DOI: 10.4314/ahs.v20i4.13.
[7]EBADI M, TANDON P, MOCTEZUMA-VELAZQUEZ C, et al. Low subcutaneous adiposity associates with higher mortality in female patients with cirrhosis[J]. J Hepatol, 2018, 69(3): 608-616. DOI: 10.1016/j.jhep.2018.04.015.
[8]HULDN E, CASTEDAL M, KARLSSON MK, et al. Osteoporosis in cirrhotics before and after liver transplantation: relation with malnutrition and inflammatory status[J]. Scand J Gastroenterol, 2020, 55(3): 354-361. DOI: 10.1080/00365521.2020.1735507.
[9]SAEKI C, OIKAWA T, KANAI T, et al. Relationship between osteoporosis, sarcopenia, vertebral fracture, and osteosarcopenia in patients with primary biliary cholangitis[J]. Eur J Gastroenterol Hepatol, 2021, 33(5): 731-737. DOI: 10.1097/MEG.0000000000001791.
[10]SAEKI C, TAKANO K, OIKAWA T, et al. Comparative assessment of sarcopenia using the JSH, AWGS, and EWGSOP2 criteria and the relationship between sarcopenia, osteoporosis, and osteosarcopenia in patients with liver cirrhosis[J]. BMC Musculoskelet Disord, 2019, 20(1): 615. DOI: 10.1186/s12891-019-2983-4.
[11]FUSARO M, CIANCIOLO G, BRANDI ML, et al. Vitamin K and osteoporosis[J]. Nutrients, 2020, 12(12): 3625. DOI: 10.3390/nu12123625.
[12]RUIZ-GASP S, GUAABENS N, JURADO S, et al. Bile acids and bilirubin effects on osteoblastic gene profile. Implications in the pathogenesis of osteoporosis in liver diseases[J]. Gene, 2020, 725: 144167. DOI: 10.1016/j.gene.2019.144167.
[13]JADZIC J, CVETKOVIC D, MILOVANOVIC P, et al. The micro-structural analysis of lumbar vertebrae in alcoholic liver cirrhosis[J]. Osteoporos Int, 2020, 31(11): 2209-2217. DOI: 10.1007/s00198-020-05509-7.
[14]WAKOLBINGER R, MUSCHITZ C, SCHERIAU G, et al. Bone microarchitecture and bone turnover in hepatic cirrhosis[J]. Osteoporos Int, 2019, 30(6): 1195-1204. DOI: 10.1007/s00198-019-04870-6.
[15]YANG YJ, KIM DJ. An overview of the molecular mechanisms contributing to musculoskeletal disorders in chronic liver disease: Osteoporosis, sarcopenia, and osteoporotic sarcopenia[J]. Int J Mol Sci, 2021, 22(5): 2604. DOI: 10.3390/ijms22052604.
[16]MORADI M, DOUSTIMOTLAGH AH, DEHPOUR AR, et al. The influence of TRAIL, adiponectin and sclerostin alterations on bone loss in BDL-induced cirrhotic rats and the effect of opioid system blockade[J]. Life Sci, 2019, 233: 116706. DOI: 10.1016/j.lfs.2019.116706.
[17]WAKOLBINGER R, MUSCHITZ C, WALLWITZ J, et al. Serum levels of sclerostin reflect altered bone microarchitecture in patients with hepatic cirrhosis [J]. Wien Klin Wochenschr, 2020, 132(1-2): 19-26. DOI: 10.1007/s00508-019-01595-8.
[18]JEONG HM, KIM DJ. Bone diseases in patients with chronic liver disease[J]. Int J Mol Sci, 2019, 20(17): 4270. DOI: 10.3390/ijms20174270.
[19]PAL CHINA S, SANYAL S, CHATTOPADHYAY N. Adiponectin signaling and its role in bone metabolism[J]. Cytokine, 2018, 112: 116-131. DOI: 10.1016/j.cyto.2018.06.012.
[20]ROOMI AB, NORI W, Al-BADRY SH. The value of serum adiponectin in osteoporotic women: does weight have an effect?[J]. J Obes, 2021, 2021: 5325813. DOI: 10.1155/2021/5325813.
[21]DA SILVA TE, COSTA-SILVA M, CORREA CG, et al. Clinical significance of serum adiponectin and resistin levels in liver cirrhosis[J]. Ann Hepatol, 2018, 17(2): 286-299. DOI: 10.5604/01.3001.0010.8659.
[22]ZHANG HQ, WANG LJ, LIU SH, et al. Adiponectin regulates bone mass in AIS osteopenia via RANKL/OPG and IL6 pathway[J]. J Transl Med, 2019, 17(1): 64. DOI: 10.1186/s12967-019-1805-7.
[23]PETRESCU AD, GRANT S, WILLIAMS E, et al. Leptin enhances hepatic fibrosis and inflammation in a mouse model of cholestasis[J]. Am J Pathol, 2022, 192(3): 484-502. DOI: 10.1016/j.ajpath.2021.11.008.
[24]MENG XH, TAN LJ, XIAO HM, et al. Examining the causal role of leptin in bone mineral density: A Mendelian randomization study [J]. Bone, 2019, 125: 25-29. DOI: 10.1016/j.bone.2019.05.006.
[25]SZALAY F, FOLHOFFER A, HORVTH A, et al. Serum leptin, soluble leptin receptor, free leptin index and bone mineral density in patients with primary biliary cirrhosis[J]. Eur J Gastroenterol Hepatol, 2005, 17(9): 923-928. DOI: 10.1097/00042737-200509000-00007.
[26]ZHAO J, QIAO L, DONG J, et al. Antioxidant effects of irisin in liver diseases: mechanistic insights[J]. Oxid Med Cell Longev, 2022, 2022: 3563518. DOI: 10.1155/2022/3563518.
[27]CHEN X, SUN K, ZHAO S, et al. Irisin promotes osteogenic differentiation of bone marrow mesenchymal stem cells by activating autophagy via the Wnt//β-catenin signal pathway[J]. Cytokine, 2020, 136: 155292. DOI: 10.1016/j.cyto.2020.155292.
[28]GOMARASCA M, BANFI G, LOMBARDI G. Myokines: The endocrine coupling of skeletal muscle and bone[J]. Adv Clin Chem, 2020, 94: 155-218. DOI: 10.1016/bs.acc.2019.07.010.
[29]PAZGAN-SIMON M, ZUWALA-JAGIELLO J, MENZYK T, et al. Serum betatrophin and irisin levels in hepatocellular carcinoma[J]. J Physiol Pharmacol, 2020, 71(1): 113-123. DOI: 10.26402/jpp.2020.1.11.
[30]WALUGA M, KUKLA M, KOTULSKI R, et al. Omentin, vaspin and irisin in chronic liver diseases[J]. J Physiol Pharmacol, 2019, 70(2): 277-285. DOI: 10.26402/jpp.2019.2.11.
[31]SEELY KD, KOTELKO CA, DOUGLAS H, et al. The human gut microbiota: A key mediator of osteoporosis and osteogenesis[J]. Int J Mol Sci, 2021, 22(17): 9452. DOI: 10.3390/ijms22179452.
[32]CASTANEDA M, SMITH KM, NIXON JC, et al. Alterations to the gut microbiome impair bone tissue strength in aged mice[J]. Bone Rep, 2021, 14: 101065. DOI: 10.1016/j.bonr.2021.101065.
[33]TANG R, WEI Y, LI Z, et al. A common variant in CLDN14 is associated with primary biliary cirrhosis and bone mineral density[J]. Sci Rep, 2016, 6: 19877. DOI: 10.1038/srep19877.
[34]YANAGAWA S, TAHARA H, TANAKA Y, et al. Analysis of risk factors affecting incidence of osteoporosis and fragility fractures in liver transplant recipients[J]. Ann Transplant, 2021, 26: e925475. DOI: 10.12659/AOT.925475.
[35]PUGLIESE N, ARCARI I, AGHEMO A, et al. Osteosarcopenia in autoimmune cholestatic liver diseases: Causes, management, and challenges[J]. World J Gastroenterol, 2022, 28(14): 1430-1443. DOI: 10.3748/wjg.v28.i14.1430.
[36]GROVER I, GUNJAN D, SINGH N, et al. Effect of vitamin D supplementation on vitamin D level and bone mineral density in patients with cirrhosis: A randomized clinical trial[J]. Am J Gastroenterol, 2021, 116(10): 2098-2104. DOI: 10.14309/ajg.0000000000001272.
[37]WU HL, ZHENG SH, JING SJ, et al. Research progress on influencing factors and prevention of adverse reac-tions of Zoledronic Acid in the treatment of osteoporosis[J]. China Med Herald, 2021, 18(23): 38-42.
吴鸿亮, 郑思杭, 景胜杰, 等. 唑来膦酸治疗骨质疏松不良反应影响因素及防治的研究进展[J]. 中国医药导报, 2021, 18(23): 38-42.
[38]
LIMA TB, SANTOS LAA, NUNES HRC, et al. Safety and efficacy of risedronate for patients with esophageal varices and liver cirrhosis: a non-randomized clinical trial[J]. Sci Rep, 2019, 9(1): 18958. DOI: 10.1038/s41598-019-55603-y.
[39]LI XN, WENG W, SHEN ZY, et al. Therapeutic effect of estradiol combined with 1,25- dihydroxyvitamin D3 on postmenopausal osteoporosis in rats[J]. J Jilin Univ(Med Edit), 2021, 47(4): 857-864. DOI: 10.13481/j.1671-587X.20210406.
李希寧, 翁伟, 沈哲源, 等. 雌二醇联合1,25-二羟维生素D3对绝经后骨质疏松症大鼠的治疗作用[J]. 吉林大学学报(医学版), 2021, 47(4): 857-864. DOI: 10.13481/j.1671-587X.20210406.
[40]RUDIC JS, POROPAT G, KRSTIC MN, et al. Hormone replacement for osteoporosis in women with primary biliary cirrhosis[J]. Cochrane Database Syst Rev, 2011(12): CD009146. DOI: 10.1002/14651858.CD009146.pub2.
[41]SAEKI C, SAITO M, OIKAWA T, et al. Effects of denosumab treatment in chronic liver disease patients with osteoporosis[J]. World J Gastroenterol, 2020, 26(33): 4960-4971. DOI: 10.3748/wjg.v26.i33.4960.
[42]GKOUFA A, ANGELOUSI A, NEONAKI A, et al. Severe symptomatic hypocalcemia associated with denosumab administration in a patient with decompensated cirrhosis and renal dysfunction[J]. Ann Pharmacother, 2022, 56(7): 853-855. DOI: 10.1177/10600280211050216.
[43]ZHOU BS, CUI XC, LI CB. A clinical study of the effect of salmon calcitonin in patients with viral cirrhosis complicated with osteoporosis[J]. Chin J Osteoporos, 2018, 24(2): 226-229. DOI: 10.3969/j.issn.1006-7108.2018.02.018.
周百岁, 崔晓纯, 李传波. 鲑鱼降钙素对病毒性肝硬化合并骨质疏松症患者影响的临床研究[J]. 中国骨质疏松杂志, 2018, 24(2): 226-229. DOI: 10.3969/j.issn.1006-7108.2018.02.018.
收稿日期:
2022-07-31;录用日期:2022-09-20
本文编辑:林姣
