燕麦根际土壤细菌多样性对盐胁迫的响应
2023-04-18李峰殷丛培殷冉王凡韩永亮杨志敏刘建成
李峰 殷丛培 殷冉 王凡 韩永亮 杨志敏 刘建成

摘要:为探究燕麦(Avena sativa L.)在不同盐胁迫处理下根际土壤微生物的群落多样性及变化特征,选取领袖(Souris,S)和爱沃(Everleaf,E)2个燕麦品种为试验材料,分别设置0(Y0)、3(Y1)、6(Y2)和9(Y3) g?kg-1NaCl胁迫处理。采用高通量测序技术对不同盐胁迫处理下燕麦根际土壤微生物进行测序,分析微生物群落多样性及其与土壤盐胁迫的相关性。结果表明,2个燕麦品种根际土壤细菌群落的多样性在4种盐胁迫处理下存在差异,其中S-Y2的群落丰度最高,S-Y3的多样性最丰富。在不同分类水平上,细菌变形菌门(Proteobacteria)、放线菌纲(Actinobacteria)、根瘤菌目(Rhizobiales)、norank_c_Subgroup_6科和norank_c_Subgroup_6 属的相对丰度较高。盐胁迫影响燕麦根际微生物的群落组成,随着盐胁迫程度的增加,其菌落组成的相对丰度发生显著变化。通过对操作分类单元(OTU)丰度的16S功能预测和COG、KEGG代谢通路数据库对比发现,燕麦根际微生物的功能富集于新陈代谢、遗传信息处理、环境信息处理、细胞过程和生物体系统等。由此表明,根际微生物在燕麦生长和响应盐胁迫中起重要作用,为进一步挖掘和利用根际功能微生物奠定了理论基础。
关键词:燕麦;根际;16S;微生物群落结构;盐胁迫doi:10.13304/j.nykjdb.2021.0906
中图分类号:S512.6 文献标志码:A 文章编号:10080864(2023)01015313
盐碱地是干旱和半干旱地区生态系统的重要组成部分,我国盐渍化土地总面积占全国可利用土地面积的4.88%,约3 600 万hm2[1]。工业进程的发展、农业化肥和农药的不当施用等人类活动[2],致使我国每年约有1%~2% 的农业生产耕地盐渍化[3]。过高的土壤盐分不但会导致植物的离子渗透胁迫[4],还会引起氧化应激反应、营养失调和器官衰老,甚至死亡。大多数植物对盐胁迫较为敏感,长久以来,通过对植物耐盐相关生理和分子机制的研究来提高农作物耐盐性、培育耐盐作物品种是保障盐渍区作物产量的基本手段[5]。
在盐胁迫下,植物可能会启动多种防御策略来降低盐胁迫对自身造成的伤害,如形成能分泌盐分的腺体[6],重建细胞离子、渗透和活性氧平衡[7]以及调节发育进程[8]等。植物的耐盐性除由遗传因素决定外[9],微生物在植物抵御逆境胁迫中也起到重要作用[1011]。植物根际微生物可以通过调节植物根系的离子稳态、产生植物激素、促进根系渗透物质积累、提高植物抗氧化活性和提高营养物质吸收等过程来改善植物的耐盐性[12]。植物根际微生物群落结构多样性具有特异性,同样土壤环境中的不同植物和不同土壤环境中的同种植物其根际微生物菌落结构均存在差异[13]。因此,研究盐胁迫下植物根际微生物菌落结构的变化,对了解根际微生物参与植物应对非生物胁迫的作用机理至关重要。
土壤细菌可以降低植物体内Na+含量[14],植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)可以提高植物对K+的吸收以及对Na+的排斥,从而提高植物体内的K+/Na+ 值[15]。小麦(Triticum aestivum L.)种子接种Nesterenkoniarhizosphaerae wp-8,可通过调控幼苗的抗氧化系统缓解盐胁迫对植株造成的损伤,促进幼苗生长和根系发育[16]。混合接种根瘤菌(Rhizobia leguminumRhOF125)、胶质类芽孢杆菌(Paenibacillusmucilaginosus BLA7)和草木犀剑菌(Ensifer melilotiRhOL1)能够显著提高蚕豆(Vicia faba L.)的耐盐性,表明根际微生物对植物响应盐胁迫有直接或间接的作用[17]。根际微生物在增强植物对盐胁迫的适应性方面有重要作用,植物招募土壤有益菌以提高其抵御盐胁迫的能力[18]。
燕麦是禾本科、燕麦属,一年生特色粮饲兼用作物[19],具有一定的耐盐碱能力,其耐盐性的研究主要集中在种子萌发、幼苗生长和生理响应等方面,关于燕麦盐胁迫下根际微生物变化的研究甚少。因此,本研究基于16S rRNA高通量测序分析不同盐胁迫下燕麦根际土壤细菌群落结构的差异,旨在评价盐胁迫对燕麦根际细菌群落组成的影响,为利用根际微生物提高作物的耐盐性奠定理论基础。
1 材料和方法
1.1 供试材料
以领袖(Souris,S)和爱沃(Everleaf,E)2 个饲用燕麦品种为供试材料,均由张家口市农科学院畜牧研究所提供。供试土壤采自河北省张家口市农业科学院畜牧研究所(40°68′N,114°93′E),土壤全碳20.31 g·kg-1、全氮0.98 g·kg-1、全钾2.45 g·kg-1、速效氮163.5 mg·kg-1、速效磷1.53 mg·kg-1、速效钾125.8 mg·kg-1,pH 7.4。
1.2 试验设计和样品采集
将取自田间耕层11—30 cm 的土壤风干,过1 mm 筛后装盆(直径11.5 cm,高9.7 cm),每盆装土量为800 g,设置0 (Y0)、3(Y1)、6(Y2)和9 g?kg-1 NaCl(Y3)共4种盐胁迫处理。挑选发育良好、籽粒饱满、大小一致的种子,用75%的酒精消毒15 min,1%(质量分数)HgCl2消毒30 min,用蒸馏水反复冲洗干净后浸泡10 h,于人工气候箱内恒温培养2 d,将发芽整齐、一致的幼苗移植到不同鹽处理的塑料盆中,每盆种植3株,置于25~28 ℃植物培养室中进行培养(光强600 μmol·m-2·s-1,光照12 h/黑暗12 h,相对湿度70%),采用随机区组设计,每个处理设10盆重复。试验使用土壤水分-温度-盐分记录仪(浙江托普云农科技股份有限公司,TZS-ECW-GT)对土壤含盐量和含水量进行监测,每2 d补充1次。
各处理均在处理21 d后,采用“抖根法”收集根际土壤样品[20],样品采集后及时装入无菌塑封袋中,?80 ℃保存。将燕麦品种领袖在不同盐胁迫下的土壤样本分别命名为S-Y0、S-Y1、S-Y2和S-Y3;燕麦品种爱沃在不同盐胁迫下的土壤样本分别命名为E-Y0、E-Y1、E-Y2和E-Y3。
1.3 土壤DNA 的提取及高通量测序
采用试剂盒E.Z.N.A.? Soil DNA Kit (OmegaBio-tek, Norcross, GA, USA)提取燕麦根际土壤细菌总DNA。纯化后采用1.5%琼脂糖凝胶电泳和Nanodrop 2000 分光光度计(Thermo Scientific,Wilmington, USA)检测DNA 的纯度和含量。以提取的DNA 为模板,利用引物338F(5-ACTCCTACGGGAGGCAGCAG-3)和806R (5-GGACTACHVGGGTWTCTAAT-3)[21]对土壤细菌16S rRNA V3~V4区进行扩增。最后,在IlluminaMiSeq平台(Illumina, San Diego, USA)进行双末端测序。
1.4 数据分析
使用QIIME v1.8.0处理原始序列数据[22],进行操作分类单元(operational taxonomic units, OTU)的聚类分析[23],对OTUs代表序列进行物种注释,并构建稀释性曲线,计算 Alpha多样性指数,包括Chao1指数、ACE指数、Shannon指数和Simpson指数[24]。通过非度量多维尺度(non-metric multidimensionalscaling, NMDS)和主坐标分析(principal co-ordinatesanalysis PCoA)进行β 多样性分析。基于PICRUSt(phylogenetic investigation of communities byreconstruction of unobserved states)方法对样本中微生物群落的功能组成进行预测[24] 。
2 结果与分析
2.1 根际微生物测序数据分析
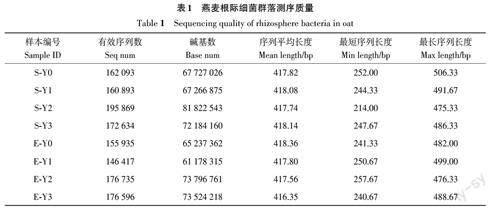
由表1可知,8个供试土壤样本共获得有效序列1 347 172条,其中样本S-Y2的有效序列数最多,为195 869 条;样本E-Y1 的有效序列数最少,为146 417条。不同处理样本平均长度为416~419 bp,平均417.73 bp。
2.2 盐胁迫对燕麦根际细菌Alpha多样性的影响
稀释性曲线可以用来比较不同样本中微生物种类的丰富度,在抽取相同序列的条件下,S-Y1、S-Y2和E-Y0样本的OTU数较多,说明S-Y1、S-Y2和E-Y0样本中的丰富度较高(图1A)。Sobs指数反映了样本中细菌群落物种丰富度的实际观测值,结果(图1B)表明,不同胁迫处理表现为Y2>Y0>Y1>Y3,且不同处理间差异显著(P<0.05),表明盐胁迫对燕麦根际细菌群落的多样性有显著影响。维恩图分析(图1C)显示,不同根际土壤样本中共有的OTU为1 668个,其中样本S-Y0和E-Y0特有OTU分别为264和220个;盐处理后各样本的OTU数量明显下降,表明盐胁迫对根际土壤细菌群落结构有显著影响。
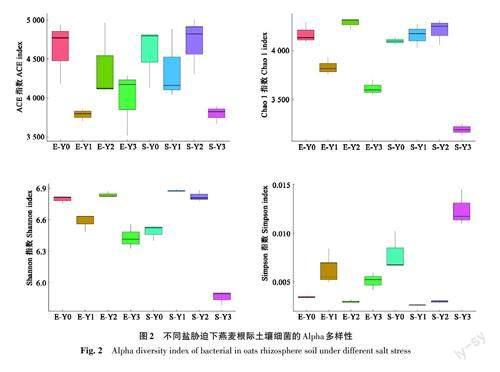
如图2所示,盐胁迫改变了燕麦根际细菌群落Alpha多样性,不同指数在不同的品种间表现不一致。其中,ACE指数和Shannon指数的变化趋势在品种E中基本相同,而在品种S中则不同;Chao 1指数和Simpson 指数的变化呈相反趋势。由此表明,盐胁迫对燕麦根际细菌群落的丰度和多样性影响显著。
2.3 盐胁迫对燕麦根际细菌Beta 多样性的影响
NMDS分析(图3A)显示,Y0和Y1根际土壤的细菌群落结构较为相似,Y2和Y3与其差异较大。PCoA 分析(图3B)显示,PC1(47.22%)和PC2(21.2%)分别由品种因子和盐胁迫因子贡献;不同处理的土壤样本分布于不同象限,表明其细菌群落组成具有明显差异。S-Y0和S-Y2与PC1和PC2均呈正相关;S-Y1、E-Y0和E-Y2与PC1呈正相关,与PC2呈负相关;E-Y3与PC1和PC均呈负相关;S-Y3与PC1呈负相关,与PC2呈正相关(图3B)。说明盐胁迫和品种均影响根际土壤微细菌的群落结构。
将供试样本按品种和盐胁迫程度进行分组,通过相似性分析(analysis of similarities ANOSIM),结果(图3C 和D)表明,组间差异均达到显著水平(P=0.001),其中品种分组的R值为0.210 4,盐胁迫程度分组的R值则为0.535 3,表明盐胁迫对燕麦根际土壤样本细菌群落多样性的影响更大。
2.4 盐胁迫对燕麦根际细菌群落结构的影响
对测序结果进行注释,共获得7 095个OTU,归属33个门、97个纲、273个目、470个科、919个属。
在门水平(图4A), 变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)的相对丰度较高,分别为24.71%~50.8%、9.59%~20.29%、5.67%~17.30%、5%~11.66%和6.11%~14.99%,累计相对丰度平均为83.18%;其次为芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、髌骨细菌门(Patescibacteria)、蓝藻细菌门(Cyanobacteria)和疣微菌门(Verrucomicrobia),相对丰度分别为2.55%~4.58%、0.93%~4.79%、1.49%~3.73%、0.85%~6.09%和0.66%~7.77%。盐胁迫显著提高了Proteobacteria、Bacteroidetes和Patescibacteria的相对丰度,而Actinobacteria、Acidobacteria、Chloroflexi、Gemmatimonadetes 和Verrucomicrobia的相对丰度显著降低。其中,Proteobacteria在樣本S-Y3中的相对丰度较S-Y0显著增加102.67%;Firmicutes 在S-1 和S-Y3 样本中的相对丰度较S-Y0 分别显著增加321.51% 和288.17%;Patescibacteria在S-Y2样本中的相对丰度较S-Y0显著增加145.39%;Gemmatimonadetes 在E-Y3 样本中的相对丰度较E-Y0显著降低65.55%。
在纲水平上(图4B), 放线菌纲(Actinobacteria)、α- 变形菌纲(Alphaproteobacteria)、γ - 变形菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)、Subgroup_6、芽单胞菌纲(Gemmatimonadetes)、δ-变形菌纲(Deltaproteobacteria)、Blastocatellia_Subgroup_4、绿弯菌纲(Chloroflexia)和厌氧绳菌纲(Anaerolineae)为优势菌纲,相对丰度分别为9.59%~20.29%、11.82%~22.74%、9.11%~25.29%、5.84%~14.71%、3.13%~10.37%、2.55%~4.58%、2.48%~5.05%、1.57%~4.25%、1.55%~3.76% 和1.67%~4.32%,累计相对丰度的平均值为80.74%。其次是芽孢杆菌纲(Bacilli)、产氧光细菌纲(Oxyphotobacteria)、疣微菌纲(Verrucomicrobiae)、Saccharimonadia 和KD4-96,相对丰度分别为0.82%~4.63%、0.77%~5.97%、0.69%~7.77%、0.88%~2.16%和0.49%~1.63%。盐胁迫显著提高了Alphaproteobacteria、Gammaproteobacteria 和Bacteroidia的相对丰度,而Actinobacteria、Subgroup_6、Deltaproteobacteria 和Verrucomicrobiae 的相对丰度显著降低。Actinobacteria、Gemmatimonadetes、Deltaproteobacteria、Chloroflexia、Bacilli 和KD4-96均在Y1处理下相对丰度最高。
在目水平上(图4C), 根瘤菌目(Rhizobiales)、norank_c__Subgroup_6、Betaproteobacteriales、鞘脂单胞菌目(Sphingomonadales)、噬纤维菌目(Cytophagales)、假单胞菌目(Pseudomonadales)、微球菌目(Micrococcales)、Chitinophagales、芽孢杆菌目(Bacillales)和芽单胞菌目(Gemmatimonadales)为优势菌目,相对丰度分别为5.29%~14.3%、3.1%~10.21%、3.19%~5.31%、3.24%~5.19%、2.86%~7.34%、0.36%~8.73%、1.53%~5.41%、2.08%~3.32%、0.82%~4.63% 和1.6%~2.87%,其相对丰度之和平均为42.14%;其次是热微菌目(Thermomicrobiales)、黏球菌目(Myxococcales)、Pyrinomonadales、Propionibacteriales 和SBR1031,相对丰度分别为1.34%~3.11%、1.2%~2.52%、1.03%~2.67%、1.07%~2.99% 和1.30%~3.35%。
盐胁迫显著降低了norank_c_Subgroup_6 和Betaproteobacteriales 的相对丰度,而Rhizobiales、Pseudomonadales 和Cytophagales 的相对丰度显著升高。Gemmatimonadales、Thermomicrobiales和Myxococcales在Y1處理下的相对丰度均显著高于其他处理。
在科水平上(图4D),norank_c_Subgroup_6、鞘脂单胞菌科(Sphingomonadaceae)、假单胞菌科(Pseudomonadaceae)、根瘤菌科(Rhizobiaceae)、芽单胞菌科(Gemmatimonadaceae)、芽孢杆菌科(Bacillaceae)、伯克氏菌科(Burkholderiaceae)、甲壳菌科(Chitinophagaceae)、Microscillaceae和梭菌科(Pyrinomonadaceae)为优势菌科,相对丰度分别为3.1%~10.21%、3.24%~3%、0.36%~8.72%、2.02%~6.73%、1.6%~2.87%、0.59%~4.22%、1.57%~3.16%、1.65%~2.79%、1.5%~2.64% 和1.03%~2.67%,其样本平均相对丰度均在2.03%以上,相对丰度之和平均为31.36%;其次是Devosiaceae、JG30-KF-CM45、类诺卡氏菌科(Nocardioidaceae)、微球菌科(Micrococcaceae)和链霉菌科(Streptomycetaceae),相对丰度分别为0.60%~6.59%、1.00%~2.46%、0.96%~2.72%、0.57%~4.28% 和0.81%~3.88%。盐胁迫显著降低了norank_c_Subgroup_6、Bacillaceae、Gemmatimonadaceae 和Burkholderiaceae 的相对丰度,而Pseudomonadaceae、Rhizobiaceae和Devosiaceae的相对丰度显著升高,其中JG30-KF-CM45在Y1和Y2处理下的相对丰度显著高于Y0和Y7处理。
在属水平(图5),其相对丰度均值排名前15的菌属中,品种S中分别有8(Y0)、7(Y1)、8(Y2)和8(Y3)个属的相对丰度高于品种E。在Y0、Y1、Y2处理下,norank_c__Subgroup_6、RB41 和节杆菌属(Arthrobacter)均表现为在品种S中的相对丰度更高;在Y3处理下,norank_c_Subgroup_6 和RB41则表现为在品种E中的相对丰度更高。假单胞菌属(Pseudomonas)在Y3处理下表现为在品种S中的相对丰度更高,而在Y0、Y1、Y2处理下均为在品种E 中的相对丰度更高;鞘脂单胞菌属(Sphingomonas)和norank_f_Gemmatimonadaceae在不同处理下均表现为在品种E 中的相对丰度更高。
2.5 盐胁迫下燕麦根际土壤细菌系统发生进化分析及功能预测
系统发生的推断能够揭示有关生物进化过程的顺序,有助于了解生物进化历史和机制。燕麦根际土壤细菌中最丰富的20个属主要归属于变形菌门(Proteobacteria) 、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)等(图6A),主要菌属为norank_Subgroup_6 和假单胞菌属 (Pseudomonas),其次是norank_Gemmatimonadaceae、RB41、芽孢杆菌属(Bacillus)和鞘脂单胞菌属(Sphingomonas)。
为了更好地了解燕麦根际细菌群落的作用,基于PICRUSt分析平台进行功能预测,将获得的OTU丰度表与相关数据库进行比对,获得相应的COG 及KO(kyoto encyclopedia of genes and genomes ontology)功能信息及其丰度。
COG结果(图6B)表明,一些代谢和基本生命活动相关功能的细菌菌群在所有盐胁迫处理的土壤样本中均有所富集,表明盐胁迫影响了燕麦根际细菌微生物的代谢和生命活动。基因注释结果中除功能未知外,氨基酸运输代谢最多;其次为一般代谢、能量产生与转化、细胞壁和细胞膜生物合成、信号转导、转录、碳水化合物转录与运输、无机离子的转运和代谢;而染色质结构与动力学、RNA加工与修饰、细胞骨架和胞外结构较少。
运用PICRUSt软件分析盐胁迫下燕麦根际细菌代谢通路在3 个水平的信息及其丰度,结果(图7A和7B)表明,一级代谢通路有6条,依次为新陈代谢(51.37%)、遗传信息处理(15.66%)、环境信息处理(14.14%)、细胞过程(3.93%)、人类疾病(0.95%)、生物体系统(0.8%)和功能未分类基因(13.16%);二级代谢通路有41条,主要包括膜转运(11.82%)、氨基酸代谢(10.97%)、糖代谢(10.29%)、复制和修复(6.8%)和能量代谢(5.82%);三级代谢通路有406条,主要包括次级代谢产物的生物和合成(ko 01 110)、不同环境中的微生物代谢(ko 01 120)、氨基酸生物合成(ko 01 230)、碳代谢(ko 01 200)、ABC 转运蛋白(ko 02 010)、核糖体(ko 03 010)、双组分系统(ko 02020)、嘌呤代谢(ko 00 230)、细菌的聚量效应(ko 02 024)和氧化磷酸化(ko 00 190)。
3 讨论
随着高通量测序技术的突破和生物信息学的发展,土壤微生物组学的研究得到了迅速发展,为研究土壤微生物、促进土壤健康和提高作物生产提供了有力的工具[25]。Fan等[26]发现,关键土壤微生物在维持土壤营养元素循环和作物高产方面具有重要作用。土壤微生物在土壤生态系统的调节、支持和供应功能中起着关键作用,是联系陆地生态系统中地上和地下部分的关键纽带[27]。
盐胁迫对植物根际微生物群落结构有显著的影响,本研究发现,盐胁迫条件下土壤细菌样本的OUT数量差异较大,表现为Y0>Y1>Y2>Y3,即随着盐胁迫程度的加剧,样本中检测到的OTU数量逐渐降低;稀释曲线分析发现样本E-Y0、S-Y1和S-Y2的细菌群落丰富度高于其他样本;Sobs指数表现为Y2>Y0>Y1>Y3,且不同程度胁迫间存在显著差异;多样性分析表明盐胁迫对燕麦根际细菌群落结构和多样性有显著影响,土壤微生物多样性越高,其生态功能越强,有利于作物高产和抵御不良环境胁迫[28]。Alpha多样性反映了土壤微生物的物种丰度及多样性。本研究表明,样本S-Y2的群落丰度最高,样本S-Y3 的多样性最丰富。
Beta多样性用来描述不同样本微生物群落间的差异,NMDS分析结果表明Y0和Y1处理下細菌的群落组成相似性较高,而Y2和Y3处理下细菌的群落组成差异较大。PCoA分析发现,各处理样本分布于不同象限,表明各处理的细菌群落组成具有明显差异。ANOSIM分析表明盐胁迫、品种类型对根际土壤微生物菌群类型均有影响,且盐胁迫对燕麦根际土壤细菌群落的多样性的影响更显著。Gao等[29]研究发现,低盐胁迫对高粱(Sorghumbicolor L.)根际土壤细菌多样性的抑制小于高盐胁迫,不同品种间细菌多样性差异不明显。本研究也发现,不同盐胁迫下燕麦根际土壤细菌多样性及群落组成存在差异,盐胁迫程度不同是造成燕麦根际土壤细菌群落多样性差异的主要原因。
本研究表明,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、Bacteroidetes、芽单胞菌门(Gemmatimonadetes)、厚壁菌门(Firmicutes)、Patescibacteria、蓝藻门(Cyanobacteria)和疣微菌门(Verrucomicrobia)为燕麦根际土壤细菌的主要优势菌门,与前人研究结果一致[3031];在其他分类水平下,燕麦根际细菌优势菌群与汪焱等[32]研究结果基本一致。盐胁迫使燕麦根际土壤中变形菌门(Proteobacteria)的相对丰度显著提高,在不同盐胁迫处理中均为最优势菌门。研究表明,变形菌门与土壤有机碳含量显著相关,其丰度的增多可更有效地固定氮源[32]。在变形菌门内主要包含α-变形菌纲(α -proteobacteria) 、β - 变形菌纲(β-proteobacteria)、δ-变形菌纲(δ-proteobacteria)、ε-变形菌纲(ε-proteobacteria)、γ-变形菌纲(γ-proteobacteria)等。Valenzuela-encinas 等[34]研究发现,无论在高盐还是低盐土壤中,变形菌门的优势类群都是γ-变形菌纲,而在中等盐度土壤中优势类群是α-变形菌纲。在本研究中,不同盐胁迫下各样本根际细菌的最优势菌纲均为α-变形菌纲。α-变形菌纲常以胞内的生活方式作为植物互惠者或植物/动物病原体,并能在营养匮乏的生境中生长。无论盐度高低,γ-变形菌纲的相对丰度均较高。酸杆菌门(Acidobacteria)在燕麦根际土壤中的相对丰度也较高,其门下菌类大多数为腐生菌,在有机物分解过程中起促进作用,具有共生固氮和解磷作用[35],也是世界上分布最广、种类最丰富的细菌之一。绿弯菌门(Chloroflexi)能够降解有机质,将糖和多糖发酵成有机酸,加快土壤中有机物的分解和吸收,具有较好的生物解磷作用,有助于硝酸盐的分解[36]。放线菌门(Actinobacteria)可以在含有3.5% NaCl的培养基上生长[37],在有机物分解导电过程中有促进作用,以往从盐土中分离的嗜盐细菌大多属于Actinobacteria。
芽孢桿菌属(Bacillus)、假单胞菌属(Pseudomonas)等能够提高寄主对不同非生物胁迫环境的耐受性。Bacillus 为革兰氏阳性菌,是严格需氧或兼性厌氧的有荚膜杆菌,该属细菌的重要特性是能够对不利条件产生具有特殊抵抗力的芽孢,芽孢是自然界已经发现的最具耐受性的细胞,处于休眠状态的芽孢对热、干燥、辐射、酸、碱和有机溶剂等具有极强的抵抗力,在作为植物促生菌或益生菌方面具有很大的潜力[38]。Pseudomonas 为直或稍弯的革兰氏阴性杆菌,为无核细菌,以极生鞭毛运动,不形成芽孢,有极强分解有机物的能力,在植物促生与抗逆方面表现更突出,可增强植株对水分和营养的吸收,提高生长素、嗜铁素、ACC脱氨酶等含量,参与调控植物诸多生理代谢功能,从而促进植物生长,提高植物的抗逆性[39],在提高棉花[40]、番茄[31]等植物的耐盐性方面有重要作用。
本研究KEGG 代谢通路分析与COG 数据库预测的结果基本一致。盐胁迫影响了燕麦根际微生物群落的功能丰度谱,尤以次生代谢产物、聚糖和氨基酸代谢合成等相关功能基因丰度变化明显。土壤微生物多样性和生态系统功能多样性呈显著正相关,多样化的土壤微生物群落能够更好地改善农业生态系统[41]。
本研究发现,盐胁迫是燕麦根际微生物群落组成显著影响,优势核心菌群可能在植物响应环境胁迫应答中起重要作用。应用核心菌种接种的微生物组工程技术可以直接调节微生物互作网络,抑制有害微生物,同时招募功能微生物,从而提升作物抗逆性[15,18]。利用微生物间的互作,通过调控土壤微生物群落结构既能够改良土壤,减少农药和肥料的施用,又可以提高作物产量和抗逆性,降低农业生产中的资源消耗,缓解环境污染等问题,因此,利用微生物作为生物防治剂或生物修复剂在农业实践中具有广阔的应用前景。
参考文献
[1] 李建国,濮励杰,朱明,等.土壤盐渍化研究现状及未来研究
热点[J].地理学报,2012,67(9):1233-1245.
LI J G, PU L J, ZHU M, et al .. The present situation and hot
issues in the salt-affected soil research [J]. Acta Geogr. Sin.,
2012, 67(9):1233-1245.
[2] MUNNS R, TESTER M. Mechanisms of salinity tolerance [J].
Ann. Rev. Plant Biol., 2008, 59(1):651-681.
[3] MEENA M D, YADAV R K, NARJARY B, et al .. Municipal
solid waste (MSW): strategies to improve salt affected soil
sustainability: a review [J]. Waste Manag., 2018, 84:38-53.
[4] YANG Y, GUO Y. Elucidating the molecular mechanisms
mediating plant salt-stress responses [J]. New Phytol., 2018,
217:523-39.
[5] 高玉坤,杨溥原,项晓冬,等.不同耐盐高粱品种全生育期对
盐胁迫的响应[J].华北农学报,2020,35(6):113-121.
GAO Y K, YANG P Y, XIANG X D, et al . Response of
different salt tolerant sorghum varieties to salt stress in the
whole growth period [J]. Acta Agric. Boreali-Sin., 2020, 35(6):
113-121.
[6] YUAN F, LENG B, WANG B. Progress in studying salt
secretion from the salt glands in recretohalophytes: how do plants
secrete salt? [J/OL]. Front Plant Sci., 2016, 7:977 [2021-09-10].
https://doi.org/10.3389/fpls.2016.00977.
[7] YANG Y, GUO Y. Unraveling salt stress signaling in plants [J].
J. Integr. Plant Biol., 2018, 60:796-804.
[8] KAZAN K, LYONS R. The link between flowering time and
stress tolerance [J]. J. Exp. Bot., 2015, 67:47-60.
[9] LOWRY D B, HALL M C, SALT D E, et al .. Genetic and
physiological basis of adaptive salt tolerance divergence
between coastal and inland Mimulus guttatus [J]. New Phytol.,
2009, 183:776-788.
[10] RODRIGUEZ P A, ROTHBALLER M, CHOWDHURY S P,
et al .. Systems biology of plant microbiome interactions [J].
Mol. Plant., 2019, 12:804-821.
[11] PAUL D, LADE H. Plant-growth-promoting rhizobacteria to
improve crop growth in saline soils: a review. [J]. Agron.
Sustain. Dev., 2014, 34:737-752.
[12] BADRI D V, VIVANCO J M. Regulation and function of root
exudates [J]. Plant Cell Environ., 2009, 32:666-681.
[13] CASTRILLO G, TEILXEIRA P, PAREDES S, et al .. Root
microbiota drive direct integration of phosphate stress and
immunity [J]. Nature, 2017, 543:513-518.
[14] LI H, LA S, ZHANG X, et al .. Salt-induced recruitment of
specific root-associated bacterial consortium capable of
enhancing plant adaptability to salt stress [J]. ISME J., 2021,
15:2865-2882.
[15] SERRANO R, RODRIGUEZ-NAVARRO A. Ion homeostasis
during salt stress in plants [J]. Curr. Opin. Cell Biol., 2001,
13(4):399-404.
[16] 王丹,趙亚光,张凤华.耐盐促生菌筛选、鉴定及对盐胁迫小
麦的效应[J].麦类作物学报,2020,40(1):110-117.
WANG D, ZHAO Y G, ZHANG F H. Screening and
identification of salt-tolerant plant growth-promoting bacteria
and its promotion effect on wheat seedling under salt stress [J].
J. Triticeae Crops, 2020, 40(1):110-117.
[17] LOUBNA B, FATIMA E K, KHALID O, et al .. Phytobeneficial
bacteria improve saline stress tolerance in Vicia faba
and modulate microbial interaction network [J/OL]. Sci. Total
Environ., 2020, 729:139020 [2021-09-10]. https://doi.org/10.1016/j.
scitotenv.2020.139020.
[18] ZHAO S, LIU J, BANERJEE S, et al.. Biogeographical distribution
of bacterial communities in saline agricultural soil [J/OL].
Geoderma, 2019, 361(1):114095 [2021-09-10]. https://doi.org/
10.1016/j.geoderma.2019.114095.
[19] 陈晓晶,刘景辉,杨彦明,等.盐胁迫对燕麦叶片生理指标和
差异蛋白组学的影响[J].作物学报, 2019, 45(9):1431-1439.
CHEN X J, LIU J H, YANG Y M, et al .. Effects of salt stress on
physiological indexes and differential proteomics of oat leaf [J].
Acta Agron. Sin., 2019, 45(9):1431-1439.
[20] CASTRILLO G, TEILXEIRA P, PAREDES S, et al .. Root
microbiota drive direct integration of phosphate stress and
immunity [J]. Nature, 2017, 543:513-518.
[21] MAGOC T, SALZBERG S L. FLASH: fast length adjustment of
short reads to improve genome assemblies [J]. Bioinformatics,
2011, 27:2957-2963.
[22] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al ..
QIIME allows analysis of high-throughput community sequencing
data [J]. Nat. Methods, 2010, 7:335-336.
[23] CHAO A, SHEN T J. Nonparametric prediction in species
sampling [J]. J. Agric. Biol. Environ. Statist., 2004, 9:253-269.
[24] BAI Y, M?LLER D B, SRINIVAS G, et al .. Functional overlap
of the Arabidopsis leaf and root microbiota [J]. Nature, 2015,
528:364-369.
[25] RAAIJMAKERS J M, MAZZOLA M. Soil immune responses [J].
Science, 2016, 352:1392-1393.
[26] FAN K, DELGADO-BAQUERIZO M, GUO X, et al ..
Biodiversity of key-stone phylotypes determines crop
production in a 4-decade fertilization experiment [J]. ISME J.,
2020, 15:550-561.
[27] DELGADO-BAQUERIZO M, MAESTRE F T, REICH P B,
et al .. Microbial diversity drives multifunctionality in terrestrial
ecosystems [J/OL]. Nat. Commun., 2016, 7: 10541 [2021-09-
10]. https://doi.org/10.1038/ncomms10541.
[28] CHEN Q L, DING J, ZHU Y G, et al .. Soil bacterial taxonomic
diversity is critical to maintaining the plant productivity [J/OL].
Environ. Int., 2020, 140:105766 [2021-09-10]. https://doi.org/
10.1016/j.envint.2020.105766.
[29] GAO Y K, CUI J H, REN G Z, et al .. Changes in the rootassociated
bacteria of sorghum are driven by the combined
effects of salt and sorghum development [J/OL]. Environ.
Microbiome, 2021, 16: 14 [2021-09-10]. https://doi.org/10.1186/
s40793-021-00383-0.
[30] YANG Y, SHAO T Y, LONG X H, et al .. Microbiome structure
and function in rhizosphere of Jerusalem artichoke grown in
saline land [J/OL]. Sci. Total Environ., 2020, 724(168):138259
[2021-09-10]. https://doi.org/10.1016/j.scitotenv.2020.138259.
[31] 蘭汝佳.根际耐盐促生菌的筛选及其对番茄耐盐性的调控
研究[D].南京:南京农业大学, 2019.
LAN R J. Screening of salt-tolerant rhizosphere-promoting
bacteria and its regulation on salt tolerance of tomato [D].
Nanjing: Nanjing Agricultural University, 2019.
[32] 汪焱,张英,苏贝贝,等.高寒区不同地域燕麦根际土壤微生
物多样性研究[J].草地学报,2020,28(2):358-366.
WANG Y, ZHANG Y, SU B B, et al .. Study on microbial
diversity of rhizosphere soil of oat in different areas in alpine
region [J]. Acta Agrestia Sin., 2020, 28(2):358-366.
[33] WAGG C, SCHLAEPPI K, BANERJEE S, et al .. Fungalbacterial
diversity and microbiome complexity predict
ecosystem functioning [J/OL]. Nat. Commun., 2019, 10:4841
[2021-09-10]. https://doi.org/10.1038/s41467-019-12798-y.
[34] VALENZUELA-ENCINAS C, NERIA-GONZ?LEZ I,
ALC?NTARA-HERN?NDEZ R J, et al .. Changes in the
bacterial populations of the highly alkaline saline soil of the
former lake Texcoco (Mexico) following flooding [J].
Extremophiles, 2009, 13(4):609-621.
[35] WARD N L, CHALLACOMBE J F, JANSSEN P H, et al ..
Three genomes from the phylum Acidobacteria provide insight
into their lifestyles in soils [J]. Appl. Environ. Microbiol.,
2009, 75(7):2046-2056.
[36] KRAGELUND C, LEVANTESI C, BORGER A. Identity
abundance and ecophysiology of filamentous Chloroflexi
species present in activated sludge treatment plants [J]. FEMS
Microbiol. Ecol., 2007, 59:671-682.
[37] MALDONADO L A, FENICAL W, JENSEN P R, et al ..
Salinispora arenicola gen. nov. sp. nov. and Salinispora tropica
sp. nov. obligate marine actinomycetes belonging to the family
Micromono sporaceae [J]. Int. J. Syst. Evol. Microbiol, 2005,
55(5):1759-1766.
[38] VARDHARAJULA, ALI S Z, GROVER M, et al .. Droughttolerant
plant growth promoting Bacillus spp.: effect on growth,
osmolytes, and antioxidant status of maize under drought stress [J].
J. Plant Interact., 2011, 6(1):1-14.
[39] RAJKUMAR M, BRUNO L B, BANU J R. Alleviation of
environmental stress in plants: the role of beneficial
Pseudomonas spp. [J]. Crit. Rev. Environ. Sci. Technol., 2017,
47(6):372-407.
[40] EGAMBERDIEV D, JABBOROV D, HASHEM A. Pseudomonas
induces salinity tolerance in cotton (Gossypium hirsutum) and
resistance to Fusarium root rot through the modulation of indole-3-
acetic acid [J]. Saudi J. Biol. Sci., 2015, 22(6):773-779.
[41] FR?C M, HANNULA S E, BE?KA M, et al .. Fungal
biodiversity and their role in soil health [J/OL]. Front.
Microbiol., 2018, 9:707 [2021-09-10]. https://doi.org/10.3389/
fmicb.2018.00707.
(責任编辑:张冬玲)
