BnMAPK2对甘蓝型油菜耐旱性的影响
2023-04-12袁大双张晓莉朱冬鸣杨友鸿姚梦楠
袁大双 张晓莉 朱冬鸣 杨友鸿 姚梦楠 梁 颖,*
对甘蓝型油菜耐旱性的影响
袁大双1,2,3张晓莉1,2朱冬鸣1,2杨友鸿1,2姚梦楠1,2梁 颖1,2,*
1西南大学农学与生物科技学院 / 油菜工程研究中心, 重庆 400715;2西南大学现代农业科学研究院, 重庆 400715;3贵州省六盘水市六枝特区自然资源局, 贵州六盘水 553400
促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联参与植物多种生物及非生物胁迫应答过程,属于MAPK级联途径最下游C族基因。本研究成功获得超量表达(OE-MAPK2)和RNA干扰表达(RNAi-MAPK2)转基因甘蓝型油菜, 在干旱条件下, OE-MAPK2植株耐旱性增加, RNAi-MAPK2植株耐旱性降低。相关生理指标试验结果证明, 在干旱胁迫下,可减缓叶片脱水程度、促进植物体内脯氨酸积累、降低丙二醛含量, 在干旱后期增加POD活性。比较干旱相关基因(、)、互作干旱相关基因(、)以及依赖ABA信号途径相关基因(、、), 在转基因植株和野生型植株中表达水平变化差异, 结果表明,可正向调控、、、、、的表达; 负调控的表达, 并且依赖ABA信号途径相关基因在OE-MAPK2植株中的表达变化趋势和突变体中一致。由此推测可通过调控植株体内渗透能力、叶片含水量、细胞膜和蛋白质结构稳定性、清除自由基、降低膜脂过氧化来增加植株耐旱性; 还可通过与互作, 负调控基因的表达, 介导STRS2依赖ABA信号途径, 增加植株的耐旱性。本研究为进一步阐明基因的抗逆作用机制奠定了基础。
甘蓝型油菜;; 耐旱性; qRT-PCR
油菜是世界食用植物油的主要来源之一[1]。我国的油菜产量和种植面积分别约占世界的三分之一[1]。长江流域是我国油菜主产区, 但在苗期、发育期及成熟期常受到不同程度的干旱和高温胁迫[2-3]。干旱胁迫会造成土壤水分降低, 植株脱水、营养物质吸收和光合产物合成降低, 干旱胁迫, 影响油菜生长发育, 曾导致我国长江流域油菜产量减产25%~ 32%[2]。因此, 培育抗旱油菜品种己成为油菜生产中亟需解决的重要问题之一。传统的遗传育种方法育种周期长, 工作量大。随着分子生物学的发展, 基因工程技术已逐渐成为培育耐热、抗旱作物新品种的有效手段。
促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs), 是一类丝氨酸/苏氨酸白激酶, 普遍存在于真核生物中, MAPK级联途径是一种重要的细胞信号传导模式, 特异性感受上游信号分子的刺激从而被激活, 通过磷酸化与去磷酸化逐级活化将胁迫信号放大, 传递到终端接收的靶蛋白, 引起细胞内一系列生理生化反应, 实现细胞的抗逆功能[4-5]。MAPK级联根据MAPK中的保守TXY基序内氨基酸序列特点, 将其分成2个大亚型——TEY和TDY, 前者包括A、B和C 3个族, 后者为D族, 目前对A族和B族的研究较多[6]。研究发现A族MAPKs主要参与激素响应及多种环境胁迫相关的途径, 拟南芥中的MAPK3受多种环境胁迫所激活[7-8], 且在活性氧的刺激下也可以被激活[9]。研究发现B族MAPKs也参与由逆境胁迫引起的细胞内信号传导以及细胞分裂过程。例如, 对拟南芥中MAPK4的研究表明, MAPK4可以被非生物胁迫和生物胁迫所激活[7-8,10]。目前对MAPK C亚族MAPK2的研究主要是基因克隆以及表达模式分析方面研究发现MAPK2基因参与多种生物和非生物胁迫, 王伟威等[11]研究表明, 在干旱诱导条件下, 大豆叶片中基因表达量下降; 还有研究证明,基因在植物多种器官中表达, 参与多种胁迫反应, 如机械损伤、镉胁迫、低温胁迫、除此外基因还受到外源激素诱导表达, 如脱落酸(abscisic acid, ABA)、茉莉酸(jasmonic acid, JA)都会诱导该基因的表达[12-14]。说明基因可响应多种逆境胁迫反应, 但基因的表达模式不同。目前, 关于中基因对甘蓝型油菜抗旱性的影响尚未见报道。本研究中证明基因可提高甘蓝型油菜耐旱性, 通过转基因技术和荧光定量PCR技术, 初步探索提高甘蓝型油菜抗旱性的机制, 为完善甘蓝型油菜耐旱分子机制提供了理论依据。
1 材料与方法
1.1 试验材料
供试甘蓝型油菜品种为Westar、PFGC5941M载体、pENTRY-MCS质粒的菌液和pEarleyGate101载体为本研究室提供; RNA提取试剂、DNA限制性内切酶、PrimerSTAR DNA聚合酶、T4-DNA连接酶、qRT-PCR荧光酶、反转录试剂盒均购自TaKaRa公司; 由生工生物工程(上海)股份有限公司合成PCR引物。
1.2 BnMAPK2转基因植株载体构建和遗传转化
已知在甘蓝型油菜中只有一个拷贝[15-17], 以甘蓝型油菜Westar系, cDNA为模板, 用引物FOVMAPK2+ROVMAPK2 (表1)在pfu高保真酶作用下扩增基因, 将获得的片段连接到表达载体pEarleyGate101上, 获得超量表达载体pEarleyGate101-OVBnMAPK2。根据所获得的基因片段, 设计特异性引物, 以pEarleyGate101-OVBnMAPK2质粒为模板pfu高保真酶扩增基因RNA干扰的反义链和正义链, 分别命名为iMAPK2-A和iMAPK2-B, 将克隆得到的RNA干扰正、反义片段连接到克隆载体pGEM-T Easy上, 命名为T-iMAPK2-A和T-iMAPK2-B, 提取T-iMAPK2-A和PFGC5941M的质粒, 使用限制性内切酶II和Ι分别双酶切T-iMAPK2-A和PFGC5941M载体质粒, 电泳、回收、连接、转化到大肠杆菌, 最后正确的载体PFGC5941M- iMAPK2-A, 将基因的正义干扰片段iMAPK2-B连接到表达载体PFGC5941M-iMAPK2-A上。应用农杆菌介导法[18]转化甘蓝型油菜, 试验材料为甘蓝型油菜Westar品种, 分别以油菜苗的子叶和无子叶的子叶柄为外植体转化甘蓝型油菜。
1.3 干旱处理方法
在一次性培养皿内放入2层浸湿的滤纸, 铺平, 加水至滤纸饱和。将T2代转基因甘蓝型油菜(OE- MAPK2、RNAi-MAPK2)和对照株系(WT)种子均匀摆在滤纸上, 置于人工气候培养箱正常管理。温度25℃, 湿度55%, PPFD 18mmol m–2s–1, 光周期14 h/ 10 h (昼/夜)。每日检查并补充滤纸水分, 同时注意通气和种子发霉情况。待油菜下胚轴伸长3~4 cm时移栽到直径约为12 cm的装有同等重量田间土∶蛭石(2∶1)的塑料盆钵里, 每盆移栽2棵, 在相同环境条件下培养至4~6叶期。分别进行自然干旱处理(连续12 d未浇水)和PEG模拟干旱处理(10% PEG- 8000)。
选取长势一致的油菜幼苗, 停止浇水, 进行自然干旱处理, 同时, 每天称各处理带株盆钵重量以监测各处理失水基本一致。分别于处理0、2、4、6、8和10 d后, 取幼苗叶片作为样品, 测定干旱相关生理指标。
选取长势一致的油菜幼苗, 向叶面喷施10% PEG-8000进行模拟干旱处理, 分别在喷施0、1、3、9、12 h后, 取叶片保存于-80℃冰箱中, 用于提取RNA对油菜抗旱相关基因表达进行qRT-PCR分析。
1.4 相关生理指标测定
采用称重法[19]测定叶片含水量(leaf water content, LWC)。称取1.0 g的油菜叶片, 于105℃杀青10 min, 80℃烘至恒重后称出干重, 以(鲜重-干重)/干重来表示叶片的含水量。
研钵内加0.1 mol L–1磷酸缓冲液将油菜叶片研磨成10%的样液, 植物叶片(g)∶磷酸缓冲液(mL) = 1∶9。采用愈创木酚氧化法[20]测定过氧化物酶(POD)活性; 采用羟胺法[21]测定超氧化物歧化酶(SOD)活性; 采用钼酸铵和可见光法[21]测定过氧化氢酶(CAT)活性; 采用硫代巴比妥酸(TBA)比色法[21]测定MDA含量; 试剂盒购自南京建成生物科技有限公司。
采用磺基水杨酸法[21]测定游离脯氨酸含量, 具体方法参见宗学凤[21]植物生理研究技术。
1.5 qRT-PCR
采用Invitrogen公司的TRIzol提取总RNA, 用RNase-free DNaseI (Fermentas公司)去除DNA杂质, 采用PrimeScript RT Reagent Kit (TaKaRa公司)分别反转录为cDNA, 以cDNA为模板, Actin7为内参, 利用相关引物(表1), 在模拟干旱条件下, 检测基因、干旱相关基因(、、)、BnMAPK2互作蛋白干旱相关基因(STRS2、CRL1)以及ABA信号通路相关基因(、、)的表达情况。

表1 本研究所用引物
1.6 试验数据处理
由Microsoft Excel 2010和Gradphad 8.0进行数据分析及图表制作, 试验数据均设置3个重复, 使用2–ΔΔCt方法分析qRT-PCR数据。
2 结果与分析
2.1 BnMAPK2转基因植株获得
由图1可知, OE-MAPK2植株、RNAi-MAPK2植株以及WT植株中基因的表达范围分别为0.77~1.65、0.03~0.04、0.11~0.16。超量表达植株中基因表达量是野生型的7~15倍, 而野生型植株中基因表达量是干扰植株的3.67~5.33倍, 说明转基因植株较稳定可用于后续研究。
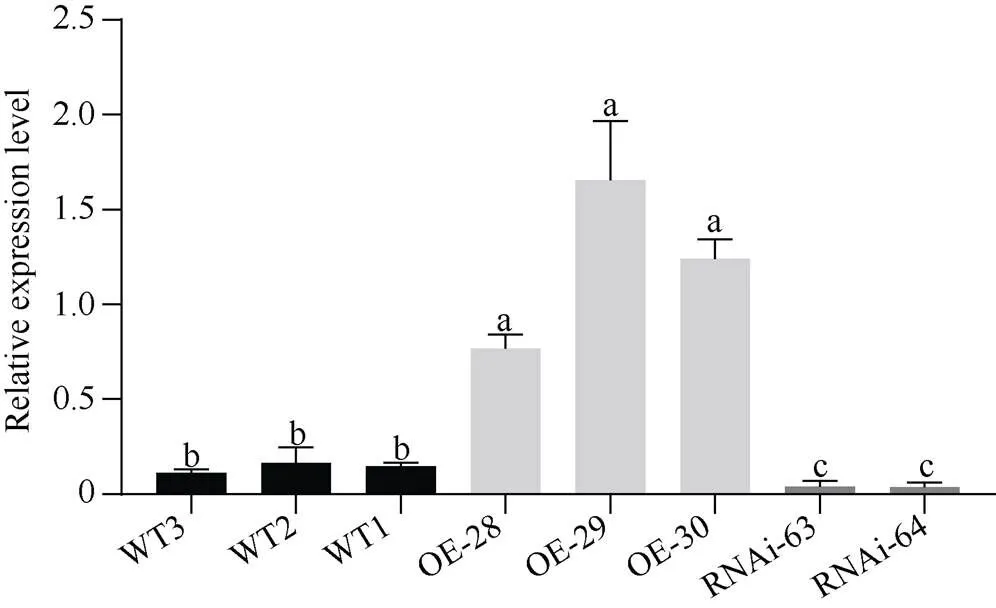
图1 转基因植株BnMAPK2和野生型植株表达量的鉴定
相同处理标以不同字母的柱值在< 0.05 水平差异显著。
Different lowercase letters are significantly different at< 0.05 within the same treatment.
2.2 模拟干旱条件下BnMAPK2基因的表达模式
模拟干旱胁迫下不同材料中表达有显著差异, 在干旱处理1 h和3 h时基因的表达量逐渐上升, 3 h时上升到最高峰, 说明的表达量明显受干旱胁迫的诱导; 在模拟干旱处理6 h时基因表达量下降到最低值, 9 h开始回升, 直到12 h时基因表达量与0 h基因表达量接近, 趋于稳定; 在模拟干旱处理整个时期中超量表达转基因植株中表达量均极显著高于WT,而干扰表达转基因株系中表达量均极显著低于WT。可见, 本试验的转基因材料为纯合、相对稳定的株系,超量表达植株中基因表达量高,对干旱胁迫有响应。
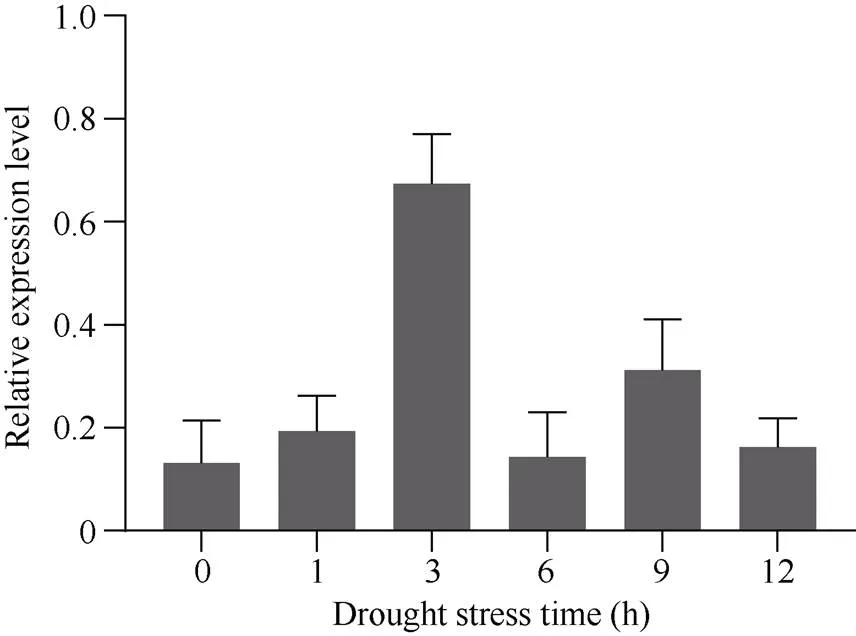
图2 干旱条件下BnMAPK2基因的表达量
数据表示为平均值±SD (= 3)。
Data are presented as means ± SDs (= 3).
2.3 干旱胁迫下植株叶片含水量和表型分析
在正常浇水的情况下, 转基因植株和野生型植株正常生长并长势基本一致(图3-A), 对转基因植株和野生型植株叶龄进行统计, 发现转基因植株和野生型植株之间并未达到显著性差异(图3-B), 说明基因对植株苗期并无显著性影响。如图3-A所示, 在干旱处理初期转基因植株与WT植株的叶片含水量变化不大, WT和干扰植株含水量在91%~88%, 超量表达植株含水量在92%~90%。随着干旱处理时间延长, 植株的叶片含水量逐渐下降, 当自然干旱第8天和第10天时野生型和超量表达植株叶片含水量达到显著性差异。自然干旱第10天时, 超量表达植株OE-MAPK2-29、野生型植株以及干扰表达植株RNAi-MAPK2-63叶片的含水量平均为83%、70.86%和67%。和干旱处理第6天相比, 野生型和干扰植株含水量比自然干旱6 d时下降了18%, 超量表达植株含水量只下降7%。在干旱10 d时对野生型植株和转基因植株进行表型对比(图3-D), 发现野生型植株叶片发生黄化和卷曲, 干扰植株叶片黄化且严重卷曲, 野生型植株和干扰植株都发生严重萎蔫, 但过表达植株叶片未发生黄化、叶片轻微卷曲萎蔫程度较轻。表明可缓解干旱胁迫下植株叶片脱水, 提高植株耐旱性。
2.4 干旱胁迫下BnMAPK2对油菜叶片脯氨酸含量影响
由图4可知, 在干旱胁迫初期, 转基因植株和WT植株叶片脯氨酸含量均较低, 随着干旱胁迫进行, 均呈上升趋势, 干旱处理第6天时, 脯氨酸含量均急剧上升, 此时0E-MAPK2-29、WT以及RNAi- MAPK2-62植株体内脯氨酸含量分别平均为4161.62、2354.39和2221.31 μg g–1, 与干旱处理第4天相比, 超量表达植株平均提高20.07~29.04倍, 野生型植株平均提高20.14倍, 干扰植株中脯氨酸含量平均提高18.04~19.58倍。当干旱处理第10天时OE-MAPK2植株和WT植株都达到显著性差异, OE-MAPK2-29、WT以及RNAi-MAPK2-63体内脯氨酸的含量分别为5012.94、4480.26和3230.31 μg g–1, 可见可加快干旱胁迫下脯氨酸的积累。
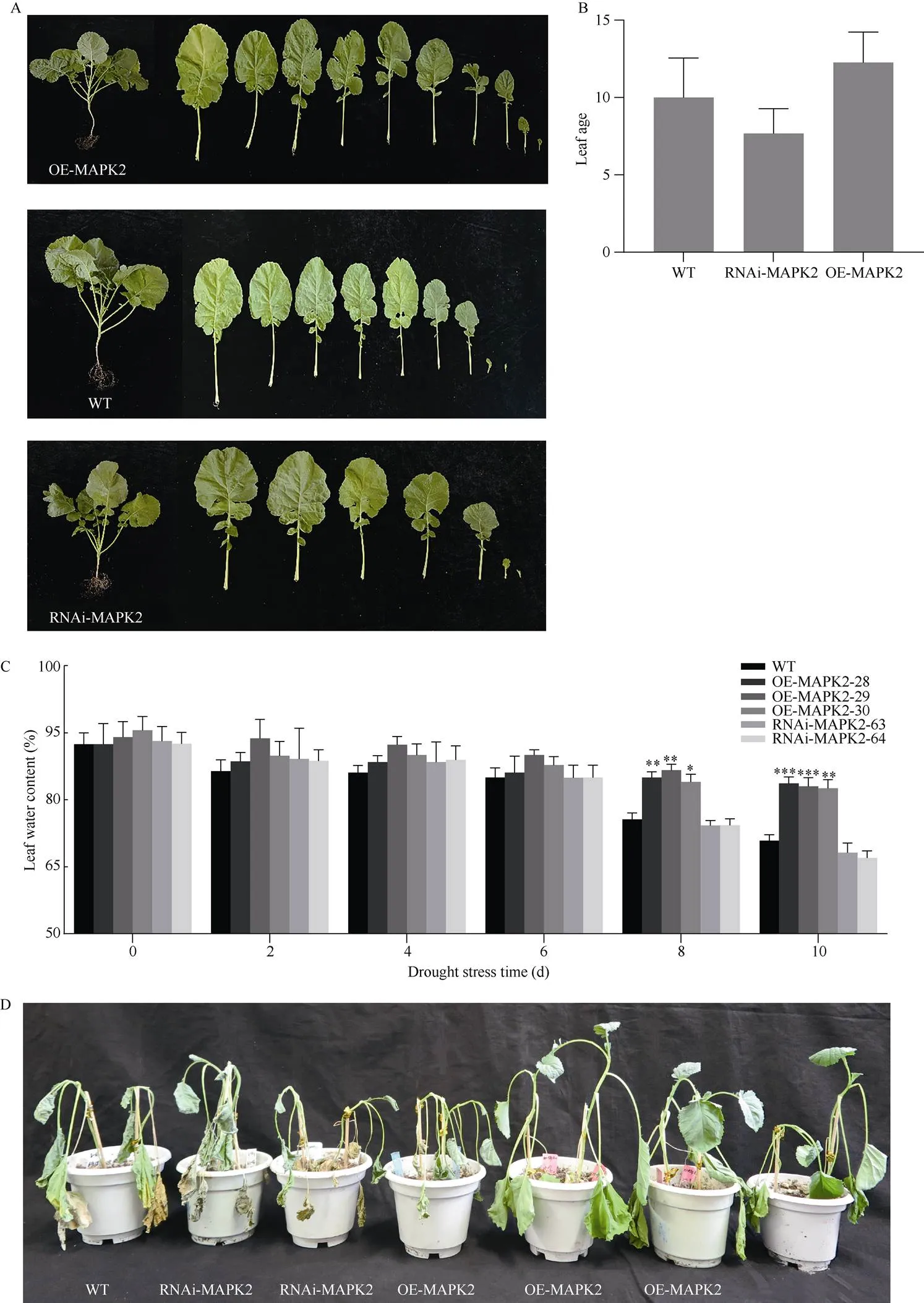
图3 干旱胁迫下转基因植株和野生型植株叶片含水量变化和表型分析
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as means ± SDs (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
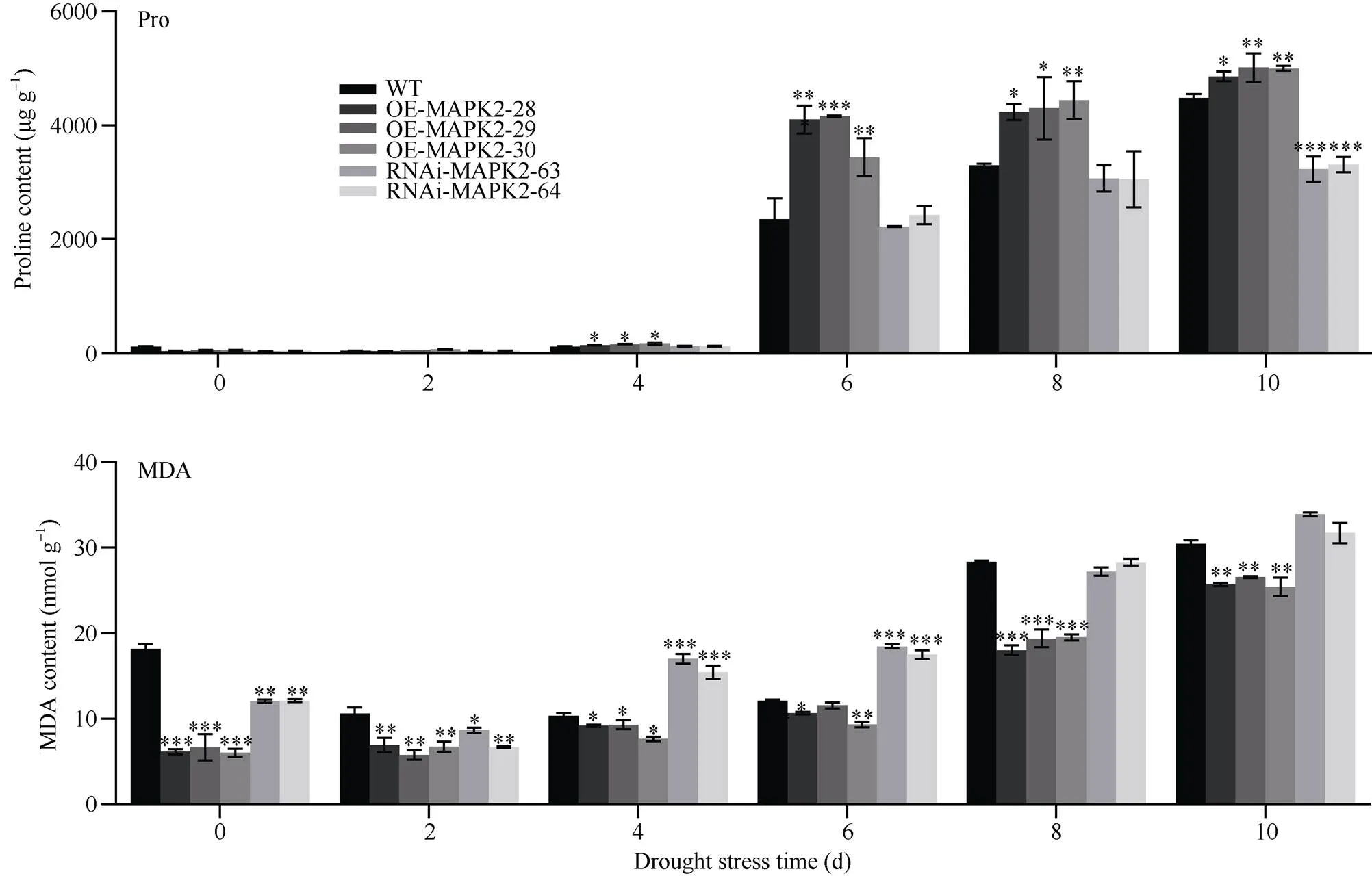
图4 自然干旱条件下转基因植株和野生型植株脯氨酸和丙二醛的对比
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as means ± SDs (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
2.5 干旱胁迫下BnMAPK2对油菜叶片丙二醛含量影响
由图4-B可知, 在整个干旱时期丙二醛的含量逐渐增加, WT植株叶片中丙二醛的含量都显著高于超量表达植株, 在干旱处理4 d时, 干扰植株中丙二醛含量极显著高于野生型, 此时RNAi- MAPK2-63植株和WT植株中丙二醛植株含量分别为17.01 nmol g–1和10.32 nmol g–1。在干旱后期第8天和第10天时, 超量表达植株中丙二醛的含量显著低于WT植株, 第8天时OE-MAPK2- 28植株中丙二醛的含量平均为18.01 nmol g–1, 野生型植株中丙二醛的含量平均为28.34 nmol g–1, 野生型植株中的含量是超量表达植株的1.57倍, 可见可降低油菜幼苗叶片丙二醛的积累, 减轻细胞膜的氧化损伤。
2.6 干旱胁迫下BnMAPK2对植株叶片抗氧化酶活性的影响
由图5可知, 在自然干旱处理过程中OE-MAPK2、RNAi-MAPK2和WT植株叶片中POD、SOD和CAT都呈现先上升后下降的趋势, SOD和CAT的活性均在处理6 d时达到峰值, 在整个干旱处理时期, 转基因植株中SOD和CAT含量都未与WT植株达到差异显著性水平, 虽在第10天时OE-MAPK2植株中SOD含量高于WT, CAT含量低于WT, 但都未达到显著性水平。OE-MAPK2、RNAi-MAPK2和WT植株中POD的含量在干旱处理第8天时达到峰值, 且此时RNAi-MAPK2植株中POD含量与WT植株达到差异显著性水平。当干旱处理第10天时, OE-MAPK2和RNAi-MAPK2植株中POD含量都与WT植株达到显著性差异, 其中OE-MAPK2-28植株中POD的含量平均为941.47 U mg–1protein, 野生型植株中平均为605.44 U mg–1protein, RNAi-MAPK2- 63植株中POD含量为496.21 U mg–1protein, OE-MAPK2-28植株中POD含量是野生型的1.56倍, 野生型植株中POD含量是干扰表达植株的1.22倍。表明在干旱胁迫下对SOD和CAT活性无显著影响, 可能通过提高POD抗氧化酶活性减少自由基积累, 从而抵御干旱对油菜的伤害。
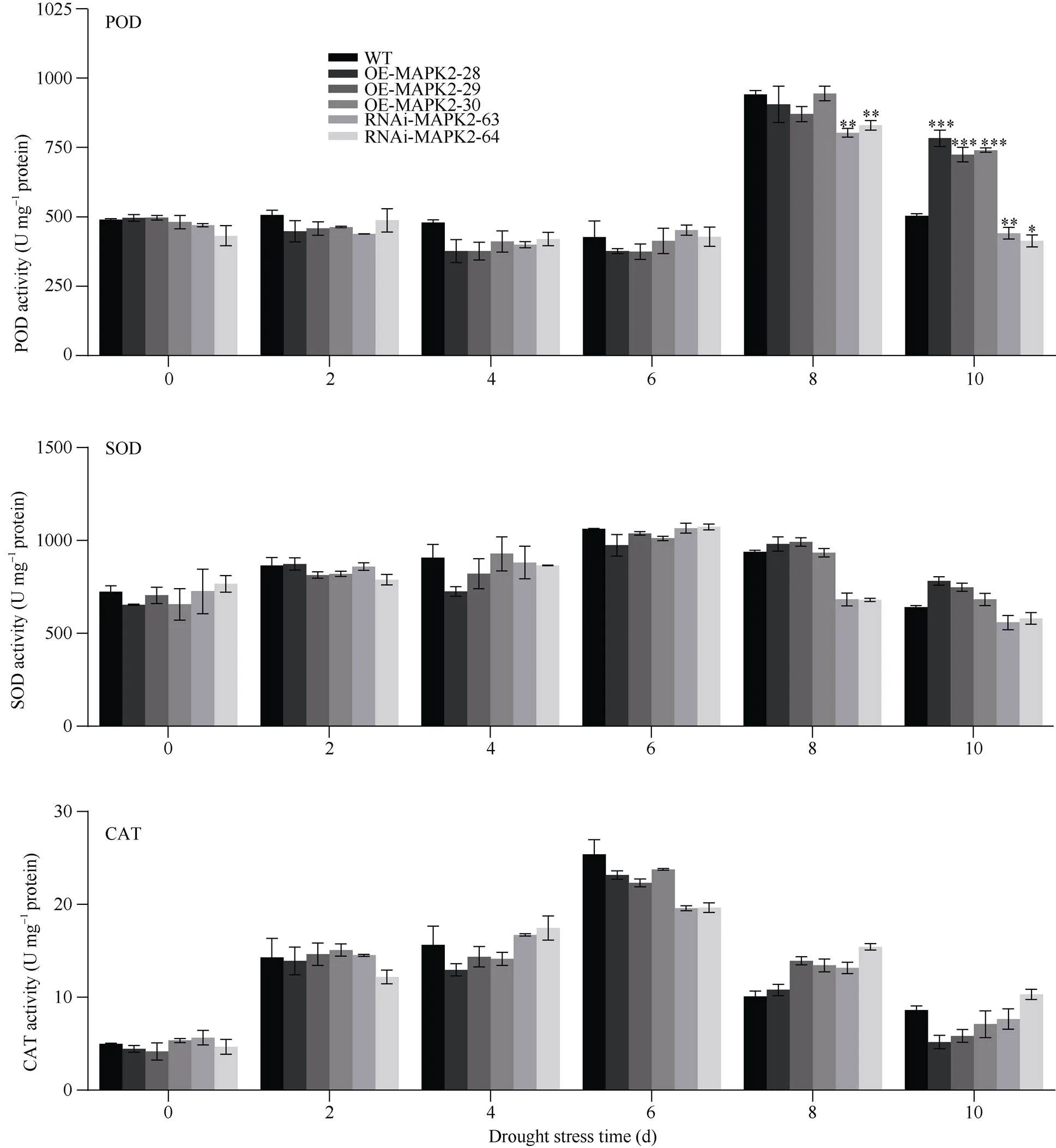
图5 自然干旱条件下转基因植株和野生型植株抗氧化酶含量的对比
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as means ± SDs (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
2.7 转基因油菜苗期叶片干旱相关基因表达量分析
为初步探索提高植株耐旱性机理, 在模拟干旱条件下检测转基因植株和野生型植株中与干旱有关基因、以及的表达情况。如图6所示, 在干旱胁迫下,以及的表达模式都是先上升后下降, 其中基因的表达量在3 h达到最高值, 此时OE-MAPK2-28植株中的表达量为9.54, WT植株中的表达量为0.61, RNAi-MAPK2植株中为0.44, 在整个干旱处理过程中, 只有在干旱处理1 h和3 h时, OE-MAPK2植株与野生型植株中基因的表达量达到差异显著性。基因的表达量在干旱处理1 h时达到最大值, 在未处理时, OE-MAPK2植株中基因的表达量显著高于WT植株, 但在整个模拟干旱处理期间, 转基因植株中基因的表达量都未与野生型植株达到差异显著性。在整个干旱处理时期和未处理时期OE-MAPK2植株中基因的表达量均与WT植株达到显著性差异, OE-MAPK2植株中基因的表达量在干旱处理1 h时达到峰值, 其中OE-MAPK2-29植株的表达量为3.05, 野生型植株中的表达量为0.52, 随着干旱胁迫进行, 超量表达植株中基因表达量逐渐下调, 但WT植株和RNAi-MAPK2植株中基因的表达量在干旱处理12 h达到最大值, 此时OE-MAPK2-29植株、RNAi-MAPK2-62以及WT植株中该基因表达量分别是1.24、1.96和1.60。表明在干旱胁迫下,正向调控和基因的表达量以提高植株的耐旱性, 且发生在干旱胁迫初期; 对基因表达无显著影响。
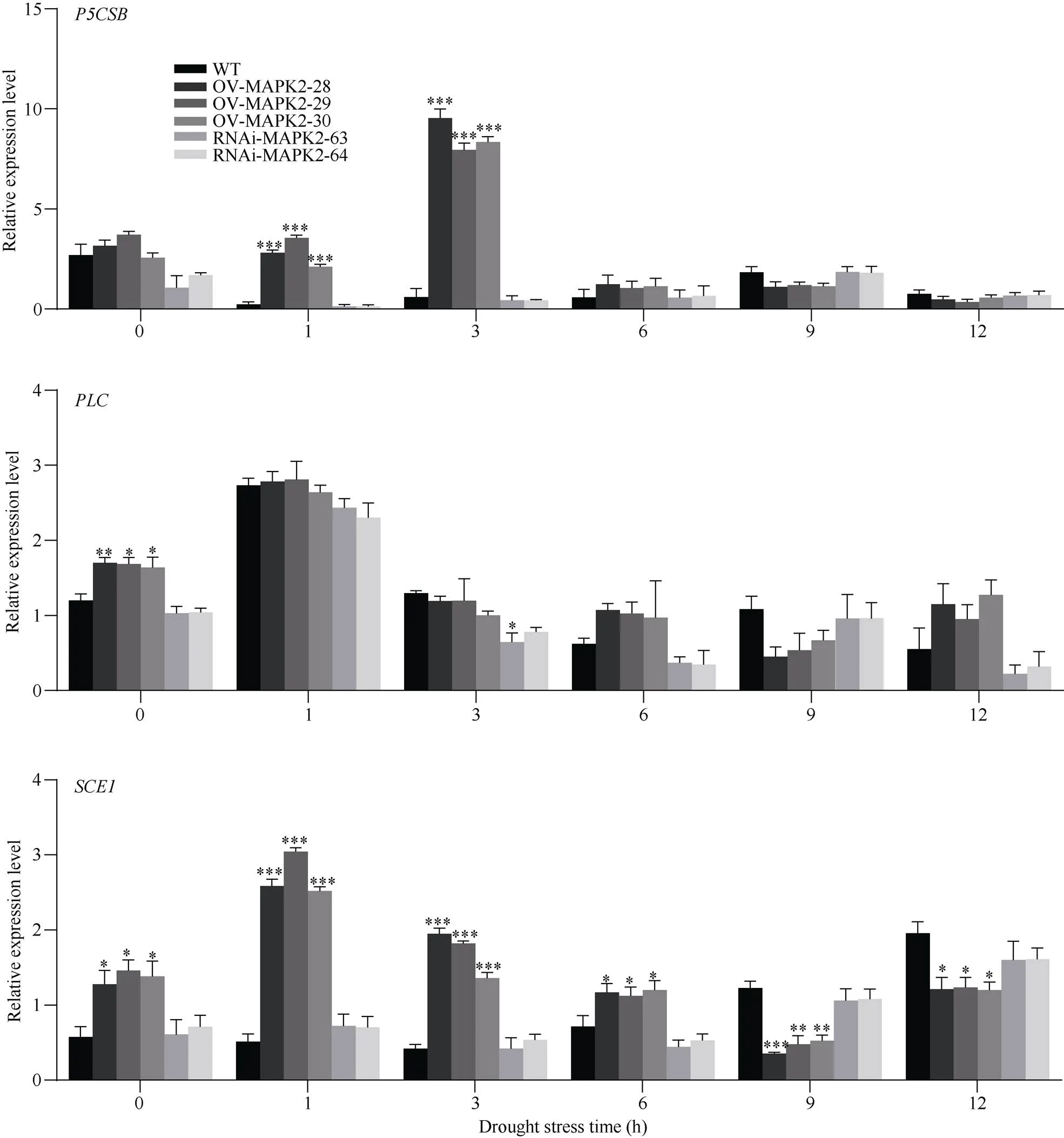
图6 干旱条件下转基因植株和野生型植株中干旱相关基因表达情况
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as means ± SDs (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
2.8 BnMAPK2互作基因表达量分析
在我们研究室前期筛选到的与BnMAPK2发生互作的蛋白相关基因中找到与植株抗旱性有关的基因和, 在模拟干旱条件下检测了OE- MAPK2、RNAi-MAPK2和WT植株中和基因表达情况, 由图7可知, 在干旱条件下,基因先下降后上升。在干旱处理3 h时, 植株中基因的表达量下降到最低值, 此时OE-MAPK2-28、RNAi-MAPK2-62以及野生型植株表达量分别是2.80、0.35和1.85, 干扰表达植株显著性低于野生型, 超量表达植株高于野生型植株, 但未达到差异显著性。干旱处理6 h后基因表达量开始上调, 在12 h达到峰值, 此时OE-MAPK2植株中该基因的表达量显著性高于WT, RNAi-MAPK2植株中该基因的表达量低于WT, 但未达到差异显著性。
在未干旱处理的情况下, OE-MAPK2植物中基因的表达水平显著性低于WT植株, 其中OE-MAPK2-28植株中该基因表达量为0.26, WT植株表达量为1, 而RNAi-MAPK2植物中的表达水平显著性高于WT, 其中RNAi-MAPK2-62植株中表达量为1.54。在干旱处理条件下,基因的表达量逐渐下降, 这与基因是一种应激反应抑制因子有关。在干旱处理前期1 h和3 h, OE-MAPK2植株中基因的表达量显著性低于野生型, 干扰表达植株中该基因表达量高, 但未与野生型达到差异显著性, 其中OE-MAPK2-28、WT和RNAi-MAPK2- 64植株中基因的表达量分别为0.06、0.28和0.20。在干旱处理后期, OE-MAPK2植株与WT植株中该基因的表达量都未达到差异显著性。基因是干旱胁迫反应正向调控因子,是干旱胁迫反应抑制因子研究结果显示能正向调控基因表达, 在干旱处理前期负调控基因表达, 说明正向调控植株干旱胁迫反应。
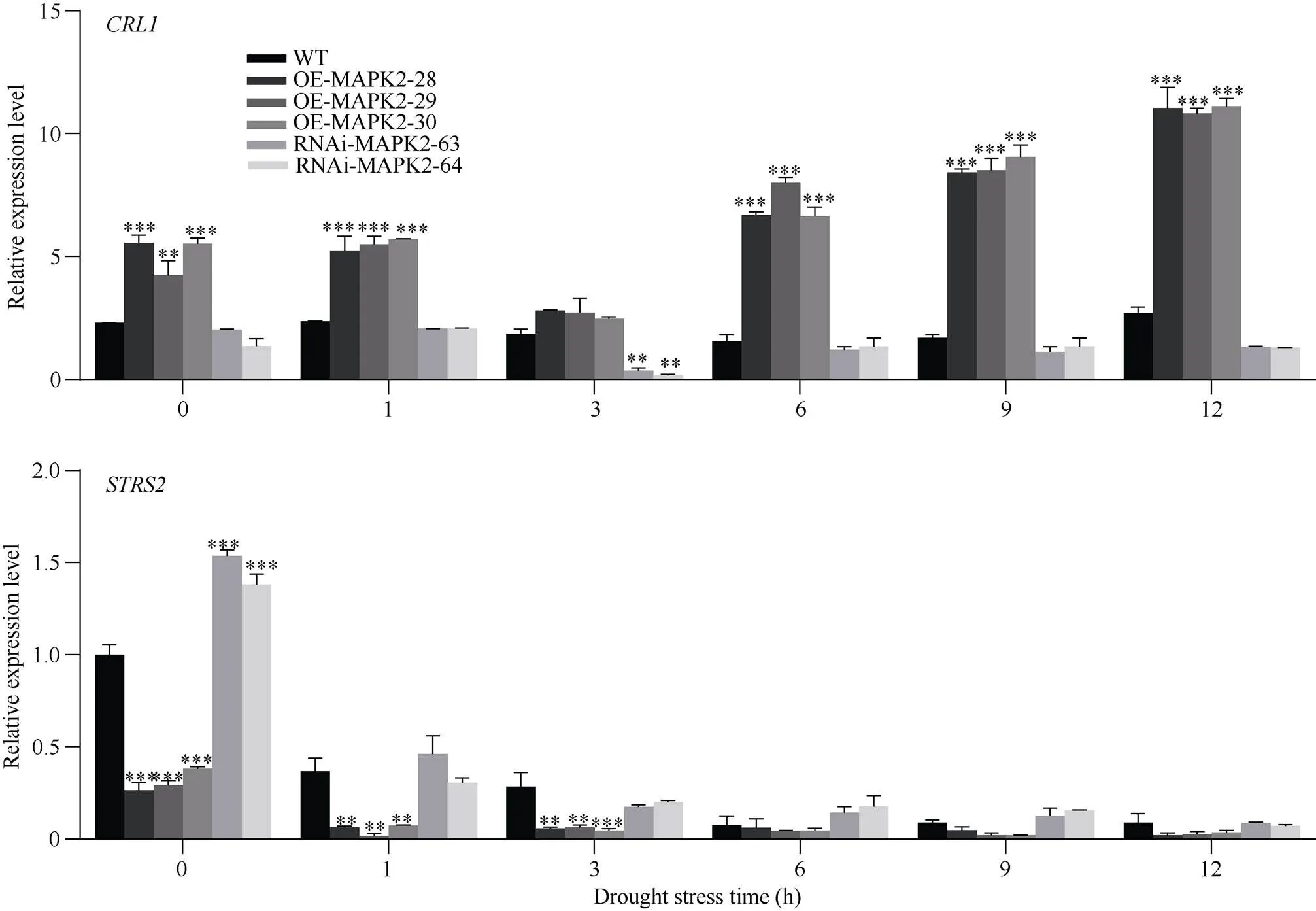
图7 干旱条件下BnMAPK2互作基因表达情况
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as means ± SDs (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
2.9 ABA信号途径相关基因表达量分析
有研究表明和都参与ABA依赖途径提高植株的耐旱性, 因此参照Kant[22], 在干旱条件下检测了OE-MAPK2、RNAi-MAPK2和WT植株中STRS2ABA信号途径有关基因以及的表达量。在干旱处理过程中3个基因表达模式都是先上升后下降(图8)。在未干旱处理时, OE-MAPK2和RNAi-MAPK2植株中基因的表达量与野生型植株达到显著性差异, 其中OE-MAPK2-29植株、WT植株以及RNAi-MAPK2-64植株中基因的表达量分别为1.50、1.02和0.63。基因的表达量在干旱处理9h达到高峰, 此时OE-MAPK2和RNAi-MAPK2植株中该基因的表达水平均与WT植株达到极显著性。在未处理时, OE-MAPK2植株中基因的表达量与WT植株达到显著性差异, 其中OE-MAPK2-30植株中基因的表达量为1.27, 野生型植株中0.49。干旱条件下,基因的表达量在6 h达到峰值, OE-MAPK2-30植株、WT植株以及RNAi- MAPK2-63中的表达量分别为2.88、2.07以及1.67, 超量表达植株都与野生型植株达到差异显著性, 干扰植株中只有RNAi-MAPK2-63与野生型植株达到差异显著性。在未处理时, OE-MAPK2和RNAi- MAPK2植株中基因的表达量都未与WT植株达到差异显著性, 在干旱处理1h时基因表达量达到最大值, 此时, OE-MAPK2植株中基因的表达水平极显著性高于WT植株, 其中OE-MAPK2-28植株和WT植株中基因的表达量分别为1.99和0.91。表明在干旱胁迫过程中基因通过与基因互作, 通过STRS2-ABA信号途径, 提高植株耐旱性。
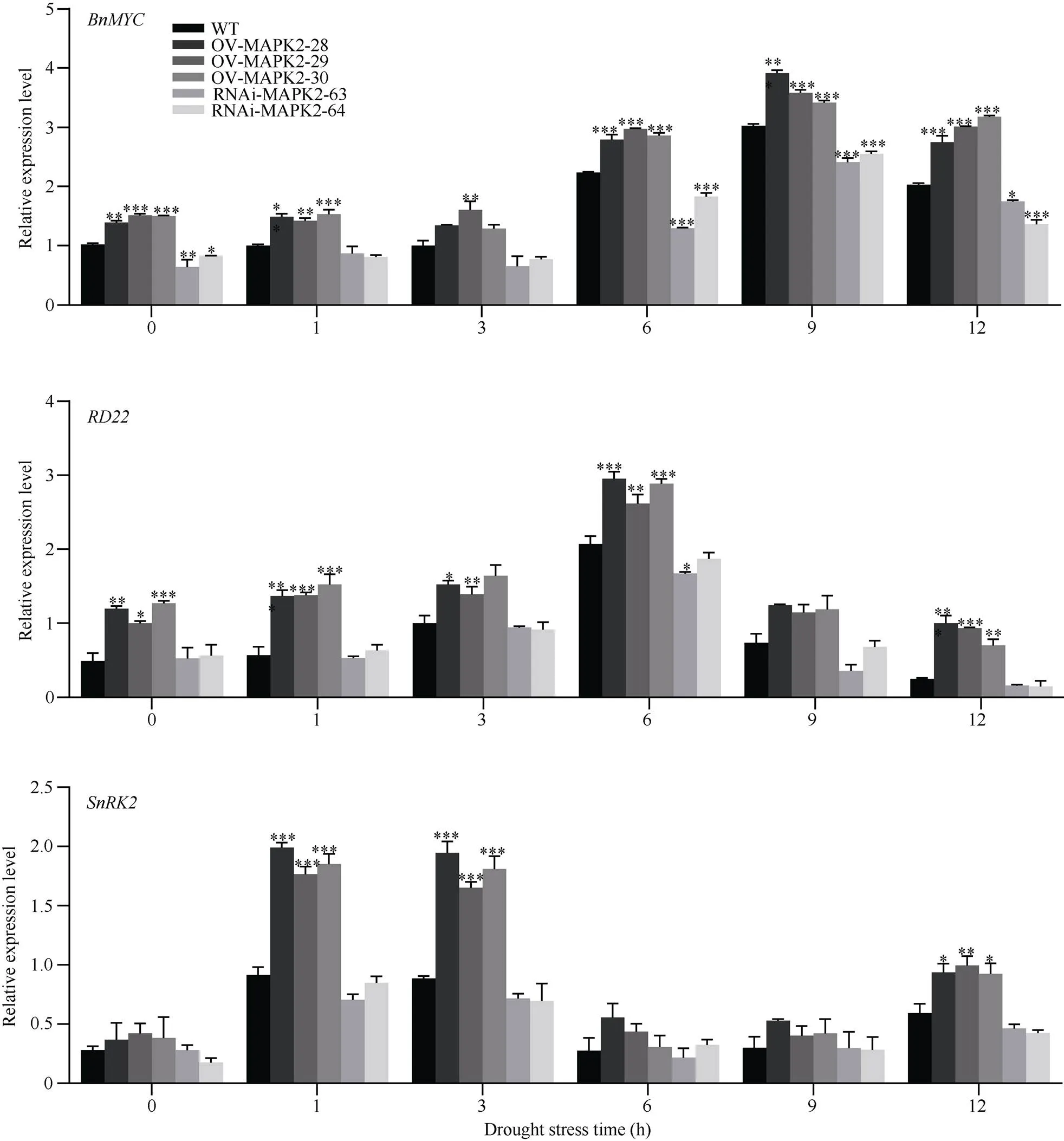
图8 ABA途径相关基因表达模式
数据表示为平均值±SD (= 3)。*、**和***分别表示在0.05、0.01、0.001概率水平差异显著。显著性均指转基因植株与野生型植株之间比较。
Data are presented as mean ± SD (= 3). *, **, and *** indicate significant differences at the 0.05, 0.01, and 0.001 probability levels, respectively. Significance refers to the difference between the transgenic plant and the wild type.
3 讨论
菜籽油是世界上产量丰富的食用油之一, 芥酸和硫代葡萄糖苷含量低。甘蓝型油菜(, 2=38, AACC)结实率较高, 被广泛种植, 其种植面积占我国油菜种植面积80%, 但其耐旱性相对较弱, 易遭旱害[23]。干旱影响了甘蓝型油菜的产量和推广种植, 若能培育抗旱性品种, 不仅能提高油菜产量还能加大我国土地利用率, 为我国农业经济做出贡献。MAPK级联途径是一种信号传导分子, 在植物中MAPK不但参与植物生物学调控机制, 还参与生物和非生物的胁迫应答[24]。本研究利用转基因(OE-MAPK2, RNAi-MAPK2)甘蓝型油菜和Westar (WT)野生型植株, 在干旱条件下进行生理特性和干旱相关基因表达水平的比较, 证明该基因可提高植株的耐旱性, 且发现在模拟干旱条件下在胁迫处理前期基因表达量剧增, 说明该基因在干旱胁迫初期改变相关基因表达来提高植株耐旱性。为了进一步了解耐旱机制, 筛选与BnMAPK2互作并与干旱有关基因, 在干旱条件下检测互作基因以及互作基因参与信号途径有关基因的表达量。研究结果表明,基因在干旱条件下可通过减少植株叶片水分的流失、增加植株叶片中脯氨酸的含量、提高POD活性以及减少植株中丙二醛的积累来提高植株抗旱性, 并且基因能正向调控与干旱相关基因和基因的表达量。脯氨酸作为一种相容的渗透剂, 脯氨酸参与渗透调节、稳定蛋白质和细胞膜的结构, 还是一种自由基清除剂和抗氧化剂[25-26]。脯氨酸还可以调节细胞溶质酸度, 在缓解压力后充当碳和氮储备, 并且可以充当能够激活防御反应的信号分子[27]。有研究表明, 当植株遇到干旱环境, 体内脯氨酸含量会迅速上升, 在抗旱植株中上升率比普通材料高[28], 并且积累的脯氨酸通过减轻组织脱水以及保护细胞膜和酶来增加植株耐旱性[29-31]。在干旱条件下, 植物体内膜脂中饱和脂肪酸的含量会增加而不饱和脂肪酸的含量会下降, 细胞膜流动性发生变化, 膜通透性增大, 丙二醛(MDA)含量增多。随着外界环境胁迫的加剧, 植物细胞膜损伤程度加重, 最终会造成细胞膜结构破坏。研究表明, 抗旱性强的作物品种较抗旱性弱的作物品种细胞膜脂过氧化程度较轻, 体内的丙二醛含量增加幅度也较小。在干旱胁迫下植物体内会发生氧化应激反应, 产生多种自由基(Reactive Oxygen Species, ROS)如: HO2–、OH–、O2–等, 这些活性氧会被植物体产生的抗氧化剂和抗氧化酶清除。因此, 编码抗氧化剂和抗氧化酶的基因在植物受到逆境时会表达上调[32]。植物体内抗氧化酶系统的相关基因过表达, 可提高植物的抗氧化能力, 以此增加植株耐旱性; 有研究发现, 随着植物体内抗氧化酶相关基因表达量或者POD、SOD、CAT含量越多, 植物抗旱性越强[33]。(Δ1-Pyrroline-5-Carboxylate Synthase)基因是植物渗透调节相关基因, 编码植物体内脯氨酸合成关键酶基因,通过反馈抑制和转录调控来调节脯氨酸的生物合成[34], 在干旱、盐分和寒冷胁迫条件下表达增加, 导致植物细胞积累大量脯氨酸, 以减少胁迫对植株损害。对大麦、水稻和其他植物的研究表明, 在干旱和盐胁迫条件下,基因的表达和活性水平上调, 从而增加了脯氨酸含量[35-37]。(Sumo Conjugation Enzyme,)是一种通过翻译后水平调节蛋白质功能的蛋白, 编码SUMO (小泛素样修饰剂)连接酶, 该连接酶引导小蛋白SUMO通过异肽键连接到目标蛋白[38]并加以修饰。在各种防御机制中, SUMO途径被认为是最重要的, 因为受此途径调节的几种核蛋白参与多种细胞功能, 例如对压力的反应、转录、翻译、RNA代谢、能量新陈代谢、修复受损DNA、确保基因组稳定性和核运输[39]。一般而言, SUMO途径有其自己特定的一组酶E1、E2和E3。SUMO结合酶SCE1 (E2)是该途径中非常重要的成员, 即使没有E3的参与, 它也可以将SUMO转移到其靶蛋白上[40]。这种酶定位于细胞核, 这种蛋白质水平降低的植物在根生长抑制试验中对ABA表现出更高的敏感性。有研究者发现,过表达可能通过调节转基因植物中的泛素化修饰水平、抗氧化能力和干旱响应基因表达来提高耐旱性[41]。此外,基因的过表达改变了转基因水稻植物的生物量和谷物产量参数。基因在转基因水稻植物中的过表达增强了干旱胁迫耐受性。相反,转基因水稻植株对干旱胁迫高度敏感[42]。由此推测通过增加和的表达量, 促进植物体内脯氨酸的合成和泛素化修饰水平,通过调控植株体内渗透能力、叶片含水量、细胞膜和蛋白质结构稳定性、清除自由基降低膜脂过氧化来增加植株耐旱性。
为进一步了解耐旱机制, 本研究前期对互作蛋白做了筛选, 从互作蛋白中挑选与干旱相关基因和, 结果显示可正调控和负调控。基因(Cinnamoyl coA: NADP oxidoreductase-like 1)编码肉桂酰辅酶A, 属于NADP氧化还原酶。有研究表明ABA、干旱和热激对有很强的诱导作用, 在种子中有很高的表达水平[43]。如, 最近研究表明,作为一种PA (phaseic acid)还原酶, PA是ABA的主要分解代谢物, 在结构上与ABA相关, 并具有类ABA激素活性, 通过调节拟南芥中的PA稳态而在ABA响应和干旱耐受性中发挥作用[44]。()属于DEA (D/H)-box RNA helicase家族, 它以依赖ATP的方式, 催化能量稳定的双链RNA二级结构的解链, 从而在多种生物过程中发挥作用, 包括转录、RNA剪接、运输和翻译[45]。有研究报道,的转录水平在冷胁迫下显著上调, 而它们的转录水平在盐胁迫或干旱胁迫下下调;突变体对干旱、盐、热胁迫表现出耐受性增强, 因此被命名为应激反应抑制基因[46]。另有研究证明, 在胁迫条件下,可抑制依赖ABA和不依赖ABA信号转导途径相关转录因子的激活, 参与植物多种胁迫反应[22]。互作蛋白相关基因都参与ABA途径提高植株的抗旱性, 并且有研究者提出通过依赖ABA信号途径提高植株对非生物胁迫抵御能力的模型图[44]。因此本研究参照Kant等[22]研究, 在干旱胁迫条件下检测OE-、RNAi-和WT植株中STRS2-ABA途径中相关基因的表达量, 分别是以及。是由ABA诱导的脱水基因[47], 并且需要蛋白质生物合成来表达ABA依赖性基因, MYC和MYB的识别位点位于RD22启动子的67 bp区域。有研究证明, 在干旱条件下, MYC和MYB蛋白都在基因响应植株脱水和ABA诱导表达中充当转录激活因子[47]。蔗糖非发酵(SNF1)相关蛋白激酶是一组在多种生理活动中发挥作用的蛋白激酶, 可以通过磷酸化下游蛋白质羟基, 诱导ABA信号转导途径中相关基因表达, 广泛参与植物抵抗逆境过程[48]。本研究结果显示这些基因在OE-植株中的表达水平趋势和在突变体植株中一样。有研究表明, ABA可减少基因的表达量, 以此增加ABA信号途径中相关基因的表达, 增加植株的抗旱性[22]。在本研究中,干旱胁迫条件下,基因在OE-植株中表达量下调。因此推测基因与基因互作, 可使基因表达量下调, 通过依赖STRS2-ABA信号途径, 促进ABA信号途径中耐旱性相关基因的表达, 以此增加植株的耐旱性。
根据干旱作用机理, 干旱相关基因可以分为两大类: 一类是功能基因, 其基因表达与植株抵御胁迫能力直接相关, 如参与渗透保护物质合成的关键酶基因、活性氧清除物质及保护酶合成相关基因, 以及各种蛋白酶基因等; 另一类是调节基因, 可通过调控多种抗旱相关信号转导途径, 增加植株耐旱性, 如多种胁迫相关转录因子、蛋白磷酸酶基因、蛋白激酶基因等[49]。由此推测,可通过调控两类干旱相关基因的表达, 增加植株耐旱性。一类是功能基因和, 通过调控功能基因表达, 调节植株体内渗透能力、叶片含水量、细胞膜和蛋白质结构稳定性以及清除自由基来降低膜脂过氧化程度增加植株抗旱性; 还有一类是调节基因和, 通过与调节基因互作参与ABA信号途径, 促进耐旱性相关基因的表达来增加植株耐旱性。虽有研究证明基因参与ABA信号途径, 但具体调控路径还未有人报道, 所以本研究只研究了STRS2-ABA信号途径中相关基因的表达量, 关于基因与互作怎样调控植株干旱胁迫还有待进一步研究。
4 结论
能响应干旱胁迫, 在干旱处理3 h表达量达到最大, 12 h该基因的表达量下降到与未处理时接近。可通过增加功能基因(脯氨酸合成关键酶基因)和(SUMO连接酶)基因的表达, 促进植物体内脯氨酸的合成和泛素化修饰水平通过调控植株体内渗透能力、叶片含水量、细胞膜和蛋白质结构稳定性、清除自由基降低膜脂过氧化来增加植株耐旱性。基因还可以通过与应激反应负调控因子(DEAD-box RNA helicases)互作, 使基因表达量下调, 介导STRS2-ABA信号途径, 促进ABA信号途径中与干旱相关基因的表达, 以此增加植株的抗旱性。
[1] 王汉中. 我国油菜产需形势分析及产业发展对策. 中国油料作物学报, 2007, 29: 101–105. Wang H Z. Analysis of my country’s rapeseed production and demand situation and industrial development countermeasures., 2007, 29: 101–105 (in Chinese with English abstract).
[2] 杨春杰, 张学昆, 邹崇顺, 程勇, 郑普英, 李桂英. PEG-6000模拟干旱胁迫对不同甘蓝型油菜品种萌发和幼苗生长的影响. 中国油料作物学报, 2007, 29: 425–430. Yang C J, Zhang X K, Zou C S, Cheng Y, Zheng P Y, Li G Y. Effects of PEG-6000 simulated drought stress on germination and seedling growth of differentvarieties., 2007, 29: 425–430 (in Chinese with English abstract).
[3] 伊淑丽. 高温对不同基因型甘蓝型油菜影响的生理生化机理研究. 西南大学博士学位论文, 重庆, 2008.Yi S L. Physiological and Biochemical Mechanisms of the Effects of High Temperature on Different Genotypes of. PhD Dissertation of Southwest University, Chongqing, China, 2008 (in Chinese with English abstract).
[4] Xu J, Zhang S. Mitogen-activated protein kinase cascades in signaling plant growth and development.2015, 20: 56–64.
[5] Danquah A, Zelicourt A D, Colcombet J, Hirt H. The role of ABA and MAPK signaling pathways in plant abiotic stress responses., 2014, 32: 40–52.
[6] Hamel L P, Nicole M C, Sritubtim S, Morency M J, Ellis M, Ehlting J, Beaudoin N, Barbazuk B, Dan K, Lee J. Ancient signals: comparative genomics of plant MAPK and MAPKK gene families., 2006, 11: 192–198.
[7] Kumar K, Raina S K, Sultan S M. Arabidopsis MAPK signaling pathways and their cross talks in abiotic stress response., 2020, 29: 1–15.
[8] Mahmood T, Khalid S, Abdullah M, Ahmed Z, Shah M K N, Ghafoor A, Du X. Insights into drought stress signaling in plants and the molecular genetic basis of cotton drought tolerance., 2019, 9: 105.
[9] Kovtun Y, Chiu W L, Tena G, Sheen J. Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in plants., 2000, 97: 2940–2945.
[10] Du X, Jin Z, Zhang L, Liu X, Yang G, Pei Y. H2S is involved in ABA-mediated stomatal movement through MPK4 to alleviate drought stress in., 2019, 435: 295–307.
[11] 王伟威, 林浩, 唐晓飞, 魏崃, 董兴月, 吴广锡, 刘丽君. 干旱胁迫下大豆相关基因的表达特性. 分子植物育种, 2014, 12: 903–908. Wang W W, Lin H, Tang X F, Wei L, Dong X Y, Wu G X, Liu L J. Expression characteristics of soybean-related genes under drought stress., 2014, 12: 903–908 (in Chinese with English abstract).
[12] 潘月云, 朱寿松, 张银东, 陈银华. 木薯促分裂原激活蛋白激酶基因的克隆和功能分析. 分子植物育种, 2019, 17: 1112–1120. Pan Y Y, Zhu S S, Zhang Y D, Chen Y H. Cloning and functional analysis of cassava mitogen-activated protein kinasegene., 2019, 17: 1112–1120 (in Chinese with English abstract)
[13] Ortiz-Masia D, Perez-Amador M A, Carbonell P, Aniento F, Carbonell J, Marcote M J. Characterization of, the first C1 subgroup MAP kinase from pea (L.)., 2008, 227: 1333–1342.
[14] Agrawal G K, Rakwal R, Iwahashi H. Isolation of novel rice (L.) multiple stress responsive MAP kinase gene,, whose mRNA accumulates rapidly in response to environmental cues., 2002, 294: 1009–1016.
[15] 陆俊杏. 甘蓝型油菜及其亲本物种白菜和甘蓝MAPK C组基因家族的克隆及甘蓝型油菜MAPK1的功能鉴定. 西南大学博士学位论文, 重庆, 2013.Lu J X. Cloning ofand Its Parent Species Chinese Cabbage andMAPK Group C Gene Family and Functional Identification ofMAPK1. PhD Dissertation of Southwest University, Chongqing, China, 2013 (in Chinese with English abstract).
[16] Wang Z, Wan Y Y, Meng X J, Zhang X L, Yao M N, Miu W J, Zhu D M, Yuan D S, Lu K, Li J N, Qu C M, Liang Y. Genome-wide identification and analysis of MKK and MAPK gene families inspecies and response to stress in., 2021, 22: 544.
[17] 袁大双, 邓琬玉, 王珍, 彭茜, 张晓莉, 姚梦楠, 缪文杰, 朱冬鸣, 李加纳, 梁颖. 甘蓝型油菜基因的克隆及功能分析. 作物学报, 2022, 48: 840–850. Yuan D S, Deng W Y, Wang Z, Pen Q, Zhang X L, Yao M N, Miu W J, Zhu D M, Li J N, Liang Y. Cloning and functional analysis ofgene in., 2022, 48: 840–850 (in Chinese with English abstract).
[18] Wang Y, Wu W H. Potassium transport and signaling in higher plants., 2013, 64: 451–476.
[19] 康雯. 土壤自然失水胁迫对地锦幼苗生理生化特性的影响. 东北林业大学硕士学位论文, 黑龙江哈尔滨, 2010. Kang W. Effect of Soil Natural Water Stress on Physiological and Biochemical Indexes inSeedling. Ms Thesis of Northeast Forestry University, Harbin, Heilongjiang, China, 2010 (in Chinese with English abstract).
[20] 张治安, 张美善, 蔚荣海. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 2004. pp 265–296. Zhang Z A, Zhang M S, Wei R H. Plant Physiology Experiment Guide. Beijing: China Agricultural Science and Technology Press, 2004. pp 265–296 (in Chinese with English abstract).
[21] 宗学凤, 王三根. 植物生理研究技术. 重庆: 西南师范大学出版社, 2011. Zong X F, Wang S G. Plant Physiology Research Technology. Chongqing: Southwest Normal University Press, 2011 (in Chinese).
[22] Kant P, Kant S, Gordon M, Shaked R, Barak S. Stress response suppressor 1 and stress response suppressor 2, two DEAD-Box RNA helicases that attenuateresponses to multiple abiotic stresses., 2007, 145: 814–830.
[23] Prakash S, Wu X, Bhat S R. History, evolution and domestication ofcrops., 2012, 35: 19–84.
[24] 朱斌, 陆俊杏, 彭茜, 翁昌梅, 王淑文, 余浩, 李加纳, 卢坤, 梁颖. 甘蓝型油菜MAPK7基因家族及其启动子的克隆与表达分析. 作物学报, 2013, 39: 789–805. Zhu B, Lu J X, Peng Q, Weng C M, Wang S W, Yu H, Li J N, Lu K, Liang Y. Cloning and expression analysis ofgene family and its promoter in, 2013, 39: 789–805 (in Chinese with English abstract).
[25] Szabados L, Savouré A. Proline: a multifunctional amino acid., 2010, 15: 89–97.
[26] Kishor P, Hong Z, Miao G H, Hu C, Verma D. Overexpression of [delta]-pyrroline-5-carboxylate synthetase increases proline production and confers osmotolerance in transgenic plants., 1995, 108: 1387–1394.
[27] Hare P D, Cress W A. Metabolic implications of stress-induced proline accumulation in plants., 1997, 21: 79–102.
[28] Bandurska H, Niedziela J, Pietrowska-Borek M, Nuc K, Chadzinikolau T, Radzikowska D. Regulation of proline biosynthesis and resistance to drought stress in two barley (L.) genotypes of different origin.2017, 118: 427–437.
[29] Sharma P, Dubey R S. Ascorbate peroxidase from rice seedlings: properties of enzyme isoforms, effects of stresses and protective roles of osmolytes., 2004, 167: 541–550.
[30] Türkan I, Bor M, Ozdemir F, Koca H. Differential responses of lipid peroxidation and antioxidants in the leaves of drought- tolerantGray and drought-sensitiveL. subjected to polyethylene glycol mediated water stress., 2005, 168: 223–231.
[31] Per T S, Khan N A, Reddy P S, Masood A, Hasanuzzaman M, Khan M I R, Anjum N A. Approaches in modulating proline metabolism in plants for salt and drought stress tolerance: phytohormones, mineral nutrients and transgenics., 2017, 115: 126–140
[32] Chaves M M, Oliveira M M. Mechanisms underlying plant resilience to water deficits: prospects for water-saving agriculture., 2004, 407: 2365–2384.
[33] Mittler R. Oxidative stress, antioxidants and stress tolerance., 2002, 7: 405–410.
[34] Zhang C S, Lu Q, Verma D P. Removal of feedback inhibition of delta 1-pyrroline-5-carboxylate synthetase, a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants., 1995, 270: 20491–20496.
[35] Bandurska H. Does proline accumulated in leaves of water deficit stressed barley plants confine cell membrane injuries? II: Proline accumulation during hardening and its involvement in reducing membrane injuries in leaves subjected to severe osmotic stress., 2001, 23: 483–490.
[36] Parida A K, Dagaonkar V S, Phalak M S, Aurangabadkar L P. Differential responses of the enzymes involved in proline biosynthesis and degradation in drought tolerant and sensitive cotton genotypes during drought stress and recovery.2008, 30: 619–627.
[37] Chakraborty K, Sairam R K, Bhattacharya R C. Salinity-induced expression of pyrrolline-5-carboxylate synthetase determine salinity tolerance inspp.2012, 34: 1935–1941.
[38] Pichler A, Fatouros C, Lee H, Eisenhardt N. SUMO conjugation: a mechanistic view., 2017, 8: 13–36.
[39] Eisenhardt N, Ilic D, Nagamalleswari E, Pichler A. Biochemical characterization of SUMO-conjugating enzymes bysumoylation assays.. 2019, 618: 167–185.
[40] Ghimire S, Tang X, Liu W, Fu X, Zhang H, Zhang N, Si H. SUMO conjugating enzyme: a vital player of SUMO pathway in plants.2021, 27: 2421–2431.
[41] Wang H, Wang M, Xia Z. Overexpression of a maize SUMO conjugating enzyme gene () increases sumoylation levels and enhances salt and drought tolerance in transgenic tobacco., 2019, 281: 113–121.
[42] Joo J, Choi D H, Lee Y H, Seo H S, Song S. The rice SUMO conjugating enzymesandhave opposing effects on drought stress., 2019, 240: 152993.
[43] Stergaard L, Lauvergeat V V, Naested H, Mattsson O, Mundy J. Two differentially regulatedgenes define a new branch of the DFR superfamily., 2001, 160: 463–472.
[44] Yin X, Bai YL, Ye T, Yu M, Wu Y, Feng Y Q. Cinnamoyl coA: NADP oxidoreductase-like 1 regulates abscisic acid response by modulating phaseic acid homeostasis in., 2022, 73: 860–872.
[45] Schmid S R, Linder P. D-E-A-D protein family of putative RNA helicases., 1992, 6: 283–291.
[46] Kim J S, Kim K A, Oh T R, Park C M, Kang H. Functional characterization of DEAD-box RNA helicases inunder abiotic stress conditions., 2008, 49: 1563–1571.
[47] Abe H, Yamaguchi-Shinozaki K, Urao T, Iwasaki T, Hosokawa D, Shinozaki K. Role ofMYC and MYB homologs in drought- and abscisic acid-regulated gene expression., 1997, 9: 1859–1868.
[48] Huai J, Wang M, He J, Zheng J, Dong Z, Lv H, Zhao J, Wang G. Cloning and characterization of thegene family from., 2008, 27: 1861–1868.
[49] 沈元月, 黄丛林, 张秀海, 曹鸣庆. 植物抗旱的分子机制研究. 中国生态农业学报, 2002, 10: 30–34. Shen Y Y, Huang C L, Zhang X H, Cao M Q. Molecular mechanism of plant drought resistance., 2002, 10: 30–34 (in Chinese with English abstract).
Effects ofon drought tolerance in
YUAN Da-Shuang1,2,3, ZHANG Xiao-Li1,2, ZHU Dong-Ming1,2, YANG You-Hong1,2, YAO Meng-Nan1,2, and LIANG Ying1,2,*
1College of Agronomy and Biotechnology, Southwest University / Chongqing Engineering Research Center for Rapeseed, Chongqing 400715, China;2Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China;3Natural Resources Bureau of Liuzhi Special Economic Zone, Liupanshui City, Guizhou Province, Liupanshui 553400, Guizhou, China
The mitogen-activated protein kinase (MAPK) cascade is involved in various biotic and abiotic stress responses in plants.belongs to the most downstream C-family genes in the MAPK cascade pathway. In this study,overexpression (OE-MAPK2) and RNA interference expression (RNAi-MAPK2) transgenicwere successfully obtained. Under drought conditions, the drought tolerance of OE-MAPK2 plants was increased, and the drought tolerance of RNAi-MAPK2 plants was decreased. The related physiological indicators showed that under drought stresscould slow down the degree of leaf dehydration, promote the accumulation of proline in plants, reduce the content of malondialdehyde, and increase the activity of POD at the later stage of drought. We compared the differences in the relative expression levels between transgenic and wild-type plants in the drought-related genes (,),-interacting drought-related genes (,), and-dependent ABA signaling pathway-related genes (,,). The results showed thatpositively regulated the relative expression levels of,,,,, and, negatively regulated the relative expression levels of, and the relative expression trends of genes related to STRS2-dependent ABA signaling pathway in OE-MAPK2 plants andmutants were consistent. Therefore, it was speculated thatcan increase plant drought tolerance by regulating thepermeability, leaf water content, cell membrane and protein structure stability, scavenging free radicals, and reducing membrane lipid peroxidation, which can also negatively regulateby interacting with. The relative expression of the genes mediated the-dependent ABA signaling pathway and increased the drought tolerance of plants. This study lays a foundation for further elucidating the anti-stress mechanism ofgene.
;; drought tolerance; qRT-PCR
10.3724/SP.J.1006.2023.24153
本研究由国家自然科学基金项目(31872876)资助。
This study was supported by the National Natural Science Foundation of China (31872876).
梁颖, E-mail: yliang@swu.edu.cn
E-mail: 1967548139@qq.com
2022-07-01;
2022-10-10;
2022-10-26.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20221025.1337.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
