基于HPLC指纹图谱及多指标成分测定结合化学计量学的不同商品规格山慈菇质量差异分析
2023-03-21郝壮壮曹宇欣刘朦朦薛静文芦艺凡范文昕王春国石晋丽
郝壮壮,曹宇欣#,刘朦朦,薛静文,张 鸽,芦艺凡,范文昕,周 莹,冯 靓,王春国,石晋丽
基于HPLC指纹图谱及多指标成分测定结合化学计量学的不同商品规格山慈菇质量差异分析
郝壮壮1,曹宇欣1#,刘朦朦1,薛静文1,张 鸽1,芦艺凡1,范文昕1,周 莹3,冯 靓4,王春国2*,石晋丽1*
1. 北京中医药大学中药学院,北京 102488 2. 北京中医药大学中医药研究院,北京 102488 3. 北京市朝阳区高碑店社区卫生服务中心,北京 100124 4. 北京市朝阳区望京社区卫生服务中心,北京 100102
建立山慈菇的HPLC指纹图谱,对其特征成分进行含量测定并结合化学计量学分析方法分析不同商品规格山慈菇(冰球子、毛慈菇)化学成分的差异,为山慈菇药材的质量控制提供参考。优化山慈菇药材的提取方法,应用HPLC法分别建立冰球子和毛慈菇指纹图谱,并对特征成分进行含量测定。采用相似度评价、聚类分析(cluster analysis,CA)、主成分分析(principalcomponent analysis,PCA)、正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)、Fisher线性判别分析(fisher linear discrimination analysis,FLDA)对特征成分进行数据分析。建立了冰球子和毛慈菇HPLC指纹图谱,分别匹配了46个和43个共有峰,共标示出17个色谱峰,指认出天麻素、loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽8个色谱峰并同时建立了上述除天麻素以外7个成分的HPLC含量测定方法。CA与PCA结果可将2种不同商品规格山慈菇样品明显区分。OPLS-DA分析结合含量测定Fisher判别分析结果表明,2种不同商品规格的山慈菇样品间存在显著性差异的5种成分是loroglossin、dactylorhin A、白芨苷、白芨联菲B、卷瓣兰蒽(<0.001)。所建立的HPLC指纹图谱结合CA、PCA、OPLS-DA分析及多成分含量测定能客观、全面、有效地确定不同商品规格山慈菇中主要成分的差异,可为山慈菇质量评价体系的完善提供依据。
山慈菇;HPLC指纹图谱;天麻素;loroglossin;dactylorhin A;白芨苷;山药素III;白芨联菲A;白芨联菲B;卷瓣兰蒽;化学计量学;质量评价
山慈菇来源于兰科植物杜鹃兰(D. Don) Makino、独蒜兰(Franch.) Rolfe或云南独蒜兰Rolfe的干燥假鳞茎,前者习称“毛慈菇”,后二者习称“冰球子”[1]。具有清热解毒、消痈散结[2]的功效。现代研究表明,山慈菇主要含有糖苷类、菲类、联苄类、多糖类及其他种类化学成分[3-10],具有抗肿瘤[11]、抗菌[12]、抑制血管生成[13]和抗氧化[14]等药理活性,常用于治疗肝癌[15]、肺癌[16]和乳腺癌[17]等恶性肿瘤。其中糖苷类成分如天麻素[18]、白芨苷[19]等,菲类和联苄类成分如山药素III[20]、白芨联菲A[21]等均具有良好的生物活性。
目前市场上山慈菇药材质量参差不齐,价格差异悬殊,分为“冰球子”和“毛慈菇”2种商品规格,二者分别来源于独蒜兰属和杜鹃兰属,形态差异明显,可能存在内在成分差异。“冰球子”的价格常在1400~2800元/kg,而“毛慈菇”则在400~1600元/kg。《中国药典》2020年版只包含性状鉴别、显微鉴别及检查项,至今未见特征图谱和含量测定项。近年来,有学者对山慈菇进行了指纹图谱研究并结合含量测定评价药材质量[22-27],如采用HPLC法建立了山慈菇药材指纹图谱,对dactylorhin A、白芨苷和秋水仙碱进行了含量测定。但目前已建立的山慈菇指纹图谱仅针对单一商品规格或药材基原不明确,对不同商品规格山慈菇之间的内在成分差异研究未见报道;分离峰的数目较少,指认出的特征峰不够全面。且仅以少数成分作为山慈菇含量测定指标,较难客观全面地评价其质量,山慈菇质量评价研究总体不够深入。
本研究以冰球子和毛慈菇2种商品规格的山慈菇样品为研究对象,收集了多个主要产地的多批冰球子和毛慈菇样本,拟建立不同商品规格山慈菇药材的HPLC指纹图谱。基于前期质谱研究锁定了多类化学成分(糖苷类、2-异丁基苹果酸酯类、2-异丁基酒石酸酯类、联苄类、菲类)中的代表成分,拟同时对多种成分进行定量分析,并结合聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)等化学计量学分析方法,筛选不同商品规格山慈菇药材的差异成分,从化学成分的角度阐明两者的质量特征,以期为山慈菇药材质量控制体系的完善提供依据,为挖掘潜在的山慈菇质量标志物提供参考。
1 材料与仪器
1.1 材料
对照品天麻素(批号A0138)、dactylorhin A(批号A1379)、白芨苷(批号A1378)、山药素III(批号A1260)、白芨联菲A(批号A1267)、白芨联菲B(批号A1299)、卷瓣兰蒽(批号A1301)均购自成都曼思特生物科技有限公司;loroglossin(批号PCS55129)购自成都植标化纯生物技术有限公司。所用对照品质量分数均≥98%;乙腈(色谱纯,美国飞世尔试剂公司),娃哈哈纯净水,其余均为分析纯。
26批山慈菇样品分别取自于贵州、云南、四川、广西各地,详细信息见表1,经北京中医药大学中药鉴定学科石晋丽教授鉴定为兰科植物杜鹃兰(D. Don) Makino、独蒜兰(Franch.) Rolfe和云南独蒜兰Rolfe的干燥假鳞茎。
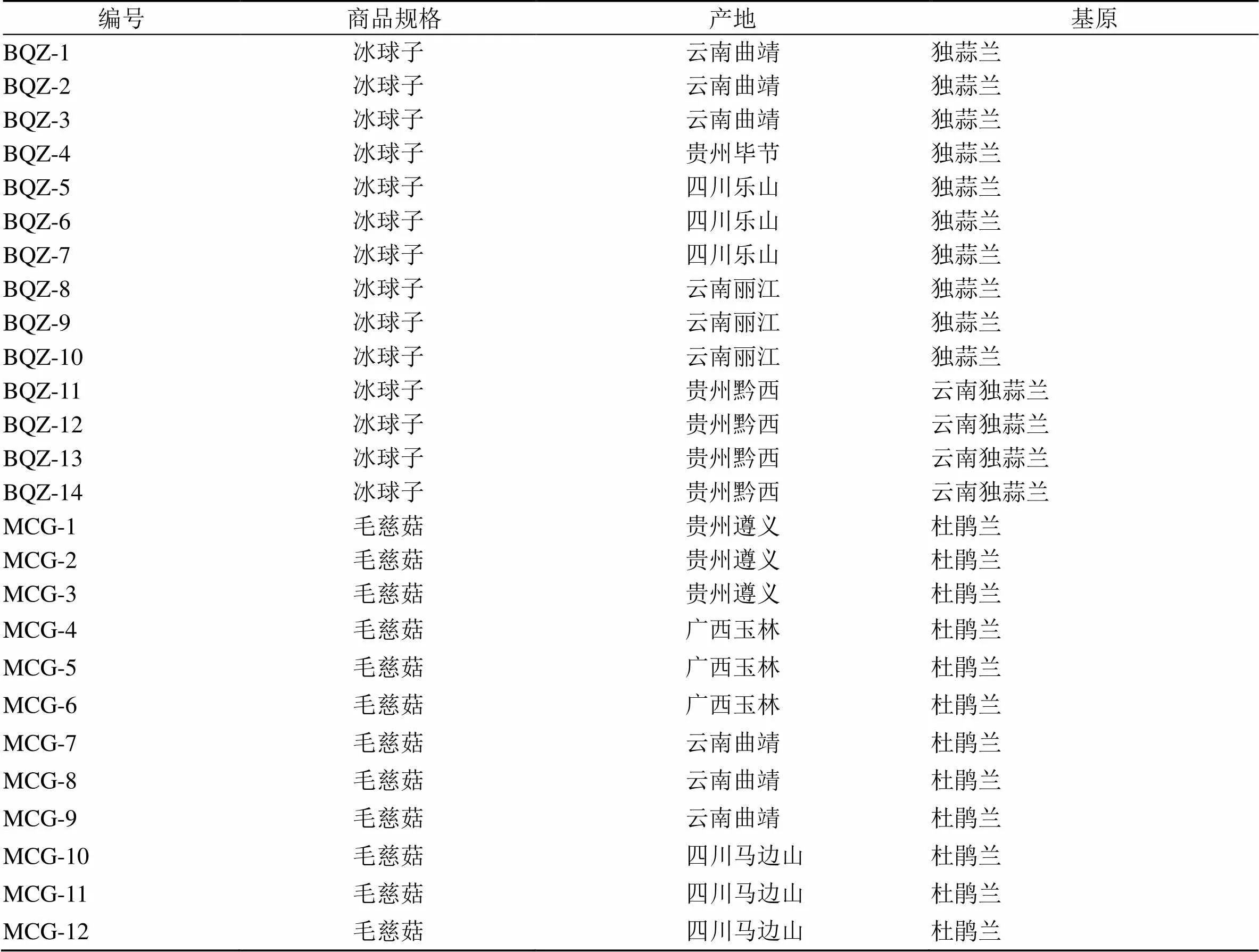
表1 26批山慈菇样品来源信息
1.2 仪器
岛津LC-20A型高效液相(日本岛津公司);Zorbax SB-C18(250 mm×4.6 mm,5 μm)色谱柱(美国安捷伦公司);ME155DU型精密电子天平(十万分之一,美国梅特勒-托利多公司);KQ-500DV型数控超声波清洗器(昆山市超声仪器有限公司);600Y型高速多功能粉碎机(浙江西厨有限公司);HH-8型数显恒温水浴锅(常州越新仪器制造有限公司);FD-1A-50型冷冻干燥机(北京博医康仪器有限公司),RE-52AA型旋转蒸发仪(上海亚荣生化厂)。
2 方法与结果
2.1 提取方法考察
2.1.1 超声提取 精密称取山慈菇样品MCG-1粉末(60目筛)2 g,精密称定,置于具塞锥形瓶中,加入10倍量70%乙醇,超声(功率1000 W、频率40 Hz)处理60 min,连续超声2次,静置,滤过,合并滤液。减压浓缩后,于冷冻干燥机中干燥至恒定质量,得山慈菇70%乙醇超声提取物干膏(C1~C3)。
2.1.2 回流提取 精密称取山慈菇样品MCG-1粉末(60目筛)2 g,精密称定,置于圆底烧瓶中,加入10倍量70%乙醇加热回流提取,每次60 min,连续提取2次,静置,滤过,合并滤液。减压浓缩后,于冷冻干燥机中干燥至恒定质量,得山慈菇70%乙醇回流提取物干膏(H1~H3)。
2.1.3 超声联合回流提取 精密称取山慈菇样品 MCG-1粉末(60目筛)2 g,精密称定,置于具塞锥形瓶中,加入10倍量70%乙醇,超声(功率1 000 W、频率40 Hz)处理60 min,静置,滤过,残渣再用10倍量70%乙醇加热回流提取60 min,静置,滤过,合并滤液。减压浓缩后,于冷冻干燥机中干燥至恒定质量,得山慈菇70%乙醇超声联合回流提取物干膏(CH1~CH3)。
参考杨红燕等[24]在HPLC指纹图谱中应用的提取方法,考察不同提取方式对山慈菇药材提取率的影响。单因素方差分析结果表明回流提取和超声结合回流提取明显优于超声提取(<0.05),但回流提取和超声结合回流提取没有统计学差异(>0.05),故选择回流提取为山慈菇提取方式,结果见表2。

表2 样品不同提取方式下提取率比较
2.2 色谱条件
色谱柱:Zorbax SB-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-水(B);梯度洗脱条件:0~4 min,5% A;4~5 min,5%~20% A;5~35 min,20%~33% A;35~70 min,33%~52% A;70~72 min,52%~95% A;72~80 min,95% A;进样体积10 μL;检测波长200 nm;体积流量1.0 mL/min;柱温30 ℃。
2.3 提取条件优化
取山慈菇样品MCG-1 9份,每份2 g,设定乙醇体积分数(A)、料液比(B)、提取时间(C)及提取次数(D)为试验因素,每个因素设计3个水平,如表3所示。采用L9(34)正交表进行试验,提取方法同“2.1.3”项下内容。
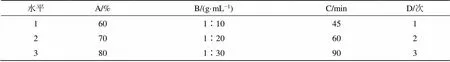
表3 正交试验因素与水平
取各试验所得干膏适量,精密称定,配制成20 mg/mL溶液按按“2.2”项进行HPLC测定,以样品提取率、HPLC色谱图总峰面积为评价指标,通过极差分析得出对2个评价指标的影响因素排序分别为A>B>D>C、A>D>B>C,最佳设计分别为A1B3C2D3、A3B1C3D1,结合双指标综合平衡法得到最佳提取条件为70%乙醇回流提取2次,每次90 min,料液比为1∶20,结果如表4、5。

表4 L9(34)正交试验结果(提取率)

表5 L9(34)正交试验结果(总峰面积)
2.4 溶液的制备
2.4.1 混合对照品溶液的制备 取对照品天麻素、loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽适量,加入60%乙腈配制成质量浓度分别12.40、3.13、8.00、55.56、1.10、16.67、16.67、16.67 µg/mL的混合对照品溶液,保存于4 ℃冰箱备用。
2.4.2 供试品溶液的制备 精密称取山慈菇各样品粉末(60目筛)适量,精密称定,置于圆底烧瓶中,加入20倍量70%乙醇加热回流提取90 min,连续提取2次,静置,滤过,合并滤液,于10 mL量瓶中定容,配成160 mg/mL(以生药量计)溶液,用0.45 μm微孔滤膜滤过,取续滤液,备用。
2.5 毛慈菇与冰球子样品HPLC指纹图谱研究
2.5.1 精密度试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,按“2.2”项分析,连续进样6次,分别计算各共有峰的保留时间与峰面积。结果表明各共有峰保留时间的RSD<0.8%,各共有峰峰面积的RSD<1.9%,表明仪器精密度良好。
2.5.2 重复性试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,按“2.2”项分析,平行进样6次,分别计算各共有峰的保留时间与峰面积,结果表明各共有峰保留时间的RSD<0.35%,各共有峰峰面积的RSD<1.93%,表明本方法重复性良好。
2.5.3 稳定性试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,分别于0、2、4、8、12、24 h进样,按“2.2”项分析,计算各共有峰的保留时间及峰面积。结果各共有峰的保留时间的RSD<0.36%,各共有峰的峰面积的RSD<1.9%。表明供试品在24 h内稳定。
2.5.4 指纹图谱的建立及相似度评价 分别称取26批山慈菇样品适量,按“2.4.2”项下条件制备成山慈菇供试品溶液,按“2.2”项分析。将所得的样品数据全谱按不同商品规格分别导入国家药典委员会《中药色谱指纹图谱相似度评价系统(2012版)》软件中,采用中位数法,时间窗口设定为0.1 min,分别选取BQZ-1和MCG-1作为参照图谱,建立各个商品规格山慈菇的指纹图谱,得到冰球子14批样品指纹图谱叠加图、毛慈菇12批样品指纹图谱叠加图及对照图谱,见图1、2。其中冰球子匹配了46个共有峰,毛慈菇匹配了43个共有峰,经与混合对照品的HPLC图进行比较,共指认出天麻素、loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽8个色谱峰,通过与前期质谱研究和文献数据[25-26]比对可确定苹果酸、手参苷、手参苷II、1,4-di(4-β--glucopyrano- syloxybenzyl)-2-benzylmalate diester、shancigusin H、手参苷V、手参苷VI、手参苷IV、手参苷V异构体共9个色谱峰。

图1 14批次冰球子和12批次毛慈菇HPLC指纹图谱

1-苹果酸 2-天麻素 3-loroglossin 4-dactylorhin A 5-手参苷 6-手参苷II 7-白芨苷 8-1,4-di(4-β-D-glucopyranosyl- oxybenzyl)-2-benzylmalate diester 9-shancigusin H 10-手参苷Ⅴ 11-手参苷VI 12-手参苷IV 13-手参苷V 异构体 14-山药素III 15-白芨联菲A 16-白芨联菲B 17-卷瓣兰蒽
利用《中药色谱指纹图谱相似度评价系统(2012版)》,以各商品规格山慈菇对照指纹图谱作为参照图谱,设其相似度为1.000,计算各个商品规格山慈菇的相似度,见表6。14批冰球子指纹图谱相似度为0.986~0.997,12批毛慈菇指纹图谱相似度为0.974~0.997。其中“毛慈菇”只有杜鹃兰一种基原,表明该基原所含化学成分一致性较好,而“冰球子”规格下包括独蒜兰和云南独蒜兰2种基原,但其化学一致性仍然较好,可能是因为独蒜兰和云南独蒜兰属于同属植物,表明独蒜兰属内化学成分差异较小。
2.6 冰球子和毛慈菇的化学模式识别
2.6.1 聚类分析(cluster analysis,CA) 将2种不同商品规格的26批山慈菇样品中16个特征峰(峰2~17)的峰面积为变量(缺失色谱峰峰面积以0计),导入SPSS 21.0软件,采用组间联接和平方Euclidean距离作为分类依据进行系统聚类分析,探讨不同商品规格山慈菇样品成分含量的一致性,结果见图3。当刻度距离为25时,26批山慈菇样品聚为2类:MCG-1~MCG-12号样品聚为第1类,BQZ-1~BQZ-14号样品聚为第2类,表明毛慈菇和冰球子化学成分的含量有明显差异,HPLC指纹图谱结合聚类分析可以初步区分这2种商品规格的山慈菇样品,但不同产地间区分不明显。

表6 山慈菇样品HPLC指纹图谱相似度结果

图3 不同商品规格山慈菇CA分析树状图
2.6.2 主成分分析(principal component analysis,PCA) PCA得分散点图可以直观显示出不同样品之间的整体差异性,反映数据的原始状态,观察到试验样品的自然分布和组别关系。采用SIMCA 14.1软件,对山慈菇样品中16个特征峰峰面积进行PCA分析,通过得分图上样品的聚散程度观察不同商品规格样品间的差异性趋势。山慈菇样品的Scores图和Loading图如图4所示。建立的模型累计模型解释率2cum为0.986,累计模型预测能力为0.796,表明建立的模型可以解释98.6%的原始信息,且2cum和2cum均大于0.5,表明建立的模型良好,稳定可靠。由Scores图可知,2种商品规格药材分别聚集在2个不同的区域,说明两者化学成分存在较大差异,可以得到较好地区分,与聚类结果基本一致。Loading图中成分点距离原点越远表明该成分对样品的差异性贡献越大,通过Loading图可知,对p[1](轴)的影响顺序由大到小依次为峰4、11、8;对p[2](轴)的影响顺序由大到小依次为峰14、15、5。
2.6.3 正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA) 不同于PCA,OPLS-DA是一种有监督的判别分析统计方法,该方法基于OPLS,使分类信息主要集中在主成分上,建立样品类别之间的关系模型,并且使模型易于解释,其判别效果及主成分得分图的可视化效果更加明显。为进一步筛选对不同商品规格山慈菇药材质量影响较大的成分,在PCA基础上将其分为2组,以冰球子和毛慈菇指纹图谱的16个特征峰峰面积为变量,利用SIMCA14.1软件建立OPLS-DA模型。在OPLS-DA得分图(2cum为0.69,2cum为0.973,2cum为0.966)中,14批冰球子及12批毛慈菇可很好地区分为2类,且相较与PCA区分度更大,如图5-a所示,其中BQZ-8、9、10略微离群,可能是产地因素导致。生成的VIP图如图5-b所示。以变量重要性投影值(VIP)>1.0为标准,共筛选出10个差异性标志物,为峰4、8、3、11、7、10、12、17、13、16,分别为dactylorhin A、1,4-di(4-β--glucopyranosyl-oxybenzyl)-2-benzyl- malate diester、loroglossin、手参苷VI、白芨苷、手参苷V、手参苷IV、卷瓣兰蒽、手参苷V 异构体、白芨联菲B,其中dactylorhin A的VIP值最大,说明毛慈菇和冰球子中dactylorhin A的含量差异最显著。为防止模型出现过拟合,通过置换检验200次对模型内部进行验证,结果如图5-c,2、2回归线的截距分别为0.114、−0.51,均小于原始值,证明模型稳定可靠,可用于2种商品规格山慈菇样品的分析。

图4 26批山慈菇PCA (a) 及16种成分PCA载荷图(b)

图5 26批山慈菇OPLS-DA得分图(a)、16个成分VIP图(b) 及OPLS-DA模型置换检验结果(c)
2.7 山慈菇中7种特征成分的HPLC含量测定
山慈菇的化学成分研究较少,目前认为其有效成分主要为菲类、联苄类以及2-异丁基苹果酸酯类成分。根据前期质谱研究结合文献报道[25-26]分析,发现其含量较高的成分主要是2-异丁基苹果酸酯类成分如 dactylorhin A、白芨苷、gymnoside等,2-异丁基酒石酸酯类成分如loroglossin、2-苄基苹果酸酯类成分如1,4-di(4-β--glucopyranosyl- oxybenzyl) 2- benzylmalate diester等,以及菲类成分如白芨联菲A、白芨联菲B、卷瓣兰蒽等,联苄类成分如山药素III等,且冰球子与毛慈菇上述成分含量差异较为明显。本研究为比较山慈菇2种商品规格的化学成分差异,完善山慈菇药材质量评价体系,根据其指纹图谱中的化学成分特征以及可行性,选取loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽7个代表性成分建立含量测定方法。
2.7.1 线性关系考察 精密吸取loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽对照品储备液适量,按倍比稀释的方法稀释成不同质量浓度的对照品溶液。按照“2.2”项下色谱条件进行测定。以峰面积为纵坐标(),质量浓度为横坐标()绘制标准曲线,计算回归方程及相关系数(2),同时进行检测限(/=3)和定量限(/=10)的测定,结果见表7,各成分在质量浓度范围内线性关系良好。

表7 标准曲线回归方程
2.7.2 精密度试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,按“2.2”项分析,连续进样6次,分别计算各待测峰的保留时间与峰面积。结果表明各待测峰保留时间的RSD<0.05%,峰面积的RSD<2.5%,表明仪器精密度良好。
2.7.3 重复性试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,按“2.2”项分析,分别计算各待测峰的保留时间与峰面积,结果表明各待测峰保留时间的RSD<0.1%,峰面积的RSD<2.43%,表明本方法重复性良好。
2.7.4 稳定性试验 取编号为BQZ-1和MCG-1的山慈菇样品,按“2.4.2”项下条件制备供试品溶液,分别于0、2、4、8、16、24 h进样,按“2.2”项分析,计算各待测峰的保留时间及峰面积。结果各待测峰的保留时间的RSD<0.3%,峰面积的RSD<3.0%。表明供试品在24 h内稳定。
2.7.5 加样回收率试验 取编号为BQZ-1和MCG-1的山慈菇样品各6份,每份0.4 g,以近1∶1的比例加入相应化学成分的对照品,于5 mL量瓶中用60%乙腈定容,配制成80 mg/g(以生药量计)的溶液,按“2.2”项分析,分别记录各成分峰的保留时间与峰面积,计算各成分的加标回收率和RSD值。冰球子和毛慈菇的各待测成分平均加样回收率分别为99.20%~103.15%和98.43%~102.25%,RSD分别为0.57%~1.64%和0.52%~1.73%,表明方法的准确度良好。
2.7.6 样品测定 取14批冰球子样品和12批毛慈菇样品,按“2.4.2”项下条件制备供试品溶液,按“2.2”项分析,根据各成分最适宜检测波长,分别在230 nm(loroglossin)、220 nm(dactylorhin A)、224 nm(白芨苷)、270 nm(山药素III、白芨联菲A)、320 nm(白芨联菲B、卷瓣兰蒽)下进行检测,得到待测成分峰面积,计算样品含量,见表8。根据各指标成分含量测定结果柱形图可以明确不同商品规格山慈菇中差异性指标成分,见图6。
2.7.7 Fisher线性判别(fisher linear discrimination analysis,FLDA) 利用SPSS 21.0统计软件的Fisher线性判别分析验证OPLS-DA中VIP大于1.0的5个指标成分作为不同商品规格山慈菇识别的适用性,将BQZ-1、5、8、11及MCG-1、4、7、10号样品设为验证集,其余样品均为训练集。将训练集样本按照商品规格进行分组建模,以loroglossin(a)、dactylorhin A(b)、白芨苷(c)、白芨联菲B(f)、卷瓣兰蒽(g)作为判别变量,建立判别函数(discriminant function,DF),DFBQZ=−43.839+0.030a+0.029b+0.003c+0.758f−2.545g,DFMCG=−53.319+0.153a+0.007b+1.959f−6.595g,组质心处的函数分别为−5.268、5.926,且判别函数的Lambda检验显著性均小于0.05。由训练集样本自身验证及验证集验证,样本总正确判别率均为100%。表明loroglossin、dactylorhin A、白芨苷、白芨联菲B、卷瓣兰蒽可以作为山慈菇商品规格区分的指标成分。
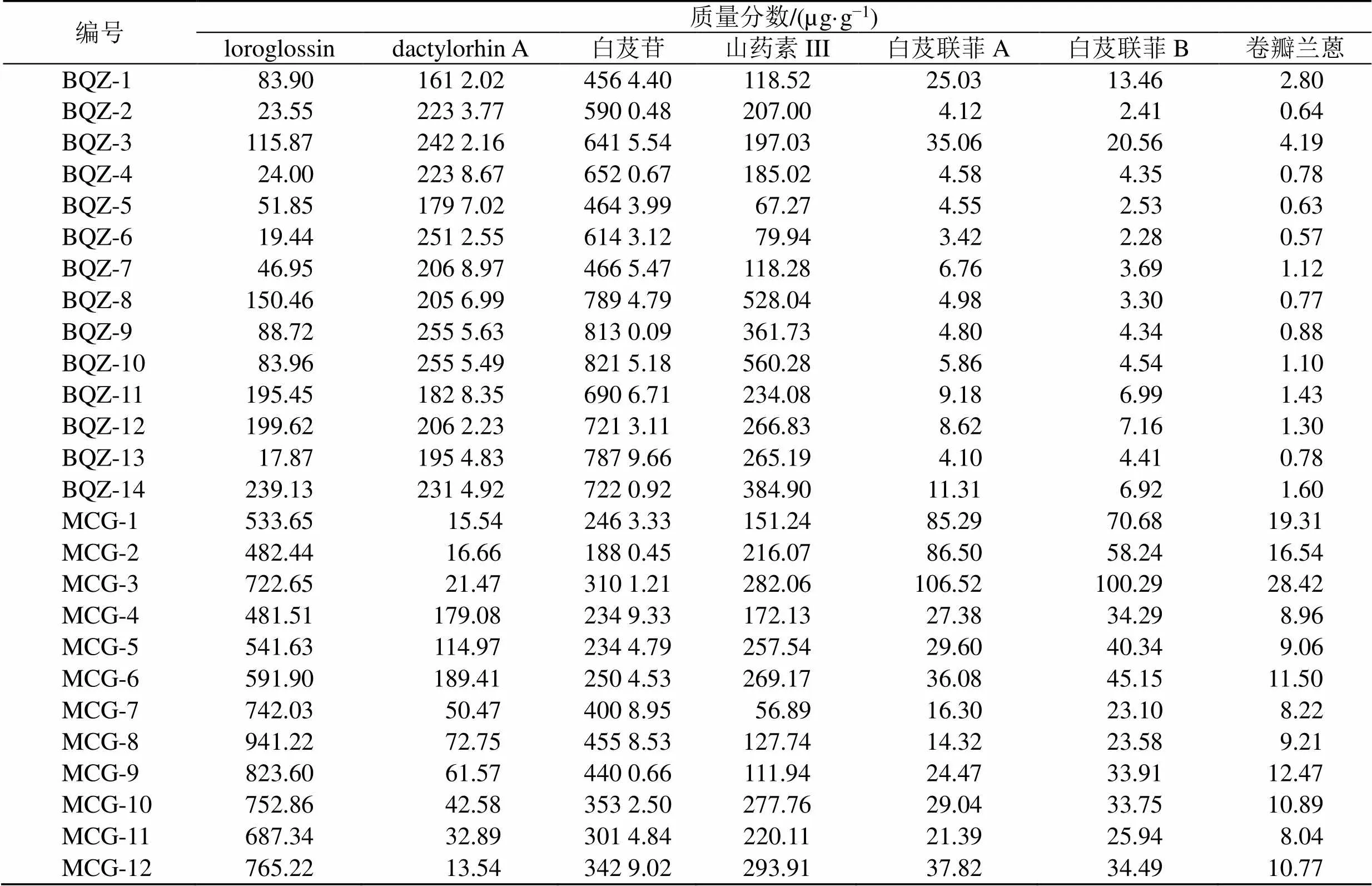
表8 26批山慈菇样品含量测定

A-loroglossin B-dactylorhin A C-白芨苷 D-山药素III E-白芨联菲A F-白芨联菲B G-卷瓣兰蒽 ***P<0.001
3 讨论
3.1 提取方法考察及提取条件优化
本实验考察了提取方法(超声提取、回流提取、超声结合回流提取)对山慈菇药材提取率的影响,并基于正交实验优化了提取条件(乙醇体积分数、料液比、提取时间、提取次数)。文献中山慈菇药材的提取常采用甲醇超声法[25]。本研究前期比较相同比例的甲醇-水、乙醇-水超声提取,发现二者并无明显差异,考虑到山慈菇药材主要的有效成分类型为菲类、联苄类及异丁基苹果酸酯类成分等,而乙醇的极性较甲醇小,对有效成分的提取可能更为完全,且乙醇较甲醇毒性小,故选择乙醇-水作为提取溶剂进行下一步的考察。
本研究通过正交试验双指标综合平衡法,基于提取率和总峰面积2个指标进行极差分析。以提取率为指标评价时,乙醇体积分数对指标的差异贡献最高,其次是料液比、回流次数、回流时间,其中在60%乙醇、1∶30、60 min、3次条件下提取率最高。以总峰面积为评价指标时,乙醇体积分数对指标的差异贡献最高,其次是回流次数、料液比、回流时间,其中在80%乙醇、1∶10、90 min、1次条件下总峰面积最大。综合各因素各水平对两个指标的差异贡献,最终确定最佳提取条件为:70%乙醇为提取溶剂,料液比为1∶20、回流提取2次,每次90 min。
3.2 色谱条件的优化
本研究前期基于杨红燕等[24]研究对HPLC洗脱梯度、柱温、流速进行优化,实验中通过HPLC指认出天麻素、loroglossin、dactylorhin A、白芨苷、山药素III、白芨联菲A、白芨联菲B、卷瓣兰蒽等山慈菇中含量较高的代表性成分,并采用PDA检测器对山慈菇供试品溶液进行190~400 nm全波长扫描,各类成分在190~210 nm吸收均较高,综合基线、峰形及分离度等因素,选取200 nm作为HPLC指纹图谱的检测波长,并选择230 nm(loroglossin)、220 nm(dactylorhin A)、224 nm(白芨苷)、270 nm(山药素III、卷瓣兰蒽)、320 nm(白芨联菲A、白芨联菲B)作为含量测定的专属检测波长,最大程度地减少对成分含量测定的影响。
3.3 指纹图谱及化学计量学分析
本研究采用相似度评价、CA、PCA和OPLS-DA等方法对多批次不同商品规格山慈菇药材指纹图谱进行全面、客观的评价,成功区分了冰球子和毛慈菇并挖掘出二者的差异性成分;利用Fisher线性判别分析验证所选的特征成分作为不同商品规格山慈菇识别指标的适用性,为山慈菇药材的质量评价指标的选择提供了依据。2个商品规格内部指纹图谱的相似度均大于0.9,但不同商品规格间相似度有所区别,表明不同商品规格药材间化学成分存在一定的差异。化学计量学分析结果也可将两者明显区分,其中BQZ-8、BQZ-9、BQZ-10在PCA和OPLS-DA中略有离群,可能是由于这3个产于云南丽江的样品中白芨苷、山药素III含量较其他产地更高,这种含量差异可能与药材生长环境、采收时间等有关。最后从标示出的16个特征峰中以OPLS-DA模型的VIP值大于1进行2种商品规格的差异成分筛选,得到了dactylorhin A、1,4-di(4-β--glucopyrano- syloxybenzyl)-2-benzylmalate diester、loroglossin、手参苷VI、白芨苷、手参苷V、手参苷IV、卷瓣兰蒽、手参苷V 异构体、白芨联菲B10个成分。该结果与PCA载荷图基本一致,说明这些成分可能是不同商品规格山慈菇药材中的差异性指标成分。
3.4 多成分含量测定
迄今为止,山慈菇的质量控制指标性成分暂不明确,质量评价体系尚未完善。因此寻找山慈菇药材中差异性成分并建立相应的含量测定方法对山慈菇质量控制具有非常重要的意义。
本研究收集了山慈菇4个主要产地的26批样品,以不同商品规格分类,选取7个特征性成分同时进行含量测定。经正态分布检验和方差齐性检验,发现白芨苷含量符合正态分布,方差齐,故采用独立样本检验,具有极显著性差异(<0.001);loroglossin、山药素III含量符合正态分布,方差不齐,采用单样本检验,loroglossin具有极显著性差异(<0.001),山药素III有差异趋势,但无显著性(>0.05);dactylorhin A、白芨联菲A、白芨联菲B、卷瓣兰蒽不符合正态分布,采用非参数检验(Mann-Whitney U),结果其均具有极显著性差异(<0.001)。通过Fisher线性判别分析,分别构建了冰球子和毛慈菇的判别函数,由训练集样本自身验证及验证集验证,样本总正确判别率为100%。说明所选的5种有效成分可作为指标成分用于鉴别两种不同商品规格山慈菇样品,为山慈菇真伪鉴别提供了参考。
另外,峰1-苹果酸和峰2-天麻素作为山慈菇中异丁基苹果酸酯类成分的结构单元,也具有一定的研究价值,但是二者极性较大,出峰过早,容易受到溶剂效应的影响,较难在C18柱中对其他小极性特征成分定量的同时兼顾,更好的定量方法有待研究。本研究建立了不同商品规格山慈菇药材的HPLC指纹图谱,指认出山慈菇中17种特征成分峰,并基于除苹果酸以外的16种特征成分的峰面积通过化学计量学分析成功区分了2种不同商品规格的山慈菇样品,通过OPLS-DA模型VIP值筛选出了10个差异性标志物;建立了同时测定7种特征成分的含量测定方法,并结合VIP值最终筛选出5种含量具有极显著差异的差异性标志物(loroglossin、dactylorhin A、白芨苷、白芨联菲B、卷瓣兰蒽),对冰球子与毛慈菇的化学成分差异做出了较为全面的分析。结果表明两者在成分的种类和含量上存在明显的差异。该研究可为不同商品规格山慈菇药材的质量评价提供参考,为山慈菇药材整体质量控制体系的完善提供数据支撑。然而,本研究还存在一些不足:第一,主要探究了不同商品规格药材间的差异性,但从化学计量学分析结果可以看出,不同产地样品间也存在一定差异,但本实验各产地样品批次较少,接下来可收集更多批次不同产地的样品,考察产地因素对其化学成分的影响。第二,手参苷类成分在山慈菇中含量较高,是山慈菇中比较重要的一类化学成分,但由于其对照品不易获得,无法对此类化学成分进行定量分析,后期可通过分离纯化制备此类成分单体,进行深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 34.
[2] 宋·掌禹锡等撰, 尚志钧辑复. 嘉祐本草辑复本 [M]. 北京: 中医古籍出版社, 2009: 73.
[3] 司函瑞, 陈小玲, 付东兴, 等. 山慈菇的化学成分研究 [J]. 特产研究, 2021, 43(6): 136-140.
[4] 原文珂, 覃彬华, 李小平, 等. 山慈菇的化学成分研究 [J]. 中国现代中药, 2017, 19(5): 639-641.
[5] 李小平. 杜鹃兰化学成分研究 [D]. 武汉: 中南民族大学, 2016.
[6] 董海玲, 郭顺星, 王春兰, 等. 山慈菇的化学成分和药理作用研究进展 [J]. 中草药, 2007, 38(11): 1734-1738.
[7] 王超. 独蒜兰乙酸乙酯部位的化学成分研究 [D]. 北京: 北京协和医学院, 2014.
[8] Wu X Q, Li W, Chen J X,. Chemical constituents and biological activity profiles on(Orchidaceae) [J]., 2019, 24(17): 3195.
[9] Liu X Q, Yuan Q Y, Guo Y Q. Two new stilbenoids from[J]., 2009, 11(2): 116-121.
[10] Xue Z, Li S, Wang S J,. Mono-, Bi-, and triphenanthrenes from the tubers of[J]., 2006, 69(6): 907-913.
[11] 张楠, 曹晓东, 刘颖, 等. 山慈菇酯提物对4T1乳腺癌免疫微环境的影响 [J]. 科学技术与工程, 2021, 21(10): 3940-3949.
[12] 余怡欣, 陈龙惠, 曹丹, 等. 山慈菇活性成分微波提取工艺优化、指纹图谱与抗植物病菌活性分析 [J/OL]. 食品工业科技. 2023, 44(5): 204-212.
[13] 李雪莲, 李智, 黄芊, 等. 山慈菇介导VEGF-A血管生成抑制乳腺癌细胞上皮-间质转化的实验研究 [J]. 中国医师杂志, 2019, 21(11): 1658-1662.
[14] 房宇坤, 宁安红, 刘磊, 等. 山慈菇多糖的提取及其抗氧化作用的研究 [J]. 大连医科大学学报, 2017, 39(6): 527-531.
[15] 孙玉莉, 王伟芹, 孙建光, 等. 尹常健教授治疗原发性肝癌临证用药特点 [J]. 中西医结合肝病杂志, 2020, 30(5): 448-449.
[16] 李杨枝, 章程, 徐超, 等. 基于文献探讨国医大师辨治肺癌的经验总结 [J]. 中医肿瘤学杂志, 2022, 4(2): 69-73.
[17] 宋敬茹, 孙明瑜. 国医大师刘嘉湘扶正法辨治乳腺癌术后经验 [J]. 中华中医药杂志, 2022, 37(4): 2020-2024.
[18] Liu S B, Yang S T. Cardiovascular protective properties of gastrodin [J]., 2022, 12(4): 141.
[19] Tian S X, Cheng W, Lu J J,. Role of militarine in PM2.5-induced BV-2 cell damage [J]., 2021, 46(6): 1423-1434.
[20] Hasriadi, Wasana P W D, Sritularak B,. Batatasin III, a constituent of, improves murine pain-like behaviors with a favorable CNS safety profile [J]., 2022, 85(7): 1816-1825.
[21] Yan X M, Tang B X, Liu M F. Phenanthrenes fromandevaluation of their antibacterial and anti-haemolytic properties [J]., 2018, 32(6): 707-710.
[22] 崔保松, 宋杰, 李帅, 等. RP-HPLC同时测定山慈菇药材中dactylorhin A和militarine的含量 [J]. 中国中药杂志, 2013, 38(24): 4347-4350.
[23] 吕林锋, 蒋永海, 朱希, 等. 山慈菇HPLC指纹图谱质量评价 [J]. 中国现代应用药学, 2016, 33(10): 1276-1280.
[24] 杨红燕, 项微微, 李玲燕. HPLC法指纹图谱在山慈菇真伪鉴别中的应用 [J]. 浙江中医杂志, 2020, 55(1): 72-73.
[25] 王静, 肖秋肖, 周祖英, 等. 基原为云南独蒜兰的山慈菇的化学成分鉴定与分析 [J]. 中国药房, 2022, 33(10): 1165-1171.
[26] 司函瑞. 山慈菇的化学成分及抗肝癌作用的研究 [D]. 长春: 吉林大学, 2022.
[27] 谢典, 朱聪, 潘红波, 等. HPLC法同时测定山慈菇中3种成分 [J]. 中成药, 2022, 44(6): 2050-2053.
Quality differences of different commercial specifications ofbased on HPLC fingerprint, multi-index component determination and chemometrics
HAO Zhuang-zhuang1, CAO Yu-xin1, LIU Meng-meng1, XUE Jing-wen1, ZHANG Ge1, LU Yi-fan1, FAN Wen-xin1, ZHOU ying3, FENG Liang4, WANG Chun-guo2, SHI Jin-li1
1. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China 2. Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 102488, China 3. Gaobeidian Community Health Service Center, Chaoyang District, Beijing 100124, China 4. Wangjing Community Health Service Center, Chaoyang District, Beijing 100102, China
To establish the HPLC fingerprint of(Shancigu), determine the content of its characteristic components, and analyze the difference of the chemical components of the different commercial specifications (BingqiuziandMaocigu) of Shancigu combined with a variety of chemometrics analyses to provide a reference for its quality control.The extraction method of Shancigu was optimized. HPLC was used to establish the fingerprint of BingqiuziandMaocigu respectively, and the content of characteristic components was determined. The data of characteristic components were analyzed by similarity evaluation, cluster analysis (CA), principal component analysis (PCA), orthogonal partial least squares discriminant analysis (OPLS-DA) and Fisher linear discriminant analysis (FLDA).HPLC fingerprints of Bingqiuzi and Maocigu were established, and a total of 46 and 43 common peaks were matched in Bingqiuzi and Maocigu respectively, 17 chromatographic peaks were calibrated, and eight chromatographic peaks were identified, including gastrodin, loroglossin, dactylorhin A, militarine, batatasin III, blestriarene A, blestriarene B, monbarbatain A, and HPLC method for the determination of the above seven components except gastrodin was established simultaneously. The results of CA and PCA can distinguish two kinds of samples of different commercial specifications. The results of OPLS-DA analysis combined with content determination Fisher discriminant analysis showed that loroglossin, dactylorhin A, militarine, blestriarene B, and monbarbatain A (< 0.001) were the components with significant differences between the samples of two different commodity specifications.The HPLC fingerprint of Shancigu combined with CA, PCA, OPLS-DA analysis and multi-component content determination, can determine the differences of the main components in different commercial specifications of Shancigu objectively, comprehensively and effectively, and provide a basis for the improvement of the quality evaluation system of Shancigu.
(shancigu); HPLC fingerprint; gastrodin; loroglossin; dactylorhin A; militarine; batatasin III; blestriarene A; blestriarene B; monbarbatain A; chemometrics; quality evaluation
R286.2
A
0253 - 2670(2023)06 - 1935 - 11
10.7501/j.issn.0253-2670.2023.06.026
2022-07-09
国家自然科学基金资助项目(82073971)
郝壮壮,男,硕士研究生,研究方向为中药药效物质基础。E-mail: bucmhzz@126.com
王春国,实验师,从事中药药效物质基础研究。E-mail: wangcg1119@126.com
石晋丽,博士生导师,教授,从事中药药效物质基础与作用机制研究。E-mail: shijl@vip.sina.com
#共同第一作者:曹宇欣,女,博士研究生,研究方向为中药药效物质基础与作用机制。E-mail: 18835196398@163.com
[责任编辑 时圣明]
