基于NLRP3炎症小体研究黄芩苷联合栀子苷防治缺血性脑卒中及并发心肌损伤的作用机制
2023-03-21张行行孙欠欠赵安东史永恒王国全
赵 麓,张行行,孙欠欠,赵安东,史永恒, 2, 3,王 川, 2,王国全, 2, 3,王 斌, 2, 3
基于NLRP3炎症小体研究黄芩苷联合栀子苷防治缺血性脑卒中及并发心肌损伤的作用机制
赵 麓1,张行行1,孙欠欠1,赵安东1,史永恒1, 2, 3,王 川1, 2,王国全1, 2, 3,王 斌1, 2, 3*
1. 陕西中医药大学,陕西 咸阳 712046 2. 中医药脑健康产业陕西省高校工程研究中心,陕西 咸阳 712046 3. 陕西省中医药管理局 中药药效机制与物质基础重点研究室,陕西 咸阳 712046
以NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体为切入点,研究黄芩苷-栀子苷(7∶3)抗脑缺血损伤及并发心肌损伤的作用机制。将雄性SD大鼠随机分为对照组、模型组、尼莫地平(10 mg/kg)组和黄芩苷-栀子苷低、中、高剂量(30、45、60 mg/kg)组,每组10只。ig药物7 d后,采用线栓法构建大鼠局灶性脑缺血模型,采用Zea-Longa评分标准进行神经功能评分;干湿质量法检测脑组织水肿情况;激光多普勒检测脑血流量;苏木素-伊红(HE)染色观察脑和心肌组织病理变化;TUNEL染色观察心肌组织凋亡情况;采用ELISA法测定心肌组织中心肌酶谱活性。利用网络药理学方法预测黄芩苷-栀子苷抗脑缺血损伤及并发心肌损伤的作用机制;采用ELISA法检测血清中白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;采用Western blotting法检测脑组织、心肌组织中NLRP3炎症小体相关蛋白表达。与对照组比较,模型组大鼠脑、心组织损伤严重,炎性因子水平升高(<0.01),心肌酶谱活性显著升高(<0.01);与模型组比较,各给药组脑、心组织病理损伤不同程度减轻,脑含水量、神经功能评分、心肌细胞凋亡率、血清中心肌酶谱显著降低(<0.05、0.01),脑血流量显著增加(<0.05、0.01)。网络药理学结果显示,NOD样信号通路在黄芩苷-栀子苷防治脑缺血及其并发心损伤中发挥重要作用,选取NOD样受体家族NLRP3炎性小体继续深入研究,ELISA和qRT-PCR结果表明,模型组大鼠血清中IL-1β、IL-6、IL-18、TNF-α水平及脑组织皮层、心肌组织中NLRP3炎症小体蛋白表达水平显著升高(<0.01),而各给药组血清中炎症因子水平和脑组织皮层、心肌组织中NLRP3炎症小体蛋白表达水平均显著降低(<0.01)。黄芩苷-栀子苷能抑制炎性介质的表达,通过下调NLRP3炎症小体发挥抗脑缺血损伤及卒中后心肌损伤作用。
黄芩苷-栀子苷;缺血性脑卒中;卒中后心损伤;脑-心轴;NLRP3;网络药理学
大脑是人体的控制中心,能够调节复杂的生命活动,因此大脑是人体耗氧量最大和消耗能量最多的器官,当脑缺血时,大脑得不到充分的氧气和营养物质,进而引起局部组织细胞凋亡和坏死,引发严重的后果[1]。缺血性脑卒中(cerebral ischemic stroke,CIS)是由于脑血管闭塞所致,约占所有脑卒中病例的72%[2],大多数CIS后死亡归因于神经损伤,而心血管并发症是CIS后死亡的第2大原因[3]。CIS后并发心脏损伤早在1947年就已被报道[4],大量临床数据也显示,脑卒中后早期患者出现心肌受损、心功能不全及心率不齐等症状,常伴有血清心肌酶升高[3,5-6],即使没有原发性心脏病的患者也在CIS后检测到心肌损伤[7]。因此,在研究CIS治疗时应同时考虑心肌组织的保护。
NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体是CIS后炎症的重要组成部分,主要在M1型极化的巨噬细胞中被激活[8],从而介导全身炎症。另有研究发现,在急性心肌梗死中NLRP3介导了不良的炎性反应,加重心肌梗死及心功能障碍[9]。故本研究以NLRP3炎症小体为切入点,探讨CIS及并发心肌损伤的作用机制及黄芩苷、栀子苷的干预作用。课题组前期基于中医基础“清热解毒”治则以及治疗脑血管疾病的现代化研究发现,黄芩和栀子中主要抗炎活性成分黄芩苷和栀子苷最佳比例7∶3联合应用能够相互促进提高入脑[10]、改善脑缺血后炎性损伤和血脑屏障透过率等效用[11];黄芩苷-栀子苷(20~60 mg/kg)能降低脑缺血后炎性指标表达,改善CIS后脑水肿等[12-13],并通过降低兴奋性氨基酸毒性[1]、调节小胶质细胞极化状态[14]等途径抗脑缺血损伤,因此,本研究在课题组前期研究的基础上,进一步探究黄芩苷-栀子苷对抗脑缺血损伤及其并发症的作用机制。
1 材料
1.1 动物
60只SPF级雄性SD大鼠,体质量(220±20)g,购自成都达硕实验动物有限公司,动物许可证号SCXK(川)2020-030。动物饲养于陕西中医药大学中药药理实验动物房内,温度23~25 ℃,相对湿度45%~55%,自由摄食与饮水,昼夜各半,适应性饲养1周。实验过程中对动物的处置符合《实验动物福利伦理审查指南》(GB/T 35892—2018)《关于善待实验动物的指导性意见》和陕西中医药大学伦理委员会规定和相关管理条例,动物实验符合3R原则,本实验通过动物实验伦理审查(批准号SUCMDL20220520002)。
1.2 药品与试剂
黄芩苷(质量分数>95%,批号419J022)、IL-18 ELISA试剂盒(批号SEKR-0054)购自北京索莱宝科技有限公司;栀子苷(质量分数>98%,C14223935)购自德国默克医药生物科技公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 ELISA试剂盒(批号分别为2401718426、11516129426、1331735426)、NRLP3抗体(批号BA-3677-2)购自武汉博士德生物工程有限公司;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(批号分别为20180901-1、20180901、20180801-2、20181201)购自潍坊泽成生物技术有限公司;TUNEL细胞凋亡检测试剂盒(批号011821210312)购自上海碧云天生物技术有限公司;二抗(批号SA00001-2)购自武汉三鹰生物科技有限公司;半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)抗体(批号GB11383)、二抗(批号GB23303)购自武汉赛维尔生物科技有限公司;凋亡斑点样蛋白(apoptotic spot-like protein,ASC)抗体(批号BS6741R)购自北京博奥森生物技术有限公司;头端直径(0.38±0.40)mm的线栓购自瑞沃德。
1.3 仪器
NW10LVF型超纯水系统(力康生物医疗科技控股集团);L420型离心机(北京六一生物科技有限公司);DP73型显微镜拍照系统(日本Olympus公司);800TS型酶标仪(美国Bio-Tek公司);DH36001B型电热恒温培养箱(天津泰斯特仪器有限公司);H-2050R型冷冻超速离心机(湖南湘仪集团);Exicycler 96荧光定量PCR仪(韩国Bioneer公司);SH01D型高速离心机(上海知信实验仪器技术有限公司);电泳仪和转膜仪(美国Bio-Rad公司);PIM3型激光多普勒血流灌注成像仪(瑞典Perimed公司)。
2 方法
2.1 动物造模、分组与给药
将60只大鼠按随机数字表法分为假手术组、模型组、尼莫地平(10 mg/kg)组、黄芩苷-栀子苷低、中、高剂量(30、45、60 mg/kg)组,每组10只。大鼠适应性饲养1周后,各给药组ig相应药物,对照组和模型组ig等体积生理盐水,1次/d,连续7 d。末次给药结束后,大鼠禁食12 h,ip 1%戊巴比妥钠(50 mg/kg)麻醉,模型组和各给药组采用改良Longa线栓法[15]制备右侧大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)模型:大鼠仰卧位固定于鼠板,颈部消毒备皮,正中切口1.5 cm,钝性分离右侧胸锁乳突肌与胸骨舌骨肌之间的肌间隙,分离颈动脉,夹闭颈总动脉,由颈外动脉插入线栓,至线栓18 mm标记进入颈内动脉与颈总动脉分叉处,术中术后保温。对照组大鼠除不插线栓外,其他与模型组大鼠操作一致,造模24 h后取材[16],进行相关指标的测定。
2.2 神经功能评分
所有大鼠均在缺血2、24 h后参考Zea-Longa 5分制评分标准[15]进行神经功能学评分,观察并记录神经功能缺损症状。
2.3 激光多普勒检测脑血流量
大鼠麻醉后,呈俯卧位固定于鼠板,脑部备皮,沿脑正中线做一约2 cm切口,棉签蘸取生理盐水擦拭去除皮下筋膜,使颅骨充分暴露,手持微型颅骨打磨机打薄颅骨,置于激光多普勒仪探测器下稳定5 min,设置激光多普勒血流成像灌注仪检测距离13 cm,参数面积3 cm×3 cm,平行检测3次大鼠脑部血流量变化,结果取平均值。
2.4 干湿质量法测定脑组织含水量
大鼠腹主动脉取血处死后,断颈法取出全脑,滤纸吸干表面水分,冰上预冷30 s,手术刀片切去嗅球及额极前部约4 mm的脑组织,并向后取约2 mm厚的脑组织,中线纵向切开,取缺血侧脑组织,称定质量得缺血侧脑组织湿质量,用铝箔纸包好脑组织放入95 ℃恒温烤箱内烘干24 h,取出,待降至室温测得干质量,计算脑含水量。
脑含水量=(湿质量-干质量)/湿质量
2.5 脑、心肌组织切片苏木素-伊红(HE)染色
脑、心肌组织分别置于4%多聚甲醛中固定,梯度乙醇脱水,二甲苯脱醇、浸蜡包埋后切片(厚度5 μm),二甲苯-乙醇脱蜡、苏木素染色10 min后,于1%盐酸-乙醇中30 s;纯水浸泡15 min后0.5%伊红染色3 min,冲洗后梯度乙醇脱水,二甲苯脱醇,中性树胶固封,于显微镜下观察。
2.6 心肌组织TUNEL检测
心肌组织固定后,脱水、包埋、切片,按试剂盒说明书进行TUNEL染色,计算心肌细胞凋亡率。
2.7 心肌组织中心肌酶谱测定
取心肌组织100 mg,加入10倍量预冷生理盐水,用冷冻型高通量组织研磨器进行组织匀浆,离心后取少许上清液,采用BCA蛋白定量试剂盒测定蛋白浓度,按照试剂盒说明书检测组织匀浆中ALT、AST、CK和LDH活性。
2.8 网络药理学预测黄芩苷-栀子苷心脑共治作用机制
利用SwissTargetPrediction数据库对黄芩苷、栀子苷进行靶点预测,将得到的靶点合并后删除重复值。以“cerebral ischemia”和“myocardial damage”为搜索词在GeneCards数据库收集得分较高相关疾病靶点,将三者靶点导入Venny数据库,取其交集,对其进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,筛选排名较高的通路进行下一步研究[17]。
2.9 ELISA测定血清中TNF-α、IL-1β、IL-6和IL-18水平
血液样本常温静置30 min,3000 r/min离心15 min,分装血清,−80 ℃冻存,按照试剂盒说明书测定血清中TNF-α、IL-1β、IL-6和IL-18水平。
2.10 Western blotting测定缺血侧皮层、心肌组织中NLRP3通路相关蛋白表达
分别取缺血侧皮层、心肌组织,加入RIPA裂解液提取蛋白并测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后加入抗体(1∶1000),4 ℃孵育过夜;洗涤后加入二抗(1∶5000)孵育,洗涤后加入ECL超敏发光液显影,采用成像仪摄像、测量,利用Image Pro Plus 5.0软件分析计算条带灰度值。
2.11 统计学分析

3 结果
3.1 黄芩苷-栀子苷干预脑缺血状态下大鼠行为学的变化
如图1所示,与对照组比较,模型组大鼠在手术2 h后行为学评分显著升高(<0.01),表明手术后模型构建成功;术后24 h,模型组大鼠行为学与术后2 h无差异,脑梗死区域稳定;与模型组比较,尼莫地平组和黄芩苷-栀子苷中、高剂量组大鼠神经功能评分显著降低(<0.05、0.01),提示黄芩苷-栀子苷中、高剂量能降低MCAO大鼠神经功能评分,改善神经功能。
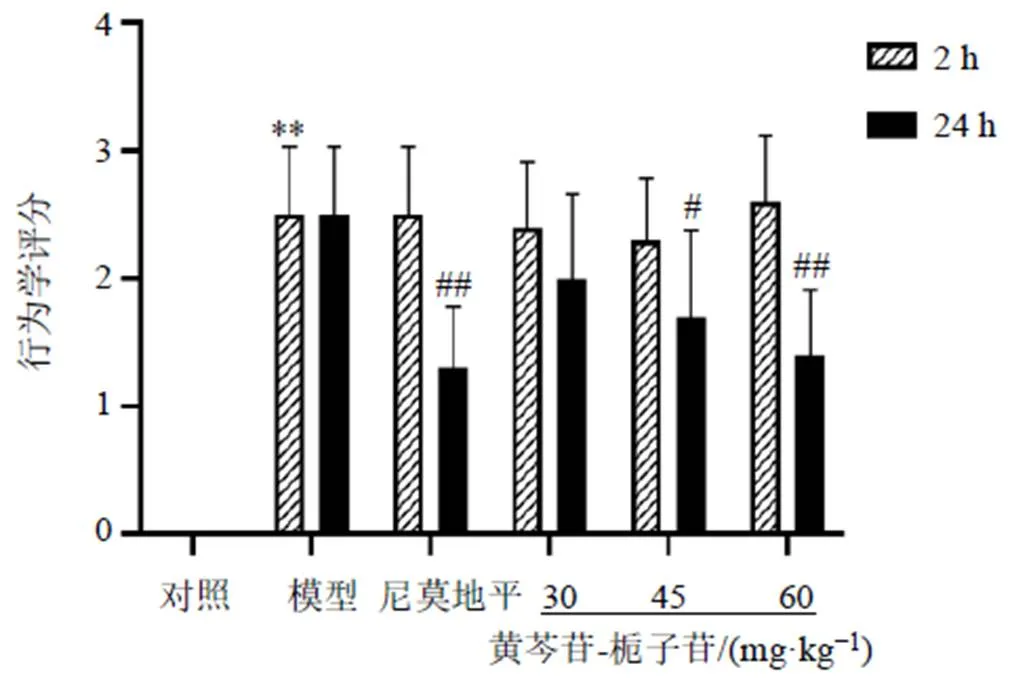
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,下图同
3.2 黄芩苷-栀子苷干预脑缺血状态下大鼠脑组织相关指标的变化
如图2所示,与对照组比较,模型组大鼠脑组织皮层结构松散、水肿,胞核皱缩或溶解,呈现空泡状,结构模糊不清,损伤严重,脑含水量显著上升(<0.01),脑血流量显著下降(<0.01);与模型组比较,各给药组大鼠脑细胞损伤、水肿、胞核萎缩等病理损伤有不同程度减轻,尼莫地平组和黄芩苷-栀子苷中、高剂量组大鼠脑组织含水量均显著降低(<0.01),脑血流量显著上升(<0.01),黄芩苷-栀子苷低剂量组大鼠脑组织含水量显著降低(<0.01),提示黄芩苷-栀子苷能够增加缺血半暗带血流供应,降低脑含水量,改善脑水肿,减轻脑组织病理损伤。

A-各组脑组织HE染色(×200) B-各组大鼠脑血流量热图 C-各组大鼠脑组织含水率(n = 4) D-各组大鼠脑血流量(n = 10)
3.3 黄芩苷-栀子苷干预脑缺血状态下大鼠心功能相关指标的变化
如图3所示,与对照组比较,模型组大鼠心肌细胞排列紊乱、层次不清,胞体萎缩,炎性细胞浸润,横纹断裂,走向不规整,损伤严重;心肌组织中ALT、AST、CK、LDH活性均显著上升(<0.01),心肌细胞凋亡率显著升高(<0.01)。与模型组比较,各给药组心肌组织病理损伤减轻,心肌组织中ALT、AST、CK活性均显著下降(<0.01),心肌细胞凋亡率显著降低(<0.05、0.01),尼莫地平组和黄芩苷-栀子苷中、高剂量组心肌组织中LDH活性显著降低(<0.01)。提示脑缺血可诱发心肌组织结构损伤、心肌细胞凋亡率上升,黄芩苷-栀子苷能够减缓由脑缺血引发的心肌损伤。
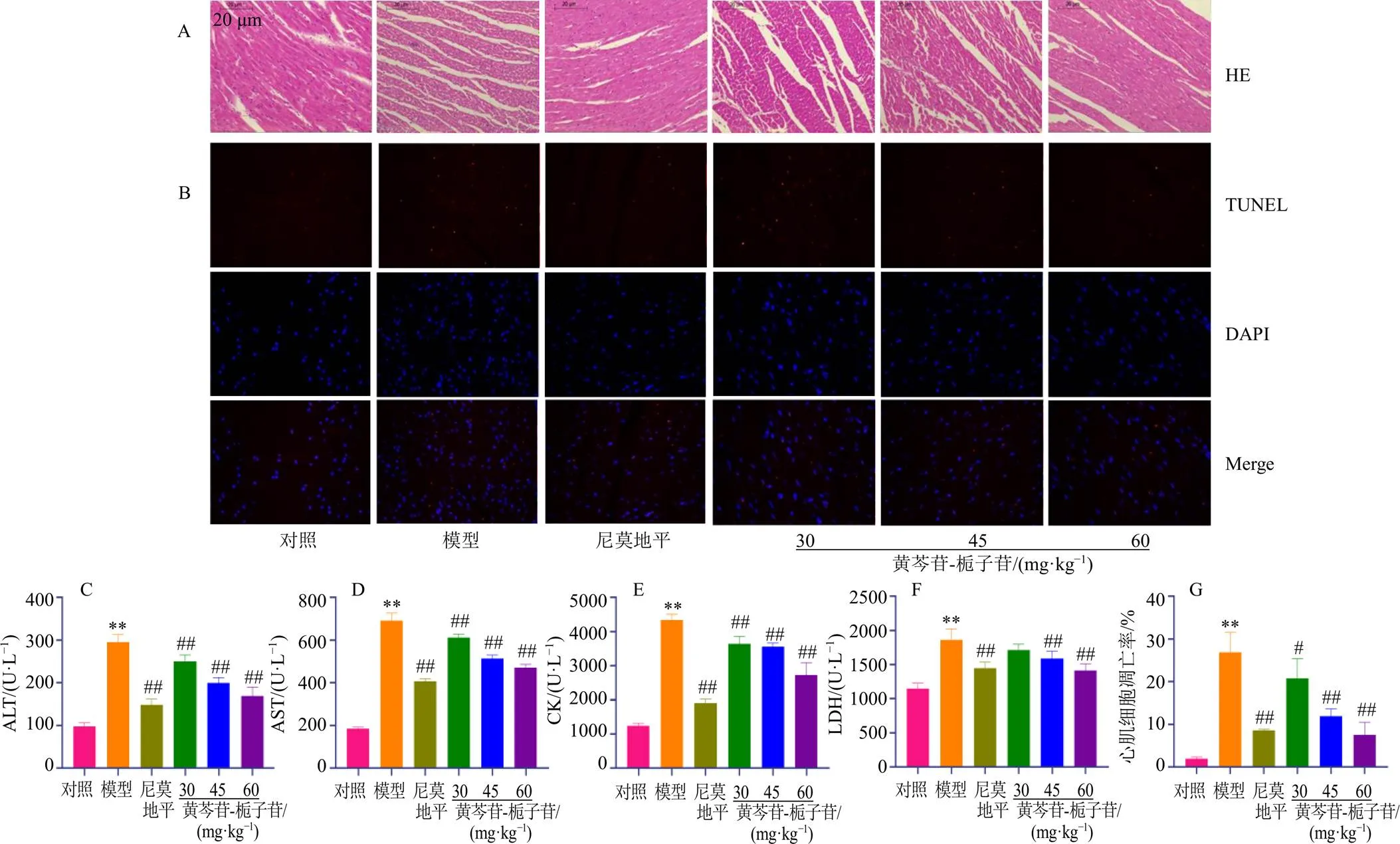
A-各组大鼠心肌组织HE染色(×200) B-各组大鼠心肌组织TUNEL染色(×400) C~F-各组大鼠心肌组织中心肌酶谱表达(n = 10) G-各组大鼠心肌细胞凋亡率(n = 4)
3.4 网络药理学预测黄芩苷-栀子苷改善脑缺血和心功能的机制
运用SwissTargetPrediction数据库对黄芩苷、栀子苷进行靶点预测,黄芩苷得到102个靶点,栀子苷得到108个靶点,合并删除重复值,黄芩苷、栀子苷共得到189个预测靶点。分别以“cerebral ischemia”和“myocardial ischemia”为搜索词在GeneCards数据库收集相关疾病靶点,筛选分数在3分以上的靶点,共得到1176个脑缺血相关靶点和770个心肌缺血相关靶点。将黄芩苷-栀子苷、脑缺血、心肌缺血3者靶点导入Venn数据库,共得到45个共同靶点(图4-A),对其进行PPI(图4-B)与KEGG通路富集分析,筛选得到网络度较高的10个靶点(表1)和与疾病相关的前10条通路(表2),结果表明,黄芩苷-栀子苷参与调节炎症反应、动脉粥样硬化、免疫、细胞凋亡等途径发挥心脑保护作用。筛选结果中,NOD样受体信号通路排名靠前,且在炎症反应、细胞凋亡、焦亡等生理过程中发挥重要作用,而NLRP3炎性小体是目前NOD样受体家族研究最多的一种受体,已有多项研究证明NLRP3介导的炎性小体的激活参与脑缺血的病理过程[18]。因此,本研究选取NLRP3炎性小体继续深入探讨黄芩苷-栀子苷抗CIS及并发心肌损伤的作用机制。

图4 黄芩苷-栀子苷、CIS、心肌损伤Venn交集(A) 与PPI网络(B)

表1 黄芩苷-栀子苷防治心脑损伤关键靶点

表2 黄芩苷-栀子苷防治心脑损伤靶点富集关键通路
3.5 黄芩苷-栀子苷干预脑缺血状态下大鼠血清中炎性因子水平和大脑皮层、心肌组织中NLRP3炎性小体相关蛋白表达
为进一步验证黄芩苷-栀子苷能否通过NLRP3起到防治CIS及并发心肌损伤的作用,利用ELISA检测血清中IL-1β、IL-6、IL-18、TNF-α水平,如图5所示,与对照组比较,模型组大鼠血清中IL-1β、IL-6、IL-18、TNF-α水平均显著升高(<0.01);与模型组比较,各给药组IL-1β、IL-6、IL-18水平均显著降低(<0.01),尼莫地平组和黄芩苷-栀子苷中、高剂量组TNF-α水平显著降低(<0.01)。
采用Western blotting检测缺血侧脑组织皮层和心肌组织中NLRP3炎性小体相关蛋白表达,如图6所示,与对照组比较,模型组大鼠大脑皮层和心肌组织中NLRP3、Caspase-1、ASC蛋白表达水平均显著升高(<0.01);与模型组比较,各给药组大鼠大脑皮层和心肌组织中ASC蛋白表达水平均显著降低(<0.01),尼莫地平组和黄芩苷-栀子苷中、高剂量组大脑皮层和心肌组织中NLRP3、Caspase-1、ASC蛋白表达水平均显著降低(<0.01)。表明黄芩苷-栀子苷可降低血清炎性因子表达,减少NLRP3炎性小体的激活,从而保护脑、心组织。
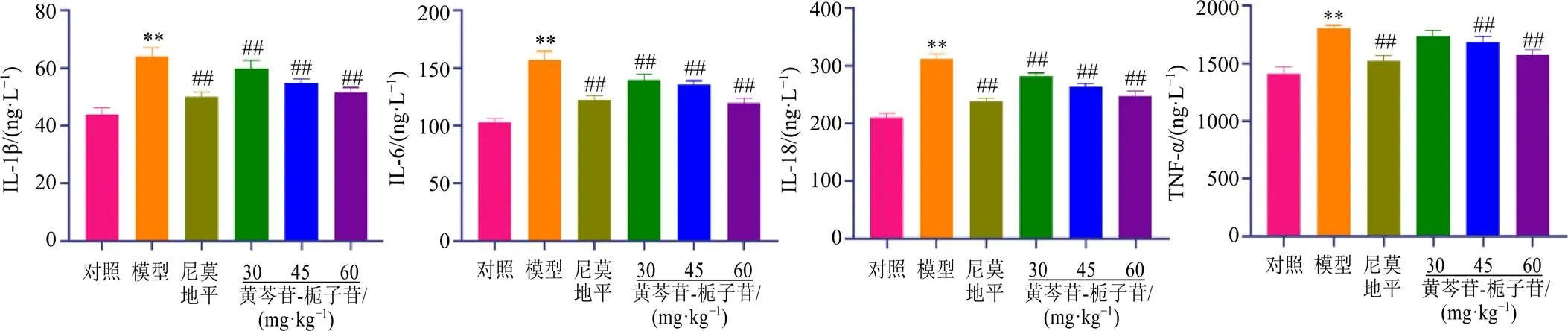
图5 黄芩苷-栀子苷干预脑缺血状态下大鼠血清中炎性因子水平(, n = 6)

图6 黄芩苷-栀子苷干预脑缺血状态下大鼠缺血测皮层(A) 和心肌组织(B) 中NLRP3炎性小体相关蛋白表达 (, n = 3)
4 讨论
脑卒中是一个全球性健康问题,近年来,多种问题致使脑卒中患者持续增加,据2022年中国心血管病报告数据[19]显示,脑卒中为我国第一大病种,每年新发病例超过300万人,因脑卒中死亡的人数近200万人,居全球首位,给社会造成了非常沉重的负担,而CIS约占所有脑卒中病例的72%。CIS发生后,可引发一系列炎症反应、氧化应激、细胞凋亡、水电解质紊乱等病理反应诱导心肌组织损伤、心脏功能失调[20],而临床上心脑血管疾病常合并出现,互相交互,互为因果,没有固定分界[21],以往采取的溶栓、取栓治疗造价昂贵且需要操作者具有较高技术水平,而传统中医药能通过多靶点、多途径有效防治这类复杂疾病,如何挖掘传统中医药理论并将其应用于防治CIS这类慢性疾病及其并发症成为医药学界的迫切需求。
黄芩苷、栀子苷分别是清热解毒类中药黄芩、栀子的主要活性成分,课题组前期研究发现,黄芩苷-栀子苷(7∶3)能有效保护神经功能损伤、减轻脑水肿、增加血流量、下调炎症反应等,且疗效优于其他比例配伍,本研究拟探讨黄芩苷-栀子苷(7∶3)防治CIS后心肌组织损伤的可行性,为预防CIS后并发症的治疗提供新的思路。本研究结果表明,模型组大鼠造模后脑部组织病理损伤严重,神经功能评分、脑含水量显著升高,脑血流量显著下降,而在脑缺血状态下,大鼠心肌组织出现明显病理损伤,心肌细胞凋亡率增加,血清中AST、ALT、CK、LDH活性显著升高,表明脑缺血状态下大鼠心肌组织结构受损,心功能受到影响。而各给药组均可不同程度地降低脑含水量、神经功能评分、心肌细胞凋亡率、心肌酶谱指标,增加脑血流量,提示黄芩苷-栀子苷在减轻脑组织损伤的同时预防心肌损伤,提示了黄芩苷-栀子苷是抗CIS及心肌损伤的潜在药物。
为进一步探讨黄芩苷-栀子苷抗CIS及心肌损伤的具体作用机制,采用网络药理学方法预测其可能的分子机制,结果表明,黄芩苷-栀子苷抗CIS及心肌损伤的作用机制主要涉及脂质和动脉粥样硬化、C型凝集素受体信号通路、TNF信号通路、IL-17信号通路、NOD样受体信号通路,提示黄芩苷-栀子苷通过参与炎症反应、细胞凋亡、血管动脉粥样硬化等途径发挥保护作用。本研究预以NOD样受体信号通路为基础,选择NLRP3炎性小体为切入点,探讨黄芩苷-栀子苷预防损伤的分子生物学基础。NLRP3炎性小体为广泛存在于免疫细胞中的多蛋白复合体,由NLRP3、ASC和pro Caspase-1组成[22],NLRP3受体负责感受周围刺激,被激活后立即与ASC结合并募集pro Caspase-1,形成完整的NLRP3炎性小体,随后可将pro Caspase-1剪切为有活性的Caspase-1(p20),p20可将pro IL-1β和pro IL-18剪切活化为IL-1β和IL-18,诱导下游IL-6、TNF-α等多种炎症因子的成熟和分泌,启动相关信号通路诱发炎症反应。本研究结果显示,模型组大鼠血清中IL-1β、IL-6、IL-18、TNF-α水平显著升高,缺血侧皮层、心肌组织中NLRP3炎症小体蛋白表达显著升高;与模型组比较,各给药组可不同程度地降低血清中IL-1β、IL-6、IL-18、TNF-α水平以及缺血测皮层、心肌组织中NLRP3炎症小体蛋白表达,表明黄芩苷-栀子苷可通过抑制NLRP3炎性小体,下调机体炎症因子的表达,调节免疫炎症反应,从而改善脑缺血状态下的大脑和心肌损伤。
本研究以线栓法构建MCAO模型,初步探讨黄芩苷-栀子苷抗CIS及并发心肌损伤中的具体体现与应用,即脑缺血状态下对心肌组织结构、功能的影响和黄芩苷-栀子苷防治的机制。提示黄芩苷-栀子苷通过抑制NLRP3炎性小体的激活,下调炎性因子表达、脑组织含水量,增加缺血区供血,稳定心肌组织结构发挥保护作用。本研究有助于揭示中医药多靶点、多途径的共效应性,有助于丰富“脑损及心”等学说,为治疗心脑血管疾病提供新参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 张欢欢. 黄芩苷和栀子苷配伍抗脑缺血兴奋性氨基酸毒性损伤的作用机制研究 [D]. 咸阳: 陕西中医药大学, 2018.
[2] 王陇德, 彭斌, 张鸿祺, 等. 《中国脑卒中防治报告2020》概要 [J]. 中国脑血管病杂志, 2022, 19(2): 136-144.
[3] Chen Z L, Venkat P, Seyfried D,. Brain-heart interaction: Cardiac complications after stroke [J]., 2017, 121(4): 451-468.
[4] Byer E, Ashman R, Toth L A. Electrocardiograms with large, upright T waves and long Q-T intervals [J]., 1947, 33(6): 796-806.
[5] Stengl H, Ganeshan R, Hellwig S,. Cardiomyocyte injury following acute ischemic stroke: Protocol for a prospective observational cohort study [J]., 2021, 10(2): e24186.
[6] Ay H, Koroshetz W J, Benner T,. Neuroanatomic correlates of stroke-related myocardial injury [J]., 2006, 66(9): 1325-1329.
[7] Bugnicourt J M, Rogez V, Guillaumont M P,. Troponin levels help predict new-onset atrial fibrillation in ischaemic stroke patients: A retrospective study [J]., 2010, 63(1): 24-28.
[8] Minutoli L, Puzzolo D, Rinaldi M,. ROS-mediated NLRP3 inflammasome activation in brain, heart, kidney, and testis ischemia/reperfusion injury [J]., 2016, 2016: 2183026.
[9] Toldo S, Abbate A. The NLRP3 inflammasome in acute myocardial infarction [J]., 2018, 15(4): 203-214.
[10] 李豪, 何林, 高原雪, 等. 微透析法测定脑缺血损伤后黄芩苷、栀子苷及兴奋性氨基酸含量变化 [J]. 中药药理与临床, 2019, 35(1): 107-112.
[11] 李敏, 曹慧, 王斌, 等. 基于AQP-4、GFAP的黄芩苷、栀子苷配伍抗脑缺血大鼠神经功能损伤的研究 [J]. 中药药理与临床, 2017, 33(2): 56-59.
[12] 刘阿萍, 李敏, 王斌, 等. 黄芩苷和栀子苷配伍对大鼠脑缺血再灌注损伤的作用研究 [J]. 中药药理与临床, 2016, 32(1): 46-48.
[13] 李敏, 王斌, 曹慧, 等. 基于AQP-4、P-gp黄芩苷、栀子苷配伍对缺血/再灌注损伤大鼠血脑屏障保护机制研究 [J]. 中国药理学通报, 2017, 33(3): 443-444.
[14] 李慧敏. 黄芩苷、栀子苷及其配伍通过5-LOX/LTB4通路调控小胶质细胞M1/M2极化抗脑缺血炎性损伤机制研究 [D]. 咸阳: 陕西中医药大学, 2021.
[15] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[16] 曹霞, 曹秉振, 常高峰. 大鼠大脑中动脉局灶性脑缺血时间与梗死体积的相关性 [J]. 中国临床康复, 2004, 8(34): 7838-7839.
[17] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[18] Franke M, Bieber M, Kraft P,. The NLRP3 inflammasome drives inflammation in ischemia/ reperfusion injury after transient middle cerebral artery occlusion in mice [J]., 2021, 92: 221-231.
[19] 中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2021概要 [J]. 心脑血管病防治, 2022, 22(4): 20-36.
[20] 崔一然, 李德凤, 张毅, 等. 脑缺血大鼠海马和心肌组织α-actinin蛋白表达及“脑心同治”方的干预作用 [J]. 中华中医药杂志, 2017, 32(2): 474-478.
[21] 刘卫红, 周明学, 李思耐, 等. 脑心同治理论对临床的指导意义 [J]. 世界中医药, 2017, 12(2): 241-242.
[22] 刘孜琦, 聂妍琦, 傅旖灵, 等. 基于NLRP3炎症小体探讨电针对脑缺血再灌注损伤大鼠细胞焦亡的影响 [J]. 中国中医药信息杂志, 2022, 29(10): 84-89.
Mechanism of baicalin combined with geniposide for prevention and treatment of cerebral ischemic stroke and complex myocardial injury based on NLRP3 inflammasome
ZHAO Lu1, ZHANG Hang-hang1, SUN Qian-qian1, ZHAO An-dong1, SHI Yong-heng1, 2, 3, WANG Chuan1, 2, WANG Guo-quan1, 2, 3, WANG Bin1, 2, 3
1. Shaanxi University of Chinese Medicine, Xianyang 712046, China 2. Shaanxi University Engineering Research Center of Traditional Chinese Medicine Brain Health Industry, Xianyang 712046, China 3. Key Laboratory of Pharmacodynamic Mechanism and Material Base of Traditional Chinese Medicine, Shaanxi Provincial Administration of Traditional Chinese Medicine, Xianyang 712046, China
To study the mechanism of baicalin-geniposide (7∶3) in preventing cerebral ischemia injury and myocardial injury by taking NOD-like receptor thermal protein domain associated protein 3 (NLRP3) inflammasome as the breakthrough point.Male SD rats were randomly divided into control group, model group, nimodipine (10 mg/kg) group and baicalin-geniposide low-, medium- and high-dose (30, 45, 60 mg/kg) groups, with 10 rats in each group. After 7 d of administration, the rat model of focal cerebral ischemia was established by thread embolism method, and neurological function was scored by Zea-Longa scoring standard. The edema of brain tissue was detected by dry-wet mass method; Cerebral blood flow was detected by laser Doppler; HE staining was used to observe the pathological changes of brain and myocardium; TUNEL staining was used to observe myocardial apoptosis; The activities of myocardial zymogram in myocardial tissue was determined by ELISA. Network pharmacology method was used to predict the mechanism of baicalin-geniposide against cerebral ischemia injury and myocardial injury; Levels of interleukin-1β (IL-1β), IL-6, IL-18 and tumor necrosis factor-α (TNF-α) in serum were detected by ELISA; Western blotting was used to detect the expressions of NLRP3 inflammasome related protein in brain tissue and myocardial tissue.Compared with control group, brain and heart tissue of model group were seriously damaged, levels of inflammatory factors were increased (< 0.01), and activities of myocardial enzymes were significantly increased (< 0.01). Compared with model group, pathological damage of brain and heart tissue were alleviated in different degrees, brain water content, neurological function score, myocardial cell apoptosis rate and myocardial enzyme spectrum in serum were significantly decreased (< 0.05, 0.01), and cerebral blood flow was significantly increased (< 0.05, 0.01) in each administration group. The results of network pharmacology showed that NOD-like signaling pathway played an important role in prevention and treatment of cerebral ischemia and its complicated myocardial injury by baicalin-geniposide. NOD-like receptor family NLRP3 inflammasome were selected for further study. The results of ELISA and qRT-PCR showed that, levels of IL-1β, IL-6, IL-18, TNF-α in serum and expressions of NLRP3 inflammasome protein in brain cortex and myocardial tissue of rats in model group were significantly increased (< 0.01), while levels of inflammatory factors in serum and expressions of NLRP3 inflammasome protein in brain cortex and myocardial tissue were significantly decreased (< 0.01).Baicalin-geniposide could inhibit the expression of inflammatory mediators, and play an anti-cerebral ischemia injury and myocardial injury after stroke by down-regulating NLRP3 inflammasome.
baicalin-gardenoside; cerebral ischemic stroke; heart injury after stroke; brain-heart axis; NLRP3; network pharmacology
R285.5
A
0253 - 2670(2023)06 - 1833 - 09
10.7501/j.issn.0253-2670.2023.06.015
2022-10-04
国家自然科学基金资助项目(81473385);中医药“双链融合”中青年科研创新团队(2022-SLRH-YQ-006);陕西省中医药科研项目(2021-ZZ-JC023);咸阳市重点研发科技项目(JBGS-001)
赵 麓,硕士研究生,研究方向为心脑血管疾病药理学。E-mail: mountainzhao@qq.com
王 斌,博士生导师,教授,从事中药药理心脑血管疾病研究。E-mail: wangbin812@126.com
[责任编辑 李亚楠]
