江南山梗菜中1个新的三萜类化合物及其生物活性研究
2023-03-21邱珏琳陈俊磊魏英焕王朝阳李欢阳苑春茂黄烈军郝小江
邱珏琳,陈俊磊,魏英焕,王朝阳,李欢阳,付 茂,苑春茂,黄烈军,郝小江, 4*,顾 玮*
•化学成分 •
江南山梗菜中1个新的三萜类化合物及其生物活性研究
邱珏琳1, 2, 3,陈俊磊1, 2,魏英焕1, 2,王朝阳1, 2,李欢阳1, 2,付 茂1, 2,苑春茂1, 2,黄烈军1, 2,郝小江1, 2, 4*,顾 玮1, 2*
1. 贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014 2. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014 3. 贵州医科大学药学院,贵州 贵阳 550025 4. 中国科学院昆明植物研究所,云南 昆明 650201
对江南山梗菜中的三萜类成分及其生物活性进行研究。采用硅胶柱色谱、Sephadex LH-20及HPLC等色谱技术进行分离纯化,运用NMR、MS等波谱技术进行化合物的结构鉴定。采用四甲基偶氮唑盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT] 法筛选分离得到化合物对人非小细胞肺癌A549细胞的细胞毒性;采用4-硝基苯基-α-吡喃葡萄糖苷(4-nitrophenyl-α--glucopyranoside,PNPG)法测定分离得到化合物对α-葡萄糖苷酶的抑制活性。从江南山梗菜的醋酸乙酯部位中分离得到6个三萜类化合物,分别鉴定为3β-正十六酸酯-齐墩果烷-12-烯-11-酮(1)、熊果酸(2)、齐墩果酸(3)、sumaresinolic acid(4)、3β-羟基-齐墩果烷-12-烯-11-酮(5)、32,33,34-三甲基-细菌藿烷-16-烯-3-β-吡喃葡萄糖苷(6)。细胞毒活性筛选结果表明,化合物1和5对A549细胞增殖有显著的抑制活性,其半数抑制浓度(median inhibition concentration,IC50)分别为(26.72±2.05)、(36.70±3.43)μmol/L。α葡萄糖苷酶抑制活性筛选结果表明,化合物2和3对α-葡萄糖苷酶有较强的抑制活性,其IC50分别为(28.97±1.73)、(11.87±1.18)μmol/L,抑制活性均高于阳性药阿卡波糖;化合物1对α-葡萄糖苷酶抑制活性的IC50为(148.47±2.09)μmol/L,抑制活性与阳性药阿卡波糖相当。化合物1为新化合物,命名为山梗菜萜A;化合物2~6均为首次从江南山梗菜中分离得到。化合物1和化合物5对A549细胞有较强的细胞毒活性。化合物1~3对α-葡萄糖苷酶有一定的抑制活性。
江南山梗菜;三萜;山梗菜萜A;细胞毒活性;α-葡萄糖苷酶抑制活性;熊果酸;齐墩果酸;3β-羟基-齐墩果烷-12-烯-11-酮
江南山梗菜Franch.为桔梗科(Campanulaceae)半边莲属L.多年生草本植物,又名大种半边莲、节节花、江南大将军、大半边莲、江南苦菜。该植物生于海拔2300 m以下的山地林边或沟边较阴湿处,主要分布在我国贵州、福建、江西、浙江、安徽等南方各地[1]。临床上主要用于治疗痈肿疔疮、蛇虫咬伤、骨结核、胃寒痛[2]。江南山梗菜作为一种重要的中药资源,目前国内外对于江南山梗菜的化学成分及其生物活性的研究报道较少,张明哲等[3]从中分离得到8个化合物,分别为三萜类、生物碱类及甾醇类,且并未对其活性成分做进一步研究。因此对其化学成分和生物活性进行系统的研究,可以更深入地阐明该植物的药效物质基础,为该药用植物的开发应用提供科学依据。本实验对江南山梗菜全草的乙醇提取物中的化学成分进行深入研究,共分离得到6个三萜类化合物,分别鉴定为3β-正十六酸酯-齐墩果烷-12-烯-11-酮(3β-hexadecanoate-olean-12-en-11-one,1)、熊果酸(ursolic acid,2)、齐墩果酸(oleanic acid,3)、sumaresinolic acid (4)、3β-羟基-齐墩果烷-12-烯-11-酮(3β-hydroxy-olean-12-en-11-one,5)、32,33,34-三甲基-细菌藿烷-16-烯-3-β-吡喃葡萄糖苷(32,33,34-trimethyl-bacteriohopan-16-ene-3-β-glucopyranoside,6)。其中化合物1为新化合物,命名为山梗菜萜A;化合物2~6均为首次从江南山梗菜中分离得到。进一步采用MTT法测定分离得到化合物对人非小细胞肺癌A549细胞的细胞毒活性;采用PNPG法测定分离得到化合物对α-葡萄糖苷酶的抑制活性。
1 仪器与材料
UV-2401PC紫外光谱仪(日本岛津公司);Autopol VI自动旋光仪(美国鲁道夫公司);Bruker Avance NEO 600MHz超导核磁共振仪(德国Bruker公司);HITACHI高效液相色谱仪Primaide(日本日立公司);Agilent ZORBAX SB-C18色谱柱(半制备柱,250 mm×9.4 mm,5 μm,美国安捷伦公司);QE Focus型串联四极杆飞行时间液质谱联用仪(赛默飞世尔科技有限公司);EYELA-1100型旋转蒸发仪(日本东京理化器械株式会社);BioTek Epoch全波长酶标仪(美国BioTek公司);40~80目和200~300目柱色谱硅胶(青岛海洋化工厂);反相填充材料RP-C18(25~40 μm,德国默克公司);Sephadex LH-20凝胶(瑞典Pharmacia公司);甲醇、石油醚、三氯甲烷、醋酸乙酯等试剂购买于天津市富宇精细化工有限公司;色谱甲醇(上海星可高纯溶剂有限公司);磷酸盐缓冲溶液(phosphate buffered saline,PBS)和四甲基偶氮唑盐[3-(4,5-dimethyl-2- thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT],上海麦克林生化科技有限公司;4-硝基苯基-α-吡喃葡萄糖苷(4-nitrophenyl-α--glucopyranoside,PNPG)和α-葡萄糖苷酶(美国Sigma Chemical公司);A549细胞来源于美国模式培养物集训库(American type culture collection,ATCC);阿卡波糖(上海毕得医药公司,批号BD111950);顺铂(上海源叶生物科技有限公司,批号B24462)。
江南山梗菜全草2020年9月采自贵州省毕节市,经贵州省中国科学院天然产物重点实验室顾玮副研究员鉴定为江南山梗菜Franch.,凭证标本(GZCNG-2020-0047)存放于贵州省中国科学院天然产物重点实验室。
2 提取与分离
江南山梗菜全草(30 kg)粉碎后用75%乙醇回流提取3次,每次3 h,滤过,合并提取液,减压浓缩后将浸膏(6.1 kg)分散于水中,依次用醋酸乙酯、正丁醇萃取。将各个部位萃取液浓缩,得到醋酸乙酯部位(1.0 kg),正丁醇部位(760.3 g)。醋酸乙酯部位首先通过正相硅胶柱色谱(40~80目),分别以石油醚-醋酸乙酯(20∶1~2∶1)、三氯甲烷-甲醇(100∶0~1∶1)梯度洗脱,并分段收集,通过薄层色谱(TCL)检测分析,合并得到9个组分Fr. 1~9。Fr. 1(31.1 g)经硅胶色谱[石油醚-醋酸乙酯(100∶0~1∶50)] 洗脱得到5个亚流分(Fr. 1-1~1-5)。Fr. 1-3(5.9 g)经过凝胶柱色谱[三氯甲烷-甲醇(1∶1)] 纯化后重结晶得到化合物1(1.1 g)。Fr. 1-5(18.7 g)反复用硅胶柱色谱[三氯甲烷-甲醇(15∶1)] 纯化后经过Sephadex LH-20凝胶柱色谱[三氯甲烷-甲醇(1∶1)] 分离得到化合物3(1.5 g)。Fr. 4(76.4 g)首先经过RP-C18柱色谱,以水-甲醇(60∶40~0∶100)梯度洗脱得到7个亚流分(Fr. 4-1~4-7)。Fr. 4-1(6.5 g)经硅胶色谱柱[氯仿-甲醇(10∶1~1∶1)] 梯度洗脱得到5个次流分(Fr. 4-1-1~4-1-5)。Fr. 4-1-3(1.3 g)经过Sephadex LH-20凝胶柱色谱[三氯甲烷-甲醇(1∶1)] 纯化再经半制备型HPLC [甲醇-水(43∶57),2 mL/min] 纯化得到化合物5(11.0 mg,R=37.5 min)。Fr. 4-3(6.4 g)经硅胶色谱柱色谱[氯仿-甲醇(20∶1~2∶1)] 梯度洗脱得到化合物2(3.9 g)。Fr. 4-6(6.4 g)用硅胶柱色谱,依次用石油醚-醋酸乙酯(10∶1)、三氯甲烷-甲醇(15∶1)梯度洗脱得到8个次流分(Fr. 4-6-1~4-6-8)。Fr. 4-6-2(1.4 g)经过Sephadex LH-20凝胶柱色谱[三氯甲烷-甲醇(1∶1)] 分离得到化合物4(20.0 mg),Fr. 4-6-3(1.4 g)经过Sephadex LH-20凝胶柱色谱[三氯甲烷-甲醇(1∶1)] 分离得到化合物6(32.0 mg)
3 结构鉴定
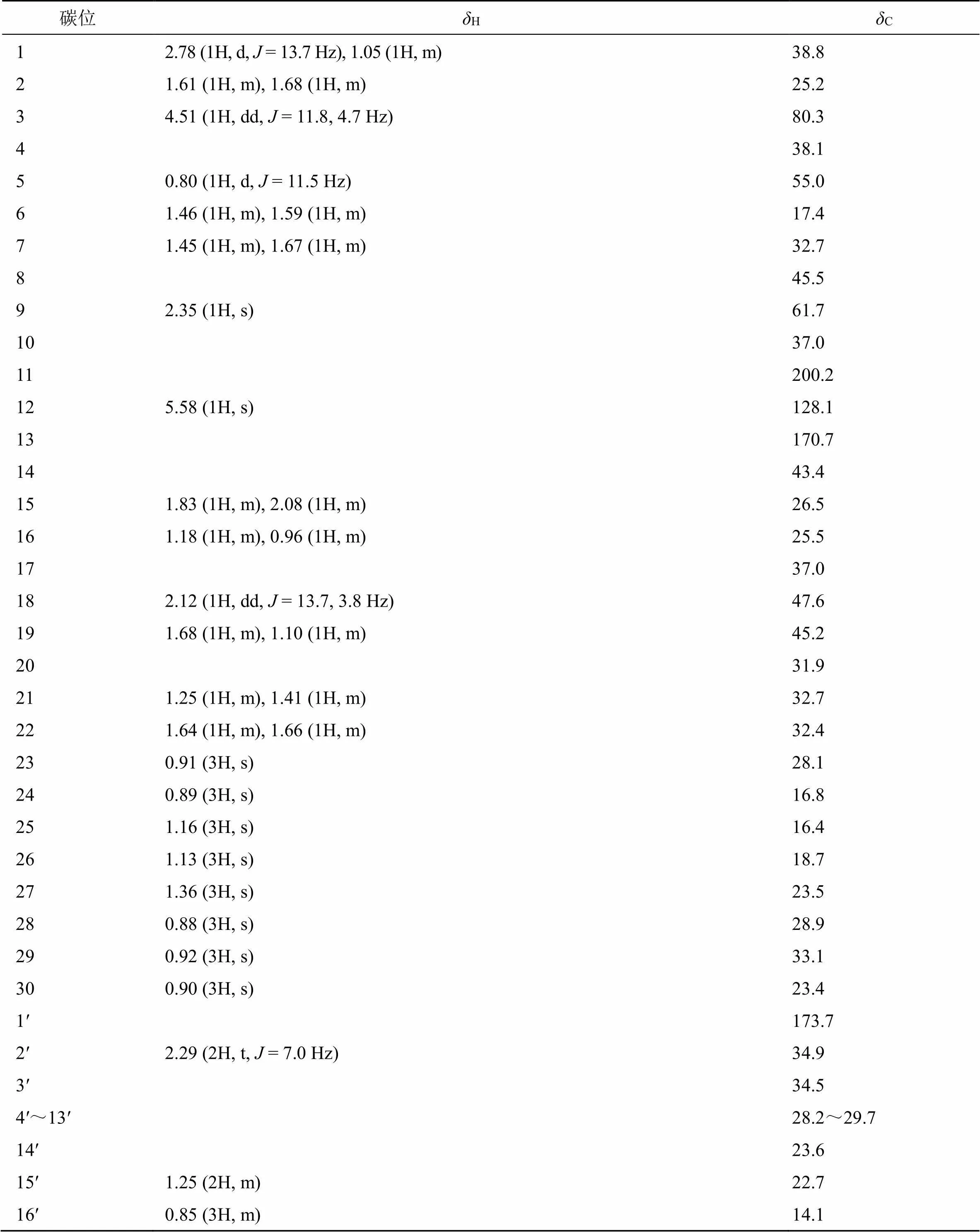
表1 化合物1的核磁共振波谱数据 (600/150 MHz, CDCl3)

图1 化合物1的结构、主要1H-1H COSY (―) 和HMBC (→) 相关
化合物2:白色粉末,分子式C30H48O3;ESI-MS/479 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 5.13 (1H, dd,= 6.8, 3.2 Hz, H-12), 3.00 (1H, m, H-3), 2.11 (1H, d,= 11.3 Hz, H-18), 1.93 (2H, dd,= 13.4, 4.2 Hz, H-11), 1.59 (1H, dt,= 6.4, 3.2 Hz, H-9), 1.57 (2H, m, H-1), 1.54 (2H, m, H-22), 1.54 (2H, m, H-16), 1.49 (1H, m, H-20), 1.46 (1H, m, H-6a), 1.42 (2H, m, H-2), 1.31 (1H, m, H-19), 1.29 (1H, m, H-6b), 1.29 (2H, m, H-21), 1.26 (2H, m, H-7), 1.05 (3H, s, H-27), 1.01 (2H, m, H-15), 0.92 (3H, s, H-30), 0.90 (3H, s, H-23), 0.87 (3H, s, H-25), 0.82 (3H, d,= 6.5 Hz, H-29), 0.75 (3H, s, H-26), 0.68 (3H, s, H-24), 0.66 (1H, s, H-5);13C-NMR (150 MHz, DMSO-6): 178.8 (C-28), 138.7 (C-13), 125.0 (C-12), 77.3 (C-3), 55.2 (C-5), 52.8 (C-18), 47.3 (C-9), 47.3 (C-16), 42.1 (C-14), 39.6 (C-8), 39.0 (C-20), 38.9 (C-19), 38.8 (C-4), 38.7 (C-1), 37.0 (C-10), 36.80 (C-22), 32.2 (C-15), 30.7 (C-7), 28.7 (C-23), 28.0 (C-21), 27.4 (C-2), 24.3 (C-11), 23.7 (C-27), 23.3 (C-16), 21.6 (C-30), 18.5 (C-6), 17.5 (C-29), 17.4 (C-24), 16.5 (C-25), 15.7 (C-26)。以上数据与文献报道一致[5],故鉴定化合物2为熊果酸。
化合物3:白色粉末,分子式C30H48O3;ESI-MS/479 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 5.16 (1H, m, H-12), 1.19 (3H, s, H-27), 0.89 (3H, s, H-26), 0.85 (9H, s, H-23, 25, 30), 0.72 (3H, s, H-29), 0.68 (3H, s, H-24);13C-NMR (150 MHz, DMSO-6): 179.1 (C-28), 144.3 (C-13), 122.0 (C-12), 77.3 (C-3), 55.2 (C-5), 47.5 (C-9), 46.1 (C-19), 45.9 (C-17), 41.8 (C-14), 41.2 (C-18), 40.4 (C-8), 39.3 (C-8), 38.8 (C-4), 38.5 (C-1), 37.0 (C-10), 33.8 (C-21), 33.3 (C-29), 32.9 (C-7), 32.5 (C-22), 30.9 (C-20), 28.6 (C-23), 27.6 (C-15), 27.4 (C-2), 26.0 (C-27), 23.8 (C-30), 23.4 (C-11), 23.0 (C-16), 18.5 (C-6), 17.3 (C-26), 16.5 (C-24), 15.6 (C-25)。以上数据与文献报道一致[6],故鉴定化合物3为齐墩果酸。
化合物4:白色粉末,分子式 C30H48O4;ESI-MS/471 [M-H]−。1H-NMR (600 MHz, CDCl3): 5.34 (1H, t,= 3.2 Hz, H-12), 4.56 (1H, s, H-6), 3.18 (1H, dd,= 10.6, 5.4 Hz, H-3), 1.32 (3H, s, H-26), 1.20 (3H, s, H-25), 1.12 (3H, s, H-24), 1.09 (3H, s, H-23), 1.09 (3H, s, H-27), 0.94 (3H, s, H-29), 0.92 (3H, H-30);13C-NMR (150 MHz, CDCl3): 184.0 (C-28), 142.8 (C-13), 122.8 (C-12), 79.1 (C-3), 68.6 (C-6), 55.7 (C-5), 47.9 (C-9), 46.5 (C-17), 45.9 (C-19), 42.2 (C-14), 40.9 (C-18), 40.5 (C-7), 40.3 (C-1), 39.5 (C-4), 38.4 (C-8), 36.5 (C-10), 33.9 (C-21), 33.1 (C-29), 32.3 (C-22), 30.7 (C-20), 27.6 (C-15), 27.9 (C-23), 27.3 (C-2), 26.0 (C-27), 23.3 (C-11), 23.0 (C-16), 23.6 (C-30), 18.2 (C-26), 17.1 (C-24), 17.0 (C-25)。以上数据与文献报道一致[7],故鉴定化合物4为sumaresinolic acid。
化合物5:白色粉末,分子式 C30H48O2;ESI-MS/439 [M-H]−。1H-NMR (600 MHz, DMSO-6):5.60 (1H, s, H-12), 3.24 (1H, dd,= 11.4, 4.8 Hz, H-3), 2.34 (1H, s, H-9), 2.13 (1H, d,= 13.6, 3.6 Hz, H-18), 1.83 (1H, m, H-2), 1.67 (3H, m, H-26), 1.37 (3H, m, H-27), 1.01 (3H, s, H-28), 0.91 (3H, s, H-30), 0.70 (1H, m, H-5);13C-NMR (150 MHz, DMSO-6): 200.4 (C-11), 170.7 (C-13), 128.1 (C-12), 78.8 (C-3), 61.8 (C-9), 54.9 (C-5), 47.6 (C-18), 45.4 (C-14), 45.2 (C-19), 43.4 (C-8), 39.2 (C-4), 37.1 (C-10), 36.5 (C-22), 34.4 (C-21), 33.1 (C-29), 32.8 (C-7), 32.4 (C-17), 31.1 (C-20), 28.8 (C-23), 27.3 (C-16), 26.5 (C-2), 26.4 (C-15), 23.5 (C-27), 18.7 (C-26), 17.5 (C-6), 16.4 (C-24), 15.6 (C-15)。以上数据与文献报道一致[8],故鉴定化合物5为3β羟基-齐墩果烷-12-烯-11-酮。
化合物6:白色粉末,分子式 C44H76O6;ESI-MS/723 [M+Na]+。1H-NMR (600 MHz, DMSO-6): 5.32 (1H, s, H-16), 4.92 (2H, m, H-6′), 4.21 (1H, d,= 7.7 Hz, H-4′), 3.13 (1H, m, H-2′), 3.08 (1H, m, H-5′), 1.94 (2H, m, H-2), 1.15 (3H, m, H-29), 0.99 (1H, m, H-21), 0.64 (3H, m, H-33);13C-NMR (150 MHz, DMSO-6):140.9 (C-17), 121.7 (C-16), 101.2 (C-1′), 77.4 (C-3), 77.2 (C-3′), 77.1 (C-2′), 73.9 (C-5′), 70.6 (C-4′), 61.5 (C-5′), 56.6 (C-21), 55.9 (C-5), 51.0 (C-13), 50.1 (C-13), 45.6 (C-4), 42.3 (C-14), 42.2 (C-18), 40.3 (C-10), 39.4 (C-20), 38.7 (C-23), 37.3 (C-19), 36.7 (C-2), 35.9 (C-22), 33.8 (C-15), 31.9 (C-2), 29.7 (C-20), 29.2 (C-23), 28.3 (C-15), 25.9 (C-34), 24.3 (C-12), 23.1 (C-31), 23.1 (C-32), 21.6 (C-11), 21.4 (C-33), 21.1 (C-29), 20.2 (C-26), 19.6 (C-27), 19.4 (C-25), 19.3 (C-24), 19.1 (C-28), 12.6 (C-32), 12.3 (C-34), 12.3 (C-33), 12.1 (C-35)。以上数据与文献报道一致[9],故鉴定化合6为32,33,34-三甲基-细菌藿烷-16-烯-3-β吡喃葡萄糖苷。
4 生物活性评价
4.1 对A549细胞的细胞毒性实验
采用MTT法对分离鉴定的6个化合物进行A549细胞的细胞毒性测定,以顺铂为阳性药,具体的细胞毒活性实验操作流程和操作方法参考本课题组前期研究报道[10]。
结果显示,化合物1对A549细胞增殖有显著的抑制活性,其半数抑制浓度(median inhibition concentration,IC50)为(26.72±2.05)μmol/L,化合物5对A549细胞增殖同样有显著的抑制活性,其IC50为(36.70±3.43)μmol/L。与阳性对照顺铂[IC50为(11.71±0.85)μmol/L]相比,对A549细胞增殖的抑制活性均稍低于阳性药。其余化合物对A549细胞增殖的抑制活性较弱,在初筛200 μmol/L浓度下,抑制率均低于50%,具体活性评价结果数据见表2。
4.2 α-葡萄糖苷酶抑制活性测定
采用PNPG法对分离鉴定的6个化合物进行体外α葡萄糖苷酶抑制活性测定,以阿卡波糖为阳性对照药物,具体的抑制活性实验操作流程和操作方法见本课题组前期研究报道[11-12]。

表2 化合物1~6对A549细胞、α-葡萄糖苷酶的IC50()
a-顺铂 b-阿卡波糖
a-cisplatin b-acarbose
实验结果显示,发现有3个化合物具有显著的α-葡萄糖苷酶抑制活性,具体活性评价结果数据见表2。化合物1的IC50值为(148.47±2.09)μmol/L,抑制活性约为阳性对照阿卡波糖的1.68倍,化合物2的IC50值为(28.97±1.73)μmol/L,抑制活性约为阳性对照阿卡波糖的8.61倍,化合物3的IC50值为(11.87±1.18)μmol/L,抑制活性约为阳性对照阿卡波糖的21.02倍。
5 讨论
本实验运用多种色谱分离方法和波谱鉴定技术从江南山梗菜醋酸乙酯部位分离鉴定了6个三萜类化合物(1~6),其中化合物1为新化合物,命名为山梗菜萜A;化合物2~6均为首次从江南山梗菜中分离得到。A549细胞的细胞毒性实验表明,化合物1和化合物5对A549细胞增殖有较强的抑制活性。α-葡萄糖苷酶抑制活性测定表明,化合物1对α-葡萄糖苷酶有一定的抑制活性,其活性与阳性药阿卡波糖相当;化合物2(熊果酸)和3(齐墩果酸)对α-葡萄糖苷酶表现出较强的抑制活性,熊果酸和齐墩果酸是很多植物体内的常见成分,关于二者的降糖作用前人已有报道。李明等[13]构建2型糖尿病模型观察了熊果酸对2型糖尿病大鼠血糖的影响,发现熊果酸高、中剂量组对2型糖尿病大鼠空腹血糖有明显降低作用且与模型组差异显著。宋志成等[14]用PNPG法对齐墩果酸极其衍生物的α-葡萄糖苷酶抑制活性进行了筛选,发现齐墩果酸表现出显著的α-葡萄糖苷酶体外抑制活性。本研究结果进一步印证了2种三萜化合物的降糖活性。可以为未来开发该类化合物的降糖药物提供一定的启示。综上,本实验从江南山梗菜中得到1个新的三萜类化合物,并印证了江南山梗菜化学成分的抗肿瘤活性和降糖活性,为发现潜在的抗癌活性成分和降糖活性成分提供参考,也为江南山梗菜资源的进一步开发和利用奠定了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国植物志编辑委员会. 中国植物志. 第73(2)卷 [M]. 北京: 科学出版社, 1983: 165.
[2] 赵娜娜. 山梗菜生物碱类化学成分的研究 [D]. 长春: 长春中医药大学, 2010.
[3] 张明哲, 王景朝. 江南山梗菜化学成分的研究[J]. 植物学报, 1992, 34 (1): 58-64.
[4] Ngamgwe R F, Yankam R, Chouna J R,. Procerenone: A fatty acid triterpenoid from the fruit pericarp of(Sapotaceae) [J]., 2014, 13(4): 1425-1430.
[5] 王军民, 刘思远, 杨莹, 等. 茯神化学成分的研究 [J]. 中成药, 2021, 43(10): 2728-2732.
[6] Al-Oqail M, Hassan W H, Ahmad M S,. Phytochemical and biological studies ofHochst [J]., 2012, 20(4): 371-379.
[7] 王峰, 方振峰. 安息香化学成分研究 [J]. 中国实验方剂学杂志, 2012, 18(17): 89-92.
[8] Martins L R, Takahashi J A. Rearrangement and oxidation of beta-amyrin promoted by growing cells of[J]., 2010, 24(8): 767-774.
[9] 李秋萍, 姚彩云, 吴玲玲, 等. 节节红化学成分研究 [J]. 中国现代中药, 2019, 21(5): 572-576.
[10] 胡永, 段玉书, 苑春茂, 等. 艾纳香中1个新倍半萜内酯及其细胞毒活性研究 [J]. 中草药, 2019, 50(14): 3274-3278.
[11] Xie R X, Chen J L, Zhou L Q,. Oreocharioside A-G, new acylated C-glycosylflavones from(Gesneriaceae) [J]., 2022, 158: 105158.
[12] Tao L L, Xu S Y, Zhang Z Z,. Bioassay-guided isolation of α-glucosidase inhibitory constituents from[J]., 2022, 21(0): 1-12.
[13] 李明, 韩淑英. 熊果酸对2型糖尿病大鼠的降糖作用 [J]. 华北理工大学学报: 医学版, 2016, 18(5): 353-355.
[14] 宋志成, 王世盛, 宋其玲, 等. 齐墩果酸的结构修饰和α-葡萄糖苷酶抑制活性 [J]. 高等学校化学学报, 2012, 33(4): 744-749.
A new triterpenoids and biological activities from
QIU Jue-lin1, 2, 3, CHEN Jun-lei1, 2, WEN Ying-huan1, 2, WANG Zhao-yang1, 2, LI Huan-yang1, 2, FU Mao1, 2, YUAN Chun-mao1, 2, HUANG Lie-jun1, 2, HAO Xiao-jiang1, 2, 4, GU Wei1, 2
1. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medical University ,Guiyang 550014, China 2. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550014, China 3. Pharmacy of Guizhou Medical University, Guiyang 550025, China 4. Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China
To study the chemical constituents and biological activities of triterpenoids from.The chemical constituents were isolated and purified by silica gel, Sephadex LH-20 and HPLC. The chemical structures were identified by the spectroscopic methods (NMR and MS). The cytotoxic activities to the human non-small-cell lung cancer A549 cells of the compounds were determined by 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl tetrazolium bromide (MTT) assay. Moreover, the α-glycosidase inhibitory activity of the compounds were determined by 4-nitrophenyl-α--glucopyranoside (PNPG) assay.Six triterpenoids were isolated from.and identified as 3β-hexadecanoate-olean-12-en-11-one (1), ursolic acid (2), oleanic acid (3), sumaresinolic acid (4), 3β-hydroxy-olean-12-en-11-one (5), and 32,33,34-trimethyl-bacteriohopan-16-ene 3-β- glucopyranoside (6). The screening results showed that compounds 1 and 5 had strong inhibitory activity for the A549 cells with the IC50value of (26.72±2.05) μmol/L and (36.70±3.43) μmol/L. While compounds 2 and 3 had strong inhibitory activities against α-glycosidase with the IC50values of (28.97±1.73) and (11.87±1.18) μmol/L, respectively, which were higher than that of acarbose, and compound 1 exhibted moderate inhibitory activities against α-glycosidase with the IC50value of (148.47±2.09) μmol/L, which was similar to acarbose.Compound 1 is a new compound named davidioterpene A. Compounds 2−6 are isolated fromfor the first time. Compounds 2 and 5 have strong inhibitory activity against A549 cells. Compounds 1−3 are found to have definite α-glycosidase inhibitory activity.
Franch.; triterpenoids; davidioterpene A; cytotoxic activity; α-glycosidase inhibitory; ursolic acid; oleanic acid; 3β-hydroxy-olean-12-en-11-one
R284.1
A
0253 - 2670(2023)06 - 1713 - 06
10.7501/j.issn.0253-2670.2023.06.002
2023-01-10
国家自然科学基金项目(32060081);国家自然科学基金项目(31860074);国家自然科学基金项目(U1812403);贵州医科大学学术新苗项目(19NSP003)
邱珏琳,女,硕士,研究方向为天然药物化学。E-mail: 1214316595@qq.com
顾 玮,女,博士,副研究员,研究方向为民族药物化学。Tel: (0851)63804492 E-mail: guwei@mail.kib.ac.cn
郝小江,男,博士,研究员,研究方向为化学生物学。Tel: (0851)63804492 E-mail: haoxj@mail.kib.ac.cn
[责任编辑 王文倩]
