白蛋白-奥曲肽纳米颗粒制备及其缓释性能
2023-03-20李昇原黄永鹏汪春江李秀兰
李昇原, 黄永鹏, 唐 慧, 汪春江, 李秀兰, 陈 博
(1. 四川轻化工大学 机械工程学院, 四川 宜宾 644000; 2. 国民核生化灾害防护国家重点实验室, 北京 102205)
多肽药物药理活性好,药效专一性高,毒副作用小,在治疗疾病时具有良好的应用前景[1-2],然而,多肽药物存在易被酶降解、 半衰期短、 稳定性弱、 组织屏障通透性差等不足,造成在临床应用上生物利用率低、 给药频繁、 患者依从性低等问题[3-5]。 纳米缓释制剂能够提高药物组织的滞留性和屏障穿透性,延长药物的作用时间,进而改善多肽药物存在的问题,是多肽药物制剂研发的重点方向[6-8]。
人血清白蛋白(human serum albumin, HSA)是人体血浆中含量最丰富的蛋白,由585个氨基酸构成,半衰期约为19 d,具有安全无毒、 生物相容性好、 低免疫原性等优点,是理想的药物载体[9-10]。人血清白蛋白纳米颗粒(HSA-NPs)的制备方法有反溶剂法、 自组装法、 乳化法、 凝胶法、 纳米喷雾干燥法和纳米白蛋白结合技术法等。反溶剂法通过向HSA溶液中添加反溶剂来降低HSA的溶解度,使HSA从水相脱溶、析出而获得纳米颗粒,工艺简单,制备的颗粒粒径较小,相较于其他方法具有明显的优势[11-13]。
将HSA制备成纳米载体并与多肽药物结合,能显著提高多肽药物在体内的稳定性及活性,避免过早被机体降解清除,延长体内的释放与作用时间[14-16]。此外,临床研究表明,HSA与奥曲肽(octreotide, OCT)等多肽药物联合用药,能够发挥更优的治疗效果[17]。目前,以HSA为载体负载多肽药物的纳米缓释药剂研究尚处于起步阶段。
本文中利用乙醇-水反溶剂法制备HSA-NPs,比较不同交联剂的交联性能,探讨白蛋白质量浓度、 醇水体积比、 脱溶温度、 溶剂pH、 交联时间等工艺参数对HSA-NPs性能的影响,获得制备HSA-NPs的优选工艺参数;选取OCT作为多肽模型药物,通过浸渍吸附-冷冻干燥法构建HSA-OCT微粉制剂,初步探索制剂的药物负载与释放效应,为研发OCT及多肽药物缓释制剂提供研究基础。
1 实验
1.1 试剂材料
药物:人血清白蛋白(HSA,质量分数为99%,上海吉至生化科技有限公司); 奥曲肽(OCT,质量分数为99.1%,批号为2018053003-1,浙江湃肽生物有限公司)。
交联剂:戊二醛溶液(体积分数为50%,上海麦克林生化科技有限公司); 1, 6-己二异氰酸酯(体积分数为99%,北京百灵威公司); 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、 京尼平(质量分数为98%、 上海阿拉丁生化科技股份有限公司); 葡萄糖(分析纯,北京化工厂)。
其他试剂: 无水乙醇、 氢氧化钠、 盐酸(分析纯,北京化工厂); 乙腈、 高氯酸(色谱纯,德国Merck公司); PBS缓冲液(pH为7.4)(武汉赛维尔生物科技有限公司)。
1.2 颗粒制备
1.2.1 白蛋白纳米颗粒
称取适量HSA, 溶于pH为3~11的水溶液中(用质量分数为0.1%的氢氧化钠和盐酸溶液调节), 配成质量浓度为5、 10、 20、 50 g/L的HSA溶液; 以转速为500 r/min进行搅拌, 分别按醇水体积比为1∶1、 2∶1、 2.5∶1、 3∶1、 4∶1、 6∶1、 8∶1向HSA溶液中加入反溶剂无水乙醇; 待溶液出现蓝色乳光, 加入交联剂, 反应时间分别为3、 6、 12、 24 h, 最后旋转蒸发除去乙醇, 得到胶体溶液; 将胶体溶液在转速为18 000 r/min条件下离心处理20 min, 并用纯水洗涤, 利用LGJ-18型真空冷冻干燥仪(北京松源华兴科技公司)冻干得到HSA-NPs冻干粉。
1.2.2 白蛋白-奥曲肽微粉制剂
采用浸渍吸附-冷冻干燥法制备白蛋白-奥曲肽微粉制剂。取50 mg冻干后的HSA-NPs,加入30 mL质量浓度为3.33 g/L的OCT溶液, 在室温条件下以转速为500 r/min搅拌12 h, 得到载有OCT的HSA-NPs混悬液; 最后将混悬液进行离心处理除去上清液, 冻干后得HSA-OCT微粉制剂。
1.3 颗粒表征
利用BT-90+型动态光散射纳米激光粒度仪(丹东百特仪器有限公司)测量HSA-NPs的粒径和多分散指数(PDI), 对比不同时间点平均粒径和PDI的变化情况, 研究纳米颗粒的储存稳定性; 采用ZS90型纳米粒度电位仪(英国马尔文仪器有限公司)测量HSA-NPs的Zeta电势; 使用SU8020型扫描电镜(日本Hitachi公司)观察HSA-NPs冻干粉和HSA-OCT微粉制剂的微观形貌。
1.4 白蛋白颗粒的综合评价方法
运用Z分综合评价法,从颗粒的性能、工艺稳定性2个方面筛选最优工艺条件。颗粒性能以平均粒径小、 PDI值低为优;工艺稳定性用多次实验所得平均粒径和PDI值的相对标准偏差(RSD)值表示,RSD值越小工艺越稳定。将各指标的Z分等权相加得到Z分,Z分越大评价结果越优。单个指标的Z分的计算公式为
(1)
1.5 白蛋白-奥曲肽微粉制剂的评价方法
1.5.1 载药量测定
采用1260型高效液相色谱法(美国Agilent公司)测定HSA-NPs中OCT的质量浓度。色谱柱Eclipse plus C18尺寸为φ4.6 mm×250 mm(直径×长度), 色谱柱内的填料间孔径为5 μm, 检测波长为210 nm, 柱温为25 ℃; 流动相中, 乙腈与质量分数为0.25%的高氯酸水溶液的体积比为30∶70,流量为1 mL/min,待检测溶液的进样体积为5 μL[18]。
取一定质量的HSA-OCT制剂置于离心管,加入纯水溶解后超声处理40 min并静置一段时间,通过分析溶液中OCT的质量浓度测定载药量。
1.5.2 药物体外释放性能的测定
药物体外释放性能参照药物体外溶出度进行评定[19]。 取一定质量的HSA-OCT微粉制剂装入透析袋, 加入PBS溶液至充盈透析袋, 保证药物制剂完全润湿; 扎紧透析袋两端并浸没在100 mL(溶出介质总体积)的PBS溶液中, 将装有全部溶出介质容器置于磁力搅拌机上, 在37 ℃恒温条件下以转速为100 r/min进行搅拌。 按照设定的时间节点, 每次取出1 mL溶出介质后再补充1 mL新鲜介质, 分析溶出介质中OCT的质量浓度。 HSA-OCT微粉制剂的累计溶出度Q的计算公式为
(2)
式中:Ci和Cn分别为第i次和第n次最终取样时OCT的质量浓度, g/L;m为OCT溶出总质量, mg;V1为每个时间节点取出的溶出介质体积, mL;V2为溶出介质总体积, mL。
2 结果与讨论
2.1 交联剂的选择
HSA分子含有大量的极性基团,从水相脱溶析出的HSA-NPs不稳定,易复溶转为水相或团聚成大颗粒[20-21]。交联剂能连接HSA分子,稳定HSA-NPs。目前,HSA的交联主要针对HSA游离的59个氨基[22]。
作为交联剂的京尼平、 葡萄糖、 1, 6-己二异氰酸酯和戊二醛均能与HSA表面游离的氨基反应,交联剂的加入质量为交联HSA分子表面59个氨基理论所需质量的100%。在交联过程中,EDC主要发挥活化HSA表面羧基、促使羧基与氨基偶联的催化作用。结合文献[23-24]和预实验结果,EDC加入量为交联HSA分子表面59个氨基理论所需量的10%,进一步提高EDC加入量会导致HSA分子过度交联产生沉淀。
取1 mL质量浓度为10 g/L的HSA溶液, 搅拌状态下加入2 mL无水乙醇, 交联时间设为3 h, 不同交联剂对HSA-NPs性能的影响如图1所示。 由图1(a)可见, 刚制备的HSA-NPs粒径差距不大, 均小于200 nm; 储存时间为10、 20 d以后, 未添加交联剂或使用葡萄糖、 京尼平的HSA-NPs粒径明显增大, 平均粒径大于750 nm, 添加交联剂EDC、 1, 6-己二异氰酸酯、 戊二醛的HSA-NPs粒径未有明显变化。 由图1(b)可见, 未添加交联剂或使用葡萄糖、 京尼平作为交联剂制备的颗粒的PDI值超过了0.25, 说明粒径均一性较差, 添加交联剂EDC、 1, 6-己二异氰酸酯、 戊二醛的HSA-NPs粒径均一性较好。
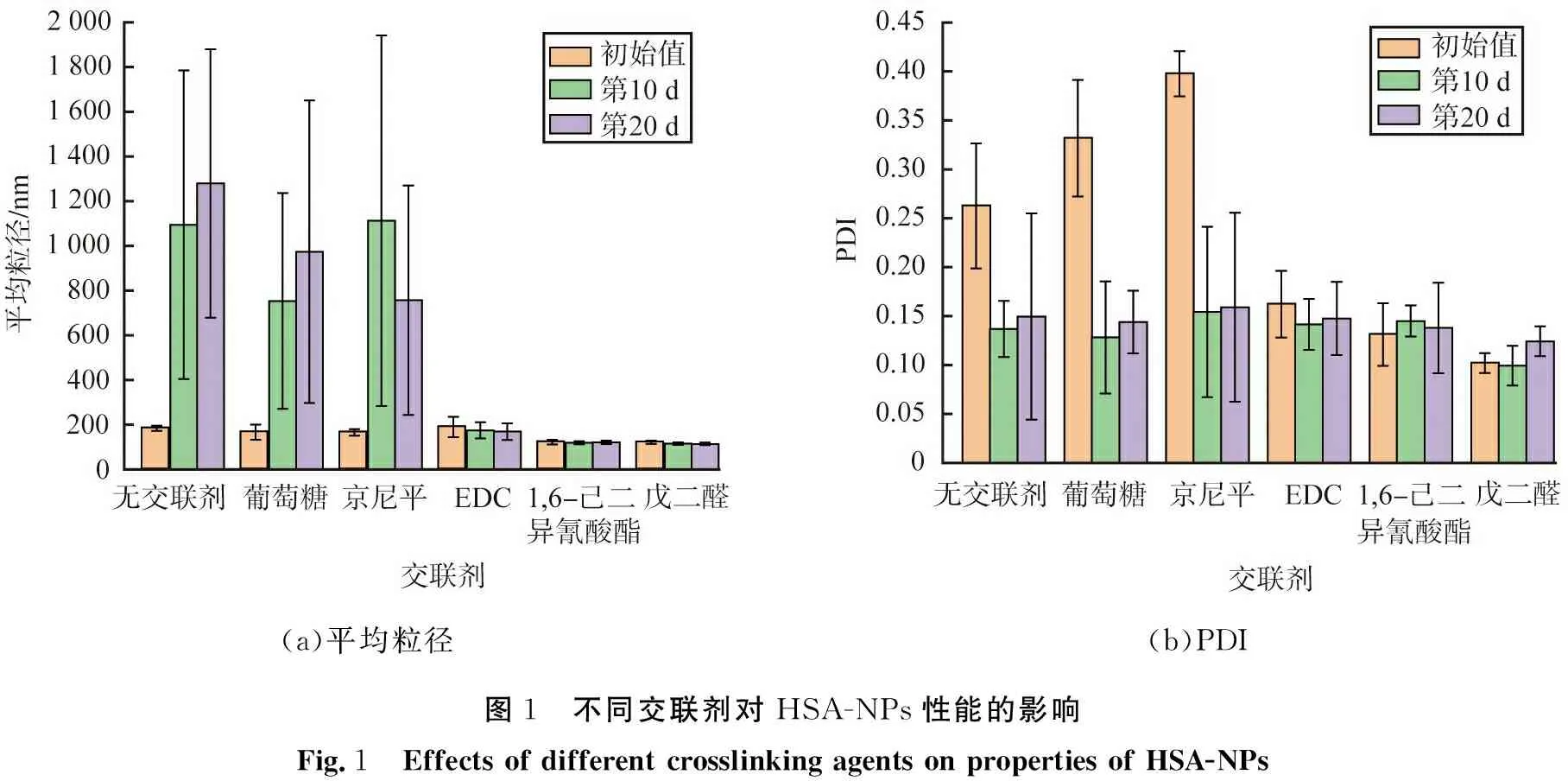
(a)平均粒径(b)PDI图1 不同交联剂对HSA-NPs性能的影响Fig.1 Effects of different crosslinking agents on properties of HSA-NPs
储存10 d后不同交联剂制得的HSA-NPs的SEM图像见图2。由图(a)—(c)可知,未添加交联剂或使用葡萄糖、京尼平作为交联剂制备的HSA-NPs颗粒之间有明显得团聚现象;图(e)、 (f)分别为使用1, 6-己二异氰酸酯和戊二醛制备的HSA-NPs颗粒,由图可知纳米颗粒呈圆球状且具有较好的分散性; 图(d)为EDC制备的HSA-NPs颗粒,对比发现颗粒之间存在一定程度的团聚,但团聚程度弱于未添加交联剂或使用葡萄糖、 京尼平作所制备的颗粒。

(a)无交联剂(b)葡萄糖(c)京尼平(d)EDC(e)1, 6-己二异氰酸酯(f)戊二醛图2 储存10 d后不同交联剂制得的HSA-NPs的SEM图像Fig.2 SEM images of HSA-NPs prepared with different crosslinking agents after storage for 10 days
反溶剂法制备HSA-NPs的实质是HSA分子从水相均相成核、 长大的过程。由于纳米颗粒表面能的增大,因此该过程还伴随着颗粒的团聚现象。交联剂不改变HSA溶液的过饱和度,因此,颗粒的粒径及稳定性由团聚倾向决定。HSA的等电点为4.8[25],当HSA处于非等点状态时,其表面会附带同种电荷。同种电荷数量越多,颗粒之间排斥力越强,就越能抵消颗粒团聚倾向,使颗粒保持稳定。交联剂能通过改变纳米颗粒表面的电荷量影响颗粒的粒径、 分散性和稳定性。纳米颗粒均带负电荷,不同交联剂制得的HSA-NPs的Zeta电势绝对值如图3所示。由图可见,未交联或使用葡萄糖、 京尼平交联后HSA-NPs的Zeta电势较小,颗粒附带的电荷量较少,颗粒间排斥力弱,因此不稳定,易团聚;因为不稳定的颗粒易在交联剂的作用下形成更大的颗粒,使颗粒粒径分布更宽,所以葡萄糖、 京尼平交联后的颗粒PDI值更大,粒径均一性更差;1, 6-己二异氰酸酯和戊二醛交联的纳米颗粒Zeta电势较大,颗粒具有较多的同种电荷,排斥力较强,没有团聚现象,制备的HSA-NPs性能较好;EDC交联的纳米颗粒Zeta电势处于中间状态,颗粒的电荷量介于二者之间,制备的HSA-NPs存在一定程度的团聚现象。
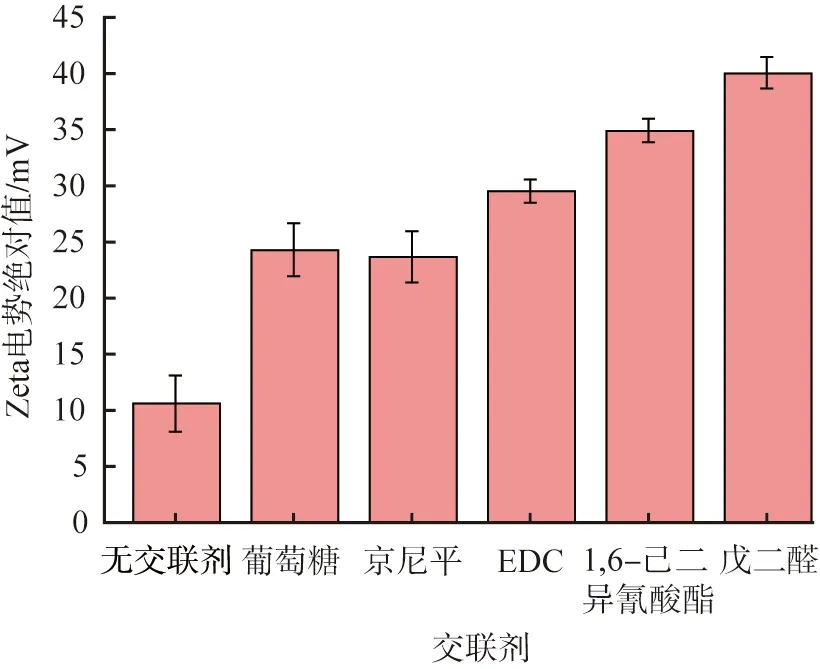
图3 不同交联剂制得的HSA-NPs的Zeta电势Fig.3 Zeta potential of HSA-NPs prepared with different crosslinking agents
表1为不同交联剂制得的HSA-NPs的Z分评价结果。由表可以看出,EDC、 戊二醛、 1, 6-己二异氰酸酯作为交联剂制备的HSA-NPs的平均粒径分别为(190.0±19.45)、 (121.7±4.70)、 (122.9±7.1) nm, PDI值分别为0.13±17.18、 0.13±8.14、 0.13±19.85;Z分分别为-4.34、 -4.34、 0.40;戊二醛交联的HSA-NPs纳米颗粒的平均粒径、 PDI值和工艺稳定性均较好,说明Z分最大的戊二醛为优选交联剂。葡萄糖、 京尼平的交联能力较差,不纳入评价。
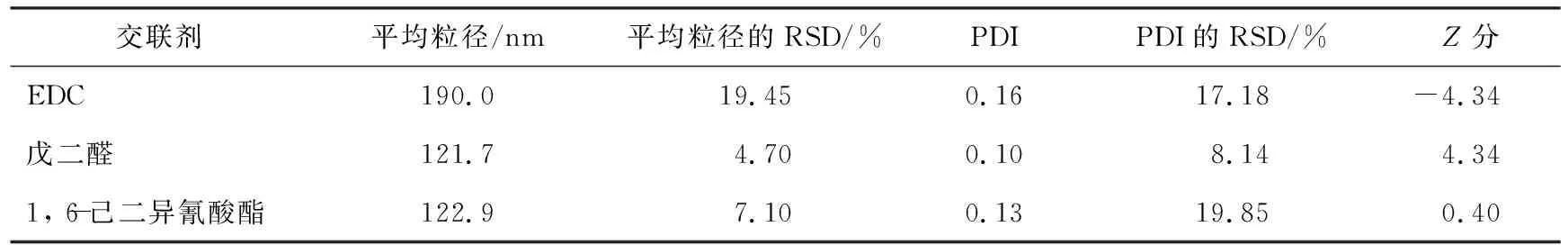
表1 不同交联剂制得的HSA-NPs的Z分评价结果
2.2 白蛋白纳米颗粒的优选工艺参数
2.2.1 白蛋白质量浓度
以戊二醛作为交联剂, 设定醇水体积比为2∶1, 交联时间为3 h, pH为7, 脱溶温度为20 ℃, HSA质量浓度对HSA-NPs性能的影响如图4所示。 由图可知, 随着HSA质量浓度的增加, HSA-NPs纳米颗粒的粒径逐渐减小, PDI值先减小后增大, 各项工艺参数的Z分则先增大后减小; 当HSA的质量浓度为10 g/L时,Z分最大为0.88,因此,根据Z分评价结果, HSA的优选质量浓度为10 g/L。

图4 HSA的质量浓度对HSA-NPs性能的影响Fig.4 Effect of HSA mass concentration on HSA-NPs performance
根据液相均匀成核理论,颗粒的成核、 生长速率是影响粒径及其分布的主要因素。质量浓度大的HSA溶液具有较大的过饱和度,颗粒成核、 生长速率快,所得纳米颗粒小,因此HSA-NPs的平均粒径随HSA质量浓度的增大而逐渐减小;另一方面,质量浓度大的HSA溶液生成的颗粒较多,颗粒之间更易碰撞、 团聚,同时由于溶液的黏度较大,降低了HSA分子在水和乙醇之间的扩散速率,因此HSA-NPs的粒径分布较宽,PDI值较大。对于质量浓度较小的HSA溶液,颗粒成核、 生长速率较慢,所需脱溶反应时间较长,使得纳米颗粒的粒径分布同样不均匀,适中的成核速率能保证颗粒的粒径及其分布均较优。
当传统的题材进入到陶瓷的领域中也在陶瓷领域的疆土中开辟出独具花鸟瓷画风格的一片疆土。这种与众不同的瓷画表现形式让皇族到百姓,无一不为之美感而折服,从而使花鸟瓷画享誉世界。
2.2.2 醇水体积比
以戊二醛作为交联剂, 设定交联时间为3 h, pH为7, 脱溶温度为20 ℃, HSA质量浓度为10 g/L, 醇水体积比对HSA-NPs性能的影响如图5所示。 由图可以看出, 当醇水体积比为1∶1时纳米颗粒平均粒径为(267.56±11.3) nm, PDI值为0.19±21.8; 醇水体积比为2∶1、 2.5∶1、 8∶1时,能获得较小的平均粒径,分别为(102.9±7.9)、 (86.9±24.6)、 (107.7±15.25) nm, 醇水体积比为2.5∶1、 8∶1时制备的纳米颗粒的PDI值大于0.25。 醇水体积比为3∶1、 4∶1、 6∶1时平均粒径超过了1 200 nm, 颗粒的性能较差, 不纳入Z分计算范围。 当醇水体积比为2∶1时,Z分最大为1.54, 因此, 根据Z分评价结果, HSA-NPs的优选醇水体积比为2∶1。

图5 醇水体积比对HSA-NPs性能的影响Fig.5 Effects of volumn ratio of alcohol to water on HSA-NPs performance
醇水体积比会改变溶液的过饱和度, 从而影响体系内颗粒的粒径、 分布情况, 不同醇水体积比制备的HSA-NPs粒径分布如图6所示。 由图可见, 醇水体积比为1∶1时, 溶液产生的过饱和度较低, 颗粒成核、 生长速率慢, 制备的颗粒粒径为100~500 nm,由于溶剂体积小,颗粒间易碰撞发生团聚,因此体系中还存在大于1 000 nm的大颗粒;醇水体积比为2∶1时,过饱和度有明显提高,此时生成的纳米颗粒粒径为50~250 nm,粒径分布较为集中;随着醇水体积比进一步的增大,溶液产生的过饱和度逐渐增大,能生成更细小的粒径小于50 nm颗粒,但小颗粒团聚倾向大,使得颗粒呈多种分散状态;醇水体积比为2.5∶1时,开始存在明显的团聚现象,制备的颗粒粒径为15~700 nm,因为体系内小颗粒数量较多,所以HSA-NPs的平均粒径小,但粒径分布宽,PDI值大;醇水体积比达到4∶1时,颗粒的团聚倾向最大,体系存在大量的大颗粒;继续增加醇水体积比,溶液中产生的过饱和度趋于恒定,但溶剂体积逐渐增大,降低了颗粒碰撞、 团聚的概率,因此颗粒的粒径有所减小;当醇水体积比为8∶1时,团聚倾向明显减弱,体系中只存在少量大颗粒。综上,从粒径分布情况来看,当醇水体积比为2∶1时,制备的HSA-NPs颗粒的性能最优。
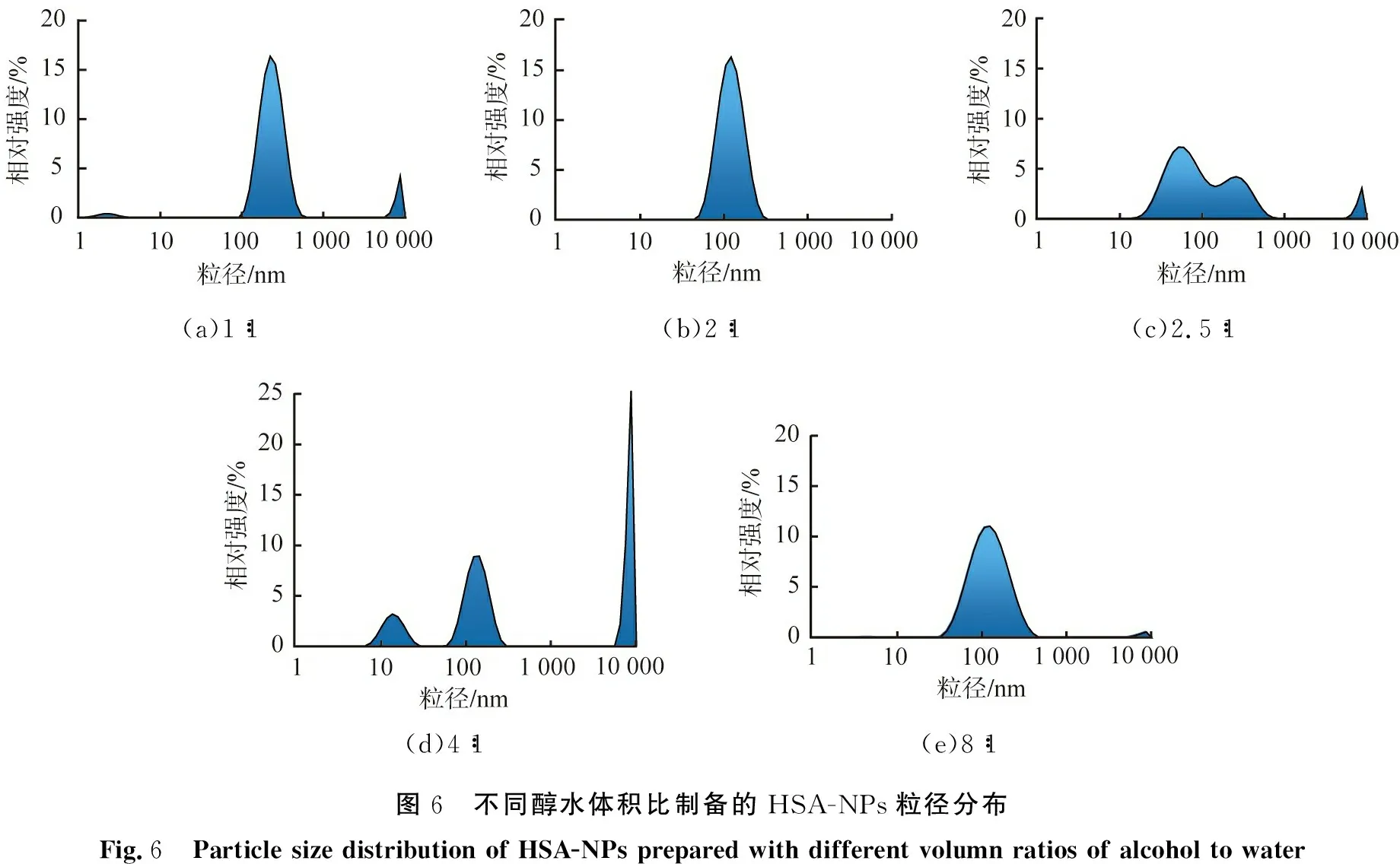
(a)1∶1(b)2∶1(c)2.5∶1(d)4∶1(e)8∶1图6 不同醇水体积比制备的HSA-NPs粒径分布Fig.6 Particle size distribution of HSA-NPs prepared with different volumn ratios of alcohol to water
2.2.3 脱溶温度
以戊二醛作为交联剂,设定交联时间为3 h,pH为7,HSA质量浓度为10 g/L,醇水体积比为2∶1,将HSA溶液进行水浴,脱溶温度对纳米颗粒性能的影响如图7所示。由图可见,当脱溶温度为5 ℃时,纳米颗粒的平均粒径与PDI值均较大;当脱溶温度为10~30 ℃时,随温度的升高,HSA-NPs的平均粒径逐渐增大,PDI值逐渐减小;Z分随着脱溶温度的升高呈现先增大后减小的变化规律;当脱溶温度为20 ℃时,Z分最大为2.68,因此,根据Z分评价结果,HSA-NPs的优选脱溶温度为20 ℃。

图7 温度对HSA-NPs性能的影响Fig.7 Effects of temperature on HSA-NPs performance
实验发现,脱溶温度为5 ℃时,溶液未观察到明显的蓝色乳光,表明体系内生成的纳米颗粒数量较少,低温抑制了HSA分子脱溶析出过程。当脱溶温度为10~30 ℃时,HSA分子能正常脱溶析出生成纳米颗粒,一方面,随着脱溶温度的升高,溶液产生的饱和度逐渐降低,体系内颗粒成核与生长速率减缓,使得制备的颗粒平均粒径逐渐增大,温度通过改变HSA的溶解度而直接影响过饱和度;另一方面,温度会影响分子的扩散速率,温度越高分子扩散速率越快,微观混合越充分,制备的颗粒粒径分布就均匀。综上,从温度对HSA的过饱和度和扩散速率的影响来看,优选脱溶温度为20 ℃。
2.2.4 溶剂pH

图8 溶剂pH对HSA-NPs性能的影响Fig.8 Effects of solvent pH on HSA-NPs performance
因为HSA分子在不同pH溶液中带电量不同,所以可以通过调节溶剂pH来改变HSA分子的静电作用, 制备不同粒径的纳米颗粒。然而, HSA分子中的咪唑环(位于16个组氨酸上)以及末端的氨基和羧基能够被质子化, 使其具有一定的酸碱缓冲能力[26], 同时, 调节溶剂pH时引入的离子, 会削弱纳米颗粒之间的静电排斥力[27], 使粒径略大于中性溶液中的颗粒。
2.2.5 交联时间
以戊二醛作为交联剂,设定HSA质量浓度为10 g/L,醇水体积比为2∶1,脱溶温度为20 ℃时, 溶剂pH为9时, 交联时间对HSA-NPs性能的影响如图9所示。 由图可见, 交联时间对颗粒的平均粒径和PDI值影响不大; 不同交联时间下, 颗粒的平均粒径均小于120 nm, 分散性良好。 当交联时间为24 h时,Z分最大为1.52, 因此, 根据Z分评价结果, HSA的优选交联时间为24 h。
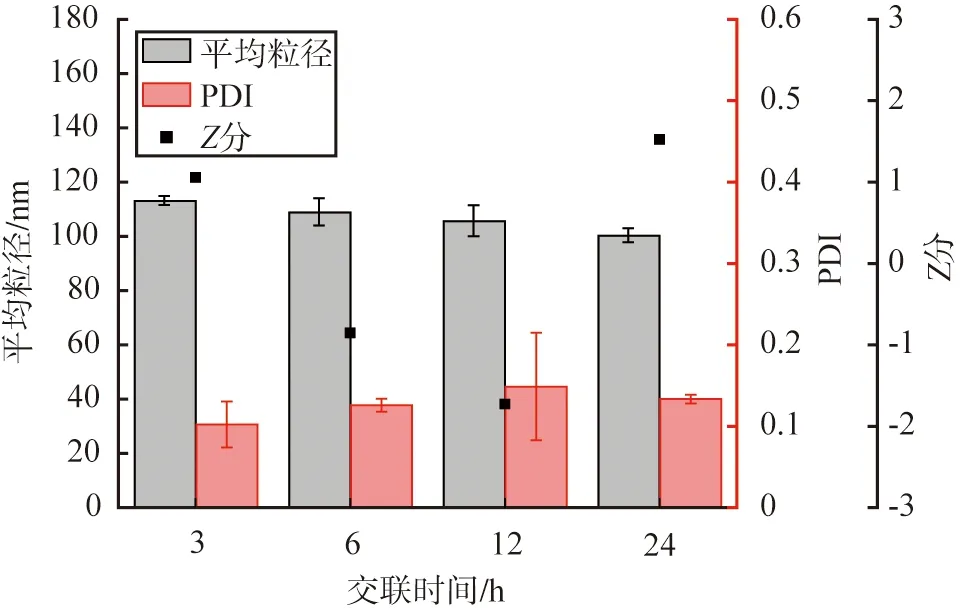
图9 交联时间对HSA-NPs性能的影响Fig.9 Effects of crosslinking time on HSA-NPs performance
2.2.6 优选工艺条件
综合上述评价结果, 制备HSA-NPs的优选工艺参数为: HSA的质量浓度为10 g/L; 醇水体积比为2∶1; 脱溶温度为20 ℃;溶剂pH为9;交联时间为24 h。在此条件下制备的HSA-NPs工艺稳定性良好,平均粒径为(100.6±2.5) nm, PDI为0.13±0.01。
2.3 纳米颗粒的载药量与体外释放性能
HSA-NPs冻干粉与HSA-OCT制剂的SEM图像如图10所示。由图可以看出,载药前、 后纳米颗粒的形态未发生明显变化,保持为规则的球状形貌,经计算,HSA-OCT微粉制剂的载药量为1.83%。对载药机理进行分析后发现,OCT的等电点为8.2[28],在纯水中OCT分子表面带正电荷,因此能与带负电荷的HSA-NPs发生静电作用,吸附于纳米颗粒表面;同时HSA分子中的α-螺旋形成了较多的网状空隙,为OCT的吸附提供了有利空间。

(a)HSA-NPs冻干粉(b)HSA-OCT制剂图10 HSA-NPs冻干粉与HSA-OCT制剂的SEM图像Fig.10 SEM images of HSA-NPs freeze-dried powder and HSA-OCT preparation
HSA-OCT制剂和OCT原药的累计溶出度随时间的变化曲线如图11。由图可见,OCT原药在累计释放时间为120 min内时累计溶出度达到了90.6%,累计释放时间为480 min后完全溶出;HSA-OCT制剂较OCT原药释放缓慢,有较明显的缓释作用, 药物累计释放时间达到2 160 min, 但时间为0~30 min时却无药物溶出, 可能是因为HSA-NPs的吸附能力较强, 需要经过一定时间后OCT才能释放。

(a)0~2 500 min(b)0~60 min图11 HSA-OCT制剂和OCT原药的累计溶出度随时间的变化曲线Fig.11 Curve of cumulative dissolution of HSA-OCT preparation and OCT agent changing with time
3 结论
本文中采用反溶剂法制备HSA-NPs,对比了不同交联剂的交联性能;研究了白蛋白质量浓度、 醇水体积比、 脱溶温度、 溶剂pH、 交联时间等工艺参数对HSA-NPs性能的影响;运用浸渍吸附-冷冻干燥法构建了HSA-OCT微粉制剂,分析了OCT原药和HSA-OCT微粉制剂的体外缓释性能。
1)交联剂能改变HSA分子表面的静电作用,降低HSA-NPs的团聚倾向,从而稳定固化HSA-NPs。在所选交联剂中,戊二醛交联的HSA-NPs纳米颗粒的性能、工艺稳定性最优,制备的颗粒微观形貌为规则球状,储存稳定性良好。经Z分综合评价戊二醛为优选交联剂。
2)HSA质量浓度、 醇水体积比和脱溶温度对HSA-NPs的性能影响较大。 根据Z分评价结果, 制备HSA-NPs颗粒的优选工艺参数为: HSA质量浓度为10 g/L, 醇水体积比为2∶1, 脱溶温度为20 ℃, 溶剂pH为9, 交联时间为24 h。 在优选工艺参数参数条件下制备的纳米颗粒的平均粒径为(100.6±2.5) nm, PDI为0.13±0.01。
3)载药前后HSA-NPs微观形貌未发生明显变化。相较于OCT原药,HSA-OCT微粉制剂具有明显的缓释效应,持续释药时间为2 160 min,具有较好的体外释放性能。
