牙鲆TAK1基因的表达分析及免疫功能探究❋
2023-03-14李恒顺王宣刚曲江波王志刚刘金相张全启于海洋
李恒顺,司 瑜,王宣刚,曲江波,王志刚,刘金相,2,3,张全启,2,3,于海洋❋❋
(1.中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003;2.中国海洋大学三亚海洋研究院 海南省热带水产种质重点实验室,海南 三亚 572000;3.青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
转化生长因子β激活激酶1(Transforming growth factor β-activated kinase 1, TAK1)又称丝裂原活化蛋白激酶激酶激酶7(Mitogen-activated protein kinase kinase kinase 7, MAP3K7),属于丝氨酸/苏氨酸(Serine/threonine)蛋白激酶,是丝裂原活化蛋白激酶激酶激酶(MAP3K)家族的重要成员[1]。作为细胞内的关键信号分子,TAK1基因可以响应外界各种刺激信号,参与调节多种细胞信号转导过程[2-3]。TAK1基因于1995年首次在转化生长因子-β(TGF-β)信号通路中被发现,最初被鉴定为TGF-β信号通路中激活丝裂原活化蛋白激酶(MAPK)的关键调节因子,可被TGF-β和骨形态发生蛋白(BMP)激活[4]。随后的研究表明,TAK1也是免疫信号传导和促炎细胞因子通路中的关键调节蛋白,可被多种免疫刺激信号分子激活,包括白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、B和T细胞受体(BCR和TCR)配体以及 Toll 样受体(TLR)配体(LPS、病毒ssRNA、dsRNA和DNA等)[3,5]。TAK1通过激活多种信号通路(如TGF-β/BMP、Wnt/Fz、JNK和NF-κB通路等),在先天性和适应性免疫反应、炎症反应、神经褶皱形态发生、血管发育和肿瘤发生等生物过程中发挥着重要的调节作用[6-8]。其中,关于TAK1对促炎和先天免疫信号通路的调节作用已被广泛研究。当细胞受到外界病原体等刺激后,位于上游的TRAF2和TRAF6通过形成K63连接的多聚泛素链来诱导TAK1的激活,随后激活的TAK1 通过分别磷酸化激活IκB激酶(IKK)复合物和MAPKs(ERK、JNK、p38 MAPK)来介导核因子-κB(NF-κB)和激活蛋白-1(AP-1)转录因子的激活,使NF-κB和AP-1转录因子从细胞质转移至细胞核中,从而激活下游促炎细胞因子基因(TNF-α、IL-1β、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)等)的转录表达[3,5,9]。同样,部分硬骨鱼中的研究也表明TAK1具有一定的免疫功能。如Zhao F等发现TAK1参与了草鱼(Ctenopharyngodonidella)抵抗小瓜虫(Ichthyophthiriusmultifiliis)感染的先天免疫防御过程[10];Li Y W等克隆鉴定了斜带石斑鱼(Epinepheluscoioides)TAK1基因,并发现其对TLR信号通路具有负调控作用[11];Jang J H等发现在虹鳟(Oncorhynchusmykiss)RTH-149细胞中敲降TAK1能够显著阻断由LPS诱导的p38 MAPK和JNK的磷酸化,并可显著下调由LPS诱导的MAPKs和NF-κB下游炎症细胞因子基因的表达[12]。
牙鲆(Paralichthysolivaceus)属硬骨鱼纲鲽形目牙鲆科牙鲆属,是中国重要的海水经济养殖物种,近年来高密度的集约化养殖使得牙鲆易受细菌、病毒、寄生虫等病原体的感染,严重阻碍了牙鲆养殖业的健康发展[13-15]。迟缓爱德华氏菌(Edwardsiellatarda)属革兰氏阴性胞内寄生致病菌,是一种牙鲆养殖过程中常见的致病菌,能够引起牙鲆的腹水病和出血性败血症,严重危害牙鲆的健康生存[16-18]。与哺乳动物不同,作为变温、低等脊椎动物,先天免疫系统在硬骨鱼免疫应答过程中发挥着主要作用[19-21]。因此在基因层面对牙鲆的免疫系统和免疫反应机制进行深入研究,可以针对不同类型的病原体制定出相应的有效对策,避免因药物滥用而导致耐药菌出现、鱼制品中抗生素残留和水体环境污染等不良后果[22],这将有助于牙鲆疾病的进一步防治,减少养殖过程中的经济损失。
本研究以牙鲆为研究对象,鉴定克隆了牙鲆TAK1基因(PoTAK1),对其序列特征、同源性和系统进化关系进行了分析;通过qRT-PCR检测了PoTAK1在健康牙鲆各组织的分布情况;进行了牙鲆鳃细胞系体外免疫刺激实验和成体牙鲆体内攻毒实验,并通过qRT-PCR检测了PoTAK1在刺激后的表达变化情况;通过亚细胞定位检测了PoTAK1在细胞中的表达位置;通过双萤光素酶报告实验探究了PoTAK1对MAPK通路下游AP-1转录因子的调控作用;最后通过体外免疫调节检测实验探究了过表达PoTAK1对AP-1下游IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子转录表达的影响。本研究为更好地理解PoTAK1在牙鲆抵御病原体感染时发挥的免疫反应机制提供了一定的理论基础。
1 材料与方法
1.1 实验材料
本实验中所用牙鲆由海阳市黄海水产有限公司提供,体长320~420 mm,体重500~700 g。实验前,将上述牙鲆置于海水中驯养一周,驯养期间保持水温18~20 ℃,pH 7.9~8.1,盐度28~30,光周期12 h光照12 h黑暗(12L∶12D),氨氮浓度(0.13 ± 0.05)mg/L,溶解氧浓度(7.95 ± 0.50)mg/L。每天用商业饲料投喂2次,每隔一日换水一次。
本实验中所用迟缓爱德华氏菌由中国水产科学研究院黄海水产研究所赠予。实验前将该菌株在LB(Luria-Bertani)培养基中28 ℃、180 r/min培养至对数生长期。
本实验室中所用牙鲆鳃细胞系(FG9307)和HEK-293T细胞系由中国海洋大学细胞工程技术实验室赠予。使用DMEM/F12培养基(10% FBS+1%青霉素-链霉素-新霉素三抗+1%MEM非必需氨基酸溶液)培养牙鲆鳃细胞系,培养条件为24 ℃。使用DMEM培养基(10%FBS+1%青霉素-链霉素-新霉素三抗+1% MEM非必需氨基酸溶液)培养HEK-293T细胞系,培养条件为37 ℃、5% CO2。
1.2 实验试剂

1.3 PoTAK1基因核心片段的获取
在NCBI(https://www.ncbi.nlm.nih.gov/)和Ensemble(http://www.ensembl.org)数据库中检索得到斑马鱼(Daniorerio)和半滑舌鳎(Cynoglossussemi-laevis)TAK1的核酸序列,将这些序列与本实验室已有的牙鲆基因组和转录组进行本地BLAST(e值为1×10-5),获得牙鲆TAK1基因序列,将获得的牙鲆TAK1基因序列与NCBI和Ensemble数据库中牙鲆TAK1基因序列进行比较,最终确定牙鲆TAK1基因序列,随后使用IDT(https://sg.idtdna.com/pages)在线网站设计牙鲆TAK1的特异性引物(见表1),以牙鲆各组织混合cDNA为模板,进行PCR克隆验证。

表1 实验所用引物
1.4 PoTAK1基因序列分析
使用DNAMAN软件导出PoTAK1基因的核苷酸序列与氨基酸序列对应图。使用SignalP 4.1工具(https://services.healthtech.dtu.dk/service.php?SignalP-4.1)预测PoTAK1是否存在信号肽。使用SMART在线网站(http://smart.embl-heidelberg.de/)和NCBI中的CD-Search工具(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测PoTAK1基因的蛋白结构域。使用Phyre2在线工具(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测PoTAK1的蛋白质三级结构,使用PyMol软件显示PoTAK1的蛋白质三级结构。使用ExPASy在线网站中的ProtParam工具(https://web.expasy.org/protparam/)计算PoTAK1蛋白的分子量(Mw)和理论等电点(pI)。使用ClustalX 2.1程序将牙鲆与其他物种TAK1的氨基酸序列进行多序列比对分析(见表2),探究不同物种中TAK1氨基酸序列的一致性。使用Muscle方法将PoTAK1与其他物种TAK1基因的氨基酸序列进行多序列比对(见表2),然后通过MEGA7.0软件并采用邻接法(Neighbor-joining met-hod)构建系统发生树,自展值(Bootstrap)=1 000。

表2 实验所用TAK1蛋白序列登录号
1.5 牙鲆迟缓爱德华氏菌攻毒实验
具体的牙鲆攻毒实验步骤详见本实验室先前的报道[23]。
1.6 免疫刺激实验

1.7 PoTAK1-EGFP-N1过表达载体构建
在PoTAK1的ORF两端设计分别带有EcoR Ⅰ 和SacⅡ 酶切位点的引物(见表1)。通过双酶切获得PoTAK1的ORF克隆片段,将其连接到pEGFP-N1质粒中,得到PoTAK1-EGFP-N1重组质粒,待转染备用。
1.8 PoTAK1的过表达与亚细胞定位
将生长状态良好的牙鲆鳃细胞系FG-9307接种于12孔板中,当细胞覆盖率达到80%以上时,按照说明书步骤,使用LipofectamineTM3000转染试剂将PoTAK1-EGFP-N1重组质粒转染至牙鲆FG-9307鳃细胞中,同时设置转染pEGFP-N1空载质粒对照组。转染6 h后更换一次新鲜的DMEM/F12培养基(10% FBS+1%青霉素-链霉素-新霉素三抗+1% NEAAS),转染48 h后,每个孔中加入DAPI(10 μg/mL)避光孵育10 min,孵育完成后,每个孔使用无菌PBS缓冲液清洗细胞3次,随后将12孔细胞培养板迅速置于激光共聚焦显微镜下观察并拍照。
1.9 双萤光素酶报告实验
设置空载质粒对照组:pEGFP-N1(300 ng)+ pAP1-luc(100 ng)+ pRL-TK(10 ng)和实验组:PoTAK1-EGFP-N1(300 ng)+ pAP1-luc(100 ng)+ pRL-TK(10 ng)。将生长状态良好的HEK-293T细胞接种于24孔板中,当细胞覆盖率达到80%以上时,严格遵循说明书步骤,使用LipofectamineTM3000转染试剂按照上述分组情况将对应的质粒共转染至HEK-293T细胞中,转染6 h后更换一次新鲜的DMEM培养基(10% FBS+1%青霉素-链霉素-新霉素三抗+1% NEAAS),转染48 h后按照双萤光素酶报告基因检测试剂盒(Promega, USA)说明书的步骤进行双萤光素酶活性检测。
1.10 免疫调节检测实验
除增设空白对照组(不转染质粒)外,其余转染步骤与1.8中步骤相同。转染48 h后,每孔加入TNF-α(20 ng/mL)进行免疫刺激。在24 ℃条件下培养24 h后,收集细胞样品,提取RNA,通过qRT-PCR检测AP-1通路下游IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达变化情况。
1.11 牙鲆各组织、细胞RNA的提取及cDNA的合成
具体的RNA提取及cDNA合成实验步骤详见本实验室先前的报道[24]。
1.12 实时荧光定量PCR(qRT-PCR)
使用SYBR qPCR SuperMix定量试剂盒在Roche Light Cycler 480荧光定量PCR仪(Roche, Basel, Switzerland)上进行qRT-PCR检测。选择牙鲆β-actin基因作为内参基因。qRT-PCR反应程序设定为:95 ℃ 5 min,95 ℃ 15 s(40个循环),60 ℃ 40 s,每个反应设置3个重复。根据目的基因和内参基因的Ct值并使用2-ΔΔCt法计算目的基因的相对表达量,2-ΔΔCt法中相对值的设定和具体的算法可参照Livak K J等的报道[25]。本文中基因的表达变化倍数(Fold change)的计算方法为将实验组和对照组在相应时间点的目的基因的相对表达量求比值得到基因的表达变化倍数。
1.13 数据分析
所有数据均以三个重复的平均值±标准误(Mean±SEM)表示。所有统计分析均使用SPSS 20.0(IBM,NY,USA)进行单因素方差分析或独立样本t检验。p<0.05表示差异有统计学意义。
2 结果
2.1 PoTAK1基因的序列分析
以牙鲆各组织混合cDNA为模板,PCR扩增获得PoTAK1基因的ORF序列,将其与NCBI数据库中的牙鲆TAK1序列进行比对,结果完全一致。PoTAK1的最长开放阅读框(ORF)长为1 728 bp,编码575个氨基酸,ExPASy中的ProtParam工具预测其蛋白分子量(Mw)约为64.33 kDa,理论等电点(pI)为6.66。SignalP 4.1工具在线预测发现PoTAK1蛋白不存在信号肽。SMART在线网站和NCBI中的CD-Search工具预测PoTAK1蛋白在第27~275 aa位点存在一个丝氨酸/苏氨酸蛋白激酶催化结构域(Serine/threonine protein kinase catalytic domain, S_TKc domain),在第499~562 aa位点存在一个卷曲螺旋区域(Coiled coil region)(见图1)。同样,在PoTAK1蛋白中也鉴定出与哺乳动物TAK1蛋白S_TKc结构域中一致的两个保守的苏氨酸残基(Thr)和一个典型的丝氨酸残基(Ser),分别位于PoTAK1蛋白序列中的Thr175、Thr178和Ser183氨基酸位点(见图1)。此外,蛋白质三级结构分析结果也显示,在PoTAK1的N端存在一个S_TKc结构域,在C端存在一个卷曲螺旋区域(见图2)。

(灰色阴影部分表示S_TKc结构域(27~275 aa位点)。绿色阴影部分表示卷曲螺旋区域(499~562 aa位点)。红色字体表示保守的丝氨酸(Ser183)和苏氨酸残基(Thr175、Thr178)。星号表示终止密码子。The S_TKc domain(27~275 aa)is shown in gray shadow.The coiled coil region(499~562 aa)is shown in green shadow.The conserved serine(Ser183)and threonine(Thr175, Thr178)residues are indicated by red font.The asterisk represents the stop codon.)
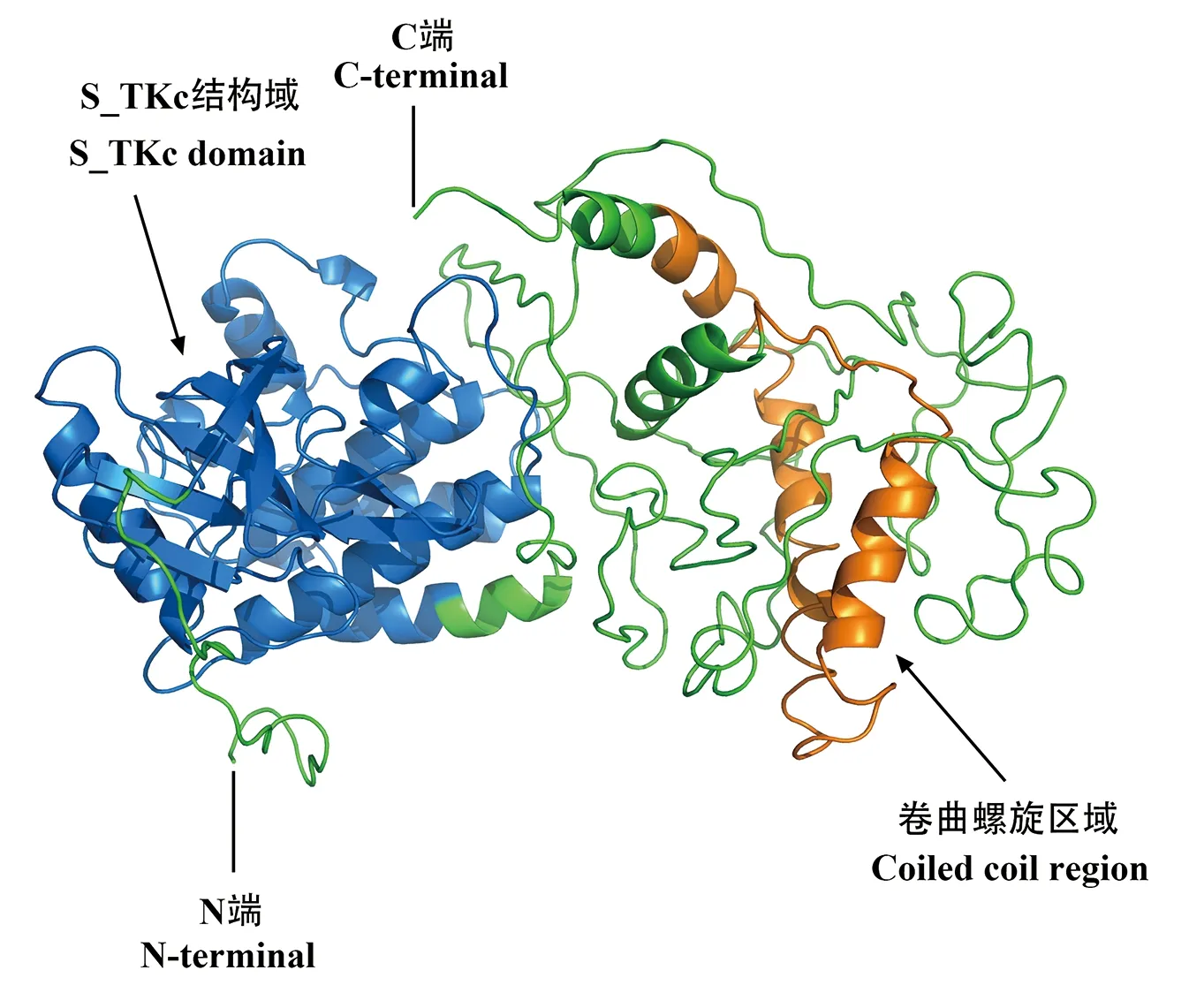
(蓝色部分表示S_TKc结构域。橙色部分表示卷曲螺旋区域。绿色部分表示PoTAK1蛋白质的其余部位。The blue part represents the S_TKc domain.The orange part represents the coiled-coil region.The green part represents the rest of the PoTAK1 protein.)
2.2 氨基酸多序列比对与系统发育分析
牙鲆(P.olivaceus)的TAK1与半滑舌鳎(C.semilaevis)、斑马鱼(D.rerio)、斑点雀鳝(Lepisosteusoculatus)、热带爪蟾(Xenopustropicalis)、原鸡(Gallusgallus)、小鼠(Musmusculus)和人(Homosapiens)的TAK1的氨基酸多序列比对结果显示,TAK1蛋白序列在各物种中具有较高的保守性。在TAK1的N端均存在一个保守的S_TKc结构域,在C端均存在一个保守的卷曲螺旋区域。此外,在S_TKc结构域中均存在两个保守的Thr残基和一个典型的Ser残基(见图3)。系统发育分析结果显示系统进化树分为明显的3枝,其中牙鲆TAK1与其他硬骨鱼聚为一枝,四足类动物TAK1(人、小鼠、原鸡和热带爪蟾)聚为一枝,而牙鲆MAP3K2作为外类群单独为一枝,且牙鲆TAK1与半滑舌鳎TAK1在亲缘关系上最接近(见图4)。

(不同颜色阴影区表示各序列中该位置处氨基酸的保守程度。红色星号表示保守的丝氨酸和苏氨酸残基。蓝色条表示S_TKc结构域,橙色条表示卷曲螺旋区域。The shaded regions with different colors indicate the degree of conservation of amino acids at this position in each sequence.Red asterisks indicate conserved serine and threonine residues.Blue bars indicate the S_TKc domain and orange bars indicate the coiled coil region.)

图4 脊椎动物TAK1的系统发育分析
2.3 PoTAK1基因的组织表达分析
通过qRT-PCR检测PoTAK1基因在健康牙鲆各组织中的表达情况,如图5所示,PoTAK1基因在各组织中均有表达,但表达水平具有一定的差异性。其中PoTAK1基因在肝脏、脑、鳃和肌肉中的表达量较高,心脏次之,在脾脏、肾脏和肠中的表达量较低。
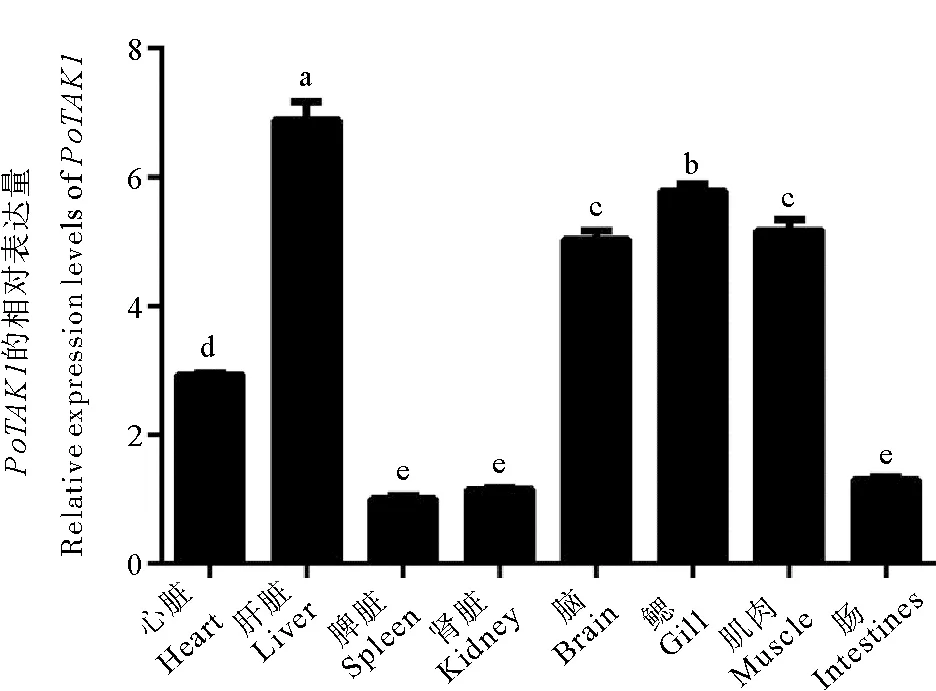
(所有数据以三个生物学重复的平均值±标准误表示。相同字母代表差异不显著(p > 0.05),不同字母代表差异显著(p < 0.05)。All data were shown as mean ± SEM of three biological replicates.The same letter represents not significant difference(p > 0.05), and different letters represent significant difference(p < 0.05).)
2.4 迟缓爱德华氏菌感染牙鲆后PoTAK1基因的表达分析
本研究使用迟缓爱德华氏菌感染牙鲆成体鱼后,对6个不同时间点(0、3、8、12、24和48 h)的注菌组和对照组的3个组织(脾脏、头肾和鳃)进行了取样,通过qRT-PCR检测迟缓爱德华氏菌感染后牙鲆各组织中PoTAK1基因的表达量变化,结果显示迟缓爱德华氏菌感染能引起PoTAK1基因表达量不同程度的变化。如图6(A)所示,在脾脏中,PoTAK1的表达量呈先升高后降低趋势,在感染后12 h达到峰值,是对照组表达量的1.67倍;如图6(B)所示,在头肾中,PoTAK1的表达量呈升高-降低-升高的趋势,在感染后3和48 h出现2个峰值,分别是对照组表达量的1.37和1.43倍;如图6(C)所示,在鳃中,注菌组和对照组之间PoTAK1的表达量无显著变化。

((A)脾脏;(B)头肾;(C)鳃。所有数据以三个生物学重复的平均值±标准误表示。和代表差异显著(:p < 0.05,:p < 0.01)。(A)Spleen;(B)Head kidney;(C)Gill.All data were shown as mean ± SEM of three biological replicates. and represent significant difference(:p < 0.05, :p < 0.01).)
2.5 免疫刺激牙鲆鳃细胞系后PoTAK1基因的表达分析

((A)PBS;(B)Poly I C;(C)TNF-α;(D)迟缓爱德华氏菌。所有数据以三个生物学重复的平均值±标准误表示。和代表差异显著(:p < 0.05,:p < 0.01)。(A)PBS;(B)Poly I C;(C)TNF-α;(D)E. tarda.All data were shown as mean ± SEM of three biological replicates. and represent significant difference(:p < 0.05, :p < 0.01).)
2.6 PoTAK1蛋白的亚细胞定位
使用激光共聚焦显微镜观察转染 pEGFP-N1空载质粒和PoTAK1-EGFP-N1重组质粒后牙鲆鳃细胞的荧光情况,结果显示与其他脊椎动物蛋白类似,PoTAK1蛋白主要在细胞质中表达(见图8)。
2.7 过表达PoTAK1对MAPK通路下游AP-1的转录调控作用
为确定PoTAK1对MAPK通路下游AP-1的转录调控作用,我们在HEK-293T细胞系中进行了双萤光素酶报告实验。结果显示,与pEGFP-N1空载质粒对照组相比,PoTAK1-EGFP-N1重组质粒组中AP-1的萤光素酶活性显著升高(见图9),表明PoTAK1的过表达能够激活MAPK通路下游AP-1转录因子的活性。
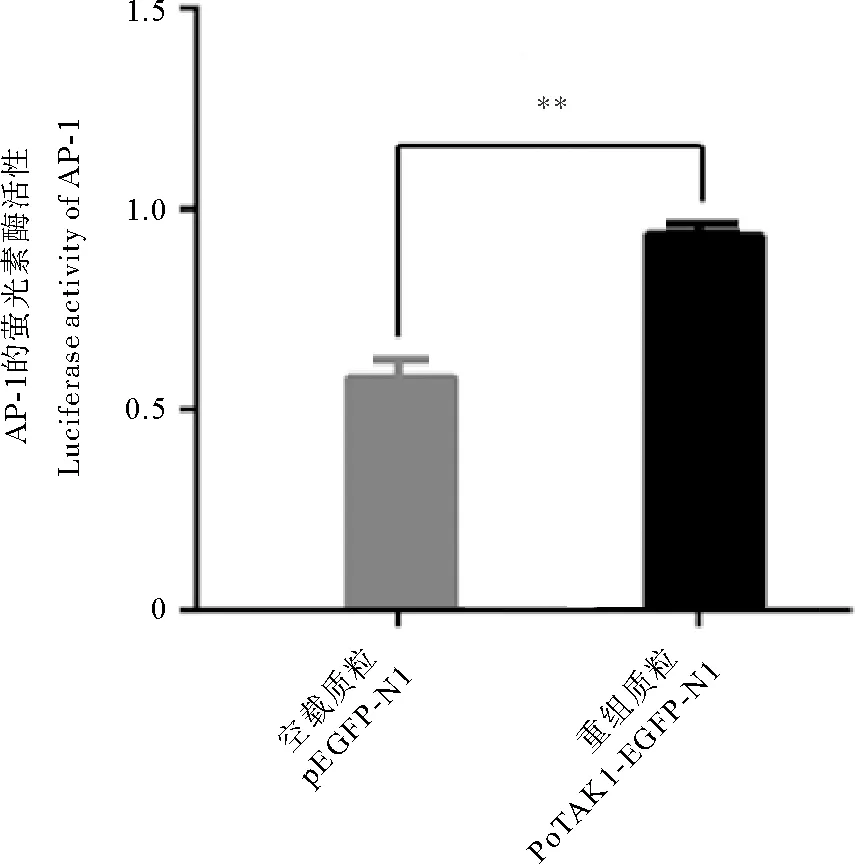
(所有数据以三个生物学重复的平均值±标准误表示。代表差异显著(p < 0.01)。All data were shown as mean ± SEM of three biological replicates.represent significant difference(p < 0.01).)
2.8 过表达PoTAK1对AP-1通路下游 IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的调节作用
本研究使用牙鲆FG-9307鳃细胞系转染PoTAK1-EGFP-N1重组质粒对PoTAK1进行过表达,如图10(A)所示,PoTAK1-EGFP-N1重组质粒组中PoTAK1的表达量显著高于空白对照组和pEGFP-N1空载质粒对照组,表明PoTAK1过表达成功。随后,我们使用TNF-α(20 ng/mL)作为免疫原,对PoTAK1过表达成功的牙鲆FG-9307鳃细胞系刺激24 h后,对各对照组和实验组的细胞进行取样,并通过qRT-PCR检测AP-1通路下游IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达量变化。结果显示,PoTAK1的过表达使得AP-1通路下游各促炎细胞因子的表达量均有不同程度的升高,其中与空白对照组和pEGFP-N1空载质粒对照组相比,IL-1β的表达量均升高约1.50倍(见图10(B));IL-6的表达量分别升高61.50和123.40倍(见图10(C));IL-8的表达量分别升高1 532.70和55.40倍(见图10(D));TNF-α的表达量分别升高7.65和5.73倍(见图10(E))。
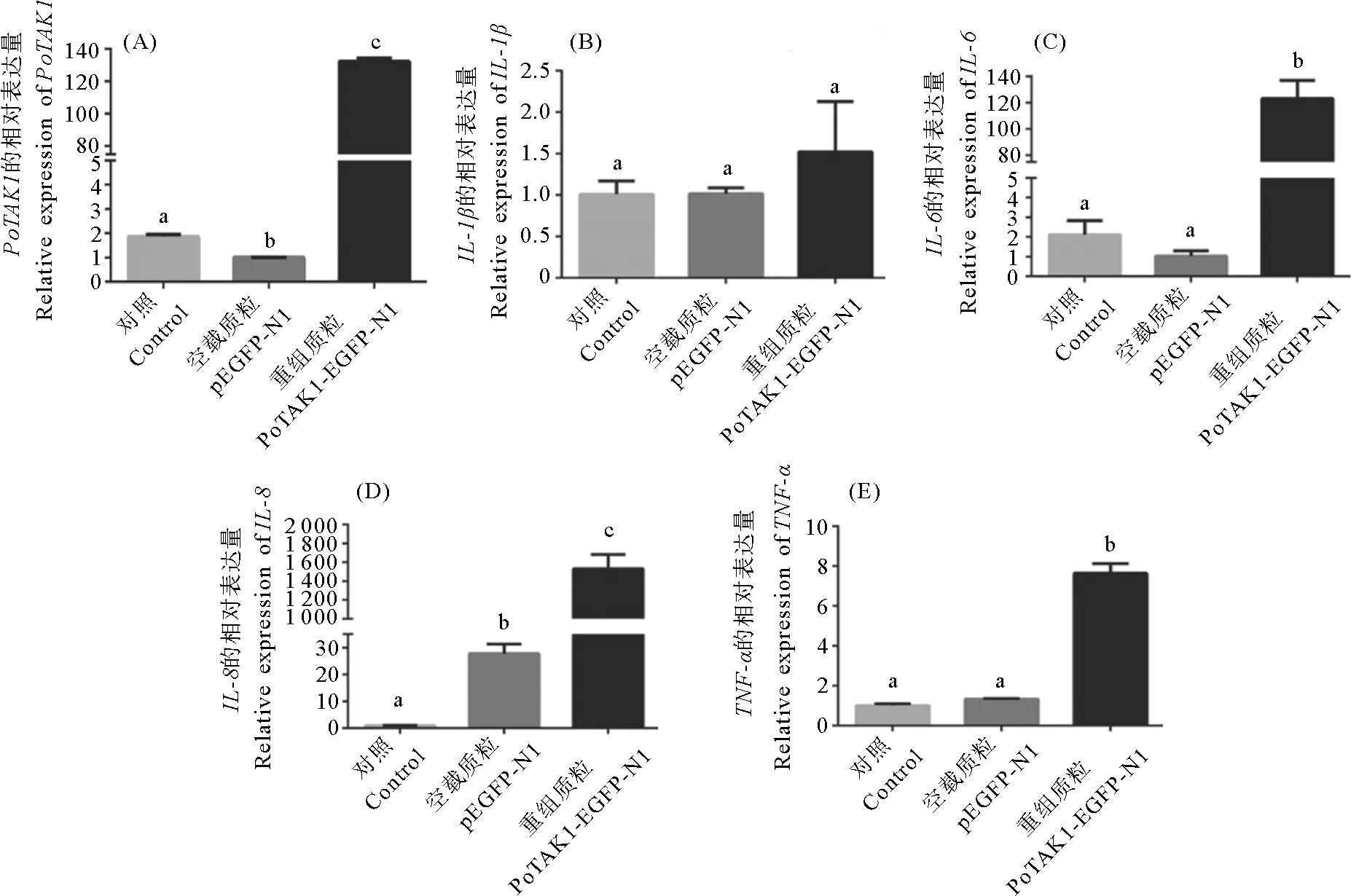
((A):在牙鲆鳃细胞中过表达PoTAK1后,TAK1基因的表达量变化;(B)、(C)、(D)、(E):转染48 h后,牙鲆鳃细胞用TNF-α(20 ng/mL)刺激24 h,通过qRT-PCR检测IL-1β、IL-6、IL-8和TNF-α的表达变化。所有数据以三个生物学重复的平均值±标准误表示。相同字母表示差异不显著(p > 0.05),不同字母表示差异显著(p < 0.05)。(A):Changes of expression levels of the TAK1 gene in Japanese flounder gill cells after PoTAK1 overexpression.(B)、(C)、(D)、(E):After transfection 48 h, the gill cells of Japanese flounder were stimulated with TNF-α(20 ng/mL)for 24 h, and the expression changes of IL-1β, IL-6, IL-8 and TNF-α were detected by qRT-PCR.All data were shown as mean ± SEM of three biological replicates.The same letter represents not significant difference(p > 0.05), and different letters represent significant difference(p < 0.05).)
3 讨论
转化生长因子β激活激酶1(TAK1,又称MAP3K7)属于丝裂原活化蛋白激酶激酶激酶(MAP3K)家族成员,在哺乳动物中已被证明是炎症和免疫信号通路中的关键调节因子[3]。有研究表明,从苍蝇(Muscadomestica)到哺乳动物,TAK1基因在先天免疫中发挥的功能是保守的[2,8]。在哺乳动物组织中(如小鼠的小肠、结肠上皮组织、皮肤表皮组织和肾脏组织等),TAK1基因对于多种炎症配体的反应至关重要[8, 26-28];而在果蝇(Drosophila)的先天免疫反应中,TAK1基因对于某些抗菌肽的表达是必需的[8,29]。在过去的几十年里,大量有关TAK1基因的研究报道主要集中于哺乳动物,如对小鼠的研究表明,TAK1基因是介导转录因子AP-1激活的关键核心分子,并在发育、细胞存活和免疫反应等生物过程中发挥着重要作用[30-33]。然而,对于硬骨鱼,尤其是牙鲆TAK1基因的结构和功能方面的研究还十分有限。因此,本研究以我国重要的海水经济养殖物种——牙鲆为研究对象,对PoTAK1基因的序列特征、蛋白保守结构域、表达模式和免疫功能等进行了探究。
在哺乳动物中的研究表明,TAK1蛋白N端的S_TKc结构域能与TAB1结合激活TAK1的激酶活性,并进一步磷酸化IKKs和MAPKs[34-35],而C端的卷曲螺旋区域能与TAB2结合,从而介导TAK1与TRAF6之间的相互作用[36]。在本研究中,通过蛋白结构域预测,我们发现PoTAK1蛋白同样在其N端具有一个保守的S_TKc结构域,在其C端具有一个保守的卷曲螺旋区域,提示PoTAK1蛋白可能也具有与哺乳动物TAK1类似的功能。多序列比对结果显示,PoTAK1氨基酸序列与其他物种的一致性非常高,均在80%以上。且PoTAK1蛋白同样具有相当保守的氨基酸残基(Thr175、Thr178和Ser183),这些氨基酸残基在哺乳动物TAK1中已被证明是TAB1诱导的TAK1自激活过程中重要的自磷酸化位点[34],提示PoTAK1可能也保留了类似的磷酸化自激活功能。此外,系统发育分析结果显示,PoTAK1与其他物种TAK1具有良好的聚类关系, PoTAK1先与半滑舌鳎TAK1聚为一小枝,再与其他硬骨鱼类TAK1聚为一大枝,其原因可能是牙鲆和半滑舌鳎同属于鲆鲽鱼类,亲缘关系较近。我们推测TAK1基因在进化上高度保守,其在各物种之间具有相似的结构与功能。
对人(H.sapiens)[37]、中华蜜蜂(Apisceranacerana)[38]、草鱼(C.idella)[10]等物种的研究表明,TAK1广泛表达于各组织中。类似的,在本研究中,通过qRT-PCR检测,我们发现PoTAK1在牙鲆各组织中均有广泛表达,但表达水平有一定的差异性,PoTAK1在肝脏和鳃中的表达量较高,这与虹鳟(O.mykiss)[12]、梭鱼(Lizahaematocheila)[39]中TAK1的组织表达情况(肝脏中的表达量较高)以及斜带石斑鱼(E.coioides)[11]中TAK1的组织表达情况(鳃中的表达量较高)类似,但与大黄鱼(Larimichthyscrocea)中TAK1的组织表达情况差别较大(肾脏和脾脏中的表达量较高)[40],这种组织表达差异可能是鱼种类不同所导致的。考虑到肝脏和鳃是硬骨鱼类重要的免疫器官[41],PoTAK1在牙鲆肝脏和鳃中的高表达提示其可能在牙鲆的先天免疫中发挥一定的作用。Qi Z T等通过qRT-PCR检测了腹腔注射停乳链球菌(Streptococcusdysgalactiae)后梭鱼(L.haematocheila)体内脾脏、头肾、鳃、肠等多个免疫器官中TAK1的表达变化,发现经停乳链球菌刺激后,梭鱼TAK1在各免疫器官中的表达量均显著上调,这表明TAK1可能参与了梭鱼抵御细菌感染的免疫反应[39]。类似的,为了探究PoTAK1潜在的免疫功能,本研究选取了牙鲆养殖过程中最常见的病原菌之一——迟缓爱德华氏菌为感染源[17-18],通过腹腔注射迟缓爱德华氏菌和qRT-PCR实验,检测了迟缓爱德华氏菌感染后牙鲆三种重要免疫器官脾脏、头肾和鳃中TAK1的表达变化,结果显示,与对照组相比,脾脏和头肾中PoTAK1的表达量在迟缓爱德华氏菌感染后均显著上调,这表明PoTAK1可能参与了牙鲆抵御迟缓爱德华氏菌感染的免疫反应。从整体上看,经迟缓爱德华氏菌刺激后,在脾脏中,PoTAK1的表达量呈先升高后降低的趋势,而在头肾中,PoTAK1的表达量呈升高-降低-升高的趋势,PoTAK1表达模式的不同可能与各组织在免疫反应中行使的功能不同有关。在鳃中PoTAK1的表达量在感染前后无显著变化,我们推测鳃中的PoTAK1可能在牙鲆抵抗迟缓爱德华氏菌感染过程中不发挥主要作用。

亚细胞定位有助于我们理解该基因所编码的蛋白在细胞中存在的具体位置及其可能发挥的功能[43]。Li Y W等通过GFP绿色荧光融合蛋白法发现斜带石斑鱼(E.coioides)的TAK1蛋白主要在 HeLa 细胞的细胞质中表达[11]。类似的,在本研究中,通过在牙鲆FG-9307细胞中转染PoTAK1-EGFP-N1融合蛋白表达质粒我们发现PoTAK1蛋白也主要在细胞质中表达,这表明TAK1蛋白可能在硬骨鱼中具有相似的定位表达模式。考虑到TAK1是细胞内的关键信号分子[4-5],我们推测PoTAK1参与了细胞质的细胞信号转导过程。
在哺乳动物中的研究表明,TAK1通过磷酸化激活MAPKs进而激活AP-1[30]。AP-1是MAPK信号通路下游的转录因子,因此AP-1的激活情况在一定程度上反映了MAPK信号通路的激活情况[44]。在本研究中,蛋白序列分析结果显示,PoTAK1保留了与哺乳动物TAK1蛋白中相对应的保守磷酸化位点(牙鲆中为Thr169和Thr175;哺乳动物中为Thr178和Thr184),这两个氨基酸位点的磷酸化对于TAK1介导的AP-1的激活是必须的[33]。基于已有的文献报道和结果,我们猜测PoTAK1也能够激活AP-1。为了验证这一猜想,我们在HEK-293T细胞中进行了双萤光素酶报告实验。结果显示PoTAK1的过表达显著激活了AP-1 萤光素酶报告质粒的活性,这表明我们的猜想正确,PoTAK1保留了哺乳动物中TAK1激活AP-1转录因子的功能,并提示在牙鲆中可能也是通过TAK1激活MAPK信号通路进而激活AP-1。
炎症细胞因子是一类主要由免疫细胞分泌的小分子多肽物质,可分为促炎和抗炎细胞因子两类,主要包括TNF-α、IL-1β、IL-6、IL-8、白细胞介素-10(IL-10)和白细胞介素-18(IL-18)等。炎症细胞因子通过与靶细胞上的受体相结合,介导和调节机体的免疫应答及炎症反应[45-46]。作为细胞内重要的转录因子,AP-1可以调节脊椎动物中促炎细胞因子的表达。如Gao Y等发现在LPS刺激的小鼠THP-1细胞中,LL202可以通过抑制AP-1的活性来抑制IL-1β、IL-6的mRNA及其蛋白的表达[47];Ondrey F G等发现激活的 AP-1 能促进人头颈部鳞状细胞癌细胞系中IL-8的表达[48];Smolinska M J等发现在LPS刺激的人原代巨噬细胞中,激活的AP-1参与了IL-6和TNF-α的表达[49]。类似的,在本研究中,为了进一步研究PoTAK1在AP-1通路中的作用,基于双萤光素酶报告实验结果,我们通过在牙鲆鳃细胞系FG-9307中过表达PoTAK1的方式激活AP-1,以TNF-α为免疫刺激物,随后检测了AP-1通路下游IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达变化,qRT-PCR结果显示PoTAK1的过表达能显著上调IL-6、IL-8和TNF-α的表达,IL-1β的表达变化虽不显著,但与对照组相比也有1.5倍的上升,这提示PoTAK1可能通过上调IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达来促进牙鲆的免疫应答与炎症反应。结合双萤光素酶报告和免疫调节检测实验结果,我们推测在受到免疫刺激后,牙鲆通过PoTAK1激活MAPK信号通路从而激活AP-1,激活的AP-1通过调节其下游IL-1β、IL-6、IL-8和TNF-α等炎症细胞因子的表达来调节牙鲆的免疫应答和炎症反应。
4 结语
本研究克隆了牙鲆PoTAK1基因,并对其序列进行了验证。氨基酸多序列比对与系统发育分析显示,TAK1基因在各物种间高度保守;组织表达分析显示,PoTAK1基因具有潜在的免疫功能;体内攻毒和体外免疫刺激实验表明,PoTAK1可能在牙鲆抵御病原体侵染过程中发挥了重要作用;亚细胞定位显示,PoTAK1为胞质蛋白,可能参与了细胞质的细胞信号转导过程;双萤光素酶报告和免疫调节检测显示,PoTAK1的过表达能够激活MAPK通路下游AP-1转录因子的活性并上调AP-1通路下游IL-1β、IL-6、IL-8和TNF-α等促炎细胞因子的表达。本研究结果为进一步研究PoTAK1在牙鲆先天免疫反应所发挥的作用奠定了基础。
