孕中期母血清学产前筛查高风险率评价筛查质量方法探索
2023-03-09段争芳黄金艺张艳红张永红戴铮段含江磊
段争芳 黄金艺 张艳红 张永红 戴铮 段含 江磊
孕中期母血清学产前筛查是指通过检测孕中期母体血清甲胎蛋白(alpha-fetoprotein,AFP)、血清人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)、血清人绒毛膜促性腺激素游离β亚基(free β subunit of hCG,F-β-hCG)、抑制素A(inhibin A,Inh-A)和非结合雌三醇(uncoujugated estriol,uE3)指标水平,结合孕妇的年龄、体质量、孕周、家族遗传史等进行综合风险评估,得出胎儿罹患21-三体综合征、18-三体综合征和开放性神经管缺陷的风险值[1]。孕中期母血清标志物检测方案有:二联法(AFP+hCG或AFP+Freeβ-hCG)、三联法(AFP+ Freeβ-hCG+uE3)、 四 联 法(AFP+Freeβ-hCG+uE3+ Inh-A)。检测方案中血清标记物检测指标数量增加,能提高血清学产前筛查检出率,同时降低假阳性率[2-3]。母血清学产前筛查作为经济、简便、有效、无创性的出生缺陷产前干预措施,在许多国家都已将其整合至孕产妇保健公共卫生服务体系中。我国也有超过20年的临床应用历史,但与欧美发达国家相比,筛查效率低,一方面受制于有限的医疗资源,大部分地区采用筛查效率较低的筛查方案;另一方面由于筛查机构对于血清学筛查质量控制局限于实验室检测环节,而缺少数据分析维度的质量管理[4]。筛查高风险率(阳性率)作为数据分析最直接的数据指标,一定程度上能够反映筛查效能。但由于高风险率易受到孕妇年龄分布情况(如:孕产年龄>35岁孕妇占比)、血清标记物中位数方程的本地适用性、样本储运条件及孕妇信息准确性等因素的影响,难以直接作为筛查结果质量评价的指标。本文旨在探讨高风险率作为母血清学产前筛查质量评价指标的方法。
1 资料与方法
1.1 一般资料
选取2017年1月—2022年9月在益阳市妇幼保健院进行孕中期母血清学产前筛查的102 285例孕妇,孕周15~20+6周,年龄13~55岁。进行产前筛查的孕妇签署知情同意书,医生详细询问并记录患者信息,孕妇年龄(28.7±4.7)岁,体质量(57.6±9.2)kg,孕周(120.7±8.4)d,并记录孕产史等信息。本研究经过益阳市妇幼保健院医学伦理委员会批准。
1.2 样本采集及检测
按照无菌操作要求,采集孕妇静脉血3~5 mL,于真空干燥采血管中。将血液标本的采血管置于室温条件下(18~28℃)0.5~2 h,待其凝固后离心分离(3 000转/min,10 min)血清。血清样本在4~8℃保存不超过7 d,在-20℃保存不超过3个月,在-70℃可长期保存,保存、检测过程中避免反复冻融。异地采血的血清样本在4~8℃运输至产前筛查实验室。
产前筛查实验室采用中孕二联方案,使用时间分辨荧光免疫分析法(dissociation-enhancement lanthanide fluorescence immuno-assay,DELFIA)检测孕妇血清中AFP、F-β-hCG的浓度,结合孕妇年龄、体质量、孕周[末次月经(last menstrual cycle,LMP)、早期B超头臀长(crown-rump length,CRL)、中期B超双顶径(biparietal diameter,BPD)由医生酌情确定孕周计算方式计算]、单双胎、是否有糖尿病、不良妊娠史等孕妇临床信息,通过配套风险评估软件Lifecycle 4.0进行风险评估。唐氏综合征(21-三体综合征)及爱德华氏综合征(18-三体综合征)的截断值分别为1/270和1/350,高于截断值者判为高风险,甲胎蛋白(alpha fetoprotein,AFP)的中位数倍数值(AFP multiple of the median,AFP MOM)≥2.5(双胎为AFP MOM≥5)时判断为开放性神经管缺陷(open neural tube defect,ONTD)高风险。唐氏综合征、爱德华氏综合征或开放性神经管缺陷高风险孕妇在签署知情同意书后进行相应的产前诊断。
1.3 仪器及试剂
采用美国PerkinElmer(PE)公司生产的全自动时间分辨荧光免疫分析仪(Auto DELFIA 1235),使用PE公司生产的配套试剂盒测定孕妇血清中AFP、F-β-hCG浓度。样本前处理及测定按照试剂盒说明进行,每批实验均设置低、中、高三个水平的室内质控,采用1-3S,R-4S,2-2S质控规则,批间变异系数控制在5%以内。参加国家卫生健康委临检中心室间质评,成绩合格。
1.4 统计学方法
采用SPSS 20.0统计学软件分析,计数资料以n(%)表示,计量资料以(±s)表示,数据组间差异比较采用多因素方差分析法,P<0.05为差异有统计学意义。孕妇年龄及高风险率分布图分别用周期为2的移动平均法及多项式进行曲线拟合。
2 结果
2.1 产前筛查高风险率年度分布
分别统计2017—2022年(截至2022年9月)产前筛查高风险率,如图1所示,其中2017年及2019年高风险率分别为7.61%(2 138/28 084)和7.76%(1 450/18 697),均低于8%,2018、2020、2021、2022年分别8.75%(1 920/21 932)、8.54%(1 335/15 636)、8.53%(1 032/12 104)、8.86%(517/5 832),均高于8%。2017—2022年,2017年高风险率为所有年份中最低,2018年高风险率较2017年明显上升,2019年高风险率下降至略高于2017年水平,2020年高风险率增加至8%以上,此后的2021年及2022年高风险率保持与2020年相近水平,除2018年外,高风险率整体表现出逐年上升趋势。
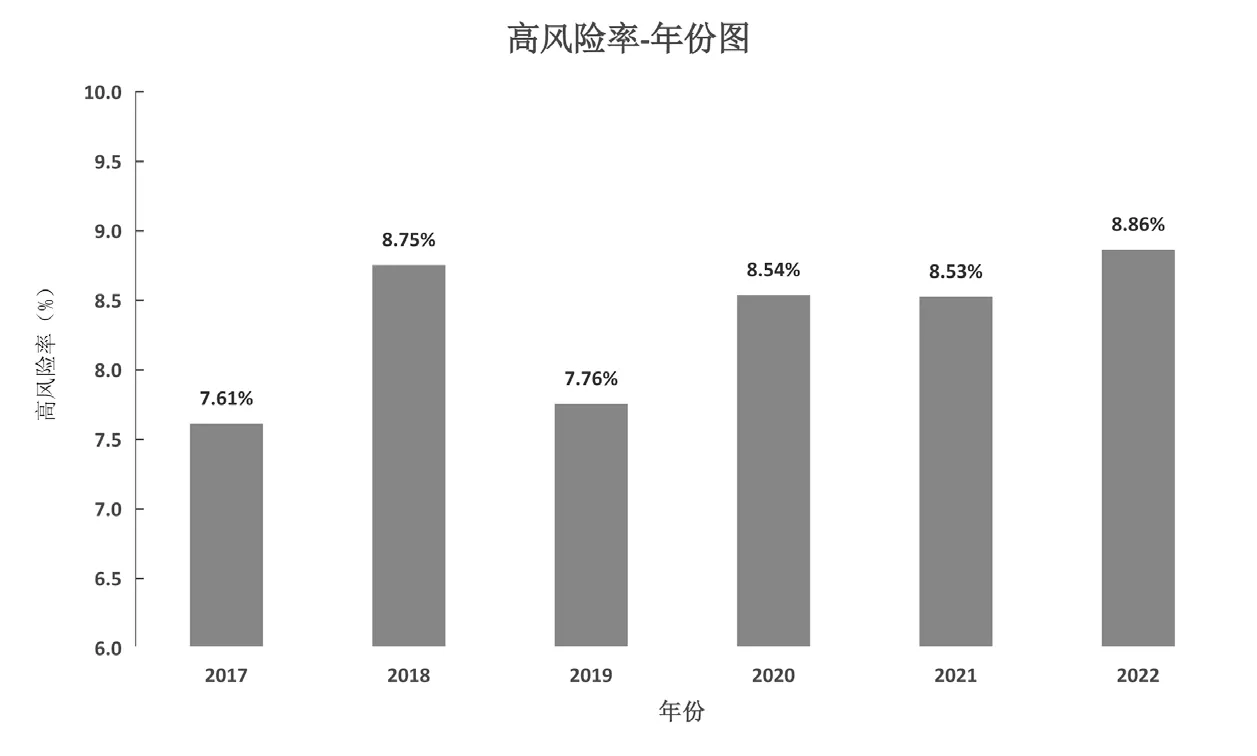
图1 产前筛查高风险率年份图
2.2 孕妇年龄分布
统计2017—2022年(截至2022年9月)产前筛查孕妇年龄分布,如表1所示,孕妇平均年龄自2017年的(27.9±4.4)岁,逐年上升,至2022年孕妇平均年龄为(29.6±4.7)岁。2017—2022年,各年份最大频率年龄(分布频率最高的孕妇年龄)表现出逐年上升趋势,但增长幅度较平均年龄大,由2017年的27岁以每年1岁的幅度增加至2022年的32岁。所有年份中,孕妇年龄>35岁比例在2017年最低,为8.2%,2018年增加至10.0%,随后2019年下降至9.7%,2020年与2019年持平后表现出上升趋势,至2022年为14.1%。

表1 孕妇年龄分布
将2017—2022年孕妇年龄从15~45岁[该年龄段占对应年份所有孕妇数97.7%(99 937/102 285)]各年龄分布频率作散点图,使用周期为2的移动平均法拟合各年份年龄分布点,如图2所示,其中,2017年孕妇年龄分布曲线呈现以最大分布频率年龄左右对称的单峰图形,最大频率年龄为27岁,最大频率12.2%(3 436/28 084)。2018年孕妇年龄分布与2017年类似,但分布曲线最大分布频率峰右移,最大频率年龄为28岁,最大频率12.0%(2 623/21 932)。2019年孕妇年龄曲线较2018年最大分布频率峰右移,最大频率年龄为29岁,最大频率11.7%(2 190/18 697)。2020年孕妇年龄曲线在25岁出现1个肩峰,此后在30岁达到最大分布频率年龄,相较于2017—2019年的类似正态分布形式表现出不同的分布曲线,且曲线最大分布频率峰继续右移,最大分布频率下降至10.1%(1 579/15 636)。2021、2022年孕妇年龄分布曲线与2020年有类似的肩峰出现在26岁附近,且分布曲线最大分布频率峰逐年右移。
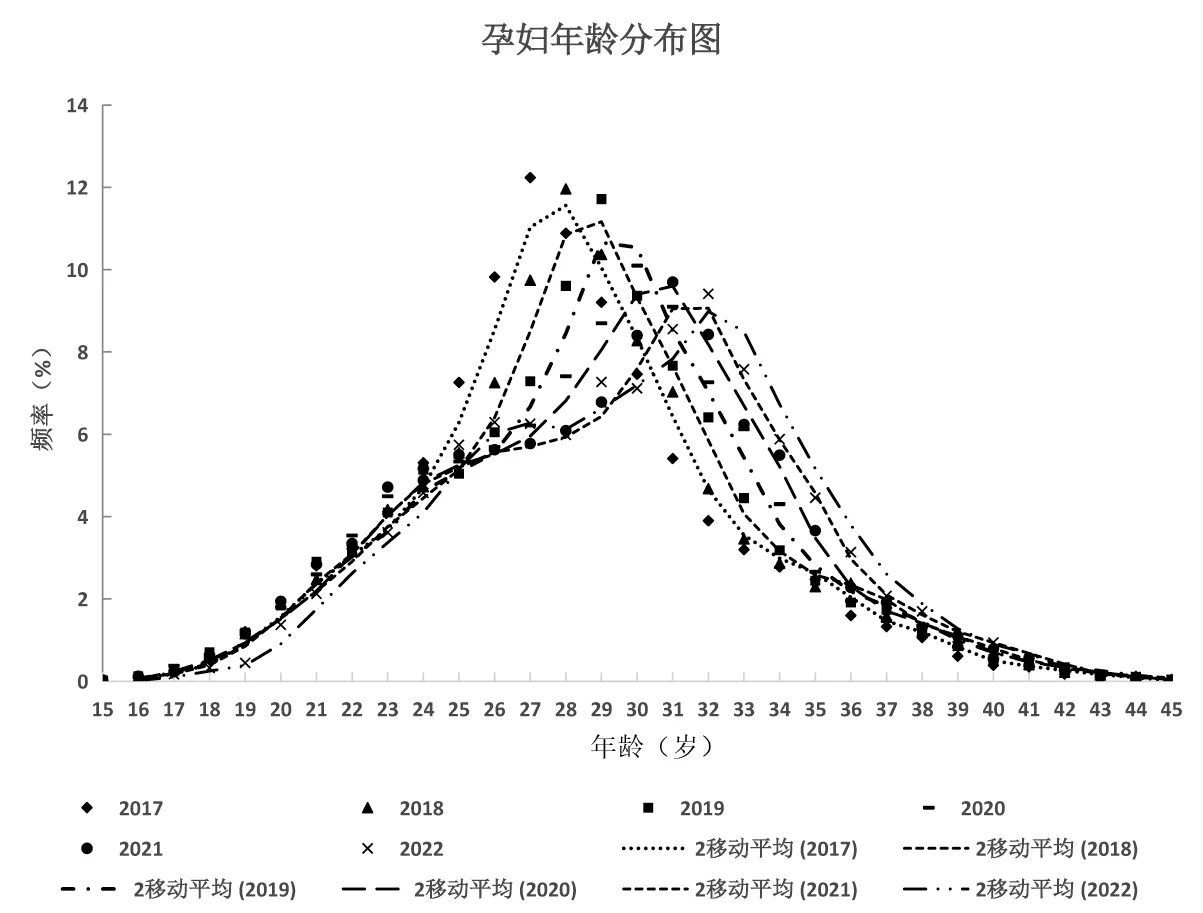
图2 孕妇年龄分布图
2.3 产前筛查高风险率年龄分布
将2017—2022年(截至2022年9月)进行产前筛查的孕妇,从年龄15~45岁,按照1岁间隔分组,计算每个年龄间隔孕妇高风险率,并进行多项式拟合趋势曲线,如图3所示,当孕妇年龄<30岁时,各年龄段高风险率处于较低水平,且高风险率不随孕妇年龄有明显增长;当孕妇年龄在30~35岁时,高风险率随孕妇年龄增加有明显上升趋势;当孕妇年龄>35岁时,高风险率随孕妇年龄增加显著上升,且不同年份间,相同年龄下高风险率表现出差异,散点图同年龄下点更加分散。孕妇的年龄分布曲线在2017—2019年呈在最大分布频率年龄左右对称的单峰分布,在2020—2022年呈在25~27岁有肩峰,在30~33岁有最大分布频率年龄的不对称分布;从多项式拟合曲线看,不同年份20~40岁拟合曲线重叠性密集;不同年份15~20岁及40~45岁两个孕妇频率每组小于2%的年龄区间拟合曲线分散。
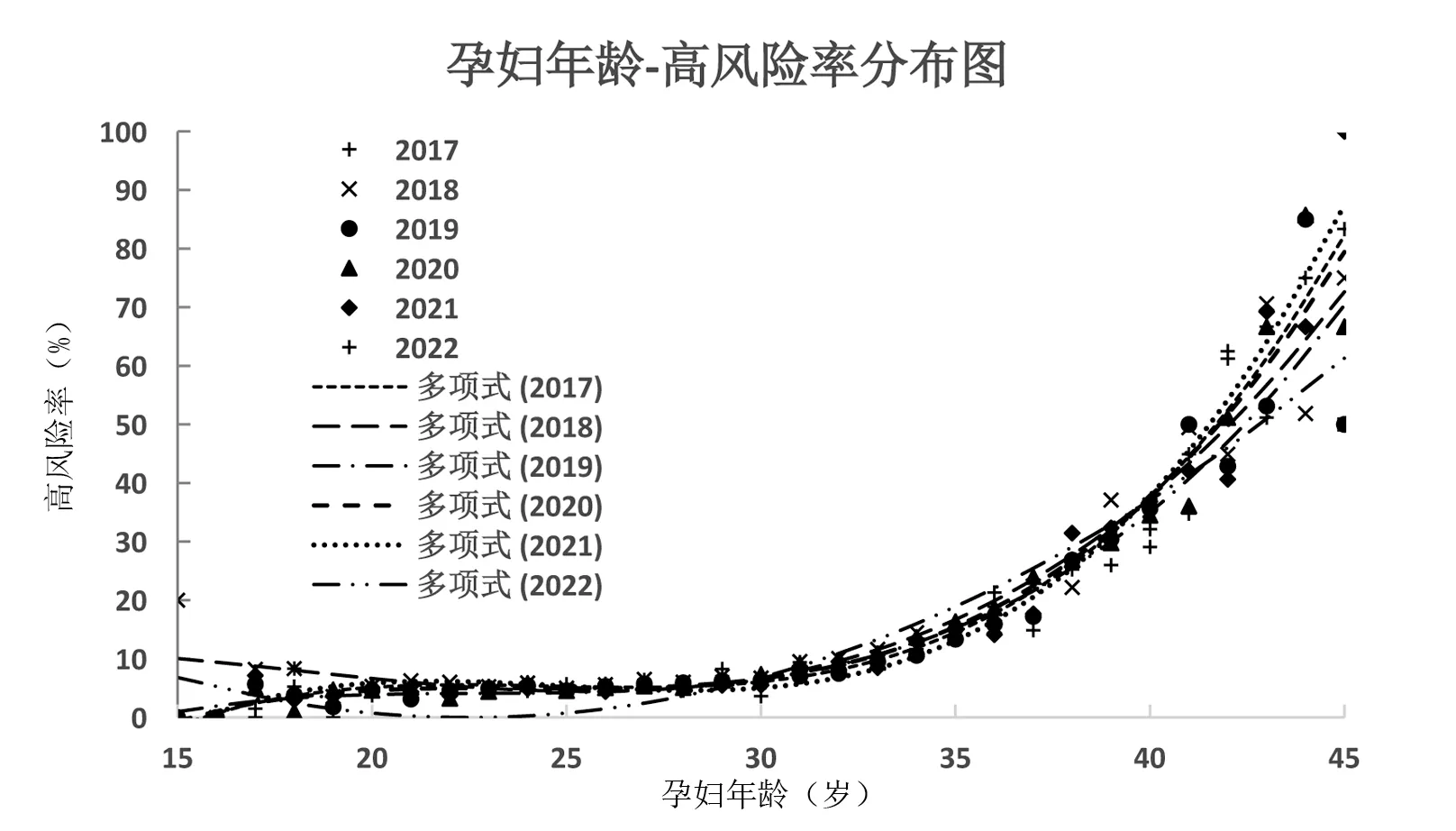
图3 孕妇年龄-高风险率分布图
2.4 高风险率组间多因素方差分析
对2017—2022年(截至2022年9月)6个年份,产前筛查孕妇年龄15~45岁按照1岁间隔,共31个年龄分组后,进行孕妇年龄和年份对于高风险率影响的多因素方差分析,孕妇年龄与高风险率之间的显著性小于0.001,即不同孕妇年龄间高风险率差异有统计学意义(P<0.001);年份与孕妇年龄分组下高风险率之间的显著性大于0.05,即不同年份间孕妇年龄分组下高风险率差异无统计学意义(P=0.387),见表2。

表2 高风险率-孕妇年龄组及年份多因素方差分析
3 讨论
孕中期母血清学产前筛查作为21-三体综合征、18-三体综合征及先天性神经管畸形出生缺陷二级预防的一线筛查方法,对于减少出生缺陷发生率发挥重要的作用[5-6]。同时,由于母血清学产前筛查是以孕妇基本信息,如孕周、年龄等结合母血清中甲胎蛋白、游离绒毛膜促性腺激素等生化指标浓度进行风险评估,得出胎儿罹患目标疾病风险值的检查方法,涉及项目环节多,只有做好各环节质量控制,才能保障项目达到预期的筛查效能[7-9]。筛查高风险率作为最直观的数据分析指标,能及时反映项目运行质量,同时由于高风险率既受到孕妇年龄分布的影响;又受到中位数方程、本试验人群适用性、样本储运条件等因素影响[10-11]。因此,在观察高风险率变化时,先要判断出是否由孕妇年龄分布影响,然后对存在的其他影响因素采取对应措施改进,保证产前筛查项目运行质量,发挥出预期的筛查效能。
本研究中,经统计发现2017—2022年间,除2018年外,高风险率整体表现出逐年上升趋势,由于高风险率与孕妇中高龄孕妇占比相关[11],遂统计了2017—2022年高龄孕妇占比情况,发现2018年高龄孕妇占比均高于2017年和2019年,高龄孕妇占比高可能是2018年高风险率在这3个年份中高的影响因素之一。同时,2018—2020年3个年份高龄孕妇占比在相近的情况下,特别是2019年与2020年,高龄孕妇占比均为9.7%,高风险率表现出较大的差异,说明单纯以高龄孕妇占比不能完全解释高风险率变化趋势。统计发现2017—2022年各年份孕妇平均年龄及最大频率年龄逐年上升,一定程度上表现出与高风险率相似的趋势,说明孕妇年龄分布与高风险率有相关性。
通过孕妇年龄分析图可以发现,2017—2019年孕妇年龄分布曲线呈现类似正态分布图形,最大分布频率的年龄均逐年上升,但最大分布频率年龄的频率下降;2020—2022年孕妇年龄分布曲线均在25~27岁附近出现分布的肩峰,且最大分布频率的年龄逐年上升,同时最大分布频率年龄的频率也逐年下降。2020—2022年表现出与2017—2019年类似正态分布曲线的不同分布趋势,不同年份间孕妇年龄分布差异可能与国家自2016年逐步实施“全面二孩”政策有关[12]。这说明2017—2022年,本研究中孕妇生育年龄随年份逐年整体上升,此外孕妇年龄在最大分布频率、分布图形上有较大的差异,难以通过从高龄孕妇占比、均值、最大分布年龄等单个指标描述孕妇年龄分布情况。
从孕妇年龄分布图可以看到,不同年份间20~40岁的孕妇为主要群体,其他年龄组占比均小于2%,而20~40岁孕妇在孕妇—年龄分布图中,不同年份的高风险率拟合曲线重叠性密集,说明20~40岁孕妇群体不同年份间高风险率差异较小,同时推测不同年份间所有年龄孕妇群体高风险率差异也较小。为了进一步验证这一推测,通过双因素方差方程分析发现,在15~45岁年龄区间,不同年份高风险率中,年龄是极显著影响因素(P<0.001),而不同年份间,相同年龄组高风险率差异无统计学意义(P>0.05)。在2017—2022年6年中高风险率由最低2017年的7.61%上升至2022年的8.86%,说明高风险率受到孕妇年龄的影响,而通过年龄分组后年份间高风险率没有显著差异,说明高风险率没有受到孕妇年龄以外因素的显著影响。高风险率的高低受到主观因素如中位数方程的本实验室适用性影响时[13-14],孕妇年龄分布的差异和样本储运条件等因素导致的高高风险率会掩盖主观因素的影响[15-16],不利于发现并处理产前筛查项目运行过程中存在的主观因素的问题。这种情况下,可以排除样本储运条件等因素影响后,通过统计年龄分组下某几个年龄段分组下高风险的变化情况或者某个年龄范围年龄分组下的高风险率均值的变化情况来判断是否存在主观因素导致了高高风险率,从而采取措施进行优化改进,保障产前筛查项目发挥会预期的筛查效能。此文的研究结果为《胎儿常见染色体异常与开放性神经管缺陷的产前筛查与诊断技术标准第 1 部分:中孕期母血清学产前筛查》[1]中产前筛查项目后期标准制定提供了借鉴内容。
综上所述,通过年龄分组的方法,对高风险率的变化情况进行分析,可以发现孕妇年龄以外的影响因素,采取措施优化产前筛查项目环节,从而提高项目运行质量。
