贝莱斯芽孢杆菌1-3产表面活性素的纯化、鉴定及表征
2023-03-06孙晓雯乔晓妮何增国
张 军,张 良,汤 伟,3,孙晓雯,唐 涛,3,乔晓妮,梁 萌,何增国
(1.中国海洋大学医药学院,山东 青岛 266000;2.青岛百奥安泰生物科技有限公司,山东 青岛 266000;3.青岛海洋生物医药研究院股份有限公司,山东 青岛 266000;4.山东省饲料兽药质量检验中心,山东 济南 250000)
传统抗菌药物在医疗卫生、食品加工和畜牧养殖业中长期不规范应用导致了耐药性病原菌的产生和蔓延,对人类健康、食品安全和畜牧生产带来了不利影响。因此,发掘绿色、安全的天然抗菌活性产物一直是医疗、食品和养殖业研究热点。世界卫生组织(World Health Organization,WHO)也将新型抗菌物质的开发视为解决耐药性病原菌的希望[1]。自然界中存在种类和数量众多的微生物,在激烈的生存竞争过程中,进化出了诸多抑制其他微生物生长的手段,对这些具有抑菌作用代谢产物的发掘和研究,可以为对治耐药性病原菌提供新的资源[2]。
芽孢杆菌是自然界中广泛存在的一类微生物,由于所处环境多样且复杂,常蕴含丰富的具有抑菌活性的代谢产物,如脂肽、细菌素等,具有潜在的应用价值[3]。有报道显示,芽孢杆菌产生具有拮抗作用的代谢产物占总基因组的比例高达5%~8%[4]。贝莱斯芽孢杆菌(Bacillus velezensis)是近年来广受关注的一种芽孢杆菌。2005 年B.velezensis首次分离于西班牙南部马拉加贝莱斯河流域,因此命名为B.velezensis[5]。之后研究发现,其与解淀粉芽孢杆菌(B.amyloliquefaciens)在理化性质上具有一定的相似性,在分类学上曾一度将其归于B.amyloliquefaciens,之后其命名几经反复,最终在2016年通过全基因组比较,确立其为一个独立的种[6-8]。B.velezensis来源广泛,在土壤、动植物体内、池塘、海洋中均有发现[9]。B.velezensis蕴含了多种具有抑菌作用的代谢产物基因,包括脂肽类、聚酮类、环肽类和抗生素类[10]。因此,B.velezensis作为新型抑菌物质的来源,具有巨大的应用潜力。目前B.velezensis较多作为生防菌应用于种植业[4,7],而在医疗卫生、食品加工、畜牧生产和环境修复中的应用较少,可能与大多数B.velezensis来源于土壤环境相关[11]。因此,为扩大B.velezensis的应用范围,一方面需要丰富其来源,从不同环境中筛选具有生物活性的菌株;另一方面需要深入研究其功能性代谢产物的种类和作用机制。
本研究从口腔样品中分离得到1 株具有抑菌活性的B.velezensis,通过对其发酵液中抑菌活性物质的分离纯化,鉴定其结构,并通过抑菌谱、抑菌活性、溶血性等对活性产物的特性进行研究,进而为其在医疗卫生、食品加工、畜牧生产和环境修复领域的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与菌株
分离样品采集自中国人民解放军战略支援部队医院口腔科的离体牙样品,置于无菌生理盐水中。
绿脓杆菌(Pseudomonas aeruginosa)、金黄色葡萄球菌(Staphylococcus aureus)、霍乱弧菌(Vibrio cholerae)、溶藻弧菌(Vibrio alginolyticus)、嗜水气单胞菌(Aeromonas hydrophila)、白色念珠菌(Candida albicans)、无乳链球菌(Streptococcus agalactiae)、蜡样芽孢杆菌(Bacillus cereus)、大肠杆菌(Escherichia coli)均由本研究室分离和保存;副溶血性弧菌(Vibrio parahaemolyticus)ATCC17802、单核细胞性李斯特菌(Listeria monocytogenes)ATCC 19115、粪肠球菌(Enterococcus faecalis)CICC21605分别购自广东微生物菌种保藏中心、宁波明舟生物科技有限公司和中国工业微生物菌种保藏管理中心。
1.1.2 培养基与试剂
胰酪胨大豆酵母浸膏肉汤(tryptic soy-yeast extract broth,TSB-YE)培养基:TSB培养基30 g,酵母提取物6 g,加水至1 L,121 ℃灭菌15 min;酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,加水至1 L,115 ℃灭菌20 min;LB(Luria-Bertani)培养基、TSB培养基、MH(Mueller-Hinton)培养基和MSR(de Man,Rogosa and Sharpe)培养基购自青岛海博科技有限公司。
葡聚糖凝胶G-50 西安蓝晓科技新材料股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Epoch酶标仪 美国BioTek公司;CR21N冷冻离心机 日本日立公司;ALPHA 1-2Ldplus真空冷冻干燥机 德国Marin Christ公司;HA99-1蛋白纯化系统 上海沪西分析仪器厂有限公司。
1.3 方法
1.3.1 菌种筛选
将采集的离体牙样品充分振荡混匀,在TSB-YE培养基中37 ℃富集12 h。之后,进行10 倍梯度稀释,选取合适的稀释度,涂布TSB-YE固体平板,37 ℃培养至长出单菌落。以L.monocytogenesATCC 19115为指示菌(下同),采用Over-lay法进行菌落筛选[12],选择抑菌圈最大的菌株(编号为1-3),在LB培养基上划线纯培养3 次,保藏于-80 ℃。
1.3.2 菌株分类鉴定
在LB固体平板上对保存的菌株1-3划线,37 ℃培养12 h,观察其菌落形态特征。采用革兰氏染色法,在显微镜下观察其菌体形态特征。对培养的菌株1-3进行需氧性实验、氧化酶实验、触酶实验以及糖发酵实验,测定其生理生化性质。
挑取LB平板上的菌株1-3单菌落,采用通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行菌落聚合酶链式反应(polymerase chain reaction,PCR)扩增菌株1-3的16S rRNA基因序列。之后,将PCR产物送生工生物工程(上海)股份有限公司测序。测得的序列在NCBI网站进行比对,在LPSN(List of Prokaryotic names with Standing in Nomenclature)网站(https://lpsn.dsmz.de/)选择相应模式菌株的16S rRNA基因序列,使用MEGA7.0软件,采用邻接法进行系统发育树构建,判定菌株1-3的种属类型。将菌株1-3在LB培养基中培养至对数中期,菌液离心后,弃上清液,菌体用生理盐水漂洗2 次,将菌体送生工生物工程(上海)股份有限公司进行转录组测序。在测得序列中,随即抽取9636 条序列在NCBI数据库中进行BLAST比对,进一步确定其种属信息。
1.3.3 发酵培养及抑菌活性物质的分离纯化
取保存的菌株1-3甘油管50 μL,接种到5 mL的TSBYE培养基中,37 ℃、180 r/min摇培过夜。1%的接种量转接到100 mL的TSB-YE培养基中,37 ℃、180 r/min摇培24 h,每4 h取样1 mL,12000 r/min离心10 min,取上清液。在含有指示菌的平板上,采用琼脂扩散法检测发酵液中的抑菌活性,并测定不同取样时间的pH值。
采用硫酸铵沉淀法分离目标产物。培养24 h的菌株1-3发酵液离心取上清液,加入饱和度30%的硫酸铵在4 ℃条件下沉淀过夜。10000 r/min、4 ℃离心30 min,沉淀用pH 7.0的磷酸盐缓冲液复溶。上清液继续补加硫酸铵至饱和度60%,10000 r/min、4 ℃离心30 min,沉淀用pH 7.0的磷酸盐缓冲液复溶。同样的操作得到90%硫酸铵的沉淀。在含有指示菌的平板上,采用牛津杯法检测各组抑菌活性。
将硫酸铵沉淀活性最强的组分,用葡聚糖凝胶G-50进一步纯化。用去离子水洗脱,流速0.5 mL/min,检测波长280 nm。收集不同洗脱时间的组分进行真空冻干,复溶于磷酸盐缓冲液(pH 7.0)中,采用牛津杯法检测不同保留时间组分的抑菌活性,并将该组分作为脂肽粗品进行表征。
1.3.4 抑菌活性物质的鉴定
采用排油方法鉴定产物的表面活性剂成分。在洁净的培养皿中加入无菌水,在水中加入200 μL食用油,使之在水面形成油膜,然后在油膜中心加入10 μL脂肽样品,观察油膜是否被挤向四周形成圆环。
将G-50 纯化的样品用薄层色谱(thinlayer chromatography,TLC)层析分离并用生物自显影方法确定抑菌活性物质的位置。具体方法为:将G-50层析收集的脂肽冻干样品,复溶于含有50%甲醇的磷酸盐缓冲液(pH 7.0)中,点于预制硅胶板上,用三氯甲烷-甲醇-水64∶25∶4的展开剂层析,用波长为254 nm的紫外灯检测层析结果。展开结束后,将硅胶板放在碘缸中熏蒸,观察层析板上是否有黄色的脂质斑点出现。在同时层析的另一块硅胶板晾干后,倒扣于含有指示菌的平板上,4 ℃冰箱中放置2 h,使产物充分扩散于琼脂中。之后将平板转移至37 ℃培养箱中,培养12 h,观察培养皿中是否有抑菌圈出现。计算碘缸熏蒸和生物自显影的迁移率。
采用高效液相色谱分离脂肽粗品,采用C18柱,流动相分别为乙腈和水,洗脱条件为:0~3 min,乙腈20%;3~10 min,乙腈20%~40%;10~15 min,乙腈40%~50%;15~30 min,乙腈50%~100%;30~40 min,乙腈100%。流速0.5 mL/min,检测波长280 nm。收集不同洗脱时间的样品,进行抑菌实验,将有抑菌活性的组分进行基质辅助激光解析电离-飞行时间质谱(matrix-assisted laser desorption ionizer-time of flight-mass spectrometry,MALDI-TOF-MS)检测,对目标峰进行二级质谱检测,并解析脂肽的结构。
1.3.5 抑菌活性物质的表征
1.3.5.1 抑菌谱
将各保存的受试菌株甘油管按照1%的接种量,接到相应的培养基中培养。其中,P.aeruginosa、S.aureus、V.parahaemolyticusATCC17802、V.cholerae、B.cereus、E.coli用MH培养基37 ℃、180 r/min培养12 h。C.albicans用YPD培养基在28 ℃条件下静置培养12 h。E.faecalisCICC21605用MRS培养基在 37 ℃静置培养12 h。L.monocytogenesATCC 19115用TSB-YE培养基37 ℃,180 r/min培养12 h。之后,将各菌种对应的固体培养基融化,待降温到40 ℃左右,按照1%的接种量接入相应的菌种,迅速混匀,倒入平板。采用牛津杯法进行抑菌实验,每孔加入20 μL的样品,分别在各菌株对应的温度下培养12 h,观察是否出现抑菌圈,并测量抑菌圈直径。
1.3.5.2 抑菌活性
纯化样品对L.monocytogenesATCC 19115的最小抑菌浓度(minimum inhibitory concentration,MIC)测定参考Zhang Jun等[13]方法进行。将样品用无菌水配制成2560 μg/mL样液,用无菌水进行2 倍梯度稀释,共稀释12 管至质量浓度0.125 μg/mL。挑取指示菌平板上的单菌落至5 mL的TSB-YE培养基中,37 ℃、180 r/min培养过夜。按照1%的接种量,将过夜培养的指示菌转接到30 mL的TSB-YE培养基中,同样条件培养至OD600nm为0.4,用TSB-YE培养基稀释1000 倍备用。在96 孔板中,分别加入90 μL稀释好的菌液和10 μL各稀释样品,每个稀释度做3 个平行。氨苄青霉素(ampicillin,Amp)和无菌水分别为阳性和阴性对照。之后将96 孔板密封,37 ℃、50 r/min摇培12 h,使用酶标仪检测OD600nm。以96 孔板内完全抑制指示菌生长质量浓度为相应的MIC值。
1.3.5.3 pH值稳定性和热稳定性
用无菌水配制2 mg/mL的样品溶液,分别加入等体积0.1 mol/L的Gly-HCl缓冲液(pH 2.0)、醋酸-醋酸钠缓冲液(pH 4.0)、磷酸盐缓冲液(pH 6.0和pH 8.0)和Gly-NaOH缓冲液(pH 10.0),将各处理组在37 ℃条件下水浴1 h。热稳定性实验,用pH 6.0磷酸缓冲液配制1 mg/mL样品溶液,分别在20、40、60、80 ℃条件下水浴1 h,100 ℃水浴30 min。不同处理的样品采用牛津杯法,测定样品对指示菌的抑菌活性。
1.3.5.4 溶血性
采用心脏采血法对Sprague Dawley(SD)大鼠进行心脏取血,加入肝素管中。取500 μL血液加入2.5 mL生理盐水,8000 r/min离心4 min,弃上清液,沉淀的血细胞用生理盐水重复洗涤2 次至上清液无色。取200 μL血细胞加入9.8 mL生理盐水制成2%红细胞悬液。取450 μL细胞悬液加入到9 个1.5 mL的EP管中,分别加入50 μL样品稀释液(终质量浓度分别为256、128、64、32、16、8、4、2、1 μg/mL)。以相同体积生理盐水和2%曲拉通-100为阴性和阳性对照。各处理组在37 ℃条件下孵育1 h,之后各样品取100 μL至96 孔板中,在540 nm波长处检测吸光度,每个处理组做3 个平行。各处理组溶血性按下式计算:
式中:A样品为各处理组的吸光度;A0为生理盐水处理组的吸光度;A100为曲拉通-100处理组的吸光度。
1.4 统计分析
2 结果与分析
2.1 菌株的筛选鉴定
以L.monocytogenesATCC 19115为指示菌,采用Overlay的方法从离体牙样品中筛选得到1 株具有抑菌活性的菌株1-3。菌落形态观察,呈圆形,半透明,表面皱褶,有凸起(图1A)。革兰氏染色呈阳性,1000 倍显微镜下观察为杆状(图2B)。对菌株1-316S rRNA基因序列测序后在NCBI网站用BLASTn比对,选择相应模式菌株的16S rRNA基因序列使用MEGA7.0构建系统发育树,结果显示菌株1-3与B.velezensis聚类到一个分支上(图2),与B.velezensisAJAS1(MT459821.1)的相似性达99.93%。将上述16S rRNA基因序列数据上传到国家微生物科学数据中心(National Microbiology Data Center,NMDC),获得序列号:NMDCN0000QQ7。

图1 菌株1-3的菌落(A)和菌体(B)形态特征Fig.1 Colonial (A) and cellular (B) morphology of strain 1-3

图2 菌株1-3的进化树Fig.2 Phylogenetic tree constructed based on 16S rRNA gene sequence of strain 1-3
糖、醇发酵实验结果显示,菌株1-3可以利用蔗糖、乳糖、甘油、果糖、葡萄糖、棉子糖、甘露醇、熊果苷、苦杏仁苷、阿拉伯糖产酸,而不能利用蜜二糖产酸,另外对纤维二糖和甲基α-D-半乳糖苷的利用则不明显(表1)。以上结果与《伯杰氏细菌手册》和文献中B.velezensis的生理生化特征描述基本一致[10,14]。因此,判定菌株1-3为B.velezensis,将其命名为B.velezensis1-3。进一步对菌株1-3转录组测序的CDS序列中,随即抽取9636 条序列进行BLASTn比对分析,发现其中的9566 条序列与B.velezensis一致(表2),更进一步证实了该菌株属于B.velezensis。
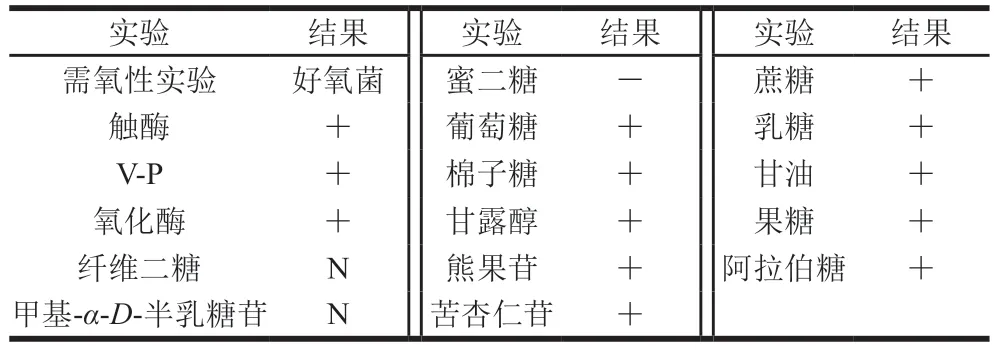
表1 菌株1-3的理化性质Table 1 Physiological and biochemical characteristics of strain 1-3
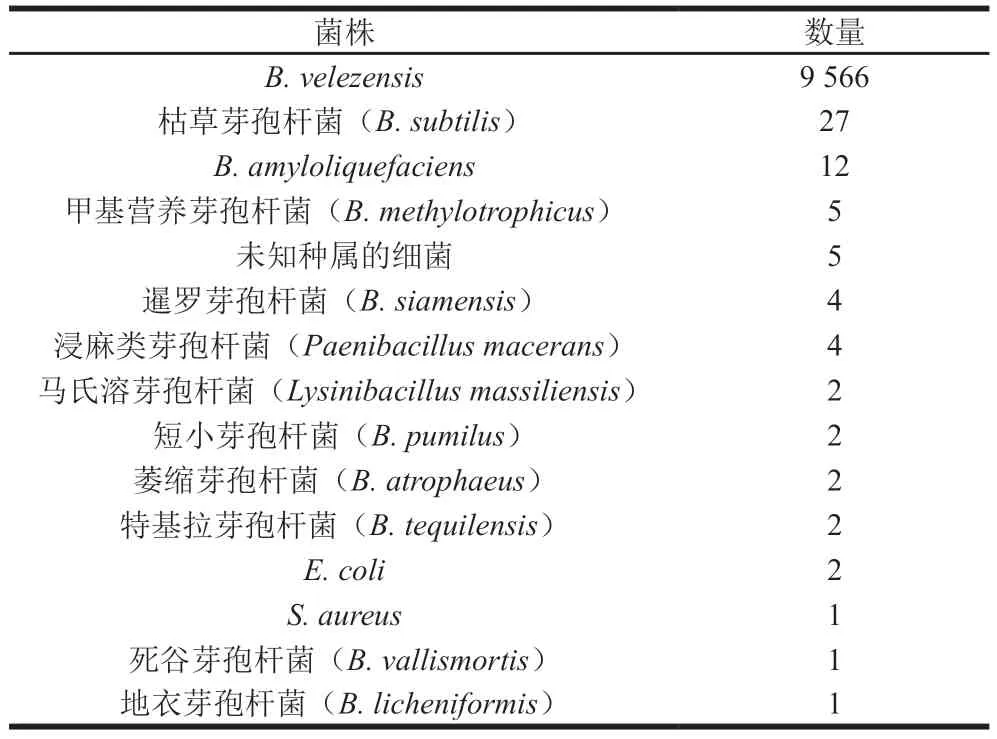
表2 菌株1-3转录组测序随机比对结果Table 2 Results of random transcriptome sequence alignment of strain 1-3
2.2 抑菌活性物质的表达与分离纯化
如图3所示,从8 h开始出现抑菌活性,随着发酵时间延长抑菌圈逐渐增大,至24 h抑菌活性最大(图3A),其中8~20 h发酵液上清液之间的抑菌圈直径达到显著差异水平,而20 h与24 h样品的抑菌圈直径差异不显著(P>0.05)(图3B)。整个发酵过程中的pH值在7.0~8.0范围内,因此可以排除pH值变化对抑菌活性的影响。采用硫酸铵分步沉淀法沉淀具有抑菌活性的产物,结果显示30%硫酸铵沉淀物的抑菌活性最大,随着硫酸铵含量的增大,上清液和沉淀的抑菌活性逐渐减小(图4),表明30%硫酸铵可得到大部分活性物质。将30%硫酸铵沉淀物进行葡聚糖凝胶G-50纯化,通过收集不同时间的洗脱组分,进行抑菌实验,结果如图5所示,在保留时间150 min左右的抑菌活性最高。将该组分收集后冻干,作为鉴定和特性研究的样品。

图3 不同培养时间上清液的抑菌活性(A)和抑菌圈直径(B)Fig.3 Antibacterial activity (A) and inhibition zone diameter (B) of supernatants at different culture time

图4 硫酸铵沉淀抑菌活性Fig.4 Antibacterial activity of precipitates obtained by ammonium sulfate salting-out

图5 G-50分子筛凝胶层析纯化层析图谱和抑菌活性Fig.5 Sephadex G-50 column chromatogram
2.3 活性物质鉴定
排油实验发现纯化产物可以将水面油膜迅速挤向四周,形成一个圆环,表明纯化产物具有表面活性剂的功能。该性能为其应用于水体、土壤等方面的有机污染物清理提供了便利[15]。同时,在石油开采中,生物表面活性剂可以有效减少界面盐水和油之间的张力,通过改变油驱比,提高了石油开采的效率[16]。这对解决日益严重的能源危机同样具有积极意义。采用预制硅胶板对葡聚糖凝胶G-50层析收集到的活性产物进行TLC分离,在254 nm紫外光下的成像结果如图6A所示。用碘缸熏蒸后出现了3 个比较明显的斑点(图6B),其迁移率分别为42%、54%和71%。通过TLC-生物自显影的方法确定纯化产物中含有抑菌活性的组分(图6C),发现迁移率为71%的组分具有抑菌活性。之前有报道,显示一种源自B.cereus的脂肽表面活性素(Surfactin)的迁移率为70%[17],与本次分离的产物类似,因此判断该产物可能是具有表面活性剂功能的脂肽Surfactin。
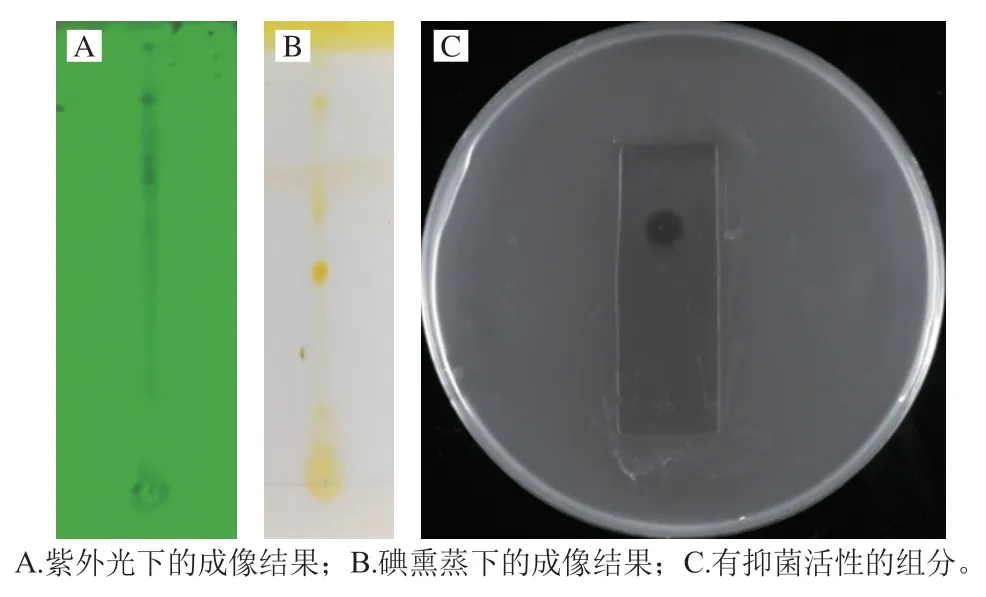
图6 脂肽物质TLC和抑菌活性生物自显影Fig.6 TLC and TLC-bioautographic analysis of lipopeptides
G-50纯化后的粗品经高效液相色谱进一步纯化后,在保留时间34.3 min的组分具有抑菌活性,将该样品进行MALDI-TOF-MS检测,发现有3 个特征峰,分子质量分别为1030.642、1044.660 Da和1058.677 Da,3 个特征峰的分子质量相差14 Da(图7)。之前有研究显示,B.velezensisKLP2016可以产生具有抑菌活性的Surfactin[15],与本研究分离得到的活性产物分子质量近似。对3 个特征峰进行二级质谱鉴定,结果如图8所示,对出现的碎片峰进行图谱解析,发现3 个特征峰得到碎片规律类似,都含有4 个亮氨酸(Leu)、1 个缬氨酸(Val)、1 个天冬氨酸(Asp)和1 个谷氨酸(Glu)组成的环状结构,以及14~16 个C的脂肪链。该结构与之前发现自B.velezensisSH-B74的环状脂肽Surfactin结构近似[18]。因此,确定在B.velezensis1-3中分离的活性产物为C14~C16的环状脂肽Surfactin。脂肽Surfactin并非由基因组直接合成,而是在非核糖体肽合成酶的作用下,将不同的模块连接在一起的特殊结构,具有复杂的生物合成过程[4]。另外,质谱分析结果显示在脂肪链中可能含有3 对双键,并且化合物在254 nm的紫外灯下有明显荧光吸收,说明其3 个双键可能依次排列形成共轭体系,但其具体位置需要进一步研究确定。
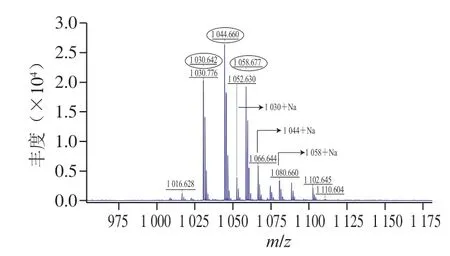
图7 脂肽物质的鉴定Fig.7 Primary MS spectra of lipopeptides
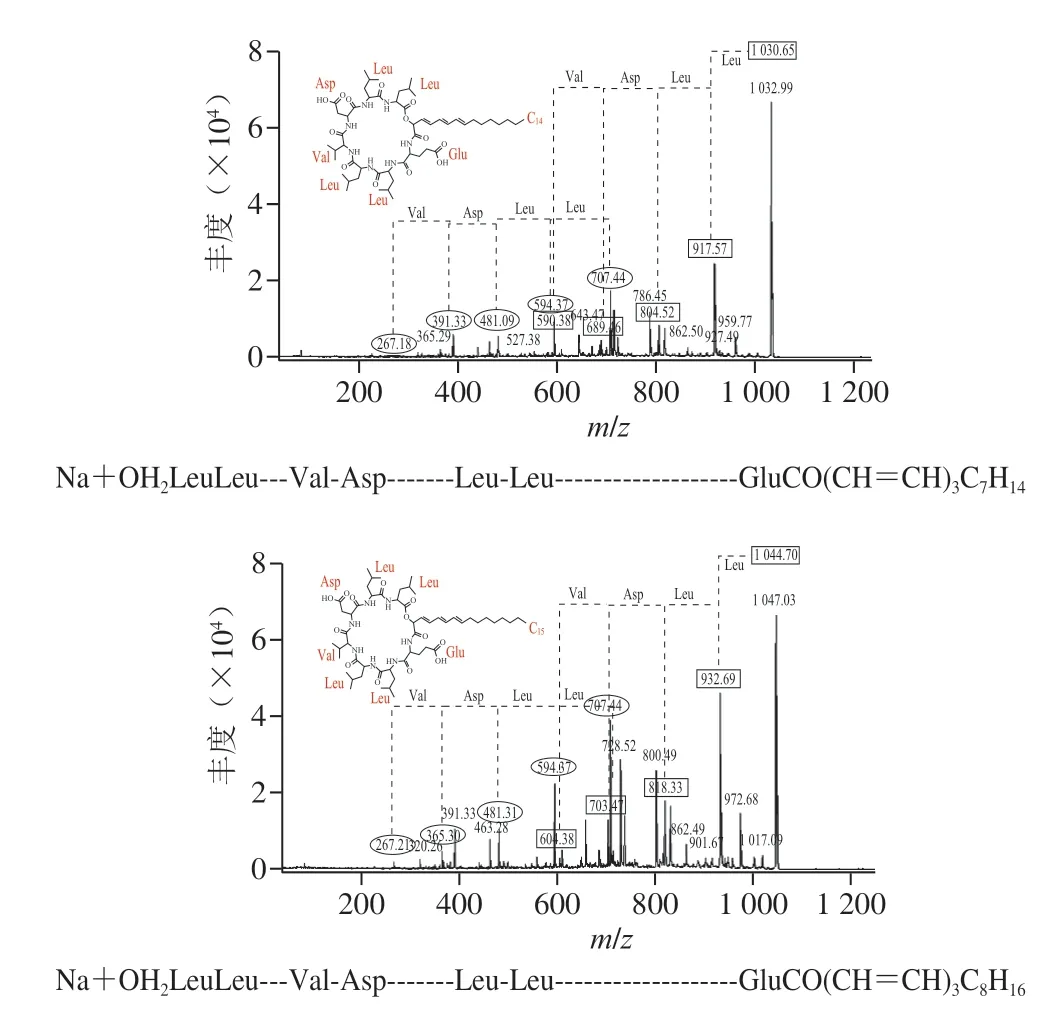
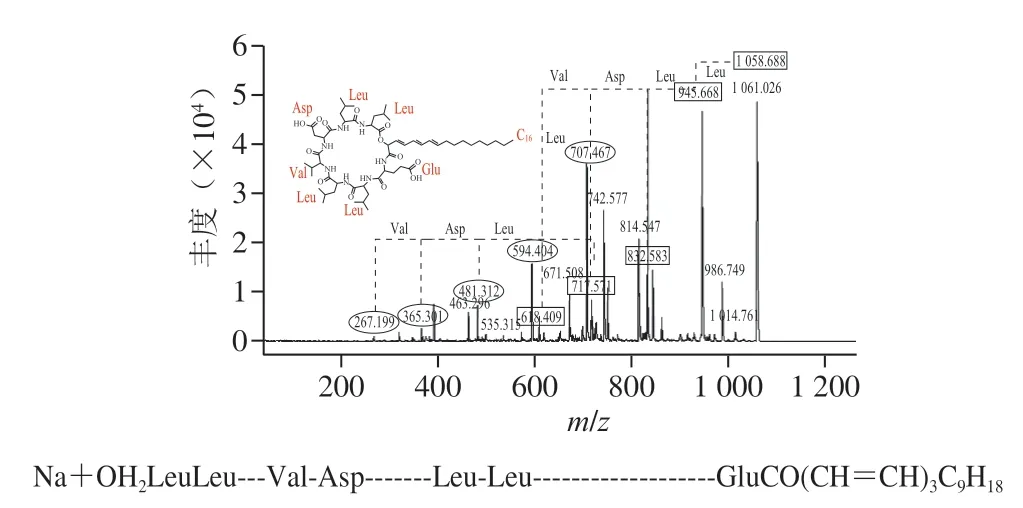
图8 3 种脂肽物质的二级质谱及结构Fig.8 Secondary MS spectra and structures of three lipopeptides
2.4 抑菌谱和MIC
采用在医疗卫生、食品加工和畜牧生产中常见的病原菌测定Surfactin的抑菌谱,其中包括5 株革兰氏阳性菌(G+)、6 株革兰氏阴性菌(G-)和1 株真菌。如表3所示,Surfactin样品对G+和G-均有一定的抑制作用,且对G+的效果明显强于G-。之前的文献报道,Surfactin对G+的S.aureus、L.monocytogenes、B.subtilis、巨大芽孢杆菌(Bacillus megaterium),G-的E.coli、肠炎沙门氏菌(Salmonella enterica)、费格森埃希菌(Escherichia fergusonii)、B.licheniformis和一些植物来源的真菌具有一定抗性[9,17,19-20]。本研究分离的Surfactin未表现出对C.albicans的抑制作用(表3)。但有研究显示,当Surfactin与氟康唑联合使用时表现出对C.albicans生长的抑制[21]。除了直接的抑菌作用外,Surfactin还可以激活植物的防御系统。Chowdhury等[22]的研究显示,来源于B.amyloliquefaciens的Surfactin可以促进莴苣根部防御基因PDF1.2的表达。同时,关于Surfactin的抗肿瘤、抗支原体、抗病毒和抑制蓝藻等方面的研究也有一定的报道[16,23]。

表3 纯化产物的抑菌谱Table 3 Antibacterial spectra of purified surfactin
L.monocytogenes是一种来源广泛的食源性致病菌,在高盐、酸性和低温(约5 ℃)条件下也可繁殖,据WHO统计,L.monocytogenes虽然感染性不高,但致死率高达20%~30%,因此各国均将其列为重要的公共卫生问题[24]。对样品MIC实验结果发现,纯化产物在第7孔和第8孔之间出现了明显的菌浓度变化,因此将样品对L.monocytogenesATCC 19115的MIC值确定为第7孔对应样品质量浓度,即4 μg/mL。相同的实验条件下,Amp对指示菌的MIC为0.0625 μg/mL。虽然Surfactin的MIC大于Amp,但面对日益严重的耐药性病原菌问题,采用抑菌作用机制不同于传统抗生素新型抗菌物质,可能是解决耐受性病原菌的有效手段。研究显示,Surfactin的抑菌机制是在病原菌的细胞膜上形成孔洞,引起细胞内的核酸、蛋白、K+、Ca2+等物外流,使细胞代谢受阻,进而导致病原菌死亡[4,9,25-26],而非传统抗生素的对细胞壁合成的抑制。
2.5 溶血性
不同质量浓度稀释样品对SD大鼠红细胞的溶血性如图9所示,将阴性和阳性对照的溶血率分别设定为0%和100%,在4~64 μg/mL下溶血率在0.44%~0.89%之间,且组间未表现出显著差异(P>0.05),而当样品质量浓度达到128 μg/mL和256 μg/mL时,溶血率分别为1.63%和4.43%,虽然组间表现出显著差异(P<0.05),但其溶血率仍处于较低水平。Nozhat等[27]对Surfactin C-15进行的体外溶血性和细胞毒性研究显示,其半溶血率(value of half of hemolytic,HC50)和半抑制浓度(half maximal inhibitory concentration,IC50)分别为47 μmol/L和86.9 μmol/L;孙立军等[28]在小鼠的体内实验表明,Surfactin无任何毒性反应,评价为无毒级。Santos等[16]总结Surfactin的体内毒性研究发现,其注射和经口饲喂的半数致死量(median lethal dose,LD50)在100~2000 mg/kg。远小于其发挥最小抑菌浓度的范围。同时,Surfactin的肽类属性其在消化道中会面临诸多蛋白酶的降解,因此不会产生药物残留。

图9 不同质量浓度Surfactin的溶血性Fig.9 Effect of surfactin at various concentrations on hemolysis of erythrocytes
2.6 pH值稳定性和热稳定性
样品在pH 4.0~10.0的环境中处理1 h,对指示菌抑菌活性未发生变化,而在pH 2.0的环境中抑菌活性有所下降,表明酸性pH值对抑菌活性有一定影响(图10A)。在Surfactin样品对温度的耐受性实验结果显示,经20、40、60 ℃处理1 h后,对抑菌活性没有影响,而在80 ℃处理1 h和100 ℃处理30 min后,抑菌活性均能维持在90%左右(图10B)。Surfactin稳定的环状结构赋予了其良好的热稳定性和广泛的pH值适应性,不同来源的Surfactin均显示具有良好的热稳定性和广泛的pH值适应性[20,29-30]。
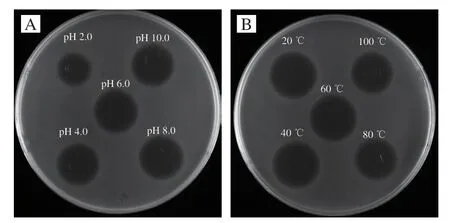
图10 Surfactin样品的pH值稳定性(A)和热稳定性(B)Fig.10 pH (A) and heat (B) stability of surfactin
3 结论
从口腔样品中分离出1 株具有抑菌活性的B.velezensis1-3。通过硫酸铵沉淀、分子筛层析得到了具有抑菌活性的组分,经排油实验、TLC、MALDI-TOF-MS等手段确定该活性组分为含有14~16 个C的环状脂肽Surfactin。抑菌谱和MIC结果表明Surfactin对常见的G+和G-具有抑菌活性,对L.monocytogenesATCC 19115的MIC可达4 μg/mL。较低的溶血性表明Surfactin具有一定的成药前景,而pH值稳定性和热稳定性研究则表明了其较强的环境适应性。综上所述,Surfactin显示出在食品加工、医疗卫生、畜牧生产和环境治理等方面可能具有一定的应用潜能。然而,目前Surfactin的生产成本仍然较高,大约在100~1000 美元/kg[31]。因此,未来通过对代谢途径的调控,大幅提高产生菌合成Surfactin的效率,将是其应用的关键。
