基于单细胞组学分析LCLAT1在喉鳞癌中的表达及其与预后的关系
2023-03-04王嘉达沈志森沈一鸣王嘉宁
王嘉达,沈志森,沈一鸣,王嘉宁
喉癌是一种常见的头颈部恶性肿瘤[1],病理类型主要是鳞状细胞癌[2]。虽然近几十年喉癌全球死亡率有所下降,但是东南亚地区喉癌疾病负担依然严峻[3]。因而寻求新的治疗靶点,抑制肿瘤进展,提高喉癌患者的生活质量是十分重要的。磷脂作为细胞膜的重要组成部分,是肿瘤细胞增殖必要的养分[4]。有研究显示心磷脂酰基转移酶1(LCLAT1)在肺癌中通过调节线粒体动力学来调节肿瘤的增殖和转移[5]。但是LCLAT1在喉癌中的作用尚不清楚,因此本研究使用单细胞转录组学分析了LCLAT1在喉癌上皮细胞亚群中的表达情况,并结合癌症基因组图谱(TCGA)数据库、Reactome数据库和String数据库进一步分析LCLAT1潜在的作用。现报道如下。
1 资料与方法
1.1 材料 来自3例喉鳞癌患者的肿瘤组织、癌旁组织及对应的淋巴转移组织共9个样本用于单细胞RNA测序,喉癌标本20例用于免疫组织化学实验,这些标本均来自2019年10—12月宁波市医疗中心李惠利医院的患者,本研究通过医院伦理委员会批准(批号:KY2020PJ191)。在Reactome数据库(https://reactome.org) 下载甘油磷脂合成途径相关基因128个。从TCGA数据库下载喉鳞癌基因转录组测序数据及对应的临床信息,共123例,其中肿瘤组织111例,正常组织12例。
1.2 单细胞转录组测序实验 将肿瘤组织切成直径约3 mm小块,用磷酸盐缓冲液(PBS)反复冲洗,去除表面杂质。使用人肿瘤解离试剂盒(Miltenyi Biotec,Cat No.130-095-929,德国)解离组织。经由70m细胞筛过滤及离心机离心后获得细胞沉淀,将细胞再次置于PBS溶液中保存。使用10 XGenomics单细胞转录组测序平台捕获单细胞、极低量RNA反转录扩增和DNA文库构建。使用NovaSeq 6000测序平台进行测序。上机要求:样本存活率>85%,细胞浓度700~1200个/l。
1.3 生信分析方法 使用“Seurat”包分析单细胞测序下游数据,数据整合及去批次效应通过CCA方法寻找锚定点细胞实现[6]。使用“AUCell”包对细胞进行生物学功能富集分析。使用“copykat”包鉴定恶性细胞。采用R软件(4.1.3版本)“limma”包和“survival”包分析128个甘油磷脂合成途径相关基因在TCGA喉癌队列中的表达水平及与总体生存率的关系。使用Cytoscape软件与String数据库构建蛋白质互作网络并鉴定核心基因。
1.4 免疫组织化学实验 免疫组化实验采用Envision两步法。石蜡切片烘烤后,用常规二甲苯和乙醇脱腊,然后用PBS洗涤3次,每次3 min。在黑暗环境下3%过氧化氢孵育10 min阻断内源性过氧化物酶后,切片先后与一抗和二抗孵育。切片用二氨基联苯胺(DAB)染色,苏木精复染,在不同浓度的乙醇中梯度脱水后,然后在病理医师的协助下用显微镜检查。抗原使用兔单克隆抗体LCLAT1[Abcam(ab122197),Cambridge,UK]。
1.5 统计方法 采用R软件进行数据分析,基因差异表达分析logFC=1。单因素回归分析采用Cox分析和Kaplan-Meier分析,取交集。P<0.05表示差异有统计学意义。
2 结果
2.1 喉鳞癌单细胞测序分析 经过多重质量控制后,获得50 618个细胞和36 567个基因用于下游分析。一共识别出10个主要细胞簇,基于一些经典的细胞标记基因,分别命名为上皮细胞、内皮细胞、CD8+T细胞、B细胞、浆细胞、髓系细胞、成纤维细胞、肥大细胞、浆细胞样树突状细胞和中性粒细胞,见图1。对上皮细胞进一步聚类,一共识别出11个细胞簇。使用“AUCell”R包计算每一个上皮细胞“细胞周期通路”的活性,发现细胞簇1是细胞周期活性最高,见图2左图浅绿色细胞簇。使用“copykat”R包鉴定出恶性细胞主要是细胞簇0、1、2、4、8,见图2右图红色细胞。
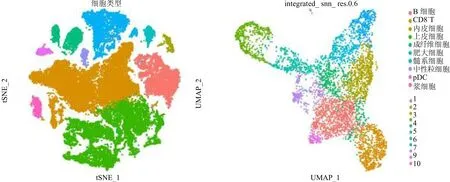
图1 通过TSNE和UMAP分别展示喉鳞癌肿瘤微环境及上皮细胞异质性注:左图tSNE图展示喉鳞癌肿瘤微环境10个主要的细胞亚群。右图UMAP图展示上皮细胞11个细胞亚群
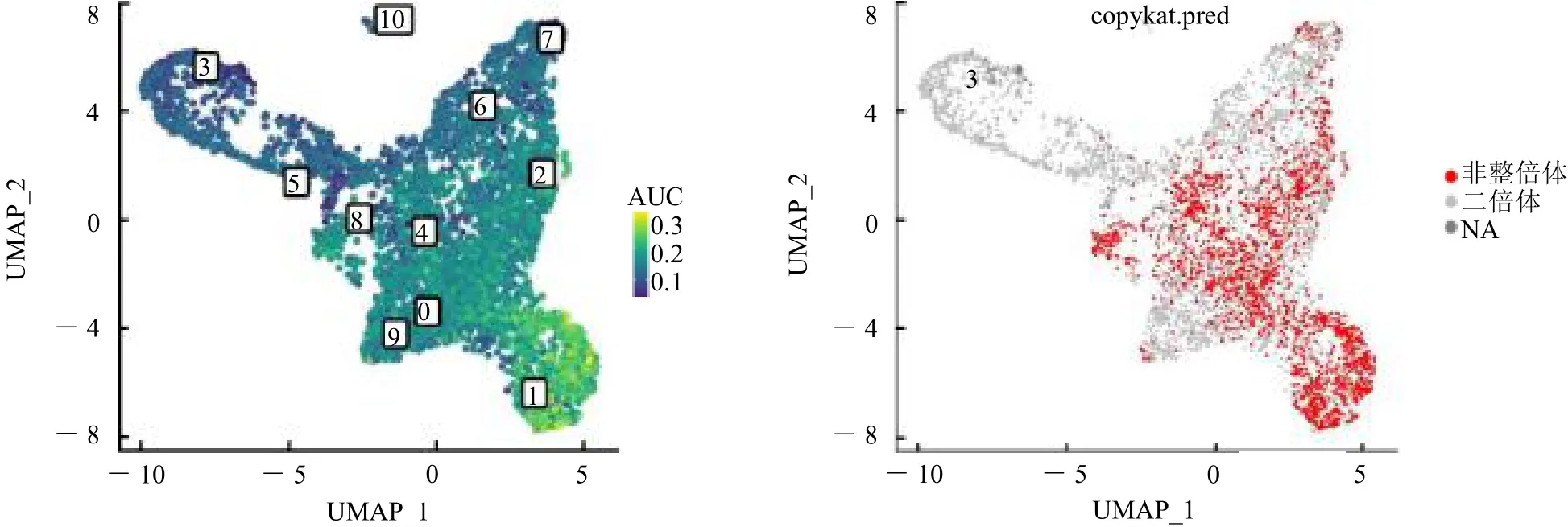
图2 上皮细胞AUCell和copykat分析结果
2.2 LCLAT1在喉癌中的表达分析 单细胞测序结果表明在上皮细胞中LCLAT1主要在细胞簇c1与c10表达,簇c1为细胞增殖活跃的恶性细胞簇,簇c10整体上远离上皮细胞,仅包含15个细胞,并且检测出大量线粒体相关基因,该细胞簇是凋亡的细胞,差异无统计学意义(P>0.05),见图3。基于TCGA喉癌队列分析,结果表明LCLAT1在肿瘤组织中高表达(LogFC=1.214,P<0.005),128个甘油磷脂合成途径相关基因中有30个基因在肿瘤与正常组织中表达差异均有统计学意义(均P<0.05),使用这30个基因构建了蛋白质相互作用网络,LCLAT1是甘油磷脂合成途径中的关键基因之一,见图3。20例喉癌标本免疫组织化学实验结果表明LCLAT1在肿瘤组织中高表达,见图4。
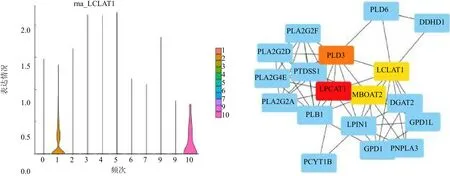
图3 LCLAT1在喉癌上皮细胞中的表达情况及在甘油磷脂合成途径中的核心价值
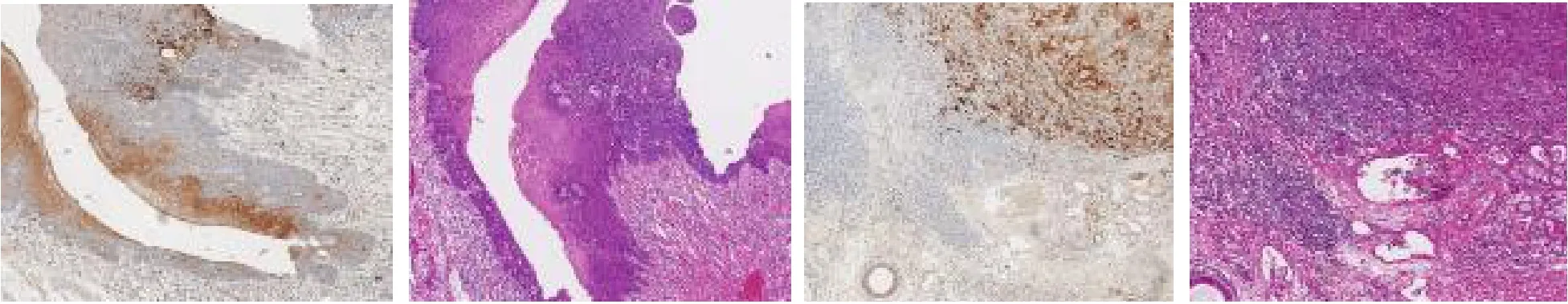
图4 喉鳞癌肿瘤组织和正常组织的免疫组织化学染色结果(HE染色,×7)
2.3 LCLAT1与喉癌预后的关系 在30个表达差异有统计学意义的基因中,有2个基因与喉癌的总体生存率相关,其中LCLAT1是危险系数最高的基因(HR=2.296,95%CI:1.172~4.498,P<0.05),另外一个是MBOAT2(HR=1.336,95%CI:1.018~1.756,P<0.05)。单因素和多因素Cox风险回归分析显示LCLAT1是喉癌的独立预后指标,见表1~2,ROC曲线分析显示LCLAT1是喉癌可靠的预后指标,1、3和5年生存率曲线下面积分别为0.657、0.608和0.629。
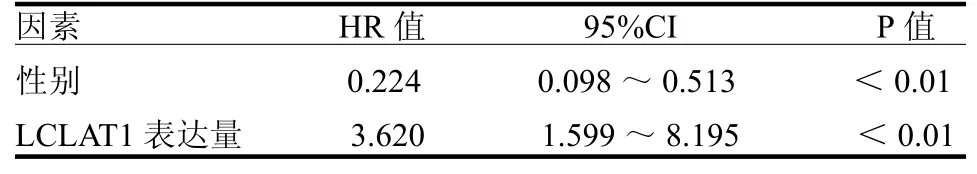
表1 影响喉癌患者生存预后的多因素回归分析
3 讨论
本研究使用单细胞转录组学重点探讨了喉鳞癌上皮细胞的异质性,检测样本包含3例喉鳞癌患者的肿瘤组织、癌旁组织及对应的淋巴结转移组织,观察了LCLAT1在上皮细胞亚群中的表达情况。结果显示LCLAT1大部分位于线粒体内,主要参与甘油磷脂合成途径。因此笔者收集了128个甘油磷脂合成途径相关基因,分析了它们在喉癌中的表达及其与预后的关系,评估LCLAT1在喉鳞癌甘油磷脂合成途径中的重要作用。最后通过对20例喉鳞癌标本进行免疫组织化学实验验证了LCLAT1在喉癌肿瘤组织中高表达,在癌旁组织中低表达。
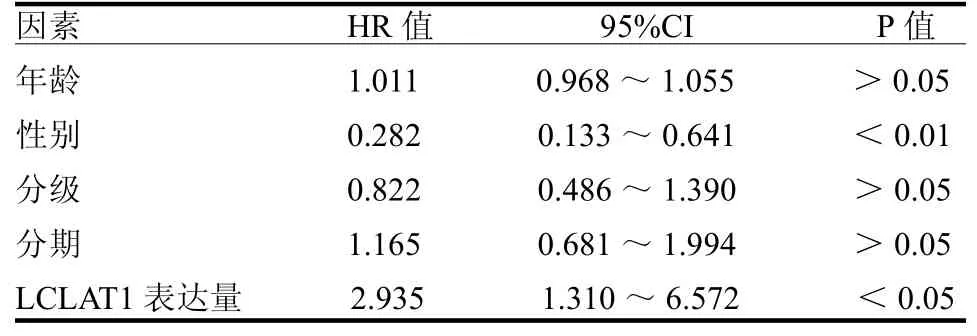
表2 影响喉癌患者生存预后的单因素回归分析
代谢重编程是癌症发生、进展和转移的主要特点[7]。线粒体作为各种代谢途径的交汇点,在癌症发展中起着重要作用。心磷脂含有大量不饱和脂肪酸,主要位于线粒体内膜,病理情况下可以易位至外膜,调控氧化应激、细胞凋亡和炎症反应等[8-10]。有研究发现胰腺癌干细胞中存在心磷脂结构改变[11],靶向线粒体功能的治疗可以明显改善癌症宿主的能量和蛋白质代谢[12]。目前已有多种靶向线粒体的纳米技术试图通过能量代谢干扰、线粒体蛋白干扰及活性氧调节等方法治疗癌症[13]。有研究发现心磷脂可以改变线粒体膜的脂质成分,导致膜透化,心磷脂与脂质包埋的柔红霉素共同递送,可以增加乳腺癌细胞的药物摄取量,提高药物细胞毒性[14]。将药物靶向递送到细胞器是分子药理学的现代趋势之一[15]。
线粒体对机体免疫系统至关重要,线粒体的细胞代谢和代谢编程与先天免疫反应密切相关[16]。免疫细胞激活后需要大量的能量,供给不同的免疫细胞线粒体会采取不同的措施,例如在活化的T细胞中线粒体通过增加糖酵解供给能量,而在调节性T细胞中则通过增加 氧化供能[17]。除了能量供给外,线粒体还可以通过产生三羧酸循环的活性氧和代谢物来调控免疫细胞活化和免疫反应的信号级联[18]。有研究发现线粒体特异性心磷脂的从头合成是CD8+T细胞维持正常的抗原反应性所必需的[19]。心磷脂不光可以影响外周免疫系统,还可以调控中枢神经系统的免疫功能[20]。还有研究发现胞外的心磷脂可以通过Toll样受体4依赖途径调节星形胶质细胞分泌的细胞因子和细胞毒素[21]。胞质接触的错位心磷脂还可以作为损伤相关分子模式通过模式识别受体诱导炎症,参与干燥综合征、系统性红斑狼疮及类风湿关节炎等自身免疫性疾病[22]。
本文结果提示LCLAT1是喉癌的危险因素。其主要功能是调节心磷脂的代谢以及进而调控线粒体功能,虽然这项研究尚在初始阶段,仍需要大量实验验证LCLAT1在喉鳞癌甘油磷脂代谢过程中的作用,但是本研究为靶向甘油磷脂代谢途径或者靶向线粒体的癌症新治疗提供了思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王嘉达:实验操作、论文撰写;王嘉达、沈一鸣、王嘉宁:数据整理、统计学分析;沈志森:研究指导、论文修改、经费支持
