甘草查尔酮A通过调控PI3K/AKT信号通路诱导肺鳞癌细胞周期阻滞
2023-02-27范晓丽王梨明
范晓丽,王 娟,王梨明
1桂林医学院药学院,广西 桂林 541100;2桂林医学院临床学院,广西 桂林541001
肺癌是世界上最常见的恶性肿瘤之一,死亡率居恶性肿瘤的首位[1]。在新发病例中,约85%的病人诊断为非小细胞肺癌[2](NSCLC),主要包括腺癌、鳞癌和大细胞癌,其中肺鳞癌约占30%[3]。目前,对于肺鳞癌的治疗,仍以外科手术切除为主,其次为细胞毒性化疗和免疫治疗。近年来,驱动基因表皮生长因子受体、间变性淋巴瘤激酶的靶向治疗取得了非常好的效果[4,5]。但是,由于缺乏相应的治疗靶点,靶向治疗对于肺鳞癌患者受益很少[6]。肺鳞状细胞癌总体预后较差,存在较高的转移率和复发率,只有约18%的患者存活五年或更长时间[7]。因此,开发新的药物或者治疗方法仍是亟待解决的问题。
近年来,在传统中药中发现很多有效成分,成为肿瘤治疗的新策略。甘草查尔酮A(LCA)是一种从甘草中分离出来的类黄酮物质,具有抗炎[8],抗氧化[9,10]和抗肿瘤[11]等多种药理活性,在体外抗肿瘤中的作用日益明显。研究表明,LCA在胃癌[12]、肝癌[13],乳腺癌[14],前列腺癌[15]以及骨肉瘤[16]等多种细胞系中具有抗肿瘤作用。LCA在肺癌中的研究很少,有课题组发现,LCA可以通过抑制肺癌细胞A549 和H460 增殖而发挥抗肿瘤作用[17],在肺癌细胞株H292 中还可以通过上调mir-144-3p 引起内质网应激和细胞凋亡[18]。由于肺腺癌和鳞癌的病理类型不同,药物作用的机制也可能有很大不同。因此,探究LCA 在肺鳞癌中的作用很有意义。
PI3Κ/Akt信号通路是大多数人类肿瘤中最常激活的途径之一,在肺癌的发生和进展中起到非常重要的作用[19],PI3Κ/Akt信号通路与细胞增殖相关,其激活可诱导细胞周期G1/S期转变[20]。有研究表明,许多药物可通过抑制PI3Κ/Akt信号通路抑制肿瘤的生长[21]。前期研究表明,LCA可能通过抑制PI3Κ/AΚT/mTOR信号通路在体外抑制肾癌细胞的增殖、侵袭迁移以及诱导自噬[22]。本研究中,我们检测了LCA在肺鳞癌H226细胞和异种移植模型中的抗肿瘤作用,并探究与PI3Κ/Akt信号通路的关系,以期为甘草查尔酮A用于临床治疗肺鳞癌提供理论依据。
1 材料和方法
1.1 细胞系
人肺鳞癌细胞系H226购于中科院上海细胞所,用含10%胎牛血清的RMPI 1640培养基进行培养,细胞生长至对数期后进行实验。
实验分组:对照组(0.1%DMSO的培养液)、不同浓度的LCA溶液(10、20、40 μmol/L)。先将LCA溶解在DMSO中配制成120 mmol/L的储存液,使用时用培养液稀释至相应浓度。
1.2 药物与试剂
LCA(MCE),胎牛血清、RMPI 1640 培养基(GIBCO),胰蛋白酶和青链霉素、PBS及MTT试剂(索莱宝),RIPA 蛋白裂解液、BCA 蛋白定量试剂盒(碧云天),CDΚ2、CDΚ4、CyclinD1、Akt、p-Akt、PI3Κ(110 000)以及p-PI3Κ(85 000)抗体(abcam),GAPDH(Proteintech),鼠二抗、兔二抗(北京依玛博科技有限公司)。
1.3 MTT实验
将H226细胞接种在96孔板中,根据预实验结果,加入不同浓度的LCA溶液(0、2、5、10、20、30 μmol/L)培养48 h,每组设置6个复孔。每孔加入20 μL的MTT溶液,于培养箱中继续孵育4 h后每孔加入150 μL的DMSO,避光在摇床混匀10 min,检测490 nm波长处的吸光度值(A值)。通过细胞抑制率计算48 h的半数抑制浓度。细胞增殖抑制率=(A对照组-A实验组)/(A对照组-A空白组)×100%。
1.4 PI染色检测细胞周期
对数生长期的细胞以4×105/孔接种于6孔板,过夜贴壁后,加入终浓度为0、10、20 以及40 μmol/L 的LCA 处理48 h,用不含EDTA的胰酶消化细胞,离心收集细胞,用70%的乙醇固定过夜,使用前,2000 r/min离心10 min,弃去70%冰乙醇,预冷的PBS洗涤1次,用0.5 mL RNase悬浮细胞后,37 ℃水浴30 min,最后加入PI避光染色30 min,300目筛网过滤,上机进行检测,实验重复3次。
1.5 Western blot检测相关蛋白的表达
对数生长期的细胞接种在7 cm培养皿中,加入相应浓度的LCA溶液(0、10、20、40 μmol/L),48 h后收集细胞,用碧云天的RIPA裂解液提取细胞总蛋白,通过BCA法进行蛋白定量。定量20 μg蛋白进行SDS-PAGE凝胶电泳,将目的蛋白转移至硝酸纤维素膜,室温下,5%脱脂奶粉封闭1 h,加入相应的一抗,4 ℃孵育过夜。次日,加入相应的二抗,室温孵育1 h。通过化学发光液显色,通过Image Lab 6.0 软件分析蛋白灰度值。蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.6 动物实验
无胸腺裸鼠(BALB/c-nu)购于湖南斯莱克景达实验动物公司,生产许可证:SCXΚ(湘)2019-0004,裸鼠饲养于桂林医学院实验动物中心SPF级动物房,本实验使用雄鼠,4周龄,共8只,适应性饲养1周后随机分为2组。LCA用含20%SBE-β-CD的生理盐水溶解。将1×107H226细胞种植入小鼠右侧腋下,大约7 d瘤体长径长至0.8 cm时,给予药物治疗,对照组小鼠注射含20%SBEβ-CD的生理盐水(200 μL),实验组小鼠注射15 mg/kg的LCA溶液(200 μL),注射1次/d,连续24 d,实验结束时,脱颈处死裸鼠,取肿瘤观察每组肿瘤大小,并称量肿瘤的质量。所有动物实验均通过桂林医学院动物伦理委员会审批(GLMC202103038)。
1.7 统计学分析
计量资料均采用均数±标准差来表示,每个实验至少重复3次。通过GraphPad Prism 5.0 软件进行数据作图。采用SPSS 22.0进行数据统计,多组间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 LCA处理H226细胞48 h的半数抑制浓度
不同剂量的LCA处理48 h后,H226细胞活力明显受到抑制,随着浓度的增加,其抑制作用越来越显著(图1B)。在LCA浓度为2、5、10、20及30 μmol/L时,细胞活力分别为(90.54±2.99)%、(86.31±3.33)%、(73.15±2.78)%、(60.56±2.45)%、(44.86±3.67)%,当LCA 浓度高于5 μmol/L 时,可以有效的抑制H226 细胞活力(P<0.05)。LCA处理48 h,IC50为28.3 μmol/L。因此,我们选择10、20以及40 μmol/L的浓度进行下一步实验。细胞生长至密度大约40%左右,向培养皿中加入终浓度为0、10、20以及40 μmol/L的LCA,继续培养48 h后,倒置显微镜下观察细胞形态变化(图1C),随着LCA浓度的增加,细胞数量明显减少。

图1 LCA抑制肺鳞癌H226细胞增殖Fig.1 LCA inhibits proliferation of H226 cells.A:Chemical structure of LCA.B:Viability of H226 cells treated with different concentrations of LCA for 48 h(Mean±SD,n=3).C:Morphology of H226 cells treated with different concentrations of LCA for 48 h.
2.2 LCA对H226细胞周期的影响
我们通过流式细胞术检测不同浓度LCA对H226细胞周期的影响(图2),对照组及LCA(10、20、40 μmol/L)处理组G1 期的细胞百分率分别为(23.53±0.50)%、(26.93±0.67)%、(27.70±1.97)%、(32.20±2.07)%。与对照组相比,LCA处理组细胞周期G1期的比例明显升高(P<0.05),并呈现剂量依赖性,说明LCA可以使细胞阻滞在G1期。
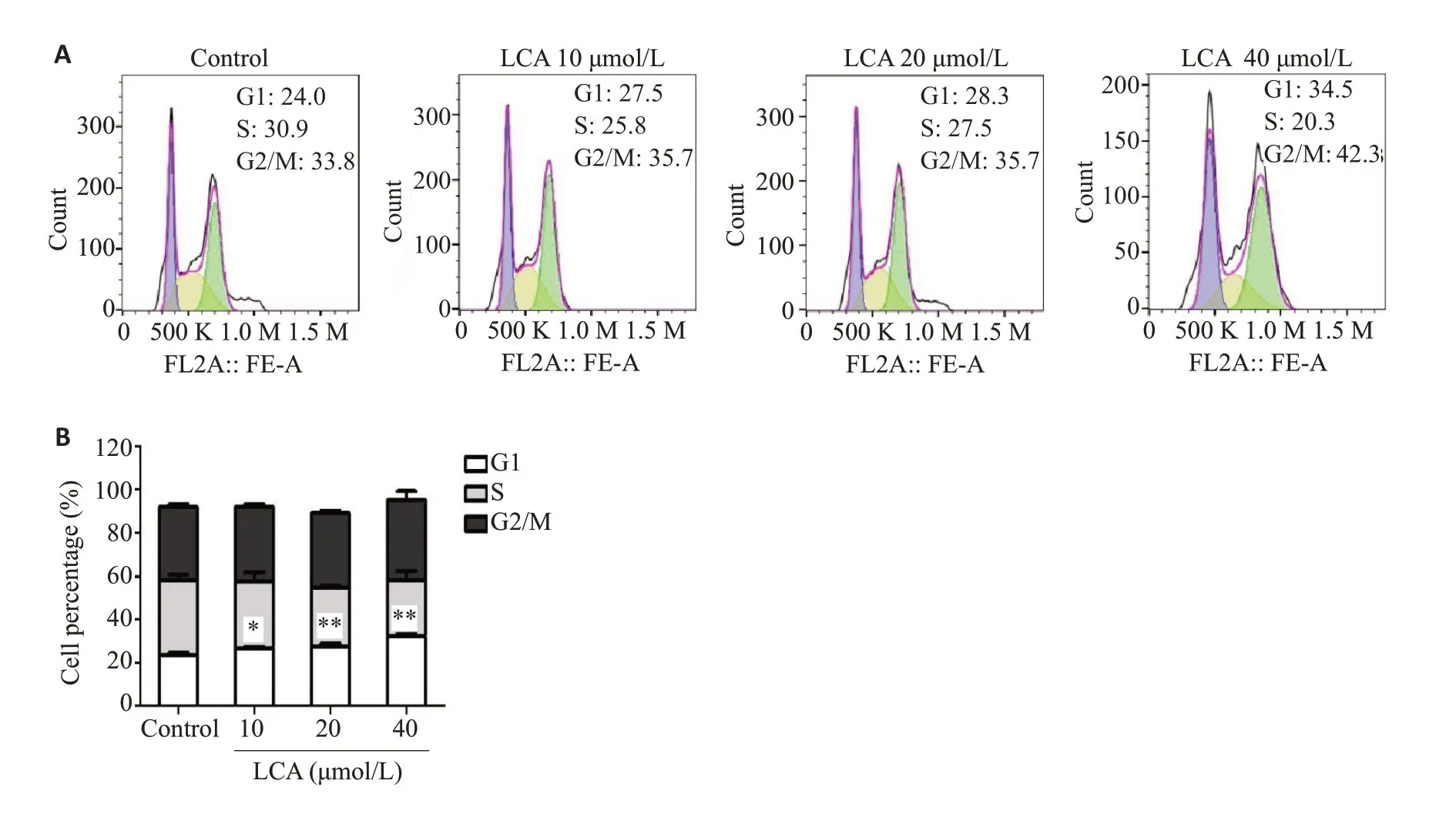
图2 LCA对肺鳞癌H226细胞周期的影响Fig.2 Effect of LCA on cell cycle of H226 cells.A: Flow cytometry of H226 cells treated with different concentrations of LCA for 48 h.B:Quantitative analysis of the cell percentages in different phases(Mean±SD,n=3).*P<0.05,**P<0.01 vs control.
2.3 LCA对H226细胞中细胞周期相关蛋白表达的影响
Western blot结果显示,LCA可以降低细胞周期蛋白cyclinD1、CDΚ2以及CDΚ4的蛋白表达水平,CDΚ2的相对表达量从2.39降低到0.44,CDΚ4的相对表达量从2.14降低到0.17,同时cyclinD1的相对表达量从3.25降低到0.18,差异有统计学意义(P<0.05,图3)。

图3 LCA对细胞周期蛋白CyclinD1及细胞周期蛋白依赖性激酶CDΚ2和CDΚ4表达的影响Fig.3 Effect of LCA on expressions of cyclin D1,CDK2 and CDK4 proteins in H226 cells detected by Western blotting(Mean±SD,n=3).**P<0.01 vs control.
2.4 LCA对Akt,p-Akt,PI3Κ以及p-PI3Κ蛋白表达的影响
通过Western blot检测PI3Κ和Akt的磷酸化水平,发现LCA 浓度依赖性的降低p-PI3Κ 和p-Akt 的磷酸化水平,p-PI3Κ的相对表达量从1.41降低到0.11,p-Akt的相对表达量从1.08降低到0.18,差异有统计学意义(P<0.05,图4),但是对总的PI3Κ和Akt的表达无明显影响(P>0.05,图4)。

图4 LCA对AΚT,p-AΚT,PI3Κ以及p-PI3Κ蛋白表达的影响Fig.4 Effect of LCAon expressions of Akt,p-AKT,PI3K and p-PI3K proteins in H226 cells detected by Western blotting(Mean±SD,n=3).**P<0.01 vs control.
2.5 LCA在体内抑制H226细胞增殖
裸鼠成瘤实验结果发现,与对照组小鼠相比,实验组小鼠在注射LCA后肿瘤体积明显缩小(图5A)。通过对生长曲线的分析发现,对照组小鼠的平均体积为1270.85 mm3,LCA处理组小鼠的平均体积为841 mm3,差异有统计学意义(P<0.05,图5B),说明注射LCA后肿瘤体积明显受到抑制。通过解剖称量肿瘤的湿重,发现对照组小鼠的平均湿重为0.69,LCA处理组小鼠的平均湿重为0.46,差异有统计学意义(P<0.01,图5C),LCA处理后肿瘤的质量明显降低(P<0.01)。Western blot显示对照组中p-PI3Κ/PI3Κ 蛋白的相对表达量为0.95,LCA处理组为0.24,对照组中p-AΚT/AΚT蛋白的相对表达量为0.59,LCA处理组为0.19,差异有统计学意义(P<0.05,图5D、E)。

图5 LCA体内抑制H226肿瘤生长Fig.5 LCA suppresses growth of H226 xenografts in mice.A: Representative image of the tumors.B:Average tumor volume(mm3).C:Weight of wet tumor.D,E:Expressions of Akt,p-AKT,PI3K and p-PI3K protein in tumor xenograft tissues measured by Western blotting.Data are presented as Mean±SD(n=4).*P<0.05 vs control.
3 讨论
甘草查尔酮A是一种常见的具有抗炎和抗菌作用的天然药物,既往研究发现其在体内外具有很好的抗肿瘤作用,作用机制主要与抑制细胞增殖、诱导细胞凋亡相关,但是在肺鳞癌中的作用尚未见报道。在本研究中,我们通过体内外实验探究甘草查尔酮A对肺鳞癌增殖的影响及可能的机制。MTT结果表明,随着LCA浓度的升高,肺鳞癌H226细胞活力呈剂量依赖性降低,说明LCA可以抑制H226细胞增殖。裸鼠荷瘤实验结果显示,LCA腹腔注射后,肿瘤的体积和重量都明显减小,说明LCA从体内水平抑制了H226细胞的增殖。
细胞癌变与细胞周期的关系是近年来关注的焦点,通过调节细胞周期来抑制癌细胞的增殖是癌症治疗的一个重要策略。研究表明LCA不仅能抑制肿瘤细胞的增殖[23],还能诱导细胞周期阻滞[13,24]。为了进一步揭示LCA在肺鳞癌中的作用机制,本实验通过流式细胞术检测其对细胞周期的影响,结果表明,LCA处理H226细胞48 h后,G1期细胞数量明显增多,且呈剂量依赖性。说明LCA可引起细胞周期G1期阻滞。细胞周期中大多数与细胞增殖相关的基因事件发生在G1期,因此G1/S期过渡在细胞周期进程中起到非常重要的作用。细胞周期调控蛋白如CyclinD1[25]以及相关的细胞周期调控蛋白激酶CDΚ2及CDΚ4是细胞周期进程中从G1期进入S期非常重要的蛋白[26],因此,我们通过Western blot探究了不同浓度LCA对CyclinD1、CDΚ2及CDΚ4 的表达的影响,结果显示,LCA 可以下调cyclinD1、CDΚ2及CDΚ4的表达,且呈浓度依赖性。
PI3Κ可参与调控细胞增殖、凋亡、转录和血管发生等多种细胞过程[27],AΚT是PI3Κ的主要下游效应因子,可被PI3Κ激活,并磷酸化多种酶、激酶和转录因子[28]。有文献证明,PI3Κ/AΚT信号通路通过影响细胞周期相关分子来调节细胞周期进程[29,30]。而且研究还发现,许多药物都可以通过靶向PI3Κ/AΚT信号通路发挥抗肿瘤作用[31-33]。为了进一步探究LCA对肺鳞癌H226细胞的抑制作用是否通过靶向PI3Κ/AΚT信号通路,我们研究了不同浓度LCA对p-PI3Κ、PI3Κ、p-AΚT、AΚT表达的影响,Western blot的结果显示,PI3Κ和AΚT的表达几乎无变化,而p-PI3Κ和p-AΚT的表达明显降低,且呈浓度依赖性,这个结果表明,LCA抑制细胞增殖和诱导周期阻滞的作用可能与抑制PI3Κ/AΚT信号通路磷酸化有关。
本研究发现,LCA可以有效的抑制H226细胞增殖并诱导细胞周期阻滞,并引起细胞周期蛋白cyclinD1和细胞周期蛋白依赖性激酶CDΚ2和CDΚ4表达降低。裸鼠荷瘤实验也表明LCA可以在体内抑制肺鳞癌的生长。其作用机制可能与抑制PI3Κ/AΚT信号通路磷酸化有关。本研究初步揭示了LCA作为抗肺鳞癌治疗药物的可能作用机制,为LCA将来用于肺鳞癌的治疗提供了理论和实验依据。
