特立帕肽通过cAMP/PKA/CREB 信号通路调控高糖微环境下的成骨细胞分化
2023-02-27秦雅芝温国琛戚孟春
侯 甜,秦雅芝,张 妍,温国琛,戚孟春,董 伟
华北理工大学口腔医学院,河北 唐山063210
糖尿病会影响骨代谢,损害细胞功能,导致骨质流失、骨的微观结构改变[1]。晚期糖基化终产物(AGEs)是糖尿病慢性并发症和骨质量恶化的一种机制[2]。骨稳态的调节是一个协同过程,涉及成骨细胞和破骨细胞之间的相互作用。AGEs可以剂量依赖性的方式抑制成骨细胞特异性基因Runt相关的转录因子2(RUNX2)和成骨细胞特异性转录因子Osterix(OSX)的表达,也可通过抑制核因子κB受体活化因子配体/核因子κB受体活化因子信号传导来抑制破骨细胞分化[3]。另有研究发现,高浓度葡萄糖可抑制MC3T3-E1细胞成骨分化并诱导其凋亡[4,5]。尽管有这些发现,但糖尿病微环境中骨细胞损伤的具体机制尚不清楚,且糖尿病性骨质疏松症(DOP)发病机制复杂多样,有待进一步探索。
环磷酸腺苷(cAMP)/蛋白激酶A(PΚA)是经典的细胞信号途径之一。cAMP通过与PΚA的调节亚基R结合来激活PΚA,进而磷酸化下游转录因子,如cAMP反应元件结合蛋白(CREB),以激活下游转录过程[6]。通过cAMP/PΚA/CREB途径激活RUNX2可促进骨髓间充质干细胞的成骨分化[7]。因此,通过激活cAMP/PΚA/CREB信号途径调节DOP患者成骨分化可能是一种潜在的分子机制。
特立帕肽是一种用于治疗骨质疏松症的合成代谢药物,可治疗男性骨质疏松,糖皮质激素治疗有关的骨质疏松症以及绝经后骨质疏松症等[8,9]。但关于其治疗DOP患者的相关研究报道较少且多为动物模型研究,关于特立帕肽发挥作用的细胞分子学机制层面的研究还未有确切详尽的阐述。因此,本研究探讨特立帕肽在高糖微环境下通过激活cAMP/PΚA/CREB信号途径调节MC3T3-E1细胞成骨分化中的分子机制,对特立帕肽治疗DOP具有重要意义。
1 材料和方法
1.1 材料
细胞MC3T3-E1(中科院上海细胞库);α-MEM培养基、胎牛血清(FBS)(BI);H-89(MedChemExpress);碱性磷酸酶(ALP)显色试剂盒、DAPI(碧云天);ALP活性试剂盒(南京建成生物工程研究所);鬼笔环肽、曲拉通TritonX-100(Sigma);茜素红染色液(雷根生物);PCR试剂盒(Abclonal)。
1.2 方法
1.2.1 细胞培养 MC3T3-E1细胞接种在细胞瓶中,用含有10%FBS、1%双抗的α-MEM培养基,在37 ℃、含5%CO2的培养箱中进行培养,隔天换液,当密度达80%~90%时,用胰酶消化下来,即可传代。用10 nmol/L 地塞米松、10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸进行成骨诱导分化培养。实验分为5 组:(1)正常糖(NG)组:给予葡萄糖浓度为5.5 mmol/L的培养基;(2)NG+特立帕肽组:在葡萄糖浓度为5.5 mmol/L培养基中加入10 nmol/L 特立帕肽;(3)高糖(HG)组:给予葡萄糖浓度为25 mmol/L的培养基;(4)HG+特立帕肽组:在葡萄糖浓度为25 mmol/L培养基中加入10 nmol/L特立帕肽;(5)HG+特立帕肽+PΚA抑制剂组:在葡萄糖浓度为25 mmol/L培养基中加入10 nmol/L 特立帕肽以及通路抑制剂20 μmol/L H-89。
1.2.2 细胞活性检测 将MC3T3-E1细胞密度调整至2×103/孔,将细胞悬液接种至96孔板,细胞贴壁后弃掉原培养基,加入按1.2.1分组新配制的100µL培养基,分别培养24、48、72 h后,随后向每孔内加入10µLCCΚ-8溶液,在培养箱中放置1 h,采用酶标仪检测细胞吸光度值A450nm。本实验重复3次。
1.2.3 细胞内cAMP水平测定 将MC3T3-E1细胞以2×105/孔的细胞密度置于24孔板中,细胞贴壁后弃掉原培养基按1.2.1分组换液,24 h后按ELISA试剂盒操作步骤处理细胞,检测各组细胞cAMP水平。本实验重复3次。
1.2.4 ALP染色和活性分析 将细胞以4×103/孔的密度接种至48孔板内过夜生长,按1.2.1分组将细胞成骨诱导培养7 d后,弃细胞上清液,PBS洗涤各孔,4%多聚甲醛固定30 min后,再用PBS洗涤各孔,按操作步骤加入ALP染色试剂盒中的染色液,随后进行孵育。显色后在倒置显微镜下观察拍照。采用活性检测试剂盒测定各组细胞的ALP活性,再根据试剂盒提供的计算方式进行计算。本实验重复3次。
1.2.5 茜素红染色分析 细胞在48孔板内以4×103/孔的密度过夜生长,按1.2.1分组将各组细胞成骨诱导培养21 d后。在室温下用染色试剂盒中的固定液固定15 min,PBS洗涤各孔,滴加茜素红染液对矿化结节进行染色,染色时间30 min,用蒸馏水洗去染色液,光镜下观察矿化结节生成情况并拍照。实验结果用Image J软件分析茜素红结节阳性区域占总区域的百分比表示。本实验重复3次。
1.2.6 荧光染色检测细胞骨架 将细胞爬片提前放置于6孔板中,每孔滴加1 mL细胞悬液,在细胞贴壁后按1.2.1中的实验分组进行换液,培养24 h后,轻柔吸去爬片上的细胞培养液,PBS清洗爬片,在室温下4%多聚甲醛固定30 min,PBS再次清洗爬片后,用0.5%Triton X-100透化15 min,PBS清洗,每张爬片滴加鬼笔环肽染液200µL,黑暗环境下孵育1 h,PBS轻柔冲洗3次,再加入DAPI染液对细胞核进行复染,室温下避光5 min。使用荧光显微镜捕获图像。本实验重复3次。
1.2.7 Real-time PCR检测 将MC3T3-E1细胞悬液滴加至6孔板中,细胞贴壁后弃掉原培养基,按1.2.1实验分组加入对应的培养液,成骨诱导培养7 d后按照RNA提取试剂盒(简石生物)操作步骤提取总RNA。逆转录成cDNA 后,使用2X Universal SYBR Green Fast qPCR Mix(ABclonal)试剂盒,按照操作说明用StepOnePlus 实时PCR 系统(Applied Biosystems)进行Real-time PCR检测。本实验重复3次,并以β-actin为内参。实验中采用的引物序列如表1,数据使用2-△△CT法进行分析。
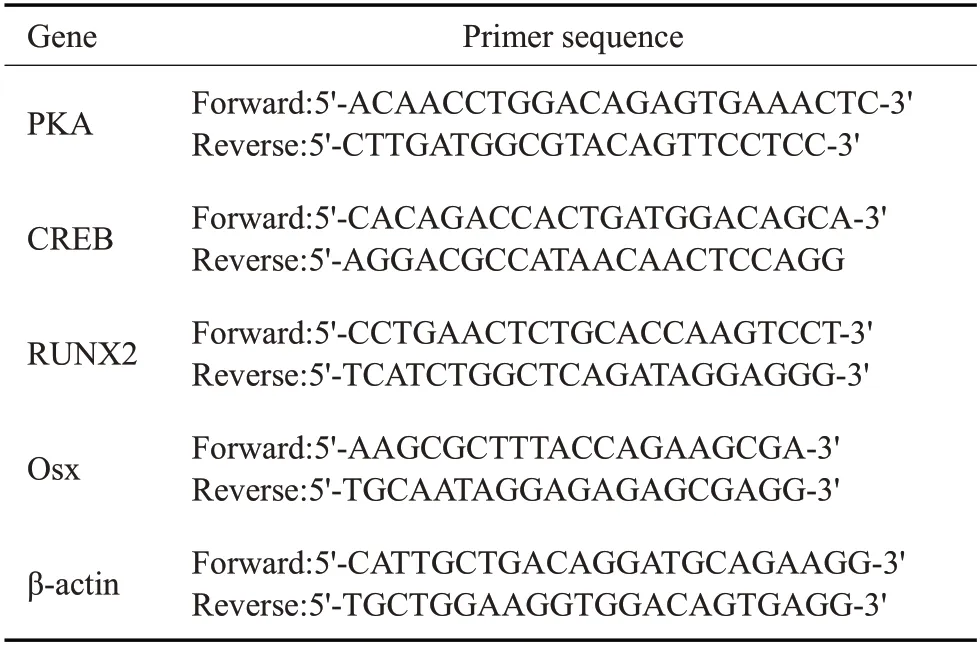
表1 引物序列Tab.1 Primer sequences for real-time PCR
1.3 统计学分析
应用SPSS 26.0 软件进行统计分析。实验结果以均数±标准差表示,采用单因素方差分析进行多组间均数的比较,组间多重比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MC3T3-E1细胞增殖能力的比较
5组MC3T3-E1细胞培养24、48、72 h后,CCΚ-8法结果显示,NG组、NG+特立帕肽组、HG组、HG+特立帕肽组、HG+特立帕肽+H-89组MC3T3-E1 细胞增殖活性差异无统计学意义(P>0.05,图1)。

图1 CCΚ-8法检测不同时间点细胞的增殖水平Fig.1 Proliferation of the cells detected by CCK-8 assay at different time points.NG:Normal glucose;HG:High glucose.
2.2 MC3T3-E1细胞内cAMP水平变化
与NG组相比,NG+特立帕肽组的cAMP水平显著升高(P<0.05),HG组cAMP水平降低(P<0.05)。同样,在特立帕肽的处理下,HG+特立帕肽组的cAMP水平与HG组比较显著上调(P<0.05)。与HG+特立帕肽组相比,HG+特立帕肽+H-89组cAMP水平下降(P<0.05,图2)。

图2 特立帕肽处理MC3T3-El细胞后cAMP水平变化Fig.2 Changes in cAMP levels in the cells after teriparatide treatment.*P<0.05 vs NG(normal glucose),#P<0.05 vs HG(high glucose),&P<0.05 vs HG+teriparatide.
2.3 各组MC3T3-El细胞内ALP染色及活性的变化
ALP染色程度及活性检测结果显示,NG+特立帕肽组ALP 活性高于NG 组(P<0.05),HG 组低于NG组(P<0.05)。HG+特立帕肽组ALP 活性高于HG 组(P<0.05),HG+特立帕肽+H-89组低于HG+特立帕肽组(P<0.05,图3)。

图3 特立帕肽处理后MC3T3-El内ALP染色及活性变化Fig.3 ALP staining of the cells and changes in ALP activity after teriparatide treatment.A:ALP staining.B:Activity of ALP.*P<0.05 vs NG,#P<0.05 vs HG,&P<0.05 vs HG+teriparatide.
2.4 各组MC3T3-El细胞内矿化结节的变化
茜素红染色结果显示,与NG组相比,NG+特立帕肽组矿化结节数量,面积增多(P<0.05);HG组矿化结节面积则减少(P<0.05)。与HG组相比,HG+特立帕肽组矿化结节面积增多(P<0.05)。与HG+特立帕肽组相比,HG+特立帕肽+H-89组矿化结节面积则减少(P<0.05,图4)。

图4 特立帕肽处理后MC3T3-El内矿化结节的变化Fig.4 Changes of the area of mineralized nodules after teriparatide treatment.A:Alizarin red staining.B:Area of mineralized nodules.*P<0.05 vs NG,#P<0.05 vs HG,&P<0.05 vs HG+teriparatide.
2.5 各组MC3T3-El细胞细胞骨架清晰度的变化
鬼笔环肽染色结果显示,与NG组相比,NG+特立帕肽组显示MC3T3-El细胞呈多角形或梭形,细胞伸展良好,铺展范围大,细胞骨架走形清晰;HG组较NG组,细胞伸展情况差,铺展范围小,内部骨架结构排列紊乱。特立帕肽加入后,可观察到HG+特立帕肽组的铺展情况及细胞骨架结构有所提升,较HG组良好。HG+特立帕肽+H-89组较HG+特立帕肽组细胞铺展较差,内部骨架结构排列紊乱(图5)。
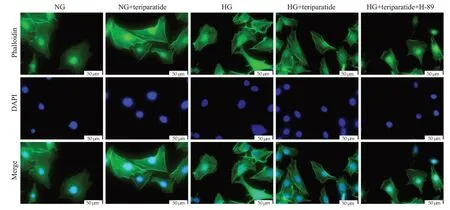
图5 特立帕肽处理后MC3T3-El内细胞骨架变化Fig.5 Changes of cytoskeleton staining after teriparatide treatment.
2.6 Real-time PCR 检测通路及成骨相关基因mRNA表达
与NG组相比,NG+特立帕肽组PΚA、CREB水平升高(P<0.05);HG组PΚA、CREB水平降低(P<0.05)。与HG组相比,HG+特立帕肽组PΚA、CREB水平升高(P<0.05)。与HG+特立帕肽组相比,HG+特立帕肽+H-89组PΚA、CREB水平降低(P<0.05)。
在MC3T3-E1细胞中检测了成骨细胞特异性基因RUNX2和Osx的mRNA表达水平显示,与NG组相比,NG+特立帕肽组RUNX2和Osx水平升高(P<0.05);HG组RUNX2和Osx水平降低(P<0.05)。与HG组相比,HG+特立帕肽组RUNX2 和Osx 水平升高(P<0.05)。与HG+特立帕肽组相比,HG+特立帕肽+H-89 组RUNX2和Osx水平降低(P<0.05,图6)。
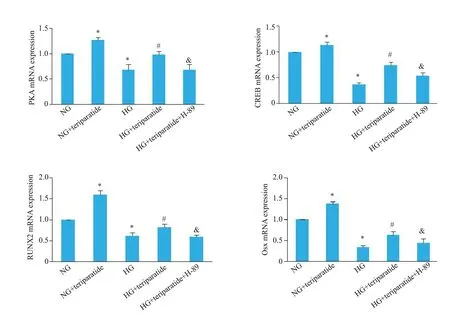
图6 Real-time PCR检测PΚA、CREB、RUNX2和Osx mRNA表达Fig.6 Detection of PKA,CREB,RUNX2 and Osx mRNA expressions by real-time PCR.*P<0.05 vs NG,#P<0.05 vs HG,&P<0.05 vs HG+teriparatide.
3 讨论
随着年龄的增长和生活方式的改变,糖尿病的患病人数越来越多,特别是AGEs的积累,大大增加了患者DOP的发病率[10,11]。有研究指出,DOP 的发病机制涉及高葡萄糖诱导产生的活性氧引发高水平的氧化应激,造成骨代谢失衡,增强机体抗氧化活性,抑制氧化应激反应,可显著改善DOP 骨流失症状[12,13]。另有研究表示糖尿病患者中RUNX2的表达下调与AGEs的形成相关,进而抑制成骨细胞分化[14]。此外,成骨细胞的细胞骨架主要是由微丝、微管、中间纤维等构成,对维持细胞形态及成骨分化都具有重要意义[15]。因此本研究将细胞骨架视为成骨细胞的生物学功能做一指标进行分析。本研究在两种不同葡萄糖浓度培养基条件下培养MC3T3-E1 细胞,HG 组细胞骨架清晰程度及ALP 活性、矿化结节检测,Real-time PCR中成骨基因RUNX2、Osx表达水平等各指标结果相较于NG组都有所下降,证实了高糖微环境对MC3T3-E1细胞成骨分化的抑制作用,这与Xia等[4]关于高糖条件下抑制成骨细胞分化的研究结果一致。
有研究显示特立帕肽可用于治疗绝经后、男性和糖皮质激素诱导的骨质疏松症[16-19]。特立帕肽与其他治疗药物相比,对于改善骨质疏松症患者的骨密度效果更佳,可有效提升患者生活质量[20]。近期研究发现特立帕肽增加了2型糖尿病骨质疏松症患者股骨颈的骨矿物质密度[21]。特立帕肽和低强度有氧运动相结合可增加糖尿病模型大鼠的骨密度[22]。现有研究中关于特立帕肽发挥作用的细胞分子学机制层面的研究还未有确切详尽的阐述。通过目前的研究发现,推测特立帕肽调节高糖微环境下MC3T3-E1细胞成骨分化可能是DOP的药物防治方法之一。本研究在高糖微环境下加入药物特立帕肽进行干预,与HG组细胞骨架清晰程度、ALP活性、矿化结节检测及Real-time PCR 中成骨基因RUNX2、Osx表达水平相比较,HG+特立帕肽组结果显示,特立帕肽能够提升MC3T3-E1细胞骨架清晰度,增强ALP 活性、矿化水平,升高成骨转录因子RUNX2、Osx的表达。各项研究结果说明特立帕肽能够缓解高糖微环境对MC3T3-E1成骨分化的抑制作用。
cAMP信号通路是经典的细胞信号通路之一,能够参与调控多种细胞分化、增殖、凋亡的基因转录过程,更是介导甲状旁腺激素对骨吸收合成代谢作用的主要调节途径[16,23,24]。因此,cAMP信号通路引起人们的广泛关注。低频脉冲电磁场可通过cAMP/PΚA信号通路促进大鼠颅骨成骨细胞成骨分化[25]。另有研究指出,具有3D多孔表面的羟基磷灰石复合聚醚醚酮样品可通过cAMP/PΚA途径调节骨髓间充质干细胞中RUNX2的表达,在早期促进骨形成[26]。有研究指出激活的cAMP/PΚA/CREB信号通路在加速间充质干细胞成骨分化中起主导作用[27]。RUNX2 和Osx 是关于成骨方面的转录因子,在成骨细胞中特异性地以高水平表达。一方面,RUNX2可以通过其下游基因Osx影响如ALP的成骨分化指标,从而促进骨形成[28]。另一方面,在高葡萄糖条件下加入未羧化骨钙素后,G蛋白偶联受体C类第6组A亚型/cAMP/PΚA/AMPΚ通路被激活,RUNX2和Osx表达增加,可促进高糖环境下MC3T3-E1细胞的成骨分化[29]。然而,特立帕肽与cAMP/PΚA/CREB通路之间的调控及其与MC3T3-E1细胞成骨分化在高糖微环境下的作用关系,尚缺乏研究。因此,本研究假设特立帕肽能通过激活cAMP/PΚA/CREB信号途径来调控MC3T3-E1细胞的成骨分化过程。本研究在高糖微环境下加入特立帕肽后结果显示,HG+特立帕肽组胞内第二信使cAMP水平相较于HG组有所升高,而其下游的通路相关基因PΚA、CREB表达上调。同时,HG+特立帕肽组的成骨转录因子RUNX2、Osx表达较HG组亦呈上升趋势,细胞骨架清晰程度,ALP活性、矿化水平也有所升高。这意味着特立帕肽能够通过激活cAMP/PΚA/CREB信号途径来调控MC3T3-E1细胞的成骨分化过程。为了进一步观察高糖微环境下特立帕肽调控成骨分化的分子学机制,实验中加入20 μmol/L通路抑制剂H-89干扰信号传导,结果显示,HG+特立帕肽组较HG+特立帕肽+H-89组的cAMP水平有所下降,Real-time PCR检测的下游基因PΚA、CREB以及成骨分化相关基因RUNX2、Osx的表达亦随之下降,细胞骨架清晰程度,ALP活性、矿化水平同样受到抑制。这提示在高糖微环境下MC3T3-E1的成骨分化过程中,cAMP/PΚA/CREB 信号途径参与其中。同时,特立帕肽可能是通过激活cAMP/PΚA/CREB 信号途径来发挥其减轻高糖微环境下对成骨分化的抑制作用。
综上所述,高糖微环境下,MC3T3-E1细胞的成骨分化能力受到抑制,同时cAMP水平变化及相关基因PΚA、CREB、RUNX2、Osx的表达变化进一步确定特立帕肽可能是通过调控cAMP/PΚA/CREB信号通路缓解高糖微环境对MC3T3-E1细胞成骨分化的抑制作用。本研究结果为深入阐明特立帕肽在高糖微环境下对MC3T3-E1成骨分化的分子学机制提供了新颖的实验依据,对更好地了解及预防治疗DOP具有一定的参考意义。但DOP发病机制复杂多样,特立帕肽在高糖微环境下激活cAMP/PΚA/CREB信号通路的过程中与其他信号通路之间存在何种关联,仍有待进一步研究。
