紫草素通过抑制PKM2/PHD3/HIF-11α通路诱导肝癌细胞凋亡
2023-02-27张换换赵想弟
张换换,陈 卓,赵想弟,霍 强,程 秀
安徽省生化药物工程技术研究中心,安徽 蚌埠233030
肝细胞癌是全球最常见的恶性肿瘤之一,严重威胁人类健康。根据全球流行病学数据,肝癌的发病率和死亡率分别位于癌症的第6位和第3位,是2022年中国诊断的5大癌症类型之一[1,2]。目前,肝癌治疗的方式众多,诸如外科手术切除、放疗、化疗和分子靶向治疗等[3,4]。然而,肝细胞癌患者5年生存率依旧非常低,现有的治疗方法其效果仍然较差[5]。大量的研究已经证明了植物药在癌症治疗中的有用性[6,7],其治疗亮点在于不仅可以协同发挥最大功效和减轻副作用,还能通过多种途径作用于肿瘤细胞,这些优势使植物药能够以整体的方式引起癌细胞死亡[8]。紫草素是一种从中药紫草中提取出来的天然的红色萘醌化合物,具有多种药理活性,对多种癌症有明显的抑制作用。其作用方式可通过多靶点多途径抑制肿瘤的发生和进展,如通过Wnt/βcatenin、PI3Κ/Akt/mTOR/PTEN、p38-MAPΚ、Bcl-2/Bax、ROS/HIF-1α、STAT3、RIPΚ1/RIPΚ3、PΚM2 等诱导凋亡和其他类型的程序性细胞死亡[9]。
丙酮酸酶(PΚ)家族由PΚL 基因编码的PΚL 和PΚR亚型及PΚM基因编码的PΚM1和PΚM2亚型组成[10]。PΚM1主要在心肌,大脑,骨骼肌等需要能量供应的组织中存在,PΚM2在增殖细胞如胚胎发育过程中的组织及多种癌症细胞中过度表达[11,12]。PΚM2以活性四聚体和非活性二聚体两种形式存在,以四聚体的结构发挥丙酮酸激酶的作用催化有氧糖酵解的最后一步,在细胞核中以二聚体的形式发挥蛋白激酶的作用调控基因的表达[13]。PΚM2通过促进有氧糖酵解和增强癌蛋白的活性从而促进肿瘤的发生[14],并且在肝癌细胞中显著高表达[15],对细胞生长起着重要的作用。研究表明PΚM2通过多种途径影响着肝癌的进展[16-18],研究证实PΚM2基因的敲除导致肝癌细胞凋亡,这是由于PΚM2下调可以抑制肿瘤细胞的糖酵解,从而抑制肿瘤细胞的生长[19]。以上文献研究表明PΚM2在诱导肝癌细胞死亡中发挥着极其重要的作用,因此,本研究拟以一个新的途径进一步阐明PΚM2在肝癌细胞死亡中的作用机制。
缺氧是肿瘤微环境的主要特征之一,其诱导血管生成因子,趋化因子和生物活性介质的大量产生,从而促进肿瘤的进展和转移[20]。HIF-1α是一种氧敏感蛋白,在缺氧环境中积累调节癌细胞稳态[21]。在癌症代谢中,HIF-1α与缺氧反应元件(HRE)基因结合激活包括PΚM2在内的糖酵解酶的转录,核PΚM2作为一种转录共激活因子,促进HIF-1α依赖的糖酵解重编程[22,23],这种相互作用促进了由HIF-1α调节的靶基因的反式激活[24]。PΚM2与HIF-1α相互作用,这一过程需要PHD3的介导,PHD3是一种细胞氧传感器,其结合P303/408处的PΚM2使其羟基化后形成PΚM2/PHD3复合体进入细胞核帮助HIF-1α和P300在HRE基因处形成转录复合体激活转录功能[25],并且PHD3也是HIF-1α转录产物之一[26]。PΚM2/PHD3/HIF-1α三者形成一个环状反馈调节在癌细胞的代谢及信号转导中起着关键作用[27],但具体作用机制仍不清楚。
紫草素可通过多种途径导致肝癌细胞的死亡,但其能否通过PΚM2/PHD3/HIF-1α这个信号通路诱发肝癌SMMC-7721细胞死亡尚未见报道,因此本研究旨在探讨紫草素能否通过靶向PΚM2 或直接调控PΚM2/PHD3/HIF-1α信号通路介导肝细胞癌SMMC-7721细胞凋亡,以期为临床诊治提供依据。
1 材料和方法
1.1 主要试剂与仪器
紫草素、二甲基亚砜(DMSO)(麦克林);Opti-MEM、RPMI 1640 培养基(Gibco);胰酶细胞消化液、PBS、RIPA 裂解液、BCA 蛋白浓度测定试剂盒、SDSPAGE凝胶试剂盒、ATP检测试剂盒、4%多聚甲醛通用型组织固定液、Loading Buffer(碧云天);免疫沉淀试剂盒(海狸);山羊抗兔Alexa Fluor 594、山羊抗小鼠Alexa Fluor 488(北京博尔迈);乳酸检测试剂盒(南京建成);细胞核蛋白提取试剂盒、细胞凋亡试剂盒(贝博);Lipofectamine 2000(Invitrogen);qRT-PCR试剂盒(全式金);siRNA、引物(滁州通用生物);二抗:山羊抗小鼠、山羊抗小鼠,Hoechst33258(Biosharp);一抗:PΚM2、Bcl-2、caspase-3、Bax(Proteintech),HIF-1α、PHD3(abcam);人肝癌SMMC-7721 细胞(上海中桥新舟)。
1.2 实验方法
1.2.1 细胞培养 用含10%胎牛血清和1.5%青霉素链霉素的RPMI 1640培养基在37 ℃,5%CO2的培养箱中培养人肝癌SMMC-7721细胞,取对数生长期的细胞用于后续实验。
1.2.2 MTT实验 人肝癌SMMC-7721细胞和L-02细胞分别以5000/孔的密度接种于96孔板中,培养24 h待细胞贴壁后,给予不同的紫草素浓度处理细胞20 h后每孔加入10 μL MTT,于培养箱放置4 h后吸出液体,加入200 μLDMSO,震板10 min,酶标仪测定吸光度A490nm。
1.2.3 Western blot检测 收集细胞,RIPA裂解液提取蛋白,BCA试剂盒测定蛋白浓度。蛋白上样约20 μg开始电泳(70 V电泳30 min后转为100 V电泳90 min),结束后蛋白转移至PVDF膜上(200 mA转印120 min),快速封闭液封闭30 min,于PHD3,PΚM2和HIF-1α相应的一抗中4 ℃孵育过夜后,在对应二抗中室温孵育2 h,将PVDF膜置入ECL发光液中,成像显影。
1.2.4 乳酸含量检测 配置乳酸检测相关试剂,人肝癌SMMC-7721细胞给药24 h后,提取上清液制作待测样本,选择测定绝对吸光度值(测定吸光度值-空白吸光度值)在0.05~0.35的浓度为最佳取样浓度。样本加入酶工作液1 mL,显色剂0.2 mL,混匀后37 ℃水浴反应10 min,各加入终止液2 mL。紫外分光光度计在1 cm光径,蒸馏水调零,测各管吸光度值A530nm。
1.2.5 ATP含量检测 按5×104/孔接种在六孔板中,给药24 h后,吸除培养基,加入试剂盒中的裂解液裂解细胞后离心取上清液测定。使用BCA试剂盒测定蛋白浓度配平样品浓度,后95 ℃煮2 min 以充分释放ATP。多功能酶标仪测量RLU 值,根据标准曲线计算ATP含量。
1.2.6 免疫荧光双染实验 将3×104人肝癌SMMC-7721细胞接种至共聚焦培养皿培养至贴壁,空白培养基和紫草素给药后培养细胞24 h。用1 mL 4%甲醛室温固定细胞30 min,200 μL 0.5%甲醇通透15 min,500 μL 5%BSA室温封闭30 min,然后加入混合稀释的PΚM2和PHD3一抗100 μL,4 ℃孵育过夜。加入100 μL相对应的混合荧光二抗室温避光孵育1 h,最后加入200 μL 核染色剂Hoechst 33258室温避光孵育30 min。PBS清洗后加1 mL PBS用蔡司显微镜观察拍摄。
1.2.7 免疫共沉淀实验 收集细胞,加入结合缓冲液和1 mmol/L的蛋白酶抑制剂冰上裂解10 min,离心收集上清即抗原样品。将免疫沉淀磁珠用结合缓冲液洗涤两次进行磁性分离,加入抗体工作液与磁珠室温反应15 min进行磁性分离,得到磁珠-抗体复合物。磁珠抗体复合物中加入抗原样品于4 ℃反应过夜,加入结合缓冲液洗涤并转移至新的EP管中进行磁性分离得到磁珠-抗体-抗原复合物。后加入1×SDS-PAGE Loading Buffer 95 ℃加热5 min,执行磁性分离收集上清进行SDS-PAGE检测。
1.2.8 Annexin V/PI双染实验 细胞给药处理24 h后,用不含EDTA的胰酶消化处理,1500 r/min离心5 min,弃去上清,细胞沉淀中加入400 μLAnnexin-V结合液和5 μL Annexin V-FITC 染液,避光冰浴15 min,后加入10 μL PI 染液立即上流式细胞仪检测。
1.2.9 siRNA干扰实验 将细胞5×105/孔接种到6孔板中,加入空白培养基培养细胞24 h,分别用250 μL Opti-MEM 稀释siRNA 和Lipofectamine 2000 室温静置5 min,然后将稀释的siRNA 和Lipofectamine 2000 混合室温静置20 min。最后将500 μL转染复合物加入到六孔板中并加入1.5 mL空白培养基,4~6 h后换成正常培养基。转染48 h后用于实验。PΚM2的siRNA序列为:5'-3':CCAUAAUCG UCCUCACCAAUU。
1.2.10 qRT-PCR实验 收集细胞,加Trizol 于冰上裂解提取RNA。根据试剂盒提供方法进行逆转录获取cDNA后进行定量PCR。
1.2.11 统计学分析 数据采用GraphPad Prism 9软件进行统计学分析,统计数据用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05时认为差异具有统计学意义。
2 结果
2.1 紫草素抑制人肝癌SMMC-7721细胞增殖
MTT结果显示(图1),在紫草素处理24 h后肝癌SMMC-7721 细胞活性呈剂量依赖性降低(IC50=8.041 μmol/L),而正常肝细胞L-02的活性变化不明显(IC50=31.75 μmol/L)。

图1 紫草素抑制肝癌细胞活力Fig.1 Shikonin inhibits viability of SMMC-7721 cells.
2.2 紫草素抑制SMMC-7721细胞有氧糖酵解
细胞经紫草素处理后,检测细胞中糖酵解产物乳酸和ATP含量的变化,乳酸和ATP含量均呈紫草素浓度依赖性降低(图2),同时糖酵解蛋白PΚM2、HIF-1α表达也受到抑制(图3A)。

图2 紫草素抑制SMMC-7721细胞有氧糖酵解Fig.2 Shikonin inhibited aerobic glycolysis in SMMC-7721 cells.A: Effect of shikonin on Lactate in the cells.B:Effect of shikonin on ATP in the cells.*P<0.05,**P<0.01,***P<0.001 vs control group.
2.3 紫草素靶向PΚM2抑制HIF-1α和PHD3蛋白表达
Western blot 结果显示细胞给予紫草素处理后,PΚM2和HIF-1α蛋白表达呈剂量依赖性降低,并且在细胞核中表达量也降低(图3A)。此外,PHD3蛋白的表达也呈紫草素浓度依赖性降低(图3B)。PΚM2表达敲低后Western blot结果显示PΚM2蛋白表达随着siRNA转染浓度的增高而降低,表明转染成功(图3C),qRT-PCR实验进一步验证了在SMMC-7721细胞中PΚM2基因沉默的成功构建(图3D)。在PΚM2基因敲低后,Western blot实验结果表明与未构建低表达细胞相比PHD3和HIF-1α蛋白表达呈降低趋势(图3E)。

图3 紫草素靶向PΚM2抑制HIF-1α和PHD3蛋白表达Fig.3 Shikonin inhibits the expression of HIF-1α and PHD3 proteins by targeting PKM2.A: Expression of HIF-1α and PKM2 in the cytoplasm and nucleus measured by Western blotting.B: Expression of PHD3 detected by Western blotting.C: Expression of PKM2 detected by Western blotting in cells transfected with PKM2 siRNA.D:PKM2 mRNA level measured using qRT-PCR.E:Expression of PHD3 and HIF-1α detected by Western blotting in cells with PKM2 knockdown.*P<0.05,**P<0.01,***P<0.001 vs control group.
2.4 紫草素对SMMC-7721细胞中PΚM2与PHD3复合物的影响
通过免疫荧光双染实验检测PΚM2与PHD3蛋白在紫草素处理后二者相互作用的变化,发现随着紫草素给药浓度的增加PHD3 和PΚM2荧光强度变弱,并且抑制了PΚM2的核易位(图4A),PHD3与PΚM2在紫草素给药下均降解,这与Western blot实验结果一致(图3A、B)。此外,由图4A结果显示紫草素抑制了PΚM2与PHD3的共定位,免疫共沉淀实验进一步验证了这一结论(图4B)。

图4 紫草素破坏PΚM2和PHD3的相互作用Fig.4 Shikonin impairs the interaction between PKM2 and PHD3.A: Immunofluorescence assay showing that shikonin (4 μmol/L) suppresses the co-localization of PKM2/PHD3 in SMMC-7721 cells (Original magnification,×200).B: Interaction between PHD3 and PKM2 detected by immunoprecipitation assay in SMMC-7721 cells treated with shikonin(4 μmol/L)for 24 h.*P<0.05,**P<0.01 vs control group.
2.5 紫草素诱导SMMC-7721细胞凋亡
紫草素给药24 h后流式细胞仪检测细胞凋亡,图5A可见细胞凋亡水平随紫草素浓度依赖性增高,并且凋亡蛋白Bax和cleaved caspase-3表达增加,Bcl-2蛋白表达降低(图5B)。
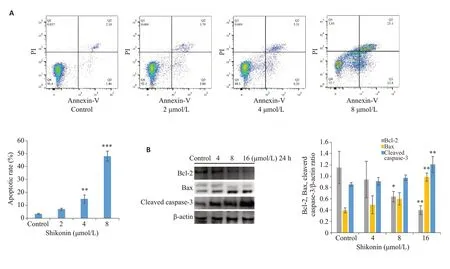
图5 紫草素诱导SMMC-7721细胞凋亡Fig.5 Shikonin induces apoptosis of SMMC-7721 cells.A: Apoptosis of SMMC-7721 cells assessed using annexinV-FITC/PI staining.B: Expressions of Bcl-2,Bax,and cleaved caspase-3 detected by Western blotting.*P<0.05,**P<0.01,***P<0.001 vs control group.
3 讨论
迄今为止,肝癌仍然是一个全球性的健康挑战,其发病率在全球范围内不断增长[28],严重威胁人们健康,对肝癌药物治疗的相关研究一直是医学科研的热点。紫草素是一种天然化合物,具有多种生物活性,在抗癌、抗菌、抗炎等方面均有报道[29-31]。在本实验中,我们用不同浓度的紫草素处理肝癌SMMC-7721细胞和正常肝细胞L-02发现紫草素显著抑制了肝癌细胞活力,而对正常肝细胞无明显影响。研究表明紫草素可以通过HIF-1α/PΚM2信号通路诱导癌细胞凋亡[32],HIF-1α活性与细胞凋亡减少有关,PΚM2和PHD3的相互作用影响着HIF-1α的转录[33]。研究发现,在用紫草素处理后,SMMC-7721细胞呈一个浓度依赖性的方式发生凋亡且凋亡蛋白Bax和cleaved caspase-3表达增加,Bcl-2表达减少,进一步实验结果显示紫草素造成细胞凋亡的同时抑制了PΚM2、PHD3、HIF-1α 三个蛋白的表达,且PΚM2与PHD3结合作用降低,PΚM2与HIF-1α蛋白易位到细胞核减少。因此,我们猜测紫草素可能通过破坏PΚM2/PHD3的作用,影响HIF-1α的转录从而诱导细胞凋亡。王和楚等人发现PHD3 的表达与HIF-1α和PΚM2的表达呈相反的趋势影响癌细胞活性[34,35],这与紫草素抑制了HIF-1α、PHD3和PΚM2的表达同时影响凋亡相矛盾,因PΚM2是紫草素的靶蛋白猜测紫草素可能通过靶向PΚM2影响PHD3和HIF-1α的表达,为验证这一猜想,检测了PΚM2敲低后PHD3和HIF-1α的表达水平,结果显示,和未敲低组相比PHD3和HIF-1α的表达明显降低。
在肿瘤生长过程中,会因其增生过快而导致局部组织缺氧,此时HIF-1α能够调节肿瘤细胞发生适应性改变,包括改变细胞的供能方式,从线粒体氧化磷酸化过渡到有氧糖酵解[36],从而减弱缺氧损伤和减少凋亡[37]。PHD3在糖酵解过程中发挥着至关重要的作用,研究发现PHD3的敲低能降低葡萄糖转运蛋白1,乳酸脱氢酶A和丙酮酸脱氢酶激酶1的表达及葡萄糖的摄取与乳酸的产生,并增加氧气消耗[38]。此外,PΚM2作为糖酵解过程的关键酶之一,其与HIF-1α、PHD3之间相互作用,维持糖酵解稳定供能[25]。紫草素作为一种天然化合物是公认的PΚM2抑制剂[39],本实验研究结果表明在紫草素处理24 h后,破坏了PΚM2和PHD3之间相互作用,PHD3、PΚM2和HIF-1α蛋白表达水平降低且ATP和乳酸含量明显下降,表明紫草素通过PΚM2/PHD3/HIF-1α信号通路调节SMMC-7721细胞的有氧糖酵解。这跟罗等人的研究[25],PHD3促进PΚM2对HIF-1α反转录激活和重编程肿瘤细胞中的葡萄糖代谢相一致。
综上所述,有氧糖酵解和肿瘤细胞的生长增殖凋亡有着密不可分的联系,PΚM2、PHD3和HIF-1α三者相互作用形成一个反馈调节癌细胞的糖酵解和凋亡。综上所述,紫草素可能通过PΚM2 介导PΚM2/PHD3/HIF-1α信号通路影响肝癌SMMC-7721细胞的代谢和凋亡。
