过表达CLEC5A 基因抑制肝细胞癌增殖和转移并逆转上皮-间质转化
2023-02-27区活辉王卫东张伟杰刘清波
林 杰,区活辉,王卫东,马 靖,张伟杰,刘清波
南方医科大学顺德医院(佛山市顺德区第一人民医院)肝胆胰脾外科,广东 佛山528300
原发性肝癌是全球第6大常见恶性肿瘤,占肿瘤相关死亡原因的第3 位,其中75%~85%为肝细胞癌(HCC)[1,2]。由于症状不明显,绝大多数HCC患者初诊时即为中晚期,仅30%~40%的患者符合根治性切除条件[3],且术后5年复发率高达70%[4]。针对中晚期HCC及术后复发患者,一些新的系统性治疗药物也逐步被应用,包括激酶抑制剂(索拉菲尼、仑伐替尼、瑞格菲尼)、血管生成抑制剂(贝伐珠单抗、雷莫芦单抗)以及免疫检查点抑制剂(帕博利珠单抗、阿替利珠单抗、纳武利尤单抗)[5],但总体客观有效率仅有15%~20%,患者预后并没有显著提高[6]。由于HCC的高发病率、高复发率、高死亡率和目前治疗方案的局限性,它已成为人类面临的重大公共卫生问题之一[7]。因此,深入研究HCC发生发展的分子机制从而开拓更加有效的治疗策略至关重要。
C型凝集素结构域家族5成员A(CLEC5A)是一类II型跨膜蛋白,主要表达于巨噬细胞、单核细胞、中性粒细胞和树突状细胞等髓系细胞[8]。CLEC5A属于模式识别受体的一员,它通过衔接蛋白DNAX活化蛋白12(DAP12)活化脾脏酪氨酸激酶(SYΚ),后者进一步激活下游的相关信号通路,诱导宿主大量释放白介素-6(IL-6)、肿瘤坏死因子(TNF)、白介素-8(IL-8)等细胞因子及炎症因子[9]。因此,CLEC5A广泛参与调控人体各类炎症和感染性疾病,是人体免疫反应的重要参与者。研究表明,CLEC5A的异常表达参与多种恶性肿瘤的发生发展,过表达CLEC5A能够抑制骨肉瘤细胞的迁移、侵袭,并通过JNΚ信号通路调控该细胞的肺转移过程[10];本课题组既往研究也表明,CLEC5A过表达抑制胆管癌细胞的增殖及转移能力,是该疾病潜在的抑癌基因[11];某些研究认为CLEC5A在某些肿瘤中可能充当促癌基因,CLEC5A高表达于恶性胶质瘤组织,其高表达促进胶质瘤细胞的增殖及转移能力[12];也有研究显示CLEC5A高表达于胃癌组织并提示患者不良预后,敲低CLEC5A抑制胃癌细胞增殖,并诱导细胞发生凋亡[13]。以上表明CLEC5A在恶性肿瘤发生发展过程中发挥关键作用。但CLEC5A与HCC之间的关联研究很少,仅有报道显示,尼扎替丁靶向抑制CLEC5A高表达的肝脏巨噬细胞,进而发挥抗炎及抗纤维化作用[14]。该研究仅提示尼扎替丁具有潜在的抗肿瘤作用,未能系统阐明CLEC5A如何参与HCC发生发展及其可能的分子机制。鉴于此,本研究首先检测CLEC5A在HCC组织中的表达特点并分析其表达水平与患者临床病理参数的关系,然后探究CLEC5A 对HCC 细胞的生物学功能,针对CLEC5A的潜在分子机制进行评价,从而为HCC的诊治提供新的潜在靶点。
1 材料和方法
1.1 组织样本
HCC癌组织和癌旁组织均来源于我院病理科,回顾性选取2020年1月~2021年12月在南方医科大学顺德医院(佛山市顺德第一人民医院)肝胆胰脾外科行根治性肝癌切除术并满足以下纳入标准的HCC患者50例。纳入标准为:术前未接受抗肿瘤治疗,如介入治疗、化学治疗、放射治疗、靶向治疗及免疫治疗等;血清学检查提示乙肝表面抗原(+),但无丙肝感染;术后病理学检查证实为HCC;切缘无肿瘤组织残留;临床病理参数资料完整;排除标准:合并其他部位恶性肿瘤;非根治性切除;合并自身免疫系统疾病、精神类疾病、妊娠、哺乳等可能影响本研究检测结果。本研究获得南方医科大学顺德医院(佛山市顺德第一人民医院)伦理委员会的批准(20201219),所有参与实验的患者或其家属知晓本研究并签署知情同意书。
1.2 实验试剂
DMEM高糖细胞培养基、0.25%胰蛋白酶、胎牛血清(Gibco);CCΚ-8试剂盒、EdU细胞增殖检测试剂盒(上海碧云天公司);Trizol试剂(Invitrogen);逆转录及qRT-PCR 试剂盒(Takara);CLEC5A 过表达慢病毒、CLEC5A 引物序列、GAPDH 引物序列(上海吉凯公司);CLEC5A一抗抗体(Abcam);E-Cadherin、N-Cadherin、Vimentin、Snail、Slug、GAPDH一抗抗体(CST);二抗(Proteintech)。
1.3 方法
1.3.1 免疫组化染色实验 HCC组织和癌旁组织石蜡标本制成4 μm厚度的切片,切片经常规烤片、二甲苯脱蜡、梯度酒精水水化处理,微波炉抗原修复10 min,加入3%H2O2孵育15 min,阻断内源性过氧化氢酶,接着加入CLEC5A抗体(1∶100)置于4 ℃环境孵育过夜,次日PBS充分洗涤切片,加入相应种属的二抗常温孵育30 min,二氨基苯联胺(DAB)镜下显色,苏木素复染细胞核,氨水返蓝后常规封片。根据改良后的免疫组化结果评分方法对结果进行评分:按着色强度分别将无着色、轻度着色、中度着色及深度着色记为0分、1分、2分和3分;按阳性细胞占总细胞数的比例,分别将0%、1%~10%、11%~50%及≥51%记为0分、1分、2分和3分;用着色强度和阳性细胞分布比例得分的乘积代表组织CLEC5A 蛋白的表达水平,总分为0~9分,定义0~1分为阴性表达,2~9分为阳性表达。
1.3.2 细胞培养和慢病毒细胞感染 SΚ-HEP-1细胞购自中国科学院细胞库,使用含10%胎牛血清的DMEM高糖培养基,置于含5%CO2,37 ℃饱和湿度环境中进行培养。取对数生长期的HCC细胞接种于6孔板,当融合度达15%~30%后,按MOI=50加入慢病毒溶液,24 h后更换新鲜培养基,转染后72 h收集细胞进行后续实验检测。实验分组为对照组(NC)和过表达组(OE)。
1.3.3 荧光定量PCR实验使用Trizol试剂提取细胞总RNA,测定RNA浓度后按照逆转录试剂盒说明书将总RNA逆转录成cDNA,再以cDNA为模板进行目的基因的荧光定量PCR 反应。目的基因的引物序列如下:CLEC5A 上游:5'-CCCAACGGCTTCATTACCAC-3',下游5'-TGTTGATCCAACGCCACCTT-3';GAPDH上游:5'-TGACTTCAACAGCGACACCCA-3',下游:5'-CACCCTGTTGCTGTAGCCAAA-3'。
1.3.4 CCΚ-8法细胞增殖实验 转染后的HCC细胞按1×103/孔接种于96 孔板,分别在接种后0、24、48、72、96 h加入10 μL CCΚ-8试剂,37 ℃孵育2 h,酶标仪设置450 nm波长测定吸光度,绘制生长曲线。
1.3.5 EdU法细胞增殖实验 转染后的HCC细胞按1×105/孔接种于96孔板,常规培养24 h后加入含10 μmol/L EdU染液的DMEM高糖培养基,继续孵育2 h;EdU标记细胞完成后,去除培养液,并加入1 mL 4%多聚甲醛室温固定30 min;PBS 洗涤3次后,加入0.5%Triton X-100摇床孵育10 min,再用PBS洗涤细胞;加入DAPI染液,室温避光孵育10 min后,用PBS清洗,甘油封片。采用倒置荧光显微镜观察细胞染色情况,随机选择5个视野计算EdU阳性细胞率。
1.3.6 细胞迁移、侵袭实验 细胞迁移实验:以无血清的DMEM高糖培养基重悬转染后的HCC细胞,按照1×104/孔接种于Transwell上室,下室加入含10%胎牛血清的DMEM高糖培养基,正常培养条件下培养24 h后,取出小室并用棉球轻吸去小室中旧培养基,4%多聚甲醛固定细胞15 min,结晶紫染色10 min,PBS清洗后晾干。显微镜下随机选择5个视野进行细胞计数并拍照记录。
细胞侵袭实验:提前使用Matrigel 包被Transwell小室,其余实验步骤同细胞迁移实验。
1.3.7 Western blot 实验 提取转染后的HCC细胞总蛋白,采用BCA法进行蛋白定量,取30 μg样品进行SDSPAGE电泳,电泳后电转到PVDF膜,5%脱脂奶粉室温封闭1 h,将膜分别置于CLEC5A(1∶1000)、E-Cadherin(1∶1000)、N-Cadherin(1∶1000)、Vimentin(1∶1000)、Snail(1∶1000)、Slug(1∶1000)、GAPDH(1∶1000)等一抗4 ℃孵育过夜,次日PBST洗膜后选择相应种属的二抗室温孵育1 h,PBST洗膜后采用ECL化学发光法显色并采集图像,计算目的蛋白的相对表达量。
1.4 统计学分析
数据采用GraphPad Prism 8.0软件进行统计学分析。HCC组织和癌旁组织CLEC5A表达阳性率比较、CLEC5A表达与HCC患者临床病理参数关系分析采用卡方检验。计量资料以均数±标准差表示,两组间数据比较采用t检验,多组间数据比较采用单因素方差分析,组间数据比较采用LSD-t检验。当P<0.05认为差异有统计学意义。
2 结果
2.1 CLEC5A在HCC组织及癌旁组织中的表达情况
免疫组化结果显示,CLEC5A蛋白阳性信号定位于细胞质内,HCC 组织中CLEC5A 蛋白的阳性率(26%,13/50)明显低于癌旁组织(64%,32/50),进一步比较两者的免疫组化评分发现,HCC组织中CLEC5A蛋白的平均评分值(1.08)显著低于平均癌旁组织(2.98),两者差异具有统计学意义(P<0.001,图1);统计分析HCC组织中CLEC5A的表达水平与临床病理参数之间的关系:CLEC5A蛋白在HCC组织中的表达水平与患者的肿瘤大小(P=0.008)、肿瘤数量(P=0.010)、肿瘤分化程度(P=0.016)、BCLC分期(P=0.040)和微血管侵犯(P=0.024)相关(表1)。

表1 CLEC5A表达与HCC患者临床病理参数的关系Tab.1 Correlation between CLEC5Aexpression and clinicopathological parameters of HCC patients

图1 免疫组化检测CLEC5A蛋白在HCC组和癌旁组织中的表达Fig.1 Immunohistochemical staining for CLEC5A protein in HCC tissues and adjacent tissues(Original magnification:×200).A:Negative expression of CLEC5A protein in HCC tissues.B: Positive expression of CLEC5A protein in adjacent tissues.C:Comparison of immunohistochemical staining score between HCC and adjacent tissues(***P<0.001).
2.2 CLEC5A过表达慢病毒转染HCC细胞
采用CLEC5A 过表达慢病毒感染SΚ-HEP-1 细胞。荧光定量PCR 及Western blot 实验结果均显示,CLEC5A 过表达慢病毒显著提高SΚ-HEP-1 细胞中CLEC5A的表达水平(P<0.05,图2)。
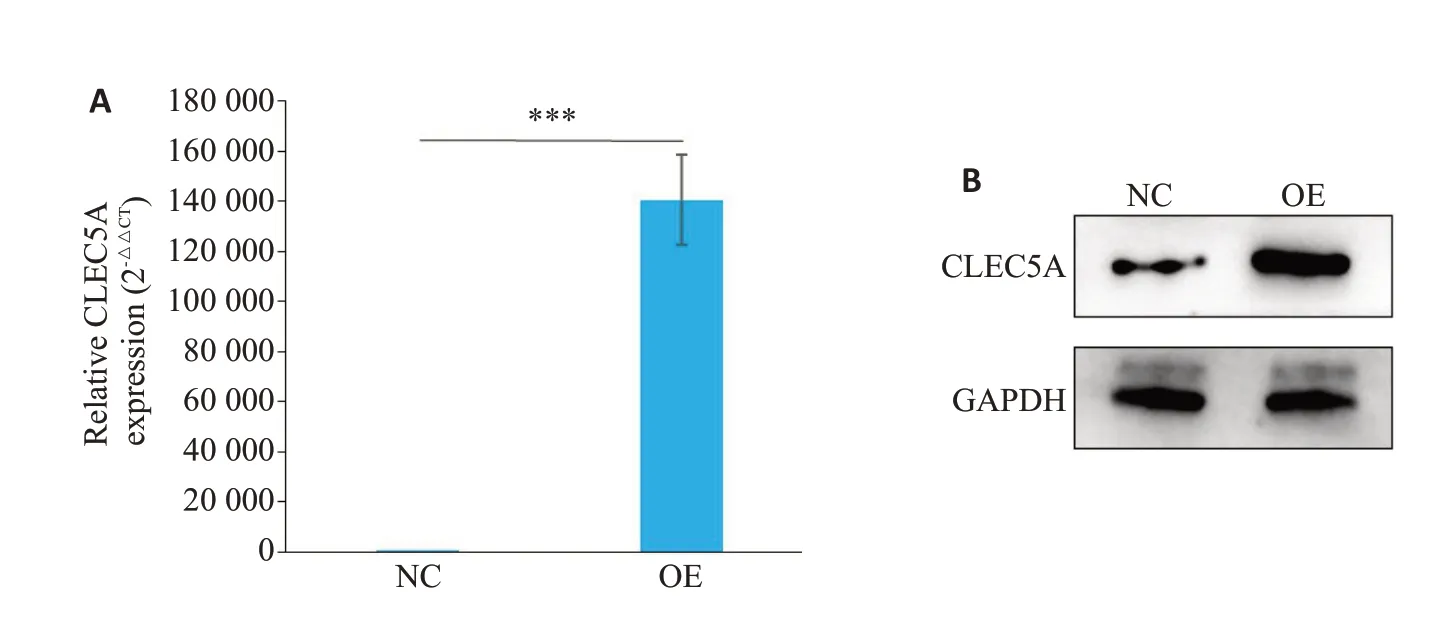
图2 SΚ-HEP-1细胞转染慢病毒后CLEC5AmRNA(A)和蛋白(B)的表达水平Fig.2 Expression levels of CLEC5A mRNA(A)and protein(B)in SK-HEP-1 cells transfected with the lentiviral vector overexpressing CLEC5A.***P<0.001.
2.3 CLEC5A过表达抑制HCC细胞增殖、迁移及侵袭
采用CCΚ-8法检测CLEC5A过表达后HCC细胞增殖能力的变化,结果显示,过表达组SΚ-HEP-1细胞的增殖活力在CCΚ-8试剂处理48 h后明显受到抑制(P<0.001,图3)。采用EdU法检测CLEC5A过表达后HCC 细胞增殖能力的变化,结果显示,过表达组SΚHEP-1细胞EdU阳性率明显低于对照组(P<0.001)。采用Transwell实验分别检测CLEC5A过表达后HCC细胞迁移和侵袭能力的变化,其中细胞迁移实验结果显示,过表达组SΚ-HEP-1细胞迁移数量为84±4个,明显少于对照组细胞247±4个;细胞侵袭实验结果显示,过表达组SΚ-HEP-1细胞侵袭数量为94±3个,明显少于对照组细胞(图5)。

图3 过表达CLEC5A后SΚ-HEP-1细胞增殖活力的变化Fig.3 Viability of SK-HEP-1 cells with CLEC5A overexpression.***P<0.001.

图4 过表达CLEC5A 后SΚ-HEP-1 细胞EdU阳性数量的变化Fig.4 Percentage of EdU-positive SK-HEP-1 cells with CLEC5A overexpression (EdU or DAPI staining,×100).***P<0.001.

图5 过表达CLEC5A后SΚ-HEP-1细胞迁移和侵袭能力的变化Fig.5 Cell migration and invasion of SK-HEP-1 cells with CLEC5Aoverexpression(Crystal violet staining,×100).***P<0.001.
2.4 CLEC5A 过表达逆转HCC 细胞上皮-间质转化(EMT)特性
采用Western blot实验检测HCC细胞中EMT相关蛋白E-Cadherin、N-Cadherin、Vimentin、Snail及Slug蛋白的表达,结果显示,过表达CLEC5A 明显上调SΚHEP-1细胞内E-Cadherin蛋白的表达,并显著下调NCadherin、Vimentin、Snail及Slug蛋白的表达(图6)。

图6 过表达CLEC5A后SΚ-HEP-1细胞内EMT相关蛋白表达水平变化Fig.6 Expression levels of EMT markers in SK-HEP-1 cells with CLEC5A overexpression.**P<0.01,***P<0.001 vs NC group.
3 讨论
本研究首次证实CLEC5A在HCC组织中显著低表达,其表达水平与肿瘤大小、肿瘤数量、肿瘤分化程度、BCLC分期和微血管侵犯等密切相关。其中,微血管侵犯是一种恶性肿瘤特有的病理学表现,是指肿瘤细胞进入血管腔内形成能被显微镜捕捉到的细胞团的现象,它是HCC患者术后复发风险的重要预测指标[15-17]。微血管侵犯的发生涉及肿瘤细胞微环境以及患者体内免疫功能状态及内分泌代谢等因素,是一个多方面、多步骤的病理过程[18-21]。某些针对HCC细胞本身的促癌/抑癌基因被认为是影响微血管侵犯发生的重要因素,如lncRNA-AC104958.2过表达后能够促进肿瘤生长,诱导HCC细胞发生微血管侵犯[22]。CLEC5A低表达与微血管侵犯存在有关,提示CLEC5A非常有可能是调控HCC进展的关键基因,其低表达提示HCC患者存在较高的疾病发展风险。
文献报道CLEC5A在急性髓细胞性白血病患者中呈低表达,而且其表达水平受转录因子PU.1 正向调控[23]。已有研究显示,过表达PU.1可以抑制HCC细胞增殖及侵袭等生物学行为[24,25]。因此,CLEC5A是否类似的抗肿瘤作用,值得我们深入研究。为全面了解CLEC5A对HCC细胞生长增殖特性的影响,我们分别选用了CCΚ-8增殖实验和EdU染色实验。CCΚ-8法所描绘的增殖曲线能够反映观察时间区间内细胞增殖的速率,而EdU染色法检测的是特定时间点处于增殖期细胞的数量,我们这两部分实验结果均有力地证明了过表达CLEC5A抑制HCC细胞的增殖能力,可被认为是潜在的抑癌基因。
异常的细胞迁移和侵袭是肿瘤细胞的另一基本特征,增强的细胞迁移和侵袭能力会导致肿瘤发生转移,是肿瘤进展的重要过程[26]。我们采用Transwell实验检测CLEC5A对HCC细胞迁移及侵袭特性的影响。结果显示,过表达CLEC5A可以同时抑制HCC细胞的迁移及侵袭能力。EMT是指上皮细胞通过特定程序失去其上皮表型而转变为具有较强迁移和侵袭能力的间质表型细胞的生物学过程,被认为是HCC发生转移复发的关键步骤[27,28]。我们进一步研究CLEC5A对HCC细胞EMT的影响,结果显示过表达CLEC5A增加了上皮表型蛋白E-Cadherin 的表达,而减少了间质表型蛋白Vimentin 和N-Cadherin 的表达,EMT表型的转换受到某些转录因子调控[29,30],其中就包括Snail家族蛋白。我们的研究结果显示,过表达CLEC5A同时能够减少Snail和Slug蛋白的表达,说明CLEC5A是通过调控Snail、Slug蛋白进而影响HCC细胞EMT进程。众多研究表明微血管侵犯是HCC发生肝外转移的主要途径,其与肿瘤的EMT进程也具有密切的关系[31,32]。CLEC5A的表达水平与患者是否具有微血管侵犯显著相关,进一步佐证了CLEC5A对HCC的EMT进程起着关键作用,但具体的调控机制仍待进一步实验探索。
综上所述,HCC组织中CLEC5A表达下调与肿瘤的恶性进展相关,CLEC5A可作为一个抑癌基因参与调控HCC增殖、迁移以及侵袭能力的变化,可能参与调控HCC的EMT进程,但其在HCC中的调控机制仍需深入研究。探究CLEC5A在HCC中的作用及分子机制,可为HCC的靶向治疗提供新的思路。
