ANP32AA沉默体外抑制结直肠癌的生长、侵袭和迁移:基于AKT信号通路活性的下降
2023-02-27丁虹芳李肖娟周璐炜蒙海德
丁虹芳,李肖娟,周璐炜,崔 智,蒙海德,王 娟
桂林医学院1基础医学院,2药学院,3生物技术学院,广西 桂林541199
结直肠癌(CRC)是世界上最常见的恶性肿瘤之一[1],也是癌症相关死亡的主要原因[2]。尽管近年来手术技术、化疗和分子靶向药物的进展改善了CRC患者的预后,但它在全球所有癌症相关死亡中排名第4[3],约有一半的CRC患者死于肿瘤转移[4]。虽然已有报道称抑癌基因和癌基因的异常改变驱动结直肠癌的发生和发展[5],但结直肠癌发病机制的确切分子机制,特别是远处转移,尚不明确[6]。因此,寻找结直肠癌转移的潜在治疗靶点和分子机制对临床治疗具有重要意义。
富含酸性亮氨酸的核磷酸化蛋白-32a(ANP32A)也称为假定的HLA相关蛋白I(IPHAPI)或PP32[5],是属于酸性核酸家族,在进化上相对保守的一种蛋白[7],调节细胞信号传导和基因表达,主要参与调节细胞骨架、细胞黏附、神经元发育或小脑形态发生等。早期认为ANP32A 是一种肿瘤抑制因子[7,8],近来有文献表明ANP32A能促进白血病细胞及口腔鳞癌的增殖[9,10],靶向ANP32A 的小肽TAT-H3BP可能是急性髓细胞白血病治疗的一种新策略[11]。我们前期也发现ANP32A在结直肠癌中高表达,抑制其表达能抑制结直肠癌的增殖[12],且与肿瘤分化程度密切相关。有研究发现敲除ANP32A显著降低了口腔鳞状细胞癌迁移和侵袭能力,可能是评估口腔癌患者预后的潜在生物标志物[10]。Tian 等[13]发现ANP32A 能促进肝癌的增殖与侵袭迁移。虽然我们的数据和别人的报道都显示ANP32A在结直肠癌组织中高表达,下调ANP32A能抑制结直肠癌细胞增殖,但是ANP32A对结直肠癌侵袭迁移能力是否有影响尚无报道。
AΚT,也被称为蛋白激酶B(PΚB),是丝氨酸/苏氨酸激酶,是生长因子诱导细胞存活的关键介质[14],参与调节细胞代谢、增殖、生存、凋亡、血管生成等[15]。AΚT的活化参与肿瘤的侵袭迁移,是预防和治疗转移性肿瘤的潜在靶点[16]。有研究证明AΚT活化参与结直肠癌侵袭与迁移能力的调控[17,18]。我们前期实验发现下调ANP32A能抑制结直肠癌细胞的增殖与AΚT活性相关[12],但是目前关于ANP32A是否调节结直肠癌侵袭迁移,以及该作用是否与AΚT的活性有关尚无报道。本研究拟探讨ANP32A对结直肠癌细胞系侵袭迁移的影响及其与AΚT活性的关系,以期寻找到治疗转移性结直肠癌的潜在新靶点。
1 材料和方法
1.1 材料
1.1.1 细胞株 本实验所用人结直肠癌HCT116 和SW480细胞为本课题组传代保存。
1.1.2 试剂与仪器 胎牛血清(CLΛRΚ);DMEM培养基(Gibco);Transwell小室(广州JET BIOFIL);基质胶(corning);噻唑蓝(MTT,北京索莱宝科技有限公司);二甲基亚砜(DMSO,广东西陇化工有限公司);SC79(GLPBIO);MΚ2206(Selleckchem);RIPA强裂解液(上海碧云天生物科技有限公司);β-actin(北京中杉金桥生物技术有限公司);AΚT、MTDH单克隆抗体(Abcam);辣根过氧化物酶标记的山羊抗鼠IgG二抗(北京依玛博科技有限公司);辣根过氧化物酶标记的山羊抗兔IgG二抗(Thermo Fisher Scientific);ECL化学发光试剂(合肥Bio sharp);二氧化碳细胞培养箱(Eppendorf);生物安全柜(ESCO);酶标仪(TECAN);蛋白电泳系统、蛋白转印系统(Bio-Rad);台式低速离心机(湖南湘仪实验室仪器开发有限公司);小型高速离心机(Eppendorf);高速冷冻离心机、细胞计数仪(Thermo Fisher Scientific);凝胶成像系统(Bio-Rad)。
1.2 方法
1.2.1 药物配制及干预 AΚT激活剂SC79用DMSO配制成浓度为50 mmol/L母液,AΚT抑制剂MΚ2206用DMSO配制成浓度为20 mmol/L母液,实验时根据实验所需浓度用培养基稀释,现配现用。进行细胞增殖实验分析时,SC79和MΚ2206的处理时间为24、48和72 h;进行侵袭迁移以及收集细胞沉淀进行Western blotting分析时二者的处理时间均为48 h。
1.2.2 细胞培养 HCT116结直肠癌细胞用DMEM培养基(含10%胎牛血清、青霉素100 U/mL、链霉素100 g/L)在37 ℃、5%CO2的培养箱中培养。在细胞融合度为80%以上时使用含EDTA胰蛋白酶消化传代,2 d传代1次,取对数生长期细胞进行实验。
1.2.3 细胞转染 由公司设计ANP32A shRNA(sh-ANP32A)及其空载体质粒(sh-NC),利用ANP32A沉默质粒和慢病毒包装质粒共转染293T细胞,在转染24 h与48 h收集上清,获得慢病毒。使用收集的上清感染HCT116 和SW480 细胞,从而构建ANP32A 沉默(sh-ANP32A)和空载质粒(sh-NC)的稳定细胞系。
1.2.4 MTT 检测细胞增殖 将对数生长期的sh-ANP32A、sh-NC及Control的HCT116和SW480细胞,按2000细胞/孔接种至96孔板中,在给予药物处理24、48及72 h用酶标仪检测光密度值(A值)。用酶标仪检测前每孔加入20 μL MTT,放入培养箱孵育4 h后,吸去孔内全部溶液,加入二甲基亚砜溶液(DMSO),待甲臜完全溶解后,用酶标仪检测A490。
将对数生长期的HCT116和SW480细胞分为对照组,SC79 组与MΚ2206 组,其中SC79 的给药浓度为2 μmol/L,MΚ2206 的给药浓度为5 μmol/L,按每孔2000个细胞接种至96孔板中,在给予药物处理24、48、72及96 h。用酶标仪检测前每孔加入20 μL MTT,放入培养箱孵育4 h后,吸去孔内全部溶液,加入二甲基亚砜溶液(DMSO),待甲臜完全溶解后,用酶标仪检测A490。
1.2.5 划痕实验检测细胞迁移能力 将对数生长期已转染成功的sh-NC与sh-ANP32A细胞,胰酶消化离心,然后按照细胞汇合度为70%接种于六孔板中,放置培养箱中培养,待细胞贴壁达到95%以上,用200 μL枪头进行划痕,用PBS清洗脱落的细胞,加入新的培养基,于倒置显微镜下观察拍照,拍照时间记为0 h,随后在划痕成功的sh-NC 与sh-ANP32A 细胞中分别给予SC79 和MΚ2206,将六孔板放入培养箱中继续培养,48 h后继续进行拍照,利用Image J软件计算划痕面积。此实验分组为sh-NC、sh-NC+SC79、sh-ANP32A、sh-ANP32A+SC79,sh-NC、sh-NC+MΚ2206、sh-ANP32A、sh-ANP32A+MΚ2206。
1.2.6 Transwell检测细胞侵袭能力 提前将基质胶放置4 ℃解冻,用DMEM(不含胎牛血清)按1∶8稀释基质胶,每孔加入30 μL稀释好的基质胶,37 ℃培养箱中放置4 h后进行实验。收集饥饿24 h后的实验组细胞,1000 r/min,5 min离心后,进行细胞计数,按每孔3×105个细胞接种在Transwell小室上室体积为200 μL,下室依照不同实验添加600 μL DMEM(含10%胎牛血清)或600 μL加药培养基(含10%胎牛血清)。6 h后加入SC79和MΚ2206,然后在37 ℃,5%CO2条件下继续培养48 h后,用4%多聚甲醛固定30 min,用0.1%结晶紫37 ℃染色20 min,用PBS清洗3次。利用倒置显微镜进行拍照,用Image J软件进行细胞计数。
1.2.7 Western blot检测细胞蛋白表达 收集细胞沉淀,加入RIPA裂解液提取细胞总蛋白,用BCA法进行细胞总蛋白定量,并将样品进行煮沸变性。随后进行电泳分离与转膜,之后用5%脱脂牛奶封闭2 h,用PBST洗膜3次后加入相应的ANP32A、AΚT、p-AΚT、MTDH 与βactin抗体,4 ℃过夜,次日用PBST洗膜3次,室温孵育辣根过氧化物酶标记的二抗1 h,用PBST洗膜3次,加入ECL化学发光试剂,用发光凝胶成像系统检测目的蛋白。利用Image J软件进行目的蛋白的灰度分析。
1.3 统计学分析
采用GraphPad 8.0与SPSS 21.0统计软件进行数据统计分析。计量资料以均数±标准差表示,多组间差异比较采用单因素方差分析,检验水准α=0.05。
2 结果
2.1 ANP32A的下调抑制细胞增殖
在结直肠癌细胞HCT116和SW480中,利用慢病毒载体构建ANP32A沉默的细胞(sh ANP32A)和阴性对照细胞(sh-NC)。Western blot结果显示sh-ANP32A组的ANP32A 表达与sh-NC 相比显著下降(P<0.01,图1C、D)。ANP32A下调后,HCT116细胞和SW480细胞形态发生变化,触角消失,细胞变圆,且更易聚集成团(图1 A、B)。细胞增殖实验结果显示阴性组(sh-NC)与空白对照组细胞增殖没有显著性差异(P>0.05),但是ANP32A下调则能显著抑制HCT116和SW480细胞的增殖(P<0.01),其中ANP32A沉默对HCT116细胞的增殖抑制作用更强,达到50%以上(图1E)。

图1 ANP32A的下调抑制细胞增殖Fig.1 ANP32A silencing inhibits proliferation of HCT116 and SW480 cells.A,B: Changes in morphology of HCT116 and SW480 cells after ANP32A silencing(Original magnification:×100).C,D:Expression level of ANP32A in HCT116 and SW480 cells after ANP32A silencing detected by Western blotting.E,F: Changes in proliferation of HCT116 and SW480 cells after ANP32Asilencing.**P<0.01 vs sh-NC group.
2.2 AΚT 的活性对HCT116 和SW480 增殖及侵袭的影响
HCT116细胞和SW480细胞敲低ANP32A的表达后,细胞内p-AΚT的表达下降(图2)。倒置显微镜下观察发现,AΚT抑制剂MΚ2206能明显抑制HCT116细胞增殖,使细胞变圆,触角消失,失去其正常的梭形形状,而其对SW480细胞,能抑制其增殖,甚至诱导其发生死亡(图2B)。细胞增殖实验结果显示2 μmol/LAΚT激活剂SC79对大肠癌HCT116和SW480细胞的增殖作用较弱,而5 μmol/L MΚ2206能显著地抑制结直肠癌细胞的增殖能力(P<0.05,图2C)。Transwell实验结果显示2 μmol/L SC79能显著促进大肠癌细胞的侵袭迁移能力(P<0.01),而5 μmol/L MΚ2206能显著地抑制结直肠癌细胞的侵袭迁移能力(P<0.01,图2D、E)。
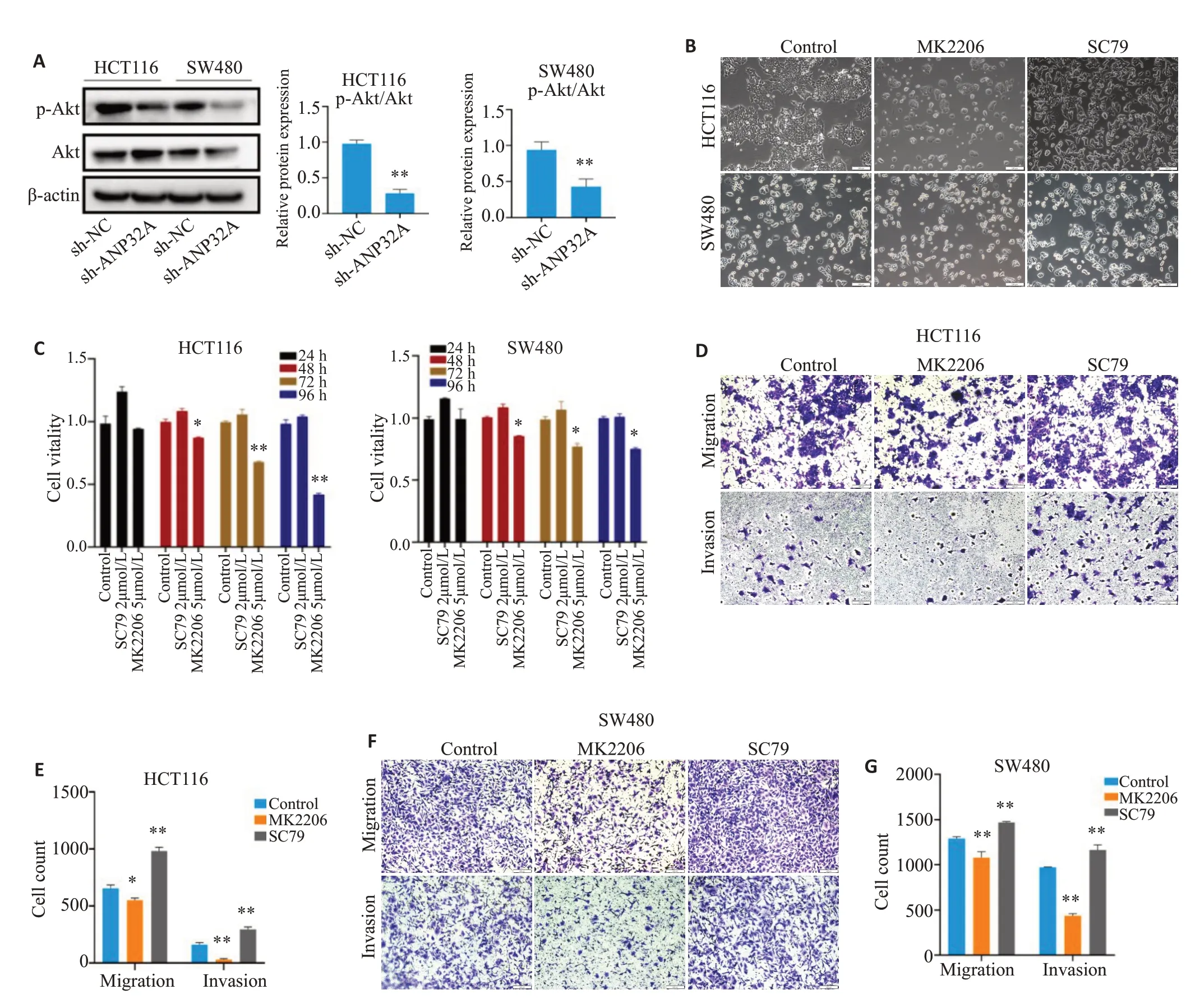
图2 AΚT的活性影响结直肠癌细胞的增殖及侵袭迁移Fig.2 Effects of AKT agonist and inhibitor on proliferation,invasion and migration of HCT116 and SW480 cells.A:Changes in AKT activity in HCT116 and SW480 cells with ANP32Asilencing.B:Effects of AKT agonist and inhibitor on morphology of HCT116 and SW480 cells(×200).C:Effect of treatments with AKT agonist and inhibitor on viability of HCT116 and SW480 cells.D-G:Effects of treatments with AKT agonist and inhibitor on invasion and migration ability of HCT116 and SW480 cells(Crystal violet staining,×200).*P<0.05,**P<0.01 vs sh-NC group.
2.3 ANP32A 下调抑制结直肠癌细胞的侵袭迁移与AΚT的活性有关
细胞划痕实验结果显示,SC79 不仅能增强对照组细胞的迁移能力(P<0.01),且能恢复由ANP32A沉默导致的结直肠癌细胞迁移能力减弱(P<0.01),而MΚ2206 则不仅能抑制对照组细胞的迁移能力(P<0.01),同时增强ANP32A 沉默引起的结直肠癌细胞迁移抑制作用(HC1116细胞中P<0.01,SW480细胞中P<0.05)(图3A~E)。Transwell实验结果也显示SC79不仅能增强对照组细胞的侵袭能力(P<0.01),且能回撤ANP32A 沉默导致的结直肠癌细胞侵袭能力减弱(P<0.01),而MΚ2206则不仅能抑制对照组细胞的侵袭能力(P<0.01),同时增强ANP32A沉默引起的侵袭抑制作用(P<0.01,图3F)。

图3 AΚT的活性对ANP32A沉默结直肠癌细胞侵袭迁移的影响Fig.3 Effects of AKT agonist and inhibitor on invasion and migration ability of HCT116 and SW480 cells with ANP32A silencing.A-D: AKT activity affects the inhibitory effects of ANP32A silencing on colon cancer cell migration(×40).E,F:AKT activity affects the inhibitory effect of ANP32A silencing on colon cancer cell invasion(Crystal violet staining,×200).**P<0.01 vs sh-NC group;#P<0.05,##P<0.01 vs sh-ANP32Agroup.
2.4 AΚT的活性对shANP32A大肠癌细胞内ANP32A表达及AΚT活性的影响
如图4A和5A所示,SC79能逆转ANP32A沉默细胞内ANP32A的表达;而MΚ2206则能进一步抑制由shANP32A导致的结直肠癌细胞内ANP32A水平的降低(图4B 和5B)。同时我们发现结直肠癌细胞中MTDH的蛋白水平能被AΚT抑制剂MΚ2206所抑制(P<0.01);被AΚT激活剂SC79所上调(P<0.05),但是在HCT116细胞中,与对照组相比没有显著性差异(P>0.05)。ANP32A 沉默后,MTDH 的表达下调,同时MΚ2206 能加强ANP32A 沉默对MTDH 的抑制作用(HC1116 细胞中P<0.01,SW480 细胞中P<0.05),在SW480细胞中SC79则能逆转ANP32A沉默对MTDH的抑制作用(P<0.05,图5A),但是在HCT116细胞中,SC79的逆转作用不显著(P>0.05,图4A)。
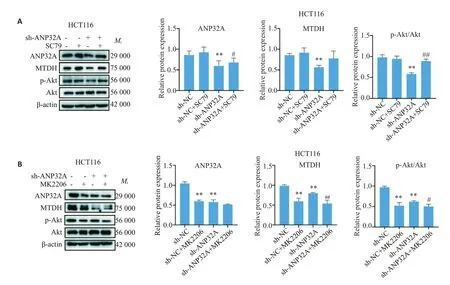
图4 HCT116细胞western blot和灰度分析Fig.4 Western blotting and gray scale analysis of ANP32A expression and AKT activity in HCT116 cells with ANP32A silencing treated with AKT agonist or inhibitor.A:Effects of Akt agonist on ANP32A expression and AKT activity in HCT116 cells with ANP32A silencing.B:Effects of AKTt inhibitor on ANP32A expression and AKT activity in HCT116 cells withANP32Asilencing.**P<0.01 vs sh-NC;#P<0.05,##P<0.01 vs sh-ANP32A.

图5 SW480细胞western blot和灰度分析Fig.5 Western blotting and gray scale analysis of SW480 cells.A:Effects of AKT agonists on ANP32A expression and AKT activity in SW480 cells with ANP32A silencing;B: Effects of AKT inhibitor on ANP32A expression and AKT activity in SW480 cells withANP32Asilencing.*P<0.05,**P<0.01 vs sh-NC group;#P<0.05,##P<0.01 vs sh-ANP32Agroup.
3 讨论
越来越多的证据表明许多基因变化与癌细胞的侵袭和转移有关[19,20]。因此,在结直肠癌中特异性上调或者下调的基因中寻找关键调控因子,对于结直肠癌的防治意义重大。早期研究表明,ANP32A被认为是一种肿瘤抑制因子[8,21],在正常组织、乳腺癌、胰腺癌和前列腺癌中表达的核磷酸蛋白[7,10],具有调节细胞分化、转录、凋亡和细胞周期进程多种细胞功能[22]。近些年来,越来越多的人发现,ANP32A在肿瘤组织中高表达,并参与了肿瘤的侵袭和转移[10]。我们前期也发现ANP32A在结直肠癌中高表达,利用siRNA干扰技术我们发现ANP32A 的沉默确实可以抑制结直肠癌细胞的增殖[12]。在本研究中,我们发现利用慢病毒构建的ANP32A沉默的稳定细胞株确实能够抑制结直肠癌细胞的增殖,同时倒置显微镜镜下发现ANP32A的沉默能够改变细胞的形态,尤其是在HCT116细胞中细胞形态改变更明显,我们发现ANP32A沉默可以导致细胞变圆,细胞更易成团,原来的形态消失,细胞接触增加,这个与以前报道的恶性侵袭表型相反[23,24],因此我们推测ANP32A可能参与了结直肠癌细胞的侵袭转移。
我们的早前研究表明利用siRNA干扰ANP32A表达后,AΚT的活性下降[12],AΚT除了参与肿瘤的增殖以后,它的异常激活更是参与了包括结直肠癌细胞在内的多种肿瘤细胞的侵袭迁移[25,26]。研究表明INTS6通过激活AΚT和ERΚ促进结直肠癌细胞的侵袭迁移,结直肠癌细胞新的治疗靶点[27]。GATA1,一种在红细胞和乳腺癌细胞的发育和进展发挥作用的转录因子,被发现能促进增殖、迁移、侵袭和上皮-间质转化(EMT),其机制主要是与其激活结直肠癌细胞中PI3Κ/AΚT信号通路的活性有关[28],INTS6,SPNS2等因子促进结直肠癌的恶性进展均与AΚT的异常活化有关[27,29]。且在结直肠癌肝转移的机制中,AΚT信号活化参与HGF促进结直肠癌的侵袭与迁移[30],说明AΚT的活性在结直肠癌的转移中起重要作用。本研究中,我们利用了AΚT的激活剂SC79和抑制剂MΚ2206去探究其活性对结直肠癌细胞侵袭迁移的影响,确实发现AΚT的活性参与调节结直肠癌的侵袭迁移。在结直肠癌细胞HCT116 与SW480细胞中,AΚT的活性抑制后,ANP32A表达下调;而AΚT活性的活化,ANP32A的表达上调,并且在ANP32A 沉默的细胞中,AΚT 活性的抑制能加强ANP32A沉默导致的结直肠癌细胞侵袭迁移能力的减弱,AΚT活性的活化则能逆转ANP32A沉默导致的结直肠癌细胞侵袭迁移能力的减弱,这表明ANP32A的表达调节结直肠癌的侵袭迁移作用与AΚT的活性有关,这在一定程度上解释了ANP32A在AΚT介导的细胞迁移和侵袭促进作用。
近年来寻找新的肿瘤转移因子是研究的热点,金属粘连蛋白(MTDH)已被发现参与多种癌症的发展,包括乳腺癌[31]、前列腺癌、肝癌、胃癌[32]、肺癌和结肠直肠癌[33,34]。MTDH已在多种肿瘤中证实了其在促进肿瘤起始、进展、转移和治疗耐药性方面的关键作用[35],MTDH被确定为参与各种类型肿瘤转移进展的重要转移驱动因子[36]。此外,在小鼠模型中敲除MTDH后没有观察到明显的生理缺陷,这使得其成为癌症治疗的一个具有吸引力的治疗靶点。在小鼠结直肠癌模型中,使用MTDH反义寡核苷酸(ASOs)可治疗显著减轻结直肠癌的进展和转移[35]。本研究中,我们发现结直肠癌细胞中ANP32A 的下调能抑制MTDH 的表达,表明ANP32A的沉默能影响AΚT的活性,也能抑制转移相关因子MTDH的表达来抑制结直肠癌的侵袭迁移。此外,我们还发现结肠癌细胞抑制AΚT的活性后,MTDH表达下调,而AΚT活性活化后,MTDH的表达上调,此结果与前人研究一致即AΚT活化参与了结直肠癌的侵袭迁移能力调控。
综上所述,本研究通过慢病毒转染技术成功构建了ANP32A沉默的稳定细胞株,并证明ANP32A的下调可以抑制结直肠癌细胞增殖,侵袭和迁移,并且抑制结直肠癌细胞PI3Κ/AΚT信号通路活性,为结直肠癌的治疗提供了一定的理论支撑。
