印度梨形孢的荧光定量PCR检测及其在水稻根系的定殖测定
2023-02-17李传明韩光杰黄立鑫祁建杭陆玉荣
夏 杨, 徐 彬, 李传明,, 刘 琴,, 韩光杰, 黄立鑫, 祁建杭, 陆玉荣, 徐 健
(1.江苏里下河地区农业科学研究所/国家农业微生物扬州观测实验站,江苏扬州 225007; 2.扬州绿源生物化工有限公司,江苏扬州 225008)
植物内生菌(endophyte)是一定阶段或全部阶段生活于健康植物的组织、器官内部或细胞间隙的真菌、细菌或放线菌[1]。内生菌长期定殖在植物体内,通过自身的代谢产物或借助于信号传导作用于植物体产生影响,产生酶、激素、拮抗物质等来改善植物对非生物胁迫(干旱、盐胁迫等)和生物胁迫(病原物、害虫等)的耐受性[2]。梨形孢属担子菌门(Basidiomycota)层菌纲(Hymenomycetes)蜡壳耳目(Sebacinales)蜡壳耳科(Sebacinaceae)梨形孢属(Piriformospora),是一类最早分化的担子门菌根菌,长期定殖存活在植物根系。1998年首次从沙漠灌木根际分离获得P.indica菌株[3],2012年在德国分离鉴定P.williamsii菌株[4]。大量研究证明,印度梨形孢寄主范围广泛,可以与200多种单子叶、双子叶植物共生[5],通过增强植物对N、P等营养物质的吸收,促进植物生长,增强植物系统抗性,是一种具有广泛应用潜力的多功能植物内生真菌[6-7]。
植物内生菌系统分布于植物的根、茎、叶、花、果实等器官和组织的细胞或细胞间隙,其种类、分布、定殖因植物种类及定殖部位不同而异[8]。不同于单细胞的内生细菌,印度梨形孢仅定殖于植物根系表面、表皮细胞和细胞间隙,并形成典型的梨形厚垣孢子,长期定殖存活在作物根系[9]。根系皮层梨形厚垣孢子的染色观察成为检测印度梨形孢在寄主植物上定殖共生的直接证据[10-12]。这种定性判别往往会受到取样组织差异、杂质污染等外部因素影响。基于EF1α基因的PCR扩增检测技术灵敏度较低,无法检测出低拷贝模板DNA。绿色荧光蛋白标记法[13]可以对定殖部位和密度进行实时动态观测,但此法必须以获得绿色荧光蛋白标记突变株为前提且外源基因的引入可能会使其生物学效应降低。实时荧光定量PCR(quantitative real-time PCR,简称qPCR)作为一种快速、灵敏、准确的技术,已在病原体检测[14]、基因表达量分析[15]、临床疾病诊断[16]等方面得到了广泛应用。本研究旨建立一种快速灵敏、准确高效的P.indica定殖定量的qPCR检测方法,为深度开展印度梨形孢与寄主作物互作研究提供科学、准确的检测方法。
1 材料与方法
1.1 试验材料与处理
供试P.indica菌株PI-020由江苏里下河地区农业科学研究所分离和保存。参考舒珊等的培养方法[17],取PI-020于PDA平板上活化,28 ℃培养5 d后,截取边缘活性菌丝块接种PDB培养液中,28 ℃、180 r/min振荡培养7 d,匀浆后获得孢子悬液。
供试水稻品种为南粳9108。2021年12月于室内将水稻种子漂洗、70%乙醇浸泡5 min、1%次氯酸钠溶液浸泡5 min表面消毒后,无菌水冲洗3次并浸种1 d,28 ℃黑暗条件下催芽3 d。
挑选长势一致的萌发种子置培养皿中,加入含PI-020(浓度为5×104CFU/mL)的营养液[18],以不含PI-020的营养液处理为对照组,于昼温 30 ℃、夜温26 ℃、光—暗周期14 h—10 h、相对湿度70%的条件下培养,每2 d更换1次营养液。分别于培养3、5、7、9、11、13 d取样截取根部组织,每个时间点取样10株,试验设置3个重复。
1.2 试验方法
1.2.1 DNA提取P.indica样品准备:PI-020于PDA平板上进行活化,28 ℃培养5 d,刮取菌丝,液氮研磨;根系样品准备:根系样品10%甲醛浸泡 10 min,无菌水冲洗3次后晾干,液氮研磨。基因组DNA提取均采用CTAB(源叶生物,中国)法[19],采用NanoPhotometer N50(IMPLEN,德国)检测DNA浓度,-20 ℃保存备用。
1.2.2 引物设计及质粒标准品的构建 根据P.indicaEF1α基因序列[20],参考Lin等的设计引物[21]Pi-F:5′-T C C G T C G C G C A C C A T T-3′,Pi-R:5′-A A A T C G C C C T C T T T C C A C A A-3′,利用NCBI的Primer-BLAST 工具完成对引物的特异性检测。以P.indica基因组DNA为模板,进行PCR扩增,反应条件为:95 ℃ 3 min;95 ℃ 15 s,55 ℃ 15 s,72 ℃ 15 s,34个循环;72 ℃ 10 min。采用琼脂糖凝胶DNA回收试剂盒回收PCR产物,并克隆至pCE2-TA/Blunt-Zero(诺唯赞,中国)载体上,获得的重组质粒pCE2-Pi,作为qPCR扩增的质粒标准品(浓度为90 ng/μL),根据质粒拷贝数计算公式,换算成拷贝数为2.03×1010copies/μL。
1.2.3 qPCR标准曲线的建立及灵敏度检测 对上述质粒标准品pCE2-Pi进行10倍梯度稀释,备用。利用StepOnePlus实时荧光定量PCR仪(ABI,美国),以2.03×107~2.03×102copies/μL共6个浓度梯度的pCE2-Pi质粒标准品为模板进行qPCR扩增。反应体系为2×ChamQ SYBR qPCR Green Master Mix 10 μL,50×ROX Reference Dye 1 0.4 μL,上下游引物(10 μmol/L)各0.4 μL,模板DNA 1 μL,ddH2O 7.8 μL。反应条件为:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环。以标准品拷贝数的对数为横坐标,CT值为纵坐标,建立标准曲线。同时进行常规PCR扩增,比较qPCR检测的灵敏度。
1.2.4 水稻苗根系P.indica的定殖检测 参考袁听等的台盼蓝染色法[10]对定殖培养水稻根系样品进行染色、镜检观察。同时,以无菌水作为稀释液,将提取的水稻根系样品DNA稀释至相同浓度(50 ng/μL),利用常规PCR法[21]以及上述已建立的qPCR方法,对样品DNA进行检测。
1.3 数据统计与分析
采用SPSS 22软件对试验数据进行单因素方差分析(one-way ANOVA)和F检验(Tukey’s检验),利用Microsoft Excel 2019、GraphPad Prism 8软件进行图表绘制。
2 结果与分析
2.1 引物检测及质粒标准品的制备
基于P.indicaEF1α基因的序列,通过引物 Pi-F/Pi-R对P.indica基因组DNA进行PCR扩增,获得了大小为84 bp的目的片段(图1)。利用该引物对实验室常备材料水稻、枯草芽孢杆菌(Bacillussubtilis)、苏云金芽孢杆菌(Bacillusthuringiensis)、灰梨孢(Pyriculariaoryae)、娄彻氏链霉菌(Streptomycesrochei)等DNA进行扩增,均未检测到目标条带(图略),表明所设计的引物特异性较好。目的片段经切胶回收,连接至pCE2-TA/Blunt-Zero载体,并转化大肠杆菌感受态细胞Trans1-T1,所得转化子通过菌液PCR鉴定,电泳获得大小为250 bp的明亮单一条带(图2),符合预期大小。目的片段经测序鉴定正确,表明重组质粒构建成功。

2.2 qPCR标准曲线的建立及灵敏度分析
以2.03×107~2.03×102copies/μL共6个浓度梯度的质粒标准品作为模板进行qPCR扩增,获得不同浓度质粒标准品的扩增曲线(图3-A),当质粒标准品浓度为2.03×102copies/μL时, 仍有扩增曲线。常规PCR结果表明,质粒标准品浓度为2.03×107~2.03×105copies/μL时,电泳有明显条带。当质粒标准品浓度小于2.03×105copies/μL时,电泳无条带(图3-B),检测灵敏度为2.03×105copies/μL。说明建立的qPCR法检测灵敏度能达到2.03×102copies/μL,比常规PCR高1 000倍。根据qPCR扩增结果,获得不同起始模板所对应的各自CT值。以起始模板对数为X轴、CT值为Y轴,所建立的标准曲线表明,随着样品浓度的减小,CT值逐渐增加,两者呈线性关系,标准曲线决定系数r2=0.999,说明拟合的线性回归方程效果较好。所得标准曲线的线性回归方程为y=-3.945x+42.045(图4)。

2.3 水稻苗根系P. indica定殖检测
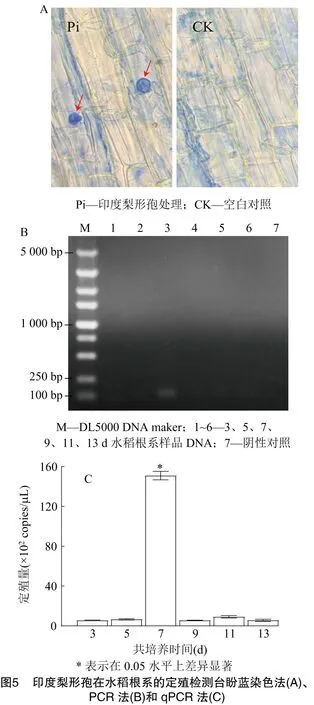
以染色法、常规PCR法、qPCR方法检测水稻苗根系P.indica的定殖,比较不同检测方法的差异。台盼蓝染色镜检P.indica处理水稻根系,仅在处理7 d的样品部分根系直接观察到经染色后呈深蓝色的厚垣孢子,对照未发现P.indica孢子定殖,说明染色镜检受取样等因素影响大,不能准确反映P.indica的实际定殖情况(图5-A)。常规PCR检测同样是处理7 d的水稻根系样品DNA能扩增出 84 bp 的目的条带,其余DNA均未扩增出条带(图5-B)。采用qPCR法对水培水稻苗根系P.indica定殖量进行检测,所有样本中均能检测到P.indica,P.indica处理3 d即成功定殖于水稻苗根系,定殖量为5.54×102copies/μL,5 d上升至 6.62×102copies/μL,7 d显著上升,达到最高定殖量1.51×104copies/μL(DNA),随后定殖量显著下降,9 d定殖量为5.58×102copies/μL,13 d仍能检测到5.58×102copies/μL的定殖量(图5-C)。


3 讨论
P.indica在植物根系稳定定殖是其发挥功能多样性的必要条件,开展高效精准的P.indica定殖检测是P.indica基础研究工作中的重要环节。qPCR具有精准定量、高效灵敏等优点,可用于样品中特定DNA序列的定性定量分析。李磊等基于立枯丝核菌融合群AG3的TEF保守区间设计特异性引物,建立的立枯丝核菌qPCR检测体系灵敏度为19.5 fg/μL,是常规PCR的1 000倍[22]。Dubey等基于ITS序列同源性设计引物,用于番茄病原菌(立枯丝核菌)的检测,其中常规PCR法检测下限为0.025 ng/μL,而qPCR法检测下限为1.24 pg/μL,灵敏度远高于常规PCR法[23]。传统的台盼蓝染色法虽然简单、快捷、直观、方便,目前作为主要的检测方法应用于P.indica定殖能力的检测试验[24-25],但在进行P.indica定殖检测时,其结果的准确度往往受根系取样部位所影响,同时只能局部显微镜检,不能全面反映内生菌的定殖情况,影响了试验的准确性。盛萍萍等研究表明,染色前样品根系的处理还应控制好KOH溶液浓度和处理时间,主要由寄主作物种类及其木质化程度所决定[26]。对于木质化程度较低的草本植物幼嫩根系,过高浓度(>10%)的KOH溶液和过长(>60 min)的处理时间都会对根系皮层细胞结构造成破坏,染色后难以观察和区分。因此,应根据P.indica自身定殖特点结合寄主作物种类,选择合适的部位(根系成熟区),运用恰当的处理方式进行检测,同时增加取样范围和频次,以进一步提高检测结果的准确度。常规PCR法虽然具有较高的灵敏度,但对于根系表面定殖数量相对较少的内生菌而言,仍难以检测到低拷贝数的DNA样品,同时不能准确统计定殖数量,分析定殖效应。本研究所建立的P.indicaqPCR定殖定量检测方法具有较高的扩增特异性,能呈现出良好的“S”形扩增曲线,基于起始模板对数与CT值所建立的标准曲线线性关系良好,灵敏度能达到2.03×102copies/μL,比常规PCR提高1 000倍,因此可以很好地用于P.indica的定殖定量检测。
4 结论
本研究建立了能够快速、精准、高效地对水稻根系P.indica定殖进行定量检测的qPCR方法,分析该方法相比于台盼蓝染色法和常规PCR法在准确度和灵敏度上所表现出来的优越性,为深度开展印度梨形孢与寄主作物互作研究提供科学、准确的检测方法。
