贝莱斯芽孢杆菌菌株NZ-4生防潜能及基因组学分析
2023-02-17王金辉丁丽丽田梦君杨志辉朱杰华
李 铮, 王金辉, 丁丽丽, 张 岱, 田梦君, 杨志辉, 朱杰华
(1.河北农业大学植物保护学院/河北省植物病虫害生物防治工程技术研究中心,河北保定 071000;2.河北省农林科学院生物技术与食品科学研究所,河北石家庄 050057; 3.秦皇岛市植保植检站,河北秦皇岛 066000)
近年来我国马铃薯种植面积逐年增加,但是连作致使马铃薯枯萎病的发生逐年加重,严重影响了马铃薯的产量,成为制约我国马铃薯产业发展的重要因素。该病害由尖孢镰刀菌(Fusariumoxysporum)所引起,已成为严重威胁马铃薯产业的重要土传病害之一[1]。该病原菌抗逆性强,使用化学杀菌剂防治效果较差,长期使用还会造成环境污染和农药残留[2]。而生物防治可作为绿色防治手段,能有效解决化学杀菌剂所带来的环境污染问题。
生物防治具有绿色无污染的特点,在多种病害防治过程中得到广泛应用。芽孢杆菌抗逆性强,广泛存在于土壤、植物表面及内部,对人和动物无毒害的同时还具有广谱抑菌活性[3]。贝莱斯芽孢杆菌(Bacillusvelezensis)是芽孢杆菌的一种,具有抑菌谱广、抗逆性强、生防机制多样等特点[4],已成功应用于多种植物病害的防治过程,且效果显著。如贝莱斯芽孢杆菌E69对稻瘟病的田间防效可达85.97%[5];贝莱斯芽孢杆菌B-36在盆栽试验中,对由尖孢镰刀菌引起的莲根腐病的防效最高可达77.1%[6]。贝莱斯芽孢杆菌能够合成分泌多种次级代谢产物实现对病原菌的抑制作用[7-8],主要包括由核糖体合成的细菌素和水解酶类,由非核糖体肽合成酶(nonribosomal peptide synthetase,NRPS)合成的脂肽类化合物及多肽类化合物,以及由聚酮合成酶(polyketidesynthase,PKS)合成的聚酮类化合物[4,9]。细菌素、脂肽类物质理化性质稳定、抗菌谱广、不易产生耐药性,是生物防治研究的重点[10]。此外,贝莱斯芽孢杆菌分泌的蛋白酶、几丁质酶和β-葡聚糖酶等对抑制病原真菌起重要作用[11]。
本实验室前期从马铃薯植株根际土壤中分离得到菌株NZ-4,该菌株对马铃薯枯萎病菌具有良好的抑制作用,抑菌圈直径在20.0 mm以上。基于gyrB基因的系统发育分析以及形态学特征,将菌株NZ-4初步鉴定为贝莱斯芽孢杆菌[12],但基于单一基因位点的分析方法难以有效区分包括贝莱斯芽孢杆菌在内的枯草芽孢杆菌复合群[13]。随着测序技术的发展,通过基因组数据分析物种间的亲缘关系更加行之有效[4]。前期研究表明,菌株NZ-4的抑菌谱较广,对包括马铃薯枯萎病菌、马铃薯炭疽病菌(Colletotrichumcoccodes)、马铃薯疮痂病菌(Streptomycesscabies)等有强烈的抑菌作用,且对小麦根腐病菌(Cochliobolussativus)、梨黑斑病菌(AlternariakikuchianaTanaka)、苹果斑点落叶病菌(Alternariaalternariaf. sp. mali)、马铃薯早疫病菌(Alternariasolani)等重要农业病害病原菌也有良好的拮抗活性[12]。此外,本研究室研究表明,该菌株具有促生、增强植株抗性水平、根际定殖能力强等多种应用潜力[14]。而该菌无菌发酵液(含有抑菌作用的次生代谢产物)对外界环境条件稳定性、抑菌促生相关酶类活性有无及抑菌物质的遗传基础仍不明确。
本研究测定了高温、强酸碱、紫外线和蛋白酶处理下贝莱斯芽孢杆菌NZ-4发酵滤液对引起马铃薯枯萎病的尖孢镰刀菌的抑菌活性稳定性,通过平板试验测定了其产生抑菌活性物质的能力,结合第二代(Illumina NovaSeq)和第三代(PacBio)测序技术,获得NZ-4完整的基因组序列,并挖掘了其脂肽类、聚酮类化合物、几丁质酶等主要抑菌活性物质的遗传基础,为生防菌剂开发和机理研究奠定了基础。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 贝莱斯芽孢杆菌(Bacillusvelezensis)菌株NZ-4和尖孢镰刀菌(Fusariumoxysporum),均由河北农业大学植物保护学院马铃薯病害研究实验室提供。
1.1.2 培养基 LB培养基、PDA培养基、蛋白酶鉴定培养基[15]、酪蛋白酶鉴定培养基[16]、几丁质酶鉴定培养基[17]、纤维素酶鉴定培养基[18]、果胶酶鉴定培养基[19]、CAS培养基[20]。
1.1.3 菌株NZ-4发酵滤液的制备 挑取菌株NZ-4单菌落接种于LB培养基,180 r/min、37 ℃振荡培养12 h获得种子液。将种子液接种于LB培养基中,180 r/min、36 ℃振荡培养72 h,获得发酵液。将发酵液10 000 r/min离心20 min,上清液通过0.22 μm的微孔过滤器后得到发酵滤液。
1.2 菌株NZ-4发酵滤液的抑菌活性稳定性检测
1.2.1 菌株NZ-4发酵滤液处理 (1)酸碱稳定性:将发酵液的pH值分别调为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0和12.0,于4 ℃静置12 h后调节pH值=7.0。(2)紫外光稳定性:将菌株 NZ-4 发酵滤液置于距离紫外灯30 cm处,照射1、2、4、8、12、16、20 h。(3)热稳定性:将发酵液分别在40、50、60、70、80、90、100 ℃水浴30 min或121 ℃处理20 min后,冷却至室温(25 ℃)。(4)蛋白酶稳定性:在发酵液中分别加入蛋白酶K或胰蛋白酶,使酶终浓度为1 mg/mL,37 ℃反应2 h。
1.2.2 抑菌活性的检测 PDA平板中加入1.5 mL发酵滤液,用涂布器充分涂抹均匀后在超净工作台中晾干备用。以尖孢镰刀菌为供试菌、以未经处理的发酵滤液为阳性对照、以清水为阴性对照,25 ℃倒置培养5 d后,用十字交叉法测量菌落直径,进行2组试验,每组试验设置4次重复。
1.2.3 数据处理分析 根据下列公式计算菌株 NZ-4 发酵液对尖孢镰刀菌的相对抑制率:
抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%;
相对抑菌活性=处理抑制率/阳性对照抑制率×100%。
1.3 菌株NZ-4水解酶的检测
将活化的菌株NZ-4点接到对应的酶鉴定或CAS培养基上,28 ℃恒温培养3~5 d,观察是否产生透明圈或产生凹陷。
1.4 菌株NZ-4的全基因组测序和分析
1.4.1 菌株NZ-4全基因组测序 收集对数生长期的菌株NZ-4菌体,提取基因组DNA。利用Illumina NovaSeq和PacBio Sequel平台分别测序,对测序数据进行质控分析,利用HGAP[21]、CANU[22]拼装三代数据得到contig序列。将二代的数据用pilon[23]软件对contig进行校正后获得完整序列。测序和拼装委托上海派森诺生物科技股份有限公司进行。
1.4.2 基因组系统发育分析 使用orthofinder[24]获得与菌株NZ-4近缘的12个芽孢杆菌的单拷贝同源蛋白序列文件,使用muscle[25]进行多序列比对。后使用MegaX[26]默认参数构建NJ(neighbour-joining)发育树,bootstrap法重复1 000次检验进化树。
1.4.3 编码蛋白基因的分析 将菌株NZ-4的完整序列上传至NCBI数据库(https://www.ncbi.nlm.nih.gov/genome/annotation_prok/)Prokaryotic Genome Annotation Pipeline(PGAP)进行功能注释。利用PSIblast v2.9.0[27]将菌株NZ-4的蛋白序列分别与COG[28]和CAZy[29]数据库进行比对,获得功能注释信息。利用antiSMASH 6.0[30]对NZ-4菌株中次生代谢物合成基因组簇进行预测。
2 结果与分析
2.1 菌株NZ-4无菌发酵滤液对尖孢镰刀菌的抑菌稳定性
菌株NZ-4发酵液在50 ℃处理后抑菌活性为80.7%,当超过60 ℃后,随着温度的升高抑菌活性逐渐下降(图1-A),100 ℃处理后抑菌活性约60.0%,121 ℃处理后几乎丧失抑菌活性。菌株 NZ-4 发酵滤液抑菌活性的最适pH值为6~9(图 1-B),pH值=3处理后抑菌活性仍在85%以上,当pH值超过10后,抑菌活性显著降低。菌株 NZ-4 的抑菌活性物质对紫外线不敏感,随着紫外线照射时间的延长,其抑菌活性有小幅下降(图1-C),紫外线照射20 h后,其抑菌活性仍达76.9%。用蛋白酶K处理2 h后,发酵液抑菌活性显著降低,说明菌株NZ-4发酵液中含有抗菌蛋白(图1-D)。但发酵液经胰蛋白酶处理后,抑菌活性没有明显改变,表明菌株NZ-4的抑菌物质对胰蛋白酶不敏感。

2.2 菌株NZ-4抑菌促生活性物质的测定
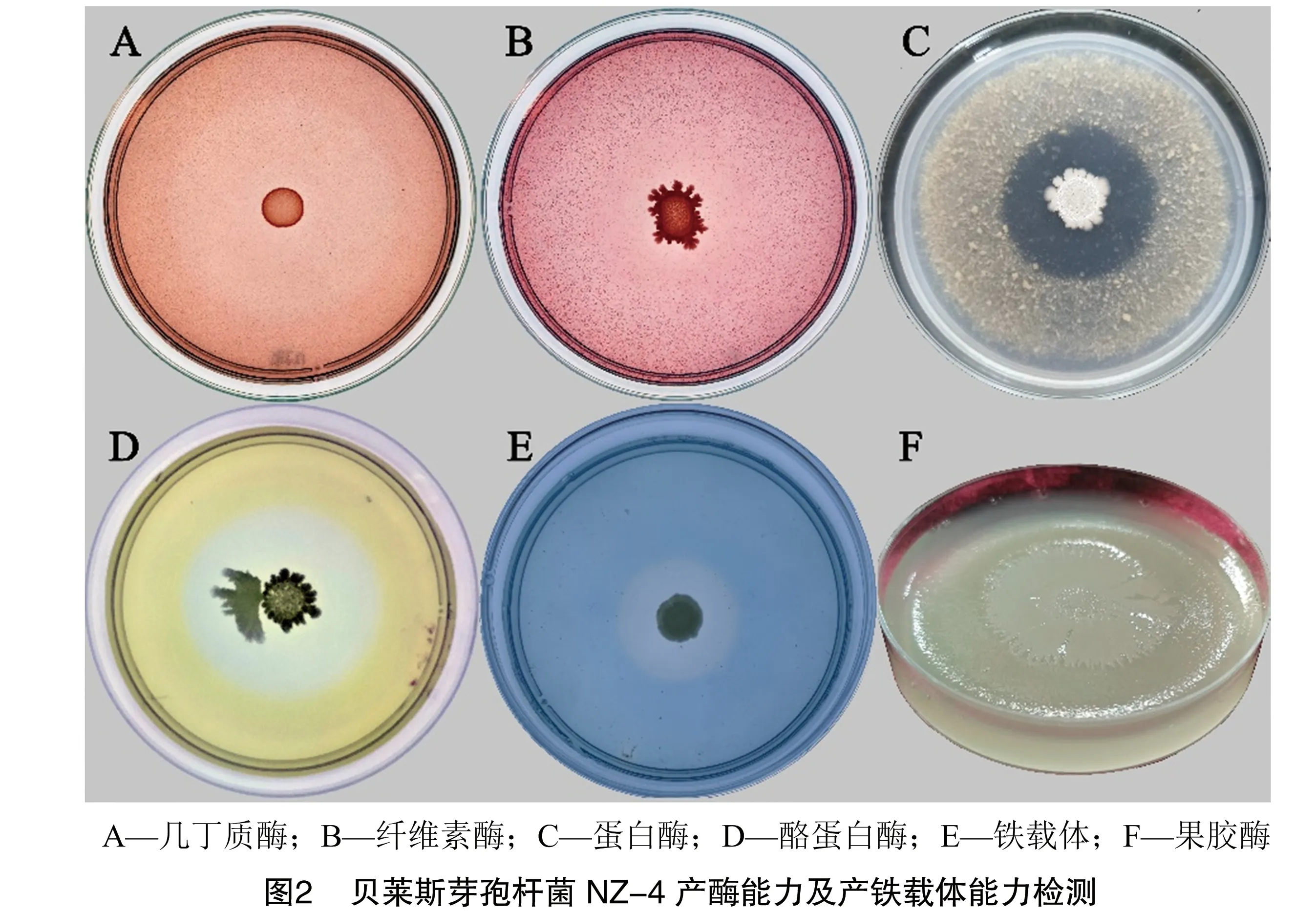
参考不同活性酶的选择性鉴定培养基,对菌株NZ-4产酶活性进行检测。结果显示,菌株NZ-4可在几丁质酶鉴定培养基(图2-A)、纤维素酶鉴定培养基(图2-B)、蛋白酶鉴定培养基(图2-C)、酪蛋白酶鉴定培养基(图2-D)和CAS培养基(图 2-E)上生长并产生透明圈,能够在果胶酶鉴定培养基上生长,并使培养基产生凹陷(图2-F)。表明菌株NZ-4能够产生几丁质酶、纤维素酶、蛋白酶、酪蛋白酶、果胶酶并能合成铁载体。该菌株可能通过分泌以上酶类物质,加速土壤中的多种碳水化合物的分解,竞争环境中稀缺的铁元素,发挥其拮抗和促生作用。
2.3 菌株NZ-4基因组概况和系统发育分析
2.3.1 菌株NZ-4基因组基本概况 菌株NZ-4基因组全长4 085 407 bp,为环状染色体,其GenBank登录号为CP076119。GC含量为46.31%,包含4 014个编码基因,3 896个蛋白基因序列(coding sequences,CDS),65个假基因(pesudogene),27个核糖体RNA(rRNA),86个转运RNA(tRNA)和5个非编码RNA(ncRNA),基因组圈图如图3所示。
菌株NZ-4编码基因的COG注释结果(图3)显示,共有3 216个基因获得功能注释,注释结果共分为24类。其中参与次生代谢产物生物合成、运输和分解代谢功能(Q)的基因共有89个,参与氨基酸转运与代谢(E)的基因312个,参与脂类转运与代谢(I)的基因157个,参与无机离子转运与代谢(P)的基因187个,参与碳水化合物转运与代谢(G)的基因281个,防御机制(V)相关基因112个。

2.3.2 基于基因组核心基因的系统发育分析及种类鉴定 基于菌株NZ-4和参考菌株的1 398个单拷贝核心同源基因构建系统发育树(图4),结果表明,菌株NZ-4与贝莱斯芽孢杆菌CC09、DSYZ、FZB42、CBMB205、CAU B946和SCGB1等菌株聚为一个大的分支;而与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌(Bacilluslicheniformis)、短小芽孢杆菌(Bacilluspumilus)和蜡样芽孢杆菌(Bacilluscereus)聚为不同的分支,表明菌株NZ-4在基因组水平上与贝莱斯芽孢杆菌亲缘关系最近。因此基于基因组水平,菌株NZ-4被鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis)。

2.4 菌株NZ-4抗生素合成相关基因簇的预测
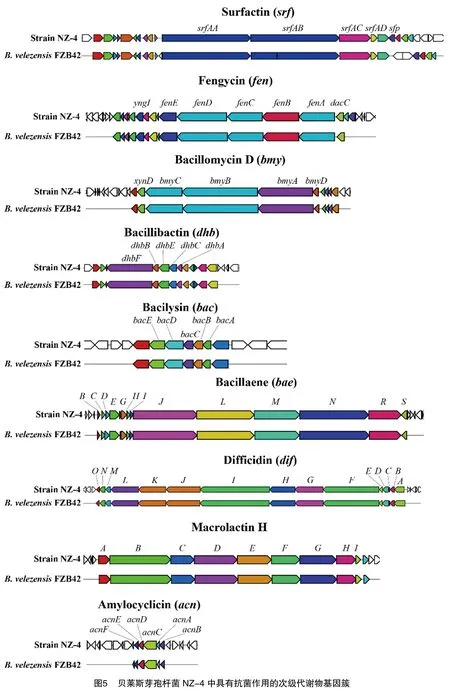
芽孢杆菌抗菌活性与其产生的次生代谢产物密切相关,本研究利用antiSMASH 6.0对菌株NZ-4基因组进行分析,结果显示,菌株NZ-4编码14种次生代谢产物合成基因簇。其中有9种与MiBiG中已经描述过的次生代谢产物合成基因簇基本一致(图5),它们分别与表面活性素(surfactin)、大环内酰亚胺H(macrolactin H)、杆菌素(bacillaene)、杆菌霉素D(bacillomycin D)、泛革素(fengycin)、地非西丁(difficidin)、儿茶酚型铁载体(bacillibactin)、解淀粉芽孢杆菌素(amylocyclicin)和溶杆菌素(bacilysin)的合成相关。此外,菌株NZ-4还编码5种没有比对到MiBiG数据库或相似度比较低、可能为该菌株所特有的次生代谢产物。
这些次生代谢产物中有5种具有抗真菌活性,包括3种脂肽类化合物,分别为表面活性素、泛革素和杆菌霉素,1种二肽溶杆菌素和1种儿茶酚型铁载体。此外,菌株NZ-4还能合成4种对细菌有抑制作用的次生代谢产物,包括3种聚酮类化合物,分别为杆菌素、大环内酰亚胺H和地非西丁,以及1种环肽解淀粉芽孢杆菌素。菌株NZ-4编码多种抗生素合成基因簇,表明该菌株可能通过这些抗菌产物发挥其抑菌功能。
2.5 菌株NZ-4碳水化合物活性酶(CAZy)及与生防有关酶类的预测
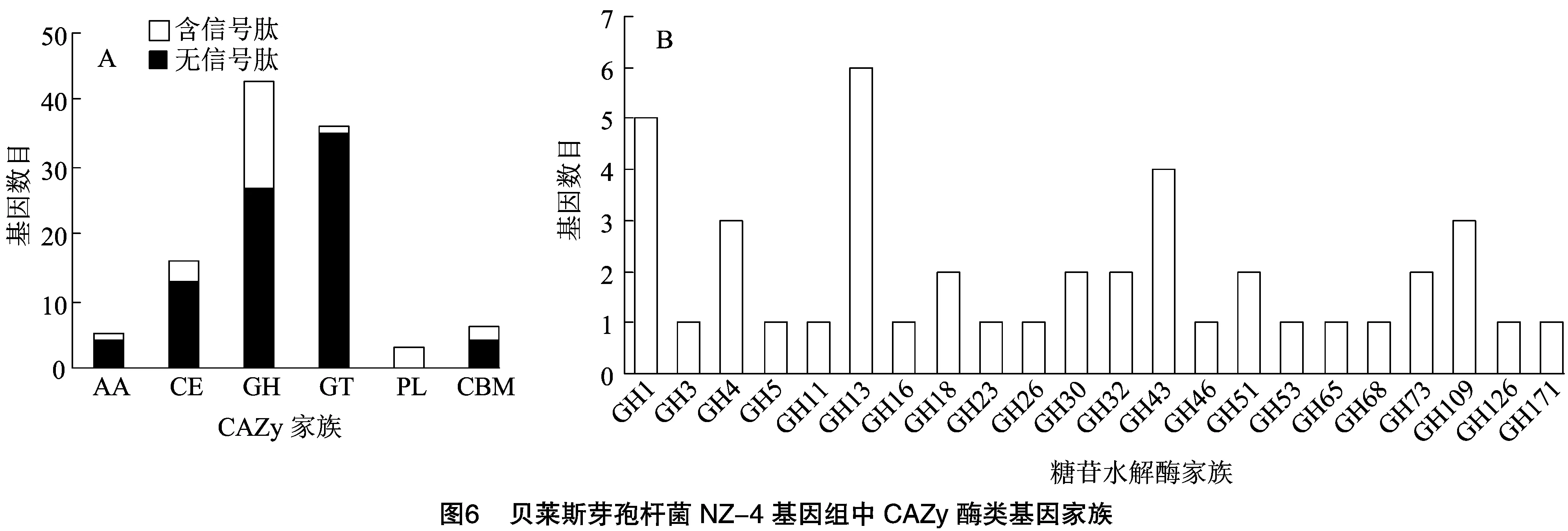
菌株NZ-4编码105个CAZy酶类基因(图6-A),包括43个糖苷水解酶(glycoside hydrolase,GHs)、36个糖基转移酶(glycosyl transferase,GTs)、16个碳水化合物酯酶(carbohydrate esterases,CEs)、6个碳水化合物结合模块(carbohydrate-binding module,CBMs)(其中4个碳水化合物结合模块又属于糖苷水解酶)、3个多糖裂解酶(ploysaccharide lyases,PLs)和5个辅助酶类(auxiliary activities,AAs)。其中GHs家族数目最多,占整个基因家族的41.0%,GTs家族次之,约占34.3%(图6-B)。其中含有信号肽的CAZyme蛋白有24个(22.9%),说明它们具有蛋白质跨膜分泌功能。分泌的CAZyme中数量最多的是GHs,43个GHs中有16个含有信号肽,而AAs和GTs中各有1个成员含有信号肽。在这些基因家族中,GH5、GH11、GH26、GH43、GH51和GH53等与纤维素降解有关;GH13和GH126与淀粉水解相关;GH18、GH23、CE9和CBM50等与几丁质降解相关;GH43、CE4、CE6和CE7等与木聚糖降解相关;GH43、PL1、PL9等与果胶降解酶类相关;GH23和GH73等与肽聚糖降解相关;GH3、GH16和GH30等与葡聚糖酶降解相关。说明菌株NZ-4具有降解纤维素、淀粉、几丁质、果胶、肽聚糖和葡聚糖等物质的潜力。
3 讨论与结论
芽孢杆菌作为生防菌如贝莱斯芽孢杆菌FZB42等,已在多种作物土传病害的防治过程中取得了显著成效[7,9,31]。菌株NZ-4是本试验室从马铃薯根际土壤中分离得到的一株贝莱斯芽孢杆菌,对多种重要农作物病原菌有良好的抑制作用[12]。本试验在此基础上,进一步研究了菌株NZ-4发酵滤液的抑菌活性稳定性,并通过对该菌株的基因组测序和分析,鉴定到该菌株发挥促生和生防作用的潜在物质,为该菌株的开发利用和机理研究奠定了基础。
本研究发现,菌株NZ-4发酵液经过不同温度、pH值、紫外照射和蛋白酶处理后,其抑菌活性在极端条件下会发生变化,说明该菌株的抑菌物质会受到外界极端环境的影响,该特性与已报道的其他芽孢杆菌相似[32-34]。 菌株NZ-4的发酵液在常规条件下具有良好的稳定性,但在极端条件下的稳定性变化,可能与发酵液中抗菌物质的种类或活性变化有关。总之,该菌株发酵液稳定性较强,能适应田间不断变化的环境条件,具备在农业生产中防治枯萎病等土传病害的潜力。
利用多种碳源快速繁殖和成功定殖是生防菌发挥生防功能的前提[35]。菌株NZ-4能够产生并分泌几丁质酶、纤维素酶、蛋白酶、酪蛋白酶、果胶酶等多种碳水化合物酶,说明该菌株能利用多种碳源生长发育,这有助于该菌株竞争环境中营养,为其在各种环境下的成功定殖奠定基础。另外,该菌株还能合成分泌铁载体,此类物质不仅能够促进植物的生长, 还能与植物病原竞争环境中微量的铁元素,从而达到抑菌效果。盆栽和田间试验结果显示,菌株NZ-4对马铃薯枯萎病有良好的防效,同时经该菌株发酵液灌根处理的马铃薯植株生长状态也显著高于对照组[14]。研究表明,几丁质酶、纤维素酶和蛋白酶等可以破坏病原真菌细胞壁,从而抑制病原真菌生长[11]。产生水解酶及合成铁载体,可能是菌株NZ-4发挥抑菌功能的重要原因。
本研究利用全基因组测序和生物信息学分析得到了该菌株的基因组序列,全长为4 085 407 bp,这与先前研究中所测定的贝莱斯芽孢杆菌基因组大小相似[32-33]。芽孢杆菌的准确鉴定是开展相关研究的基础,随着测序成本的下降,利用基因组序列来鉴定芽孢杆菌已在多种芽孢杆菌的鉴定过程中得到应用。如在贝莱斯芽孢杆菌LF01[36]及贝莱斯芽孢杆菌CMRP4490[37]的鉴定过程中,通过全基因组测序结合基于待测菌株和参考菌株单拷贝核心同源基因构建系统发育树,进行菌株的种类鉴定。本研究同样充分利用测序数据,使用生物信息学手段,将菌株NZ-4鉴定为贝莱斯芽孢杆菌。
芽孢杆菌产生的抗菌活性物质主要包括脂肽、聚酮及抗菌蛋白等[9,38]。在先前的研究中已经证明,抗菌活性物质的产生可显著影响芽孢杆菌的抗菌能力,而菌株NZ-4基因组中存在大量与抗菌物质合成基因簇,包括与已报道的大环内酰亚胺H、杆菌素、杆菌霉素、泛革素、地非西丁、儿茶酚型铁载体、解淀粉芽孢杆菌素和溶杆菌素等物质完全一致的合成基因簇,以及同源性较高的表面活性素等物质,说明菌株NZ-4至少具有合成上述抗生素的潜力。其中表面活性素是一种广谱性的抗菌物质,能够改变细胞膜的结构发挥抗菌和抗病毒活性[39],能在极端的pH值、温度和盐浓度下发挥作用[40],而NZ-4基因组中同样存在表面活性素的合成基因簇,这可能是菌株NZ-4发酵滤液抑菌稳定性较高的原因之一。儿茶酚型铁载体是一种对铁离子具有高亲和性的螯合剂,可以竞争性结合环境中病原菌生长必需的铁离子[41]。杆菌素是一种多聚烯类抗生素,能够抑制原核生物蛋白质的合成[42],而上述物质在NZ-4中的作用仍需进一步研究。总的来说,菌株NZ-4的抗菌物质合成基因簇丰富,其对病原真菌的抑菌活性可能主要来源于这些已知的具有良好抑菌活性的物质,而其他尚不明确的代谢物同样可能具有一定的抑菌活性。
CAZy分析结果显示,菌株NZ-4基因组中含有大量与蛋白质、纤维素、淀粉、几丁质、木聚糖、肽聚糖等降解相关的基因,表明菌株NZ-4可以利用多种碳源生长发育及完成定殖。其中几丁质酶、葡聚糖酶、纤维素酶和蛋白酶等能够协同作用,破坏真菌细胞壁结构,从而抑制一些真菌的孢子萌发和菌丝生长[11,43]。从平板试验结果来看,菌株NZ-4能分泌几丁质酶、纤维素酶和蛋白酶等,说明该菌株能够产生有活性的酶,进而说明与这些酶的产生相关的基因是具有活性的,该菌株可能以分泌多种水解酶为手段降解病原真菌细胞壁,从而抑制病原菌生长。
本实验室前期研究表明,菌株NZ-4能抑制包括引起马铃薯枯萎病的尖孢镰刀菌在内的多种植物病原真菌,同时还能够促进马铃薯植株的生长以及诱导马铃薯抗病相关酶活性提高,并且该菌株能够在马铃薯根际土壤中成功定殖[14]。说明菌株 NZ-4 具有广泛的应用范围,能够实现“一菌多效”。本研究发现,菌株NZ-4发酵滤液有良好的抑菌稳定性,说明该菌株具有适应田间复杂环境的潜力。本研究对菌株NZ-4进行了全基因测序,从基因组角度分析了该菌株能够产生的抑菌物质种类,发现该菌株具有合成和分泌多种抗生素的潜力,这可能是其抑菌谱广的重要原因,另外该菌株具备的多生物活性令其在植物促生和防病方面有更大的研究价值。综上所述,贝莱斯芽孢杆菌NZ-4在植物促生和抗病方面有着巨大的研究潜力和应用价值,本研究则为深入研究和开发利用该菌株奠定了基础。
