江西铅山红芽芋蔗糖合成酶基因的克隆和表达分析
2023-02-17张艺欣符卉卉顾佳怡兰佳欣
张艺欣, 段 菲, 樊 洁, 符卉卉, 顾佳怡, 兰佳欣, 李 娇
(1.上饶师范学院生命科学学院,江西上饶 334001; 2.上饶农业技术创新研究院,江西上饶 334001;3.上饶市药食同源植物资源保护与利用重点实验室,江西上饶 334001;4.上饶市薯芋类作物种质保存与利用重点实验室,江西上饶 334001)
江西铅山红芽芋(ColocasiaesculentaL. Schoot var.cormosus‘Hongyayu’)为天南星科芋属多子芋类型草本宿根植物,为江西省铅山县“两红”(红芽芋和河红茶)产业之一,2013年4月15日被核准为国家地理标志农产品,其肉白芽红,营养丰富,肉质细嫩,口感细松滑,糯香可口,是药食兼优、老幼皆宜的上好滋补佳品[1-2]。当植物处于逆境时,适度积累蔗糖可保证细胞质膜的稳定性,避免胞内外相关蛋白的降解,还可作为逆境胁迫下植物代谢所需能量的来源[3]。作为蔗糖代谢过程中的关键酶,蔗糖合成酶主要负责植物组织细胞壁成分或淀粉合成的调控,直接参与植物的生长发育过程[4]。因此,克隆江西铅山红芽芋蔗糖合成酶基因并检测其组织表达特异性,对于了解江西铅山红芽芋糖类代谢及其品质形成具有重要意义。目前,对红芽芋的研究主要集中在营养成分[5]、品质选育[6]、种植栽培[7]、组织培养[8]等方面。红芽芋的淀粉含量较高,且淀粉颗粒细小,易被消化[5]。大量研究发现,蔗糖合成酶的功能主要是参与淀粉的合成[9]。目前,关于红芽芋蔗糖合成酶基因同源克隆和表达特性分析的研究还未见报道,关于红芽芋蔗糖合成酶cDNA序列及其在红芽芋不同组织器官中如何表达、如何参与红芽芋淀粉的合成等问题尚待解决。本研究通过江西铅山红芽芋试管苗转录组数据库筛选到江西铅山红芽芋蔗糖合成酶基因的核心片段,通过设计简并引物,用RT-PCR方法克隆江西铅山红芽芋蔗糖合成酶的编码基因,并对其进行氨基酸序列比对、蛋白质二级结构和三级结构预测、系统进化树分析,利用实时荧光定量PCR技术分析蔗糖合成酶编码基因在江西铅山红芽芋不同器官(根、茎和叶)、不同球茎膨大时期(初期、中期和末期)的表达情况,为进一步研究蔗糖合成酶基因功能及代谢途径奠定理论基础,同时为江西铅山红芽芋蔗糖代谢和生长发育提供较为丰富有效的科学理论依据。
1 材料与方法
1.1 试验材料
江西铅山红芽芋单芽在MS液体培养基中培养2个月,形成球茎膨大初期的完整试管苗;在MS液体培养基培养4个月,形成球茎膨大中期的完整试管苗;在MS液体培养基培养6个月,形成球茎膨大末期的完整试管苗。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第1链的合成 2020年8月,参试剂盒说明书,用TRIzol提取江西铅山红芽芋试管苗的总RNA,RNA浓度和完整性用紫外分光光度计和琼脂糖凝胶电泳进行检测。以提取的RNA作为模版,参照试剂盒(M-MLV cDNA第1链的合成)说明书进行cDNA第1链的合成。以Oligo(dT)18 Primer作为逆转录引物(引物序列:5′-G G C C A C G C G T C G A C T A G T A C T T T T T T T T T T T T T T T T T T-3′)。
1.2.2 蔗糖合成酶基因的克隆 江西铅山红芽芋蔗糖合成酶的转录组Unigene序列信息为TRINITY_DN8401_c0_g1,引物用Primer Premier 5.0软件设计,F:5′-A T G C C G G A A C G C C A G C T G A-3′;R:5′-T C A C T T C T C A T A G A T A C G C T T C A G G-3′。PCR扩增条件:95 ℃ 2 min;95 ℃ 30 s,57.5 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。用1%琼脂糖凝胶电泳对PCR产物进行检测后,将含有目的基因的条带与pMD19-T载体连接,并用热激法将其转化到感受态细胞EscherichiacoliDH5α中,对鉴定正确的阳性转化子提取质粒后,送至生工生物工程(上海)股份有限公司进行测序。
1.2.3 蔗糖合成酶基因的生物信息学分析 用BioEdit软件将基因序列翻译为氨基酸序列,用 ProtParam预测酶的理化性质,用ProtScale预测酶的疏/亲水性,用GOR软件在线预测酶的二级结构,用SWISS-MODEL在线预测酶的三级结构,用WoLF PSORT在线预测基因的表达部位。通过DNAMAN和BioEdit软件进行氨基酸序列的比对,用MEGA 5.0软件进行系统进化树的构建。
1.2.4 蔗糖合成酶基因的组织表达分析 取在MS液体培养基中培养2个月的江西铅山红芽芋完整试管苗根、茎、叶以检测蔗糖合成酶基因在不同器官中的表达情况;取江西铅山红芽芋在MS液体培养基中培养2个月(球茎膨大初期)、4个月(球茎膨大中期)和6个月(球茎膨大末期)的完整试管苗的试管球茎以检测蔗糖合成酶基因在球茎膨大不同时期的表达情况。以上材料各提取得到500 ng RNA,将其反转录为cDNA。通过荧光定量PCR(qRT-PCR,SYBR Green I)检测得出,其内参基因为GAPDH。设计引物(F:5′-G C C C C G T C T T A T T C A T A C C C T C G-3′;R:5′-C A T G C T T T T C C C A T T T T G T C C T C A-3′)。qRT-PCR检测采用20 μL反应体系,PCR反应程序:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 34 s,95 ℃ 15 s,40个循环。用2-ΔΔCT法计算基因的表达水平。试验重复3次,所有数据均表示为平均值±标准差,并用SPSS 19.0软件进行统计分析,用单因素方差分析(One-way ANOVA)检验蔗糖合成酶基因组织表达的差异显著性(α=0.05)。
2 结果与分析
2.1 江西铅山红芽芋蔗糖合成酶基因的cDNA序列
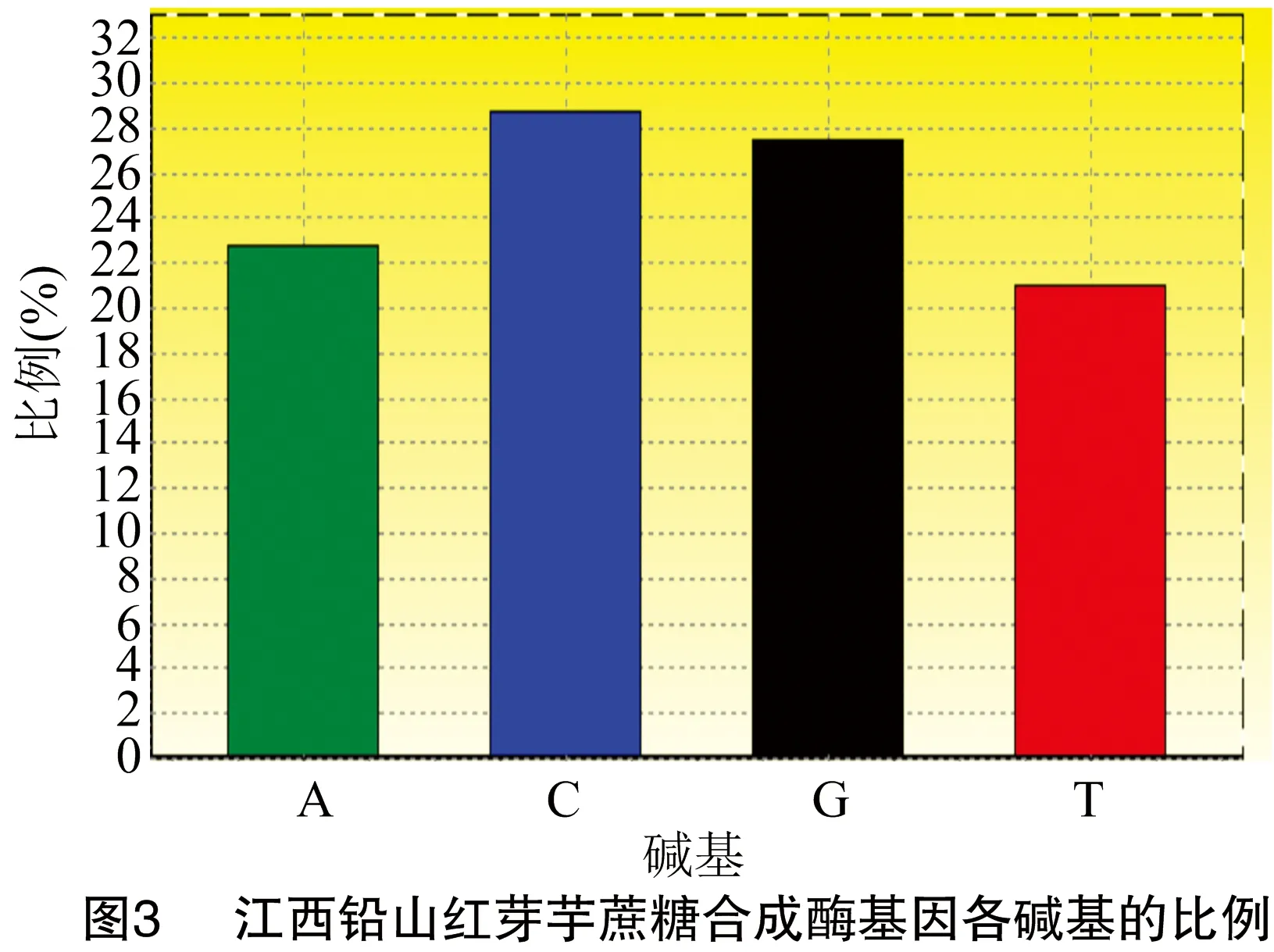
对江西铅山红芽芋蔗糖合成酶基因进行PCR扩增,结果见图1。江西铅山红芽芋蔗糖合成酶基因cDNA总长度为2256bp(图2),G+C含量为56.21%(图3)。

2.2 江西铅山红芽芋蔗糖合成酶的氨基酸序列
通过ProtParam预测,得出江西铅山红芽芋蔗糖合成酶的氨基酸序列(图4)。江西铅山红芽芋蔗糖合成酶由751个氨基酸组成,相对分子量为 85 350.64 u,等电点为5.83,为亲水性蛋白。各氨基酸的数目和占比如下:丙氨酸(Ala,A),47个,占比6.3%;精氨酸(Arg,R),44个,占比5.9%;天冬酰胺(Asn,N),32个,占比4.3%;天冬氨酸(Asp,D),40个,占比5.3%;半胱氨酸(Cys,C),10个,占比1.3%; 谷氨酰胺(Gln,Q),26个,占比3.5%;谷氨酸(Glu,E),60个,占比8.0%;甘氨酸(Gly,G),51个,占比6.8%;组氨酸(His,H),29个,占比3.9%;异亮氨酸(Ile,I),41个,占比5.5%;亮氨酸(Leu,L),86个,占比11.5%;赖氨酸(Lys,K),36个,占比4.8%;甲硫氨酸(Met,M),16个,占比2.1%;苯丙氨酸(Phe,F),36个,占比4.8%;脯氨酸(Pro,P),37个,占比4.9%;丝氨酸(Ser,S),38个,占比5.1%;苏氨酸(Thr,T),32个,占比4.3%;色氨酸(Trp,W),8个,占比1.1%;酪氨酸(Tyr,Y),27个,占比3.6%;缬氨酸(Val,V),55个, 占比7.3%。带负电残基总数(Asp+Glu)为100个,正电荷残基(Arg+Lys)总数为80个。估计半衰期:30 h(哺乳动物网织红细胞,体外)>20 h(酵母,体内)>10 h(大肠杆菌,体内)。经计算, 江西铅山红芽芋蔗糖合成酶失稳指数(Ⅱ)为35.94,表明其在分类上属于稳定蛋白。


2.3 江西铅山红芽芋蔗糖合成酶亲疏水性的分析
图5中高峰值(正值)区域表示疏水区域,而负值的“低谷”区域是亲水区域。疏水性结果显示,最大疏水值为2.5左右,说明在该多肽中该处的疏水性最强;亲水峰最大值为-2.5左右,整个蛋白质表现出高度的亲水性,说明该蛋白为亲水性蛋白。

2.4 江西铅山红芽芋蔗糖合成酶二级结构的分析
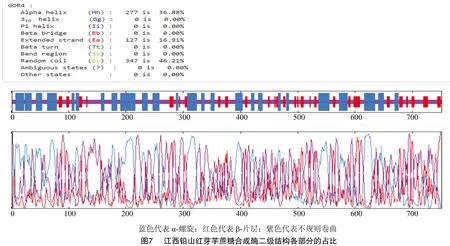
江西铅山红芽芋蔗糖合成酶的二级结构(图6)预测如下:根据GOR预测结果,其二级结构由α螺旋(alpha helix,占比36.88%)、β-片层(extended strand,占比16.91%)、无规则卷曲(random coil,占比46.21%)构成(图7)。从分布位点上来看,C端主要含有无规则卷曲和α-螺旋,N端主要含有无规则卷曲和β-片层,无规则卷曲、β-片层和 α-螺旋散布于整个蛋白质中。

2.5 江西铅山红芽芋蔗糖合成酶三级结构的分析
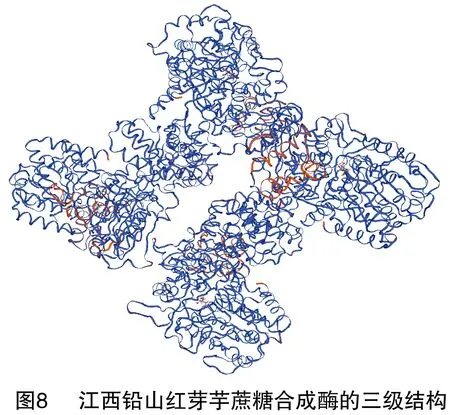
蛋白质的三级结构是指整条多肽链的三维空间结构,也就是包括碳骨架、侧链在内的所有原子的空间排列。SWISS-MODEL是一款用同源建模法预测蛋白质三级结构的全自动在线预测软件,共有3个工作方式:First Approach mode、Alignment Interface mode、Project(Optimise)mode。SWISS-MODEL预测结果显示,江西铅山红芽芋蔗糖合成酶的三级结构为同源四聚体,详见图8。
2.6 江西铅山红芽芋蔗糖合成酶的亚细胞定位
用WoLF PSORT在线软件对江西铅山红芽芋蔗糖合成酶基因的表达部位进行预测,图9结果显示,定位于细胞质中的蔗糖合成酶基因数量为6个,定位于线粒体中的蔗糖合成酶基因数量为4.5个,定位于细胞质_线粒体中的蔗糖合成酶基因数量为3个,定位于叶绿体中的蔗糖合成酶基因数量为1个,定位于细胞骨架_质膜中的蔗糖合成酶基因数量为1个,表明江西铅山红芽芋蔗糖合成酶基因主要存在细胞质中。
2.7 江西铅山红芽芋蔗糖合成酶的系统进化分析
从构建的进化树(图10)可以看出,江西铅山红芽芋与芋(Colocasiaesculenta)、眼子菜(Potamogetondistinctus)在一个大分支下,说明江西铅山红芽芋蔗糖合成酶在进化上与C.esculentahypothetical protein Taro_012658(MQL80204_c0_g1)、P.distinctussucrose synthase(BAE06059.1)的亲缘关系较近,特别是与C.esculentahypothetical protein Taro_012658(MQL80204_c0_g1)具有最高的亲缘关系。


2.8 江西铅山红芽芋蔗糖合成酶同源蛋白序列的比对结果
江西铅山红芽芋蔗糖合成酶同源蛋白的序列比对信息见图11,其中的“※”号区域是该蛋白家族的保守结构域。由图11可知,江西铅山红芽芋与芋(Colocasiaesculenta)、眼子菜(Potamogetondistinctus)的同源性较高,再次说明江西铅山红芽芋蔗糖合成酶在进化上与C.esculentahypothetical protein Taro_012658(MQL80204_c0_g1)、P.distinctussucrose synthase(BAE06059.1)的亲缘关系较近,特别是与C.esculentahypothetical protein Taro_012658(MQL80204_c0_g1)具有最高的亲缘关系。
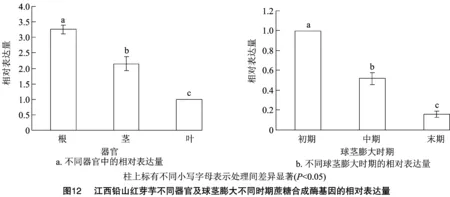
2.9 江西铅山红芽芋不同器官及球茎膨大不同时期蔗糖合成酶基因的表达分析
以江西铅山红芽芋的GAPDH为内参,利用实时荧光定量PCR分析江西铅山红芽芋蔗糖合成酶基因在江西铅山红芽芋不同器官中的表达情况。结果显示,江西铅山红芽芋蔗糖合成酶基因在根、茎、叶中均有表达,但在不同组织器官中的表达情况差异显著(图12),其中江西铅山红芽芋蔗糖合成酶基因在根、球茎膨大初期的相对表达量最高。
3 讨论
植物光合作用的主要产物为蔗糖,植物经光合作用形成蔗糖后通过叶片源源不断地向库器官(块根、块茎、球茎、鳞茎等)输送,到达库器官后直接或间接参与其生理代谢进程,从而进一步影响植株的生长发育和产量调控[10]。蔗糖到达库器官后不能直接被细胞吸收利用,必须依靠蔗糖转化酶或蔗糖合成酶的作用将其分解后才能参与植物的代谢活动[11]。因此,蔗糖合成酶是蔗糖代谢的关键调节酶,主要影响植物细胞之间的碳水化合物分配及碳水化合物的结构组成和贮藏[12]。蔗糖合成酶分解蔗糖活性的强弱与植物淀粉贮藏器官库强度密切相关,包括植物的变态根、变态茎等[13]。在江西铅山红芽芋中,蔗糖是叶片光合碳水化合物转运和分配的主要形式,是江西铅山红芽芋球茎淀粉合成的初始原料。本试验利用同源克隆技术成功克隆了江西铅山红芽芋蔗糖合成酶基因序列,该基因cDNA总长度为2 256 bp,G+C含量为56.21%;江西铅山红芽芋蔗糖合成酶由751个氨基酸组成,分子量为85 350.64 u,等电点为5.83,为亲水性蛋白;江西铅山红芽芋蔗糖合成酶二级结构由α-螺旋(36.88%)、β-片层(16.91%)、无规则卷曲(46.21%)构成,三级结构为同源四聚体;江西铅山红芽芋蔗糖合成酶主要存在于细胞质、线粒体中,在进化上与C.esculenta、P.distinctus的亲缘关系较近,尤其是与C.esculentahypothetical protein Taro_012658(MQL80204_c0_g1)在进化上具有最高的亲缘关系。
研究发现,蔗糖合成酶基因在植物中具有组织特异性和时间特异性。白及蔗糖合成酶基因的实时定量PCR结果表明,蔗糖合成酶基因在叶片中的表达量最高,在块茎中的表达量最低;成熟叶片的表达量高于未成熟叶片的表达量[14]。半定量RT-PCR分析结果表明,蔗糖合成酶基因HbSS1、HbSS2在巴西橡胶树各组织器官中均有表达,其中蔗糖合成酶基因HbSS1在叶中的表达量最高,蔗糖合成酶基因HbSS2在树皮中的表达量最高[15]。蔗糖合成酶基因组织表达特异性分析结果显示,SoSuS1在甘蔗热带种Badila茎、叶鞘、叶片中均有表达,且SoSuS1在甘蔗热带种Badila茎中的表达量最高[16]。实时定量PCR表达分析结果显示,蔗糖合成酶LbSusy基因在枸杞茎中的表达量最高,在根中的表达水平较低[17]。半定量RT-PCR表达分析结果表明,蔗糖合成酶基因PhSUS在蝴蝶兰的组织中均有表达,在花蕾发育中后期、成熟花和花器官的表达量都比营养阶段根、叶中的表达量高[18]。蔗糖合成酶ZmSus6、ZmSus7基因在甜玉米的根、茎、叶、玉米芯和籽粒中均有表达,但以叶、根中的相对表达量最高[19]。铁皮石斛叶、茎、根蔗糖合成酶的半定量RT-PCR检测结果表明,蔗糖合成酶基因在铁皮石斛植株中不同部位表达量不同,其表达模式表现为茎>叶>根[20]。玉米蔗糖合成酶的组织表达特异性分析发现,蔗糖合成酶基因ZmSUS1和ZmSUS2在胚和胚乳中大量表达,蔗糖合成酶基因ZmSUS5在所有被检测组织中的表达量很低,蔗糖合成酶基因ZmSUS3及ZmSUS4在被检测的组织中均有较高的表达量[21]。本试验结果与上述结果较为类似。本试验的实时定量PCR结果显示,蔗糖合成酶基因在江西铅山红芽芋的表达存在器官特异性,在根、球茎膨大初期中的表达量最高。因此,江西铅山红芽芋蔗糖合成酶基因的克隆不仅为研究该基因在江西铅山红芽芋中的表达调控奠定了基础,而且丰富了植物蔗糖合成酶分子进化和结构功能研究的材料。