镉在草地早熟禾中的分布和化学形态研究
2023-02-10牛奎举董文科马晖玲
崔 婷,王 勇,牛奎举,董文科,张 然,马晖玲
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070)
镉(Cadmium,Cd)是典型的土壤重金属污染物,主要来自于工矿“三废”的排放及人类农事活动中农药化肥的过量使用[1]。Cd是植物非必要的微量金属元素,当其进入植物体并积累到一定程度时,就会表现为生长抑制、失绿、萎蔫,甚至死亡等毒害症状[2-3]。因而寻求一种安全有效的土壤Cd污染治理手段是当务之急。植物修复是一种高效、经济、环保的重金属污染土壤修复技术[4-5]。由于草地早熟禾对Cd的吸收效率高、抗Cd能力强、生物量高、生长快[6]。因此,草地早熟禾在Cd污染土壤修复中具有潜在优势[7]。
Cd的亚细胞分布和化学形态会影响其在植物体的积累和耐受性[8-9]。植物细胞壁沉积和液泡区隔化在重金属脱毒、耐受和过量积累中起着重要作用[10]。细胞壁是阻止Cd进入植物体的第一道屏障,Cd进入后可以被细胞壁成分的活性基团如果胶、纤维素、半纤维素和木质素等螯合,从而改变植物结合Cd的能力,并提高植物对Cd的耐受性[11-12]。液泡是细胞可溶性组分中最重要的组成部分,能够储存代谢物、信号物质和潜在毒性物质,是大多数植物提高重金属耐性的主要途径[13-14]。此外,植物中Cd存在的不同化学形态是另一种重要的Cd解毒机制。有研究表明,以无机和有机形式存在的水溶性Cd的生物利用率、迁移性和毒性高于与果胶和蛋白质结合的Cd,而难溶性Cd磷酸盐和与草酸结合的Cd毒性较小[15-16]。植物根细胞中的无机态Cd、水溶性有机酸和H2PO4结合的Cd以及与果胶和蛋白质结合的Cd,一部分被区隔在液泡中,另一部分被装载到木质部中,通过长距离运输从根转运至地上部[17]。难溶解的Cd磷酸盐和草酸结合的Cd则是贮存在液泡和细胞壁中[16]。这些化学形态具有较低的移动性和植物毒性,在Cd的解毒中起着关键作用。
在本课题组前期研究中,发现高浓度的Cd胁迫会抑制草地早熟禾的生长及代谢[7]。然而,关于Cd在草地早熟禾中的分配和解毒机制尚不明确。本试验以耐Cd品种‘午夜’(‘Midnight’,M)和敏感品种‘橄榄球2号’(‘Rugby II’,R)为研究材料,探究600 μmol·L-1Cd胁迫对草地早熟禾的亚细胞分布和化学形态的影响。试验结果旨在为重金属污染土壤的草地早熟禾修复提供理论及实践依据。
1 材料与方法
1.1 试验材料及来源
供试材料为耐Cd草地早熟禾品种‘午夜’(Midnight)和敏感品种‘橄榄球2号’(RugbyⅡ),均为本课题组前期筛选所得[18]。种子购买自北京克劳沃草业技术开发中心。
1.2 试验设计
1.2.1试验材料培养 供试种子经0.1%(W/V)次氯酸钠溶液消毒15 min,灭菌水冲洗5~6次,晾干后均匀撒播0.2 g草地早熟禾种子至以蛭石为基质的育苗盘中(8 cm×10 cm),发芽后置于人工气候箱(光强2 000 lx,光期14 h,25℃,湿度70%;暗期10 h,20℃,湿度60%)继续培养。每天喷洒蒸馏水待幼苗长至3 cm时改用Hoagland营养液浇灌,每5 d更换一次营养液。继续培养30 d后,挑选长势一致的幼苗移栽至水培盒(长×宽×高:12 cm × 8 cm ×11 cm),每盒移栽18株草地早熟禾,Hoagland营养液培养7 d后进行Cd胁迫处理。
1.2.2试验设计与处理 M和R品种各挑选8盒上述水培盒中长势一致的幼苗,处理组(Cd)在营养液条件下根施600 μmol·L-1Cd胁迫,对照组(CK)继续用Hoagland营养液培养,每个处理包含4个水培盒作为重复。期间每5 d更换一次处理液,处理14 d后进行各项指标测定。
1.3 指标测定与方法
1.3.1幼苗生长指标测定 株高:采用厘米尺测定。叶片和根系鲜重:采用分析天平称量。
1.3.2亚细胞组分分离与Cd含量测定 亚细胞组分的分离参照Wu等[4]的方法,称取1 g新鲜草地早熟禾叶片或根系用10 mmol·L-1EDTA-Na2解离表面吸附的Cd2+20 min,然后用蒸馏水冲洗干净后,加入20 mL预冷的提取液[0.25 mmol·L-1蔗糖+50 mmol·L-1Tris-HCI缓冲液(pH=7.5)]及植物样品至研钵中,研磨匀浆。混合液离心10 min(2 000 g,4℃),沉淀为细胞壁,上清液继续离心45 min(12 000 g,4℃),沉淀为细胞器,上清液为可溶性部分。细胞壁和细胞器组分在105℃烘至恒重,并加入7 mL HNO3和1 mL H2O2在微波消解仪中消解至澄清,1%HNO3定容至50 mL,而后用原子吸收分光光度计(AA-6800,岛津,日本)测定细胞壁、细胞器及可溶性部分的Cd含量。
1.3.3植物组织分离、组织Cd含量测定及Cd的化学形态提取 植物组织分离参照以下方法[17],分别将2.5 g草地早熟禾叶片或根系剪碎后,加入80%乙醇冰浴研磨至叶肉和维管束分离,根系皮层和中柱分离,匀浆通过0.15 mm尼龙网过滤,在光学显微镜下观察根系中柱和叶片维管束,不含有皮层和叶肉时结束分离,即叶片分离为表皮和叶肉(滤液)及维管束(残渣),根系分离为表皮和皮层(滤液)及中柱(残渣)。不同组织分离物在80℃烘至恒重用于后续试验。不同组织Cd含量消解与测定方法同1.3.2。
Cd的化学形态的提取采用五步连续提取法[19],将0.2 g草地早熟禾叶片或根系干燥粉碎,依次加入5种不同的萃取剂进行提取,每种萃取剂加入40 mL,每次提取24 h,萃取剂的加入和相应的Cd的化学形态如下:
(1)80%乙醇,提取水溶性无机态Cd;
(2)去离子水,提取水溶性的有机酸盐及Cd(H2PO4)2;
(3)1 mol·L-1NaCl,提取果胶和蛋白结合态Cd;
(5)0.6 mol·L-1HCl,提取草酸结合态Cd。
最后为残留态,加入混合酸10 mL(HNO3∶HClO4=5∶1),盖上弯颈漏斗,放置于通风橱内浸提过夜,将样品转移到温度可调的电热板上,微热至反应物颜色变浅,用少量去离子水冲洗锥形瓶内壁,逐步提高温度至消化液处于微沸状态,消解至澄清后用原子吸收分光光度计测定Cd含量。
1.4 数据处理
采用IBM SPSS Statistics 25.0进行显著性检验,测定结果用“平均值±标准误”表示,使用GraphPad Prism 9.0.0作图。
2 结果与分析
2.1 Cd胁迫对草地早熟禾生长的影响
Cd胁迫下,敏感品种R与耐Cd品种M相比,表现出严重的失绿症状(图1A~1B)。Cd胁迫显著抑制草地早熟禾株高,与CK相比,M和R株高在Cd胁迫处理下分别降低18.83%和22.03%,差异显著(P<0.05)。Cd处理下M品种叶片鲜重与CK相比无显著差异,但Cd胁迫显著降低R品种叶片鲜重(P<0.05)。另外,M和R根系鲜重在Cd胁迫下均被显著抑制,R品种下降幅度更大(P<0.05)。这些结果证明M品种具有更高的Cd耐受性。
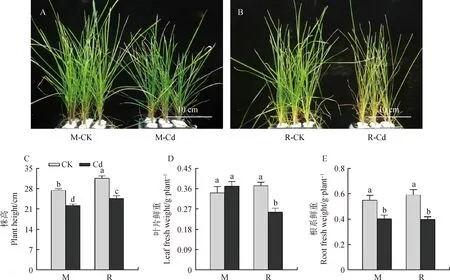
图1 Cd胁迫对草地早熟禾表型(A,B)、株高(C)及鲜重(D,E)的影响
2.2 Cd在草地早熟禾不同组织中的分布
Cd在在不同组织中的分布与其植物毒性及转移能力密切相关。图2显示了Cd在不同抗性草地早熟禾表皮+叶肉、维管束、表皮+皮层、中柱中的分布。耐Cd品种M叶片的表皮+叶肉、维管束及根系表皮+皮层中的Cd含量显著低于R品种(P<0.05),而根系中柱中的Cd含量两个品种之间差异不显著(图2A和2B)。因此,敏感品种R对Cd具有更高转运能力。
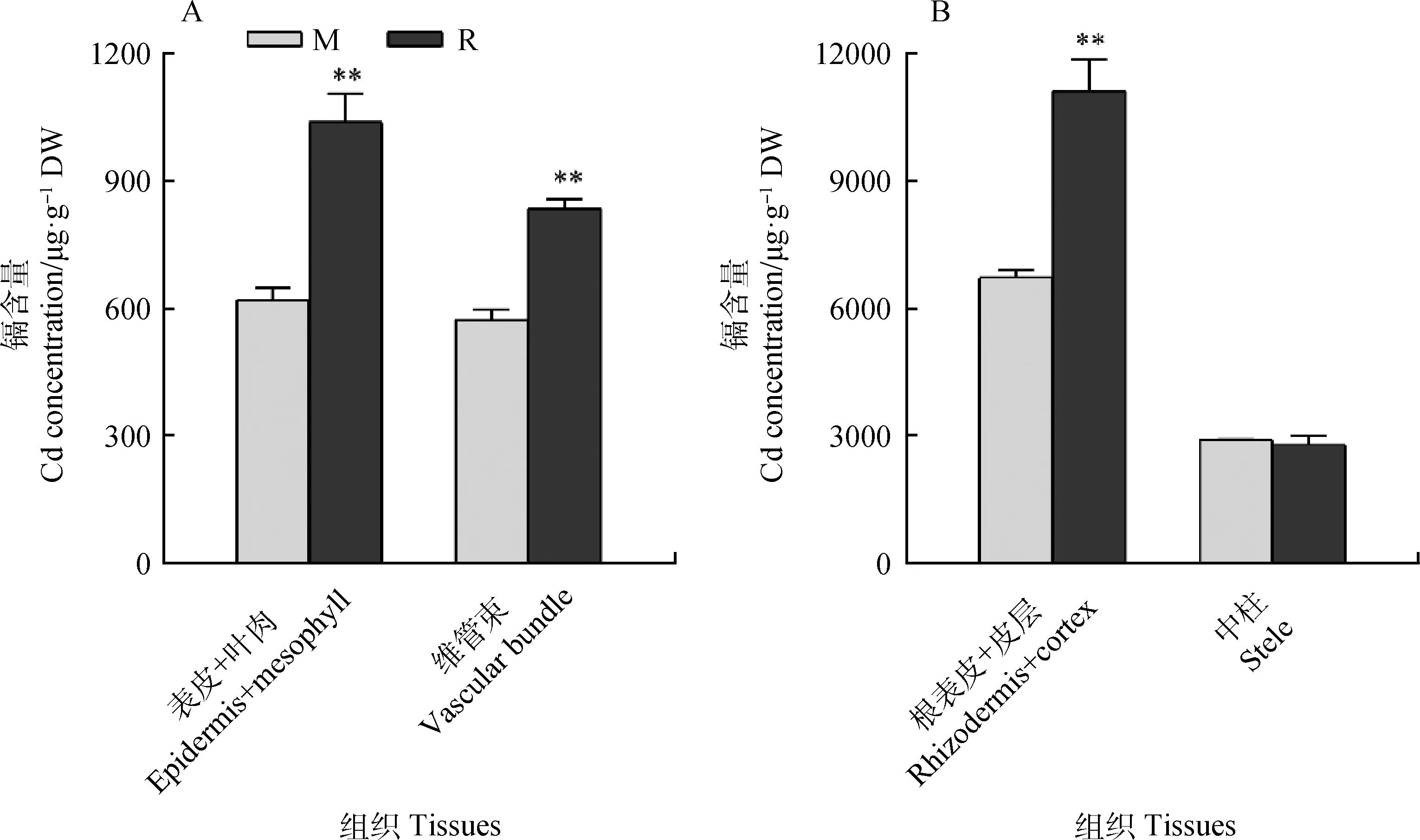
图2 Cd在草地早熟禾不同组织中的分布
2.3 Cd在不同抗性草地早熟禾中的亚细胞分布
Cd的亚细胞分布与其生物毒性密切相关。图3A显示,M品种细胞壁组分Cd含量显著低于R品种(P<0.05)。R品种叶片和根系细胞器部分Cd含量均高于M品种(图3B),且在叶片中差异显著(P<0.05)。而根系可溶性部分Cd含量(图3C)M品种显著高于R品种(P<0.05)。亚细胞组分Cd的分布比例分析发现(图3D),R品种叶片中可溶性部分Cd含量占比小于M品种,而细胞器部分Cd含量占比高于R品种。根系中,M品种可溶性部分Cd含量高于R品种。这些结果表明,R品种细胞器组分含有较高的Cd含量及可溶性部分含有较低Cd含量。
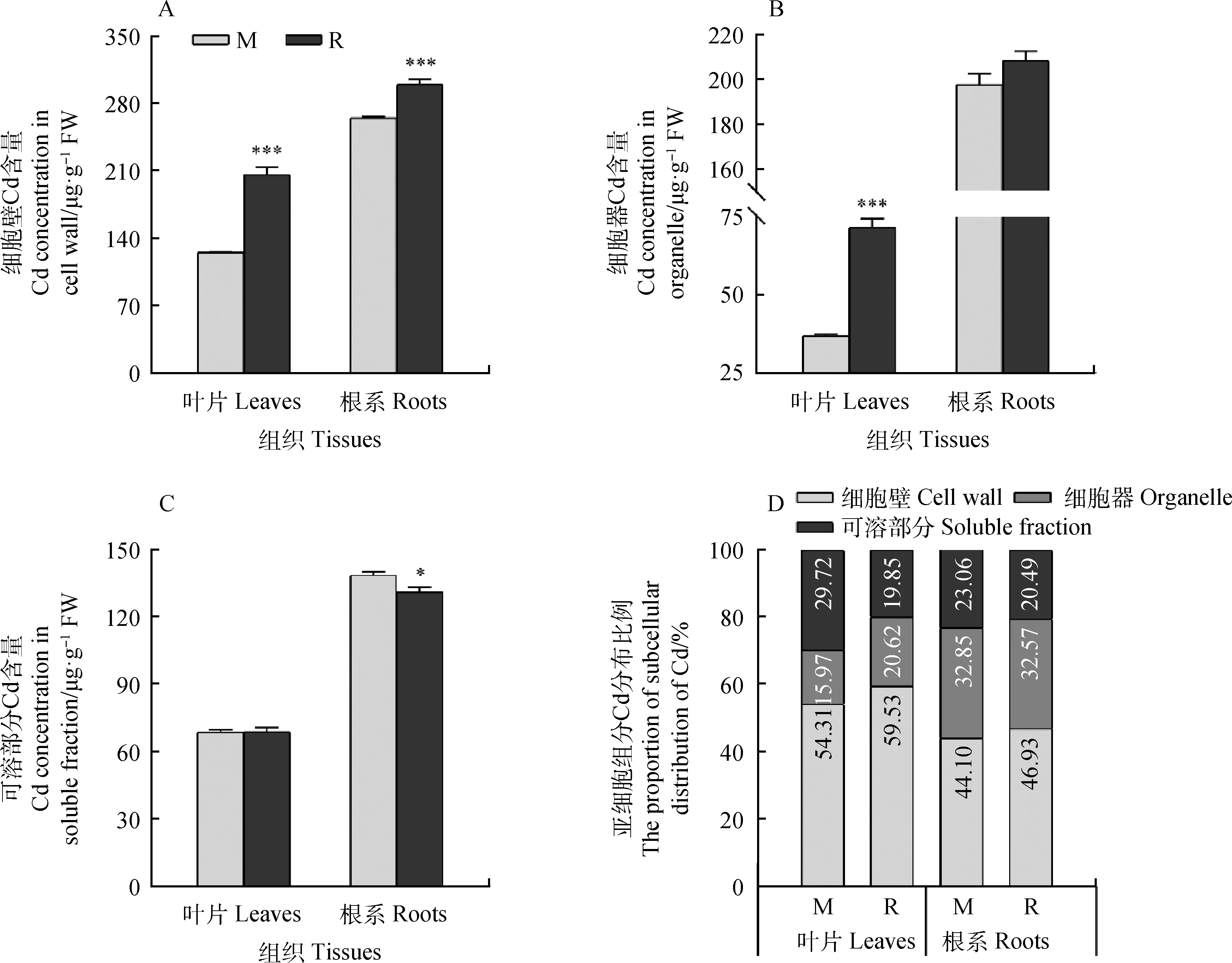
图3 Cd在耐Cd及Cd敏感品种草地早熟禾的亚细胞中分布
2.4 Cd在草地早熟禾不同组织中的化学形态
Cd在植物中的化学形态与其可移动性及植物毒性密切相关。图4A显示,R品种表皮+叶肉、维管束、根表皮+皮层组织中乙醇提取的无机态Cd含量显著高于M品种(P<0.01)。而水溶性的有机酸盐和可溶性磷酸盐态的Cd在M品种根表皮+皮层和中柱中显著高于R品种(P<0.05),但在表皮+叶肉中R品种有机酸盐和可溶性磷酸盐态的Cd含量较高(图4B)。图4C显示,NaCl提取的果胶酸盐结合的Cd在M品种各组织均低于R品种(P<0.05)。图4D和4F表明,M品种中HAc提取的难溶性磷酸盐态的Cd及残渣态的Cd在表皮+叶肉、维管束、根表皮+皮层组织中显著高于低于R品种(P<0.05)。另外,HCl提取的草酸盐态的Cd在M品种表皮+叶肉、根表皮+皮层中显著低于R品种,但在根系中柱中M品种草酸盐态的Cd含量显著高于R品种(图4E)。
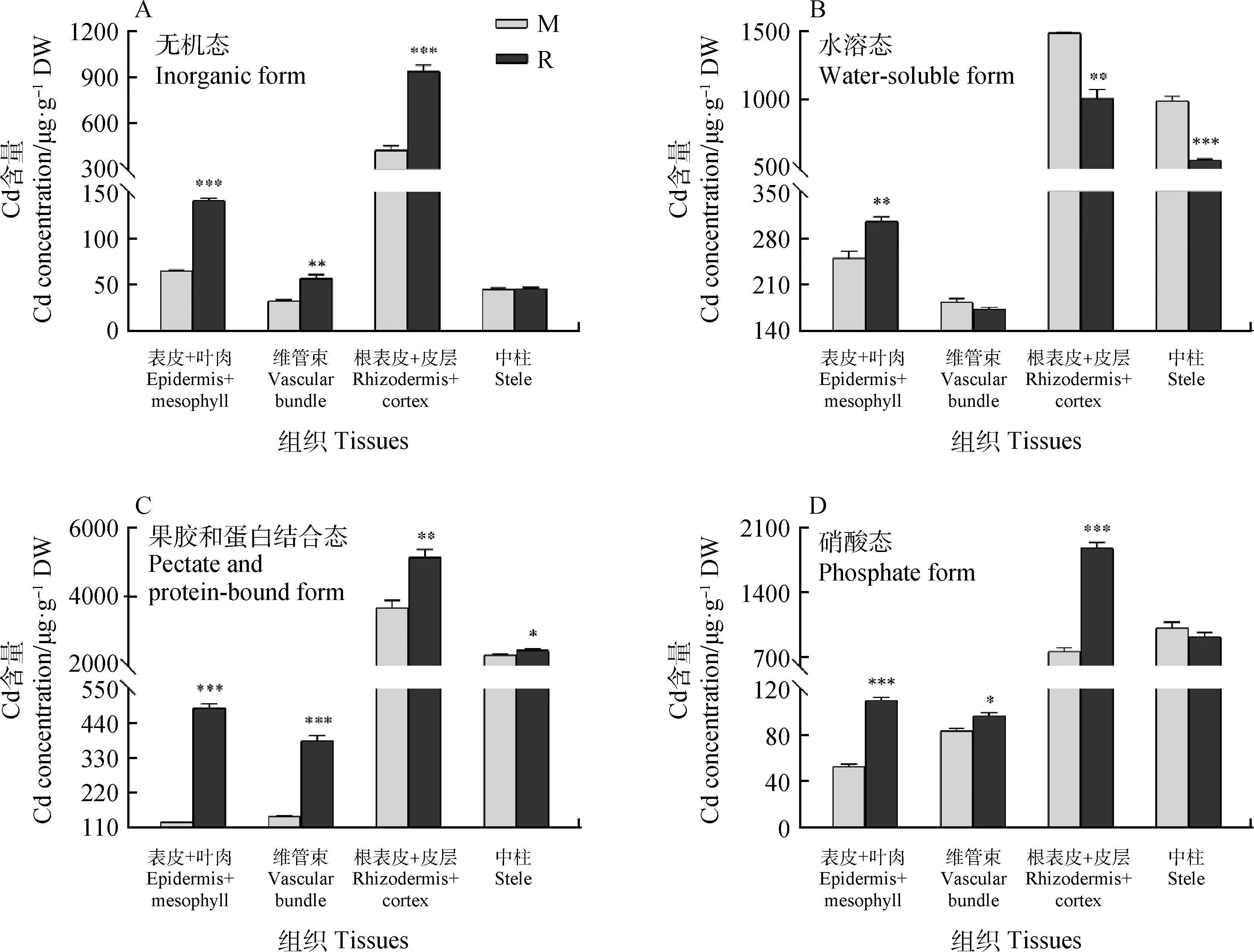
图4 Cd在草地早熟禾不同组织中的化学形态
2.5 不同组织中各化学形态Cd的分布比例
R品种各组织中果胶酸盐和蛋白质结合的Cd含量占比最高(图5)。在叶片表皮+叶肉和维管束中,M品种中水溶性有机酸盐和可溶性磷酸盐态Cd占比最高(图5A和5B)。但在M品种根表皮+皮层和中柱中果胶酸盐和蛋白质结合的Cd含量占比最高(图5C和5D)。M品种中水溶性有机酸盐和可溶性磷酸盐态Cd占比在各组织中均高于R品种(图5)。另外,M品种维管束中HAc提取的难溶性磷酸盐态的Cd占比高于R品种(图5B)。M品种HCl提取的草酸盐态的占比Cd在维管束、根表皮+皮层、中柱中含量均高于R品种(图5B~5D)。
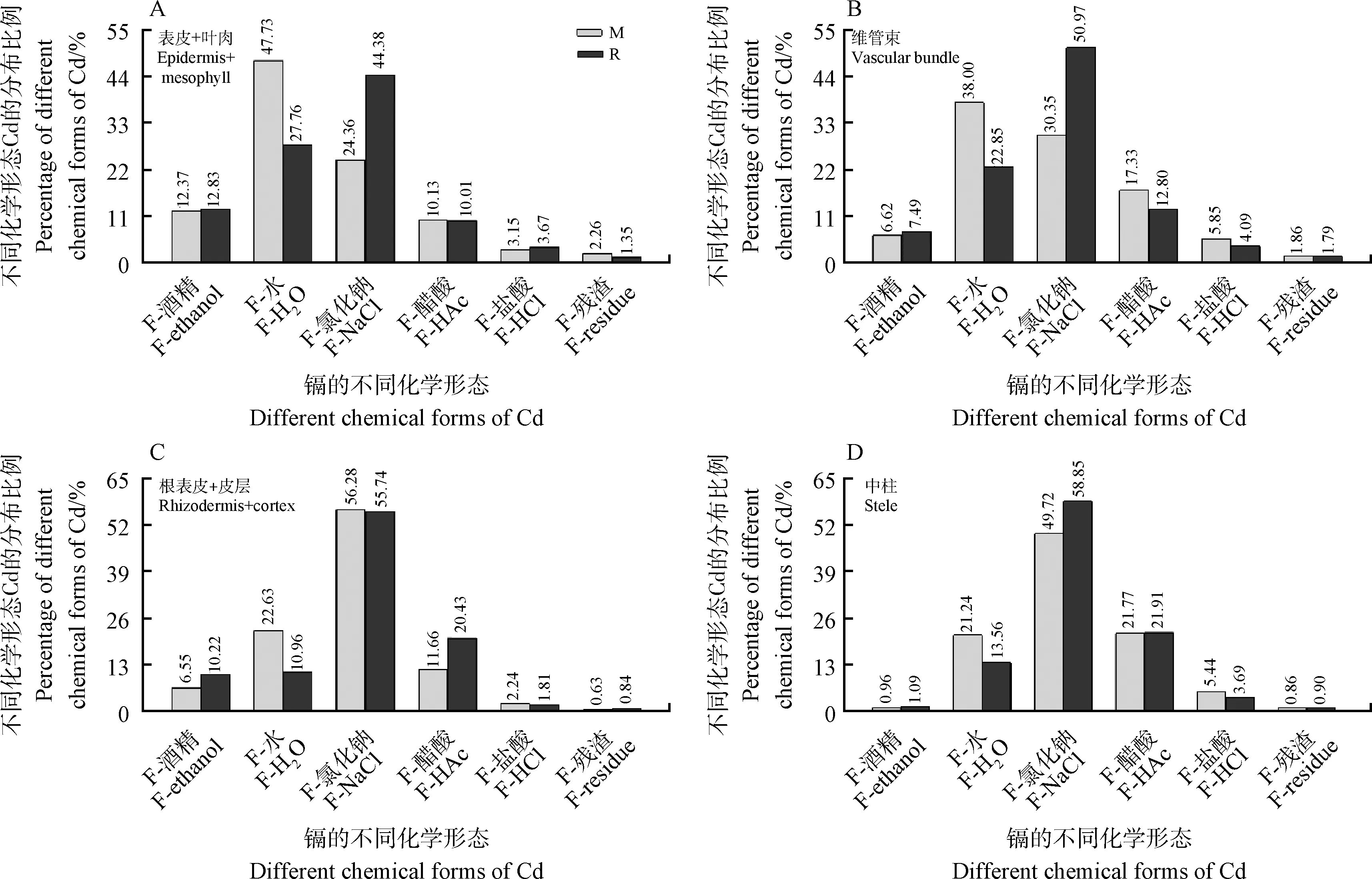
图5 草地早熟禾不同组织中各化学形态Cd分布比例
3 讨论
植物通过共质体结合的方式将体内大量的Cd吸附在细胞壁上,而进入细胞的Cd一部分被液泡螯合,而另一部分通过共质体途径进行从根系到叶片的长距离运输[20]。通常认为,细胞壁和液泡螯合的Cd具有较低的移动性和毒性,而吸附在细胞器或细胞质中游离的Cd具有更高的移动性和毒性[21]。本研究观察到,未施加Cd胁迫时,M品种和R品种叶片和根系鲜重无显著差异,R品种株高显著高于M品种,Cd胁迫下耐Cd草地早熟禾品种M根系和叶片受到的生长抑制较小,叶片失绿较少,而Cd敏感品种R则受到更严重的生长抑制及叶片黄化(图1)。进一步分析M和R品种根系和叶片各组织中的Cd含量,发现R品种叶片表皮+叶肉、维管束及根表皮+皮层中Cd含量显著高于M品种(图2)。因此,R品种对Cd敏感是可能因为更多的Cd进入共质体途径并向叶片转运。
Cd在亚细胞水平的分布与其毒性密切相关,细胞壁组分果胶和半纤维素含有丰富的游离羧基和羟基,可以结合大量的Cd,从而减少Cd向细胞内部的运输[22]。另外,Cd胁迫通常可引起细胞壁木质化,减少Cd进入细胞[23]。而进入细胞的Cd可被谷胱甘肽、植物螯合肽、有机酸、烟酰胺等金属配位体螯合,降低Cd毒性,或者以游离态的形式吸附在细胞器和细胞膜上,造成毒害作用[24-26]。金属配位体螯合的Cd一部分进入液泡保存,另一部分被转运进入中柱进行长距离运输[27]。因此,细胞壁结合与液泡区隔化在植物Cd解毒中具有关键作用。研究认为,细胞中可溶性Cd可以代表其液泡中保存的Cd[20]。在草地早熟禾中,大部分的Cd可与细胞壁结合或被保存在液泡中。因此,液泡区隔化及细胞壁结合两种方式是草地早熟禾主要的解毒方式。另外,我们发现R品种细胞壁与细胞器部分Cd含量均高于M品种,而在M品种根系中可溶性部分Cd含量占比均高于R品种。这些结果表明,相比于R品种,M品种对Cd的吸收能力较弱,同时可将更多的Cd保存在液泡中,减轻毒害作用。而R品种吸收Cd的能力较强,同时细胞器中Cd含量较高,这可能是导致其对Cd敏感的主要原因。
Cd在植物体内的移动性及毒性与其存在的化学形态密切相关[22]。研究表明,在低浓度Cd处理下,高Cd积累型的豆瓣菜(NasturtiumofficinaleR.Br.)水溶性Cd含量高于低Cd积累型豆瓣菜,但高Cd浓度处理可提高低Cd积累型品种水溶性Cd的比例[28]。草地早熟禾中,M品种中无机态Cd含量显著低于R品种,这可能是由R品种较高的富集量引起。草地早熟禾M品种根表皮+皮层及中柱中水溶性有机酸和可溶性磷酸盐结合的Cd显著高于R品种,这可能是因为Cd胁迫促进M品种有机酸合成[29]。在R品种中果胶酸盐和蛋白质结合态的Cd及难溶性磷酸盐结合的Cd显著高于M品种,可能有利于R品种吸收大量Cd之后缓解其毒性[4]。M品种草酸盐态Cd在中柱中的含量显著高于R品种,由于其移动性较差,可能降低了M品种中Cd从根系向叶片的转运[30]。而残渣态Cd含量在R品种中显著高于M品种可能由R品种吸收较多Cd导致。此外,M品种中较高占比的有机酸盐态Cd(水溶性有机酸及草酸盐)可能在提高M品种在Cd胁迫下的抗性中具有关键作用。
4 结论
草地早熟禾耐Cd品种M对Cd的吸收和转运能力低于敏感品种R。细胞壁螯合与液泡区隔化作用是草地早熟禾降低Cd毒性及减少向上运输的关键机制。较高的液泡区隔化作用使得M品种在Cd胁迫下抗性更高。另外,Cd胁迫下M品种可通过增加可溶性有机酸及草酸盐结合的Cd提高其抗性并降低Cd向叶片的长距离运输。
