油茶籽乙醇提取物代谢物组成及其抗炎活性
2023-02-07付湘晋钟海雁
林 欣,李 杨,詹 淼,付湘晋,2,*,钟海雁,姚 文,刘 成
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.湖南省营养健康品工程技术研究中心,湖南省药食同源功能性食品工程技术研究中心,湖南省调味料绿色制造工程技术研究中心,湖南 长沙 410004;3.湖南巨雄油茶油脂研究院,湖南 岳阳 414000;4.亿丰农林牧科技有限公司,湖南 邵阳 422300)
油茶树(Camellia oleiferaAbel.)在我国已有两千多年的栽培历史,广泛分布在我国南方地区,湖南是主要产区之一[1]。对油茶的利用迄今已有一千多年,许多医书典籍都记载了油茶的效用[2]。油茶籽是油茶的成熟种子,含油量较高[3]。茶籽油是我国特色食用油,单不饱和脂肪酸含量高达80%,还具有多种活性成分如黄酮类、多酚类、多糖类等,其功能活性已成为研究热点[4-5]。前期研究发现多酚类代谢物是油茶中最重要的代谢物之一,对油茶的风味[6]、稳定性[7]以及功能活性[8]有重要作用。
茶籽油具有胃肠保护和抗炎作用[9]。Cheng Yuting等[10]报道了山茶油对酮洛芬所致急性胃肠溃疡的治疗作用,结果表明山茶油可抑制环氧化酶-2(cyclooxygenase 2,COX-2)蛋白的表达,抑制白细胞介素-6(interleukin-6,IL-6)和一氧化氮(nitric oxide,NO)的产生,减少胃肠道黏膜的氧化损伤。Wang等[11]也报道了山茶油可通过降低炎症介质IL-6、肿瘤坏死因子-α和COX-2的水平,提高血红素氧化酶-1活性,防止小鼠胃肠道黏膜损伤引发炎症。这些研究说明茶籽油对胃肠道的氧化损伤具有保护作用,目前对油茶的研究主要集中在油茶组成及其已知的营养素和生物活性成分分析,而对于许多未知的营养素和活性成分鲜见报道,对于茶籽提取物抗肠炎的机制也有待进一步研究。
代谢组学可以同时表征生物基质中的大量化学代谢物,全面分析代谢产物含量的变化,因此常被用于食品成分分析[12]。利用代谢组学技术对油茶研究主要集中于对茶籽油、茶籽仁和茶籽壳的代谢物分析,而对油茶籽提取物中的活性代谢物检测分析还比较片面。本研究采用超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)技术检测15 个批次油茶籽乙醇提取物中的小分子代谢物,分析各代谢物类别组成,探究油茶籽乙醇提取物的抗肠炎活性,对油茶籽乙醇提取物中代谢物进行分析筛选,鉴定其关键代谢产物,阐明不同代谢产物与抗炎活性之间的变化规律,从而评价油茶籽乙醇提取物中代谢物的效果,为油茶籽提取物抗肠炎的机制研究提供一定参考。
1 材料与方法
1.1 材料与试剂
油茶籽由洞口亿丰农林牧科技有限公司提供,于2020年9—12月采集了湖南省邵阳市洞口县不同成熟期的普通油茶籽共43 份,以数字进行编号,选取15 个批次成熟期油茶籽样品(编号为28~31、33~43)进行研究。
野生型残翅果蝇(实验室饲养)培养在(25±1)℃的恒温箱中。果蝇饲养玉米-酵母培养基:酵母粉24.50 g、琼脂10.00 g、蔗糖7.25 g、红糖30 g、玉米粉50.00 g、丙酸4 mL。
福林-酚定量试剂盒(分析纯) 北京鼎国昌盛生物技术有限责任公司;可食用亮蓝、硫酸葡聚糖钠盐、柳氮磺胺吡啶(分析纯) 上海阿拉丁生化科技股份有限公司;甲醇、乙腈(色谱纯) 德国CNW科技公司;甲酸(色谱纯) 美国Sigma公司;2-氨基异丁酸、L-苯丙氨酸、N,N-二甲基甘氨酸、2-羟基丁酸、L-丝氨酸(纯度均≥99%) 上海麦克林生化科技有限公司;异芒果苷(纯度≥99%) 上海毕得医药科技股份有限公司;5,7,4’-三羟基-6-异戊烯基异黄酮、山柰苷、山柰酚-3-O-芸香糖苷、表儿茶素(纯度均≥99%) 上海源叶生物科技有限公司。
1.2 仪器与设备
Mixplus涡旋混匀仪 美国ABSON科学仪器集团;7045TR+HDMI体视显微镜 广东省东莞市今视光电科技有限公司;SPK-150BIII微生物培养箱 北京中兴伟业仪器有限公司;TG25KR高速冷冻离心机湖南省长沙东旺实验仪器有限公司;ExionLC AD UPLC仪、QTrap 6500高灵敏MS仪 美国AB SCIEX公司;Heraeus Fresco17离心机 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 油茶籽乙醇提取物的提取
用植物粉碎机粉碎油茶籽120~180 s,过0.425 mm筛,密封后在-20 ℃冰箱保存待用。
称取一定质量的油茶籽粉于烧杯中,按料液比1∶15(mg/mL)加入体积分数70%乙醇提取液。60 ℃、超声功率100 W条件下提取30 min,1856×g离心15 min,取上清液,即粗提液[13]。将粗提液旋转蒸发并冷冻干燥,即得油茶籽乙醇提取物。
1.3.2 油茶籽乙醇提取物抗肠炎活性的测定
参照文献[14]方法,采用果蝇“蓝精灵”实验测定各提取物的抗炎活性。将油茶籽乙醇提取物溶于乙醇,通过预实验,选取多酚质量浓度为0.1 mg/mL的油茶籽乙醇提取液测定其对果蝇肠炎的抑制。空白组中滤液为5%葡聚糖硫酸钠(dextran sulfate sodium,DSS)溶液和2.5%可食用亮蓝染液;实验组中滤液为5% DSS溶液、2.5%可食用亮蓝染液和0.1 mg/mL样品提取液。在果蝇管中饲喂12 h后在体视镜下观察果蝇染色情况,若腹腔、胸腔等部位出现蓝色则判定为肠道出现渗漏,说明果蝇肠道结构发生变化出现严重损伤;肠道出现渗漏后,蓝色染料浸满全身,果蝇形似“蓝精灵”。按下式计算果蝇肠炎抑制率,以同质量浓度药品(柳氮磺胺吡啶)作为阳性对照:

1.3.3 油茶籽乙醇提取物的鉴定
1.3.3.1 预处理
称取20 mg的油茶籽乙醇提取物到离心管中,加两粒小钢珠,加入-40 ℃预冷的500 μL甲醇-水溶液(3∶1,V/V,含内标),涡旋30 s,35 Hz匀浆4 min,冰水浴超声5 min,重复匀浆超声3 次,在混匀仪上4 ℃过夜。4 ℃、13800×g离心15 min,取上清液,使用0.22 μm微孔滤膜过滤。用提取液50 倍稀释滤液,涡旋30 s。各取40 μL样品混合成质控(quality control,QC)样本,置于-80 ℃贮存直到上机检测。
1.3.3.2 色谱条件
ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm);流动相:A为0.1%甲酸溶液,B为乙腈,流速400 μL/min;梯度洗脱程序:0~0.5 min,98% A、2% B;0.5~11 min,98%~5% A、2%~95% B;11~13 m i n,5% A、95% B;13~13.1 m i n,5%~98% A、95%~2% B;13.1~15 min,98% A、2% B;柱温40 ℃;进样器温度4 ℃;进样体积2 μL。
1.3.3.3 质谱条件
以多反应监测模式(multiple reaction monitoring,MRM)进行质谱分析。电喷雾离子源;离子喷射电压为+5500/-4500 V;帷幕式气体压强35 psi;温度400 ℃;离子源气体1气压60 psi;离子源气体2气压60 psi;正离子模式优化去簇电压100 V。
1.3.4 化合物与脂氧合酶(lipoxidase,LOX)分子对接
1.3.4.1 受体结构准备及处理
从PDB数据库(http://www.rcsb.org)下载LOX(PDB ID:1YGE)的蛋白晶体结构(含配体),作为对接所用的蛋白,保存为PDB格式。使用Autodock Tools1.5.7软件对蛋白晶体结构进行去除溶剂分子、加氢等处理,保存为PDBQT格式,备用。
1.3.4.2 配体结构准备及处理
从PubChem(https://pubchem.ncbi.nlm.nih.gov)和ZINC数据库(https://zinc.docking.org)下载配体化合物结构,使用AutodockTools1.5.7软件对配体小分子进行加氢、计算电荷等处理。
1.3.4.3 分子对接方法
使用AutoDock软件预测各化合物与受体LOX蛋白的结合,对接参数采用默认设置。用AutoGrid计算格点能量,采用拉马克遗传算法,用半经验的自由能计算方法评价各化合物与蛋白受体之间的结合情况,选择每组中对接结合能小于-5 kcal/mol、均方根偏差(root mean square deviation,RMSD)小于2 Å的小分子配体与受体蛋白进一步分析其结合位点[15],使用PyMOL软件生成对接结果的图形视图[16]。
1.4 数据处理
质谱数据采集及目标化合物定量分析均通过SCIEX Analyst 1.6.3软件完成,使用MS conventer软件将质谱原始转成TXT格式,再使用自撰写R程序包结合自建数据库完成提峰、注释等工作。
抗炎活性实验均重复3 次,结果取平均值,采用Excel进行数据预处理,使用SPSS 22.0软件对抗炎活性与代谢组学数据进行相关性分析,用Origin 2021和GraphPad Prim 8软件绘图。
2 结果与分析
2.1 油茶籽乙醇提取物抗肠炎活性
肠黏膜屏障由肠上皮细胞紧密连接构成,肠上皮细胞的损伤或紧密连接蛋白的破坏及成分、排布的变化都会增加肠道的通透性,导致肠内容物中的分子和微生物大量渗入肠道组织,造成感染引发肠道炎症[17-18]。
果蝇拥有与人类高度保守的天然免疫信号、较少的基因组、更好的适应性以及操作的有效性和经济性,是理想的肠道疾病模型[19]。由图1可知,油茶籽乙醇提取物对DSS导致的肠炎均有抑制作用,且不同批次油茶籽乙醇提取物对果蝇肠炎抑制效果有一定差异。柳氮磺胺吡啶对果蝇肠炎的抑制率为27.99%,油茶籽乙醇提取物的抑制率为15.06%~61.71%,40号样品的抑制率最高,起到了抑制肠道炎症反应的效果。

图1 不同油茶籽乙醇提取物的果蝇肠炎抑制率Fig.1 Inhibitory activity of ethanolic extracts of C.oleifera seeds against enteritis in Drosophila
2.2 油茶籽乙醇提取物代谢组学分析
2.2.1 油茶籽乙醇提取物中各代谢物类别组成及含量分布
通过UPLC-MS/MS对15 个批次油茶籽乙醇提取物中小分子代谢物进行检测,共得到926 个色谱峰,经过预处理后885 个峰被保留。这些色谱峰包括小分子有机酸、氨基酸、维生素、糖类、脂类、糖醇类、酚类、生物碱、黄酮类化合物等(主要分为多酚类、氨基酸类、有机酸类、核苷酸类、糖类、脂类和其他类)。
由图2可知,15 个批次油茶籽乙醇提取物中,41号样品的代谢物总含量最高,其次为28号和33号,36号样品的代谢物总含量最低。所有代谢物中,糖类化合物的含量最高,占代谢物总含量的30.25%;其次为多酚类、脂类和氨基酸类化合物,分别占18.78%、15.93%和14.26%;而核苷酸类、有机酸类化合物的相对含量较低,小于10%;其他类化合物的相对含量为5.11%。

图2 15 个批次油茶籽提取物中各代谢物类别组成及含量分布Fig.2 Composition and content of metabolites in ethanol extracts of 15 batches of C.oleifera seeds
2.2.2 油茶籽乙醇提取物中代谢物组成及含量分析
15 个批次油茶籽乙醇提取物中丰度大于10的代谢物共208 个,其中多酚类76 个、氨基酸类33 个、糖类 8 个、有机酸类17 个、脂类11 个、核苷酸及其衍生物11 个、其他类52 个。
油茶籽乙醇提取物中,多酚类化合物的总含量较高(图2)、种类最丰富。如图3所示,不同油茶籽乙醇提取物中,多酚类化合物的含量存在一定差异。由于植物多酚种类繁多,根据它们的结构可大致分为黄酮类、酚酸类、萜类和木脂素类[20],在油茶籽多酚类化合物中,黄酮类占主体,其次为酚酸类和萜类,木脂素类较少。
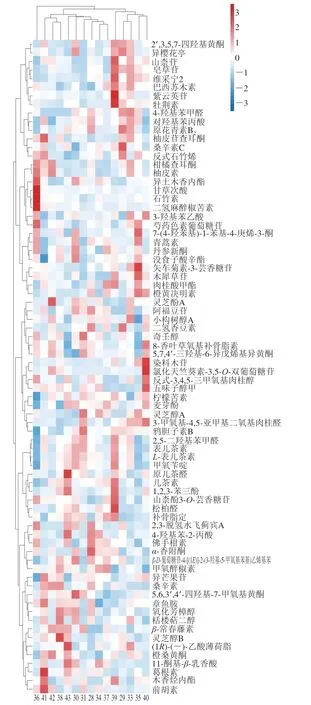
图3 15 个批次油茶籽乙醇提取物中酚类化合物的层次聚类热图Fig.3 Hierarchical clustering heatmap of phenolic compounds in ethanol extracts of 15 batches of C.oleifera seeds
有11 个多酚类化合物的丰度高于1000,其中黄酮类的山柰苷、山柰酚-3-O-芸香糖苷、矢车菊素-3-芸香糖苷、表儿茶素、原花青素B2、木犀草苷已有大量报道[21-25],其余5 个多酚类化合物是首次在油茶籽中被检出,包括黄酮类的阿福豆苷、5,7,4’-三羟基-6-异戊烯基异黄酮,酚酸类的章鱼胺,萜类的丹参新酮以及8-香叶草氧基补骨脂素。
2.3 相关性分析筛选油茶籽乙醇提取物抗炎活性化合物
由图4可知,油茶籽乙醇提取物中与肠炎抑制活性呈正相关的化合物共11 个,呈负相关的化合物共21 个。酚类化合物中与果蝇肠炎抑制活性呈显著正相关的化合物为鸦胆子素B,呈极显著正相关的化合物为异芒果苷,这两种多酚类化合物都是首次在油茶籽中被检出;呈显著负相关的化合物为佛手柑素、二氢麻醉椒苦素、异土木香内酯、丹参新酮、辛可尼丁、辛可宁、N-对香豆酰真蛸胺,呈极显著负相关的化合物为青蒿素、石竹素、甘草次酸。有机酸及氨基酸中与果蝇肠炎抑制活性呈显著正相关的化合物为2-氨基异丁酸、L-苯丙氨酸、N,N-二甲基甘氨酸、2-羟基丁酸,呈极显著正相关的化合物为D-丝氨酸和L-丝氨酸;呈显著负相关的化合物为L-哌啶酸、L-羟基脯氨酸、磷酸、脯氨酸甜菜碱,呈极显著负相关的化合物为烟酸。其他类与果蝇肠炎抑制活性呈显著正相关的化合物为22-脱氢赤桐甾醇、O-乙酰乙醇胺、Parsonsine;呈显著负相关的化合物为二烯丙基二硫醚、尿刊酸,呈极显著负相关的化合物为1-茚酮、2-羟基-3-苯丙酮酸甲酯、甜菜碱醛、甘露糖-6-磷酸。其中鸦胆子素B[26]、异芒果苷[27]、L-苯丙氨酸[28]、丝氨酸[29]、N,N-二甲基甘氨酸[30]已被报道与炎症代谢通路相关,与本研究一致。

图4 油茶籽乙醇提取物中化合物与抗炎活性的相关性Fig.4 Correlation between metabolites in ethanol extract of C.oleifera seeds and its anti-inflammatory activity
2.4 基于分子对接技术的油茶籽乙醇提取物抗炎活性化合物的筛选
2.4.1 18 种化合物与LOX分子对接分析
前期研究发现,抑制LOX活性可能是油茶籽乙醇提取物的抗肠炎机制之一[31]。因此,选取含量高的多酚类化合物、与肠炎呈正相关的多酚类及氨基酸类化合物共18 种(表1),分别与LOX进行分子对接。配体构象的对接结合能越低,构象越稳定,与蛋白质受体结合的亲和力越强,对蛋白质受体可能具有抑制活性。RMSD值越小,对接构象与目标构象越接近[32]。一般认为最低对接结合能小于-5 kcal/mol,则对接构象稳定;RMSD值小于2 Å,说明配体与受体进行有效对接。
由表1可知,鸦胆子素B、5,7,4’-三羟基-6-异戊烯基异黄酮、丹参新酮、8-香叶草氧基补骨脂素、表儿茶素、山柰苷、山柰酚-3-O-芸香糖苷与LOX对接构象稳定,说明这7 种化合物可能对LOX具有抑制作用。已有研究报道了表儿茶素对LOX的抑制作用[33],与本研究结果一致。

表1 油茶籽乙醇提取物中化合物与LOX对接构象的对接结合能与RMSD值Table 1 Docking binding energy and RMSD values between LOX and metabolites in ethanol extract of C.oleifera seeds
2.4.2 分子对接结果可视化分析
根据表1中的分子对接打分情况,选取对接结合能小于-5 kcal/mol,RMSD值小于2 Å的化合物:鸦胆子素B、5,7,4’-三羟基-6-异戊烯基异黄酮、丹参新酮、8-香叶草氧基补骨脂素、表儿茶素、山柰苷、山柰酚-3-O-芸香糖苷,将其最优构象进行可视化分析。
如图5所示,7 种化合物与LOX的结合位点都位于其活性口袋内,被受体的氨基酸残基所包围。鸦胆子素B与LOX对接结果显示,配体与氨基酸Met-395存在两条氢键,键长分别为2.7 Å和2.3 Å;与氨基酸Ala-385、Leu-388、Leu-390、Gly-392均存在一条氢键,键长分别为2.6、3.3、2.3 Å和2.3 Å。5,7,4’-三羟基-6-异戊烯基异黄酮与LOX对接结果显示,配体与氨基酸Asp-768、Asn-835和Pro-530均存在一条氢键,键长分别为2.4、2.4 Å和2.9 Å。丹参新酮与LOX对接结果显示,配体与氨基酸Phe-143、Phe-144均存在一条氢键,键长分别为2.1、2.9 Å。8-香叶草氧基补骨脂素与LOX对接结果显示,配体与氨基酸Thr-529存在一条氢键,键长为2.5 Å。表儿茶素与LOX对接结果显示,配体与氨基酸Val-126存在两条氢键,键长分别为2.3 Å和2.5 Å;与氨基酸Ala-145、Phe-144和Ile-142均存在一条氢键,键长分别为2.5、2.4 Å和2.0 Å。山柰苷与LOX对接结果显示,配体与氨基酸Glu-176和Asn-245存在两条氢键,键长分别为3.3、2.7 Å和1.9、2.6 Å;与氨基酸Arg-177、Val-237和Val-240均存在一条氢键,键长分别为2.9、3.3 Å和2.5 Å。山柰酚-3-O-芸香糖苷与LOX对接结果显示,配体与氨基酸Lys-178、Val-240均存在一条氢键,键长均为2.3 Å。上述7 个化合物均与LOX形成了较稳定的复合物,说明这7 个化合物可能对LOX有良好的抑制活性。鸦胆子素B[26]、丹参新酮[34]、8-香叶草氧基补骨脂素[35]都已被报道过有抗炎效果,选取5,7,4’-三羟基-6-异戊烯基异黄酮及含量高的山柰苷、山柰酚-3-O-芸香糖苷进行“蓝精灵”实验以验证其抗炎活性。


图5 油茶籽乙醇提取物中7 种化合物与LOX的分子对接效果图Fig.5 Molecular docking of seven compounds in ethanol extract of C.oleifera seeds with LOX
2.5 油茶籽乙醇提取物的抗炎活性化合物对果蝇肠炎的抑制活性
在相同条件下,选取相关性分析得到的与果蝇肠炎抑制活性显著正相关的化合物异芒果苷、2-氨基异丁酸、L-苯丙氨酸、N,N-二甲基甘氨酸、2-羟基丁酸、L-丝氨酸,与LOX对接具有稳定构象的5,7,4’-三羟基-6-异戊烯基异黄酮及含量高的山柰苷、山柰酚-3-O-芸香糖苷进行果蝇“蓝精灵”实验。表儿茶素是儿茶素类化合物,是油茶籽多酚的主要成分,已被广泛报道具有抗炎活性[9],选用表儿茶素作为参比,柳氮磺胺吡啶作为阳性对照。
如图6所示,对果蝇肠炎具有抑制作用的化合物有7 个,其中有4 个多酚化合物的抑制率高于50%,N,N-二甲基甘氨酸、L-丝氨酸和L-苯丙氨酸3 种氨基酸对果蝇肠炎抑制活性很低,甚至表现出轻微促炎作用。异芒果苷与LOX进行分子对接的结果不是很理想,但却表现出较高抗肠炎活性,可能是通过与炎症相关的其他通路(如抑制关键酶COX-2、诱导型一氧化氮合酶的表达)发挥抗炎效果[36]。综上所述,异芒果苷、5,7,4’-三羟基-6-异戊烯基异黄酮、山柰苷、山柰酚-3-O-芸香糖苷表现出较高的果蝇肠炎抑制活性,且4 种多酚类化合物抑制活性显著高于表儿茶素与柳氮磺胺吡啶。其中5,7,4’-三羟基-6-异戊烯基异黄酮是一种天然类黄酮化合物,也是油茶籽中检测到的一种新型化合物,有研究报道其具有抗肿瘤[37]、保肝[38]和抑菌[39]活性。本研究首次对5,7,4’-三羟基-6-异戊烯基异黄酮的抗炎活性进行了研究并证实了其具有较高的果蝇肠炎抑制活性,0.1 mg/mL给药量时抑制率达到64%;此外,抑制LOX活性可能是其抗肠炎机制之一。

图6 油茶籽乙醇提取物中不同化合物对果蝇肠炎抑制率Fig.6 Inhibitory activity of different compounds in ethanol extract of C.oleifera seeds against Drosophila enteritis
3 结论
采用UPLC-MS/MS检测15 个批次油茶籽乙醇提取物中的小分子代谢物,分析各代谢物类别组成,探究油茶籽乙醇提取物的抗肠炎活性,对油茶籽乙醇提取物中代谢物进行分析筛选,鉴定其关键代谢产物,阐明不同代谢产物与抗炎活性之间的变化规律,从而评价油茶籽乙醇提取物中代谢物的效果。结果显示:油茶籽乙醇提取物具有良好的果蝇肠炎抑制活性;初步筛选了油茶籽乙醇提取物中具有较高抗肠炎活性的化合物为鸦胆子素B、丹参新酮、8-香叶草氧基补骨脂素、异芒果苷、5,7,4’-三羟基-6-异戊烯基异黄酮、山柰苷和山柰酚-3-O-芸香糖苷,其中鸦胆子素B、异芒果苷、5,7,4’-三羟基-6-异戊烯基异黄酮、丹参新酮、8-香叶草氧基补骨脂素是首次在油茶籽中发现,同时5,7,4’-三羟基-6-异戊烯基异黄酮是首次被发现具有抗炎活性。本研究为进一步探究油茶籽乙醇提取物内外抗肠炎活性及其机制奠定了基础,为油茶籽增效开发提供一定理论依据。
